茶叶中霉菌毒素危害与质量控制研究进展
2023-10-17缪伊雯童华荣
缪伊雯,白 菲,童华荣*
(西南大学食品科学学院,重庆 400715)
茶(Camellia sinensisL.)属山茶科山茶属,原产于中国的常绿灌木,是世界上最受欢迎的无酒精饮料之一[1-3]。中国已有千年的饮茶史,2020年我国茶叶产量高达297万 t[4-5]。茶叶按照加工工艺分为六大类,其中绿茶加工工艺较简单,有效保留了其鲜叶所含的天然物质,在中、日、韩等国备受欢迎;白茶、黄茶和乌龙茶是中国特有茶类,主要在中国产销;红茶是一种酶促发酵的全发酵茶,在亚洲和欧洲备受欢迎,在全世界销量位居第一;黑茶则是一种由酶、微生物和湿热加工条件三者综合作用的后发酵茶,主产于中国西南部地区[6]。茶叶因具有多种保健功能而深受大众的喜爱,然而有毒化学物质污染可能会削弱茶叶的健康作用[2,7]。如今,茶叶质量安全已日益引起关注,其中与霉菌毒素相关的风险评估是当前学界与大众所关注的热点[8]。茶叶在种采、加工和流通等环节中极易受到霉菌侵染,其中产毒菌在适宜的条件下会产生霉菌毒素,人类通过饮用茶汤可能会存在霉菌毒素膳食暴露的风险[9-10]。
霉菌毒素主要是由曲霉属(Aspergillus)、青霉属(Penicillium)、链格孢属(Alternaria)和镰刀菌属(Fusarium)等特定霉菌在适宜的产毒条件下产生的次生代谢产物,经口、皮肤或呼吸道等途径吸收时会导致机体机能下降、生病或死亡,是世界范围内食品和饲料中最常见的污染物,如黄曲霉毒素(aflatoxins,AFs)曾被美国食品和药物管理局(Food and Drug Administration,FDA)评价为食品中不可避免的污染物[11-12]。
如今,发达国家相继要求对茶叶进行微生物项目检验,这无形中增加了我国茶叶出口贸易的技术性贸易壁垒,使茶叶产业陷入十分被动的局面[13]。中国食品土畜进出口商会所编写的《出口商品技术指南-输欧茶叶》也曾指出,茶企有必要关注茶叶中存在的霉菌毒素风险,以应对发达国家的技术法规、标准和合格评定程序的复杂多变[14]。因此,世界各国卫生部门加强对霉菌毒素的监督是大势所趋,而茶叶中霉菌毒素的控制、分析检测仍然是目前学术界研究的热点。本文对茶叶中霉菌毒素的来源、种类及危害进行了简述,对茶叶中霉菌毒素污染现状进行了总结,探讨了相关检测技术的优缺点,并对茶叶中霉菌毒素的防控措施进行了展望,旨在为茶叶质量控制提供参考。
1 茶叶中霉菌毒素的来源
目前,全球范围内被认定的霉菌毒素已超过400 种[15]。茶叶加工的周期长短不一且步骤多样导致其在任何阶段可发生霉菌侵染,如种采、加工与流通等环节[2]。如图1所示,霉菌侵染的影响因素和发生污染的概率存在差异,其中茶叶的特性和贮藏条件又会进一步影响霉菌的产毒能力,而茶叶中霉菌毒素残留会影响茶叶的品质和贸易,并对人类构成潜在的健康风险。因此,掌握霉菌侵染茶叶的途径可有效改善茶叶中霉菌毒素污染[16-17]。
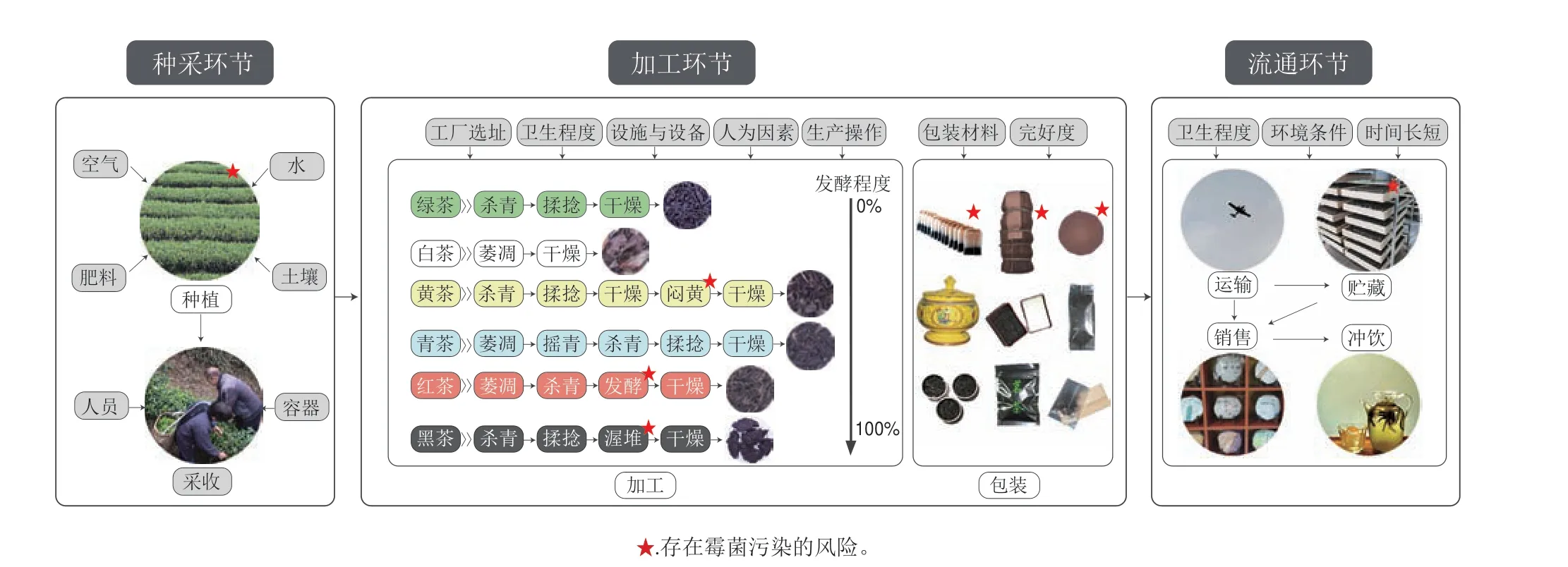
图1 中国6 种典型茶类的生产流程、霉菌侵染的风险程度与影响因素Fig.1 Production process of six kinds of typical Chinese tea, degree of risk of mold contamination, and its influential factors
1.1 种采环节
气温20~30 ℃、土温25~30 ℃、酸性土壤且最大持水量80%~90%的环境有利于茶树生长发育,但温暖湿润的环境也为霉菌定植和产毒提供了最佳条件[6]。当前,茶叶中常见的霉菌包括曲霉属、青霉属、链格孢属、镰刀菌属、散囊菌属(Eurotiumsp.)和根霉属(Rhizopusspp.)等[2]。青霉属、镰刀菌属是田间霉菌,可能存在于茶树种植区的空气、土壤、水源和肥料中,并在茶树的生长和采收过程中附着于鲜叶上并带入后续加工中。此外,采收环节中工作人员与容器的卫生情况则会进一步影响霉菌污染茶叶的程度[2,6]。
目前,在世界上主要的茶叶生产国中,中国和印度地处亚热带气候,这也直接导致中印两国是受霉菌毒素影响最严重的国家[2]。在针对中国的六大茶类的霉菌毒素检测中均发现了不同程度的霉菌毒素感染情况,其中,产自拉脱维亚的绿茶和黑茶中检测出的脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)和T-2毒素(T-2 toxin,T-2)通常是由田间霉菌入侵而产生的[17-18]。虽然曲霉属归属于仓贮性霉菌,但在日本茶园的27 份酸性土壤中也分离出57 株黄曲霉属真菌[19],王鹭等[20]则在日本绿茶中检出黄曲霉毒素B2(aflatoxins B2,AFB2)(4.40 μg/kg),这表明在茶叶的生产实践中,茶叶所受到的侵染菌和产毒菌是多样的,且存在污染扩散的情况。
1.2 加工环节
茶叶鲜叶的水分质量分数约为75%,蛋白含量较低,含有可溶性糖,加工成干毛茶后水分质量分数降至2%~10%不等,可被多种来自环境或自带的潜在产毒霉菌侵染[21-22]。Dutta等[23]从茶厂的空气、叶际和土壤样本中分离出34 种霉菌,包括产生霉菌毒素的黑曲霉(A.niger)、黄曲霉(A.flavus)、烟曲霉(A.fumigatus)和乳酸镰刀菌(Fusarium lactis)。此外,霉菌的繁殖能力较强,所产的霉菌孢子可以通过原料、空气、生产用水、工具等媒介侵入茶样并在条件适宜时萌发繁殖,对茶样造成进一步污染[24]。
不同的茶类具有不同的加工工艺,造成各大茶类霉菌侵染的影响因素和发生污染的概率存在差异[2,24]。绿茶被认为是加工过程中受污染风险最小的茶类,这主要与绿茶加工步骤简单、周期短及干茶水分质量分数低(4.64%~9.73%)密切相关[2,25],但目前也有研究报道了绿茶中感染AFB2、黄曲霉毒素G1(aflatoxins G1,AFG1)、互隔交链孢酚(alternariol,AOH)、恩镰孢菌素B(enniatin B,ENN B)、腾毒素(tentoxin,TENT)和玉米赤霉烯酮(zearalenone,ZEN)等毒素的案例。其中,AOH(1.70~5.90 μg/kg)、TENT(4.60 μg/kg)和HT-2毒素(HT-2 toxin,HT-2)(5.58 μg/kg)仅在绿茶样品中有报道[16-17],赭曲霉毒素A(ochratoxin A,OTA)在绿茶的袋泡茶(0.01~19.96 µg/kg)、茶汤(0.10~0.80 ng/L)和散茶(0.54~20.35 µg/kg)中均有检出[26-27]。此外,研究人员认为绿茶受到霉菌毒素污染风险较低,与其富含的多酚类化合物具有一定的抗菌作用密切相关[6,24]。
同样,作为加工步骤较少的白茶,也被认为是受污染较少的茶类,截至目前仅有2 例报道,在西班牙样品中检出了OTA、AFs、ZEN、T-2、DON和桔青霉素(citrinin,CIT),其中DON高达259.10 µg/kg[28]。在中国的13 个白茶样品中检出的棒曲霉素(patulin,PAT)含量最高可达10.90 µg/kg,而此前针对PAT的关注更多是在水果及其制品中[29],这表明随着科学技术的发展,越来越多研究人员开始重视在其他食品类别中存在的霉菌毒素在茶叶中的检出情况。黄茶需要在高湿高温的条件下进行闷黄,可为霉菌的繁殖及产毒提供条件[30],针对黄茶的研究仅在Li Hai等[29]报道的7 份黄茶样品中检出PAT(<2.90 µg/kg),究其原因可能是黄茶本身的产销量较少,在全球的消费群体数量少于其他茶类,但随着人类对健康的关注程度不断提高,当前对于茶叶的风险评估正在逐步扩大试验茶样的范围。青茶在工序上采用的毛火温度高、烘焙时间长,所制成的茶水分质量分数为4%~7%,因此,青茶受到的霉菌侵染较少,可能是因为在此过程中不耐高温的霉菌毒素会发生降解,从而降低霉菌毒素的含量[6]。至今,仅在中国所产销的青茶样品中检出黄曲霉毒素B1(aflatoxins B1,AFB1)(34 µg/kg)[31]、AFB2(5.76 µg/kg)[20]和PAT(<21.40 µg/kg)[29]。
红茶作为一种全发酵茶,其在揉捻时各种营养物质外溢增多,有利于霉菌菌丝和孢子大量繁殖,同时,霉菌代谢产生蛋白酶和氨基酸脱羧酶,分解后会产生臭味,影响红茶的品质[32]。和青茶一样,高温干燥可以有效降低红茶中部分不耐高温的霉菌毒素的含量。
AFs[17,20,27,33]和OTA[17,26-27,31,34]是在红茶中检出率最高的2 类霉菌毒素,这主要是因为AFs和OTA的熔点较高,分别为269 ℃和169 ℃,且针对AFs和OTA的检测技术最为成熟,研究者关注度较高[24]。伏马毒素B1(fumonisin B1,F B1)是红茶中检出的含量最高的霉菌毒素,可达280 µg/kg,这可能与FB1热稳定性强,且具有水溶性有关[35]。
以微生物后发酵为主的黑茶是如今受污染和研究最多的一类茶叶[36]。黑茶的渥堆发酵主要是在炎热潮湿的复杂环境下进行,来自原料茶、环境和人员等媒介的霉菌或霉菌孢子在渥堆发酵阶段侵染茶样,主要包括曲霉属、散囊菌属和青霉属[37-38]。此外,普洱茶在发酵过程中的水分质量分数(10%~30%)、pH值(5~6)、渥堆中心温度(<50 ℃)等条件有利于霉菌繁殖并产毒[39]。目前,世界各国针对黑茶中霉菌毒素的研究较多。Haas等[38]在36 份普洱茶样品中检测到根霉、毛霉和青霉。在茯砖茶生产过程中,散囊菌属中的冠突散囊菌是“发花”和“菌花香”的来源,而青霉和黑曲霉则属于污染菌[40]。相反,曲霉属是六堡茶渥堆阶段的优势菌[35,39],胡沛然[41]在六堡茶中分离出伞状毛霉菌(Lichtheimia corymbifera)、塔宾曲霉(A.tubingensis)和烟曲霉(A.fumigatus)。与红茶类似,AFs和OTA是研究和检出率最高的两类霉菌毒素,其中黄曲霉毒素G2(aflatoxins G2,AFG2)含量可达59 600 µg/kg,是绿茶中的784 倍[42-43]。因此,相较于其他茶类,黑茶具有更加多元化的侵染菌与产毒菌和多样化的霉菌毒素。
此外,成茶所选择的外包装方式亦能影响霉菌侵染程度[44]。采用天然材料(木质、竹质等)、纸材料类(纸袋、纸盒、棉纸等)和陶瓷材料类(土陶、紫砂等)等密闭性较差、易受潮的材料可能会在包装破损或不适当的储存方式下发生霉菌侵染并产毒,而金属包装(铁罐、铝罐、锡罐、不锈钢罐等)、塑料包装(聚乙烯、聚丙稀、聚氯乙烯等)和复合材料包装(纸塑复合包装盒、铝塑复合真空包装袋等)等具有较好的阻气性、防潮性,采用此类包装材料加之真空或充氮技术包装茶叶则能在一定程度上降低茶叶霉变的概率[45]。
1.3 流通环节
由于茶叶具有多孔性结构,若在流通环节因包装破损或储存条件不当会导致茶叶的水分活度升高,加大了茶叶受霉菌侵染并产毒的可能性[46-47]。其中,运输工具的洁净程度、贮藏时间的长短和环境条件是最重要的影响因素。当前,对茶叶中霉菌毒素的研究主要是针对市售样品,例如,在奥地利购买的36 份市售普洱茶样品中,有11%的样品含有OTA,含量最高可达94.70 µg/kg[38]。此外,也有部分学者针对贮藏时间与条件展开研究,在对不同年份六堡茶的研究中发现,CIT与贮藏时间相关,其陈化过程储存温度在25~42 ℃之间,这有利于曲霉和青霉的繁殖和产生CIT,而贮藏过程中的气候条件和水分活动是影响霉菌定植和CIT积累的关键因素[48]。
2 茶叶中常见的霉菌毒素及危害
由于茶叶加工工艺不规范或是在环境中感染霉菌,特别是未知霉菌产生的次生代谢物可能对茶叶的饮用安全构成风险[49]。霉菌毒素毒性谱较广,对人体具有致神经内分泌紊乱及肝肾损伤等危害。同时,如AFs、OTA、CIT等霉菌毒素已被证实具有致癌、致畸和致突变作用[46]。霉菌毒素的中毒症状及严重程度取决于霉菌毒素的类型、暴露的数量和持续时间、暴露个体的年龄、健康状况和性别及与其他物质的协同效应[16,46]。另外,丰富的品类和多样的饮茶方式,导致世界各地对不同茶类的饮用习惯不同,例如,中国以热饮茶为主,而美国则喜欢冰茶[50];绿茶的冲泡时间较短,水温较低[51],而黑茶除清饮外[2],在中国少数民族地区的酥油茶[52]和咸奶茶[53]则会进行较长时间熬煮。因此,生茶的污染程度、冲泡温度的高低、冲泡时间的长短、溶剂性质、霉菌毒素的热稳定性及从基质转移到茶汤中的能力都会影响茶叶中霉菌毒素的浸出率,从而影响饮茶者的霉菌毒素膳食暴露量和健康情况[54]。目前,茶叶中常见的霉菌毒素主要包括AFs、CIT、OTA、ZEN等共31 种[2,16-17,24,48]。
2.1 黄曲霉毒素
AFs是一类结构和理化性质相似的二氢呋喃杂氧萘的衍生物,因其在食品基质中的强致癌性成为了茶叶中首先被追踪的候选物质[2]。AFs急性中毒导致死亡,慢性中毒导致癌症、免疫抑制等[46]。AFs能够与DNA和蛋白质结合,已被国际癌症研究机构(International Agency for Research on Cancer,IARC)列为1类致癌物[16]。通过饮食摄入AFs被认为是引发原发性肝细胞癌的重要危险因素,特别是乙型肝炎患者[46]。据报道,AFs从茶叶迁移到饮料中的比例约为30%~40%[16]。但AFs具有很高的脂溶性,难溶于水,耐热,茶叶受到AFs污染后只有少量会在冲泡过程中进入茶汤[24]。
2.2 赭曲霉毒素A
OTA是继AFs之后被人们所关注到的一类具有香豆素和苯丙氨酸结构的类似物,OTA是最强的肾脏致癌物,已被IARC认定为2B类致癌物,在人体内的半衰期最长[55]。此外,动物实验研究表明OTA还具有肝毒性、免疫毒性、神经毒性、致畸性,具有物种和性别敏感性差异的特点[46]。OTA以多种方式干扰细胞生理活动。OTA微溶于水,在茶汤中的转移率比AFs高,膳食暴露风险更高,且其产毒菌曲霉属和青霉属均为茶叶加工和仓储过程中的常见微生物[55]。此外,在冲泡过程中茶叶与水接触时间越长,茶汤中浸出的OTA含量越高[34]。
2.3 桔青霉素
CIT为聚酮类化合物,摄入被CIT污染的产品对人和动物具有肾毒性、肝毒性、免疫抑制和致癌作用。肾脏被认为是CIT的关键靶器官,且CIT与OTA的协同作用和肾毒性已有报道[56]。据IARC报道,暂无科学证据表明CIT具有致癌性,被列为第3类致癌物。然而,值得引起关注的是在茶叶中CIT与OTA共存的比例较高,且CIT具有一定的水溶性[48]。此外,细胞中活性氧(reactive oxygen species,ROS)的产生和细胞内三磷酸腺苷(adenosine 5’-triphosphate,ATP)含量的降低已被发现与CIT有关[56]。目前,白茶和黑茶中已有相关检出的报道[28,48]。
2.4 玉米赤霉烯酮
ZEN是一类2,4-二羟基苯甲酸内酯类化合物,具有免疫毒性、肝毒性等。它与人类卵巢产生的主要激素雌二醇非常相似,以至于它可以与哺乳动物靶细胞中的雌激素受体结合,具有很强的雌激素样作用和合成代谢作用。ZEN及其代谢物随食物摄入后会被人体吸收,可出现在血液、尿液和母乳等生物体液中[46]。人体推荐的玉米赤霉烯酮安全摄入量为每天0.05 g/kgmb[24]。目前,ZEN在中国红茶[8]、摩洛哥绿茶[16]、拉脱维亚黑茶[17]和西班牙白茶[30]的研究中均有报道。
2.5 伏马菌素B1
FB1是一种双酯化合物,主要由丙三羧酸和不同的多氢醇组成。与OTA同属于2B类致癌物,FB1可损伤肝肾功能,在中国和南非部分地区伏马毒素污染与食道癌发病率呈正相关[46]。与其他霉菌毒素不同,FB1极易溶于水,这就可能导致FB1在实际冲泡茶汤时转移率高等问题,因此需要加大对茶叶中FB1的关注[24,35]。目前,FB1在绿茶、红茶和黑茶中均有报道[20,35,57]。
2.6 其他毒素
除上述霉菌毒素外,柄曲霉素(sterigmatocystin,STC)[8]、TENT[16]和HT-2[17]等霉菌毒素在茶叶中也有检出,但由于其检出含量较少或危害较小,研究人员暂时对其关注度相对偏低,相关报道研究较少。
茶叶中存在的产毒菌及霉菌毒素如表1所示;表2列举了近年来茶叶中霉菌毒素的检测结果。
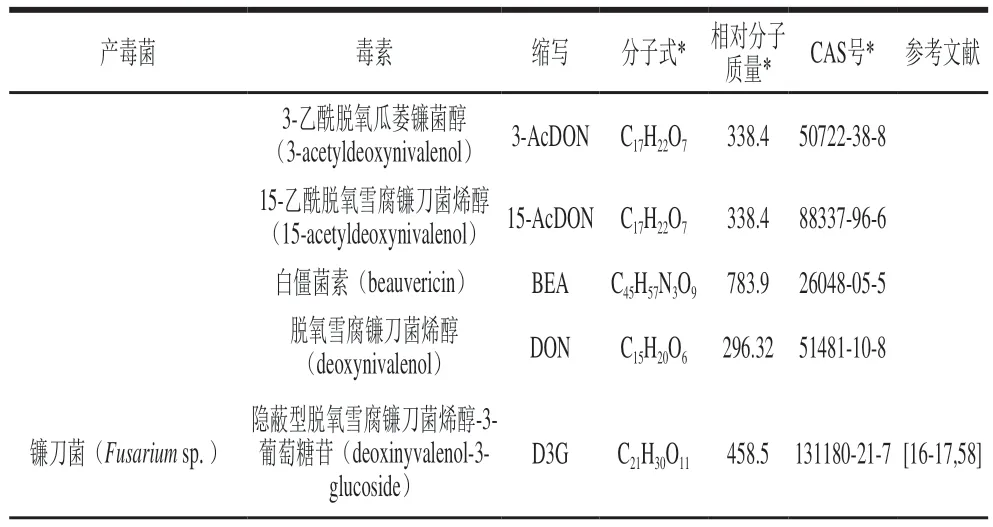
表1 茶叶中存在的产毒菌及霉菌毒素Table 1 Toxigenic fungi and mycotoxins present in tea
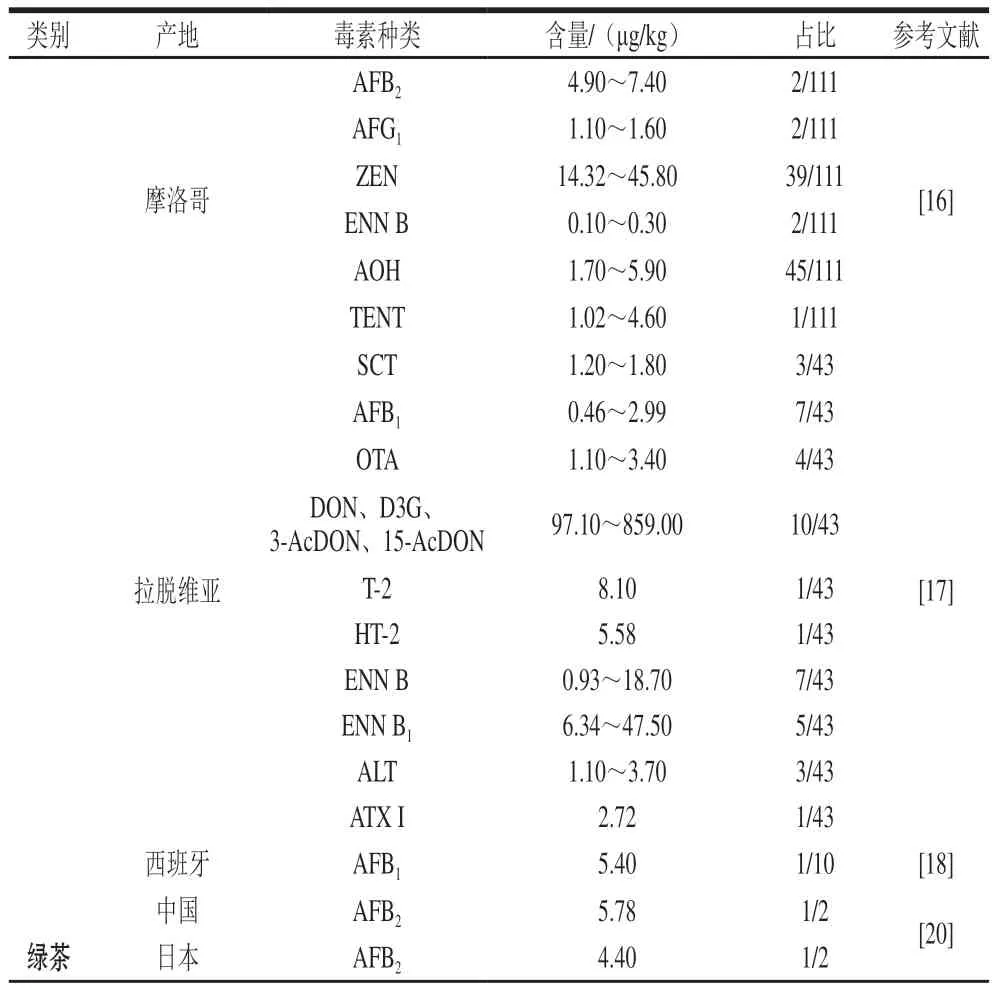
表2 茶叶中霉菌毒素的检测结果Table 2 Mycotoxin contents in tea
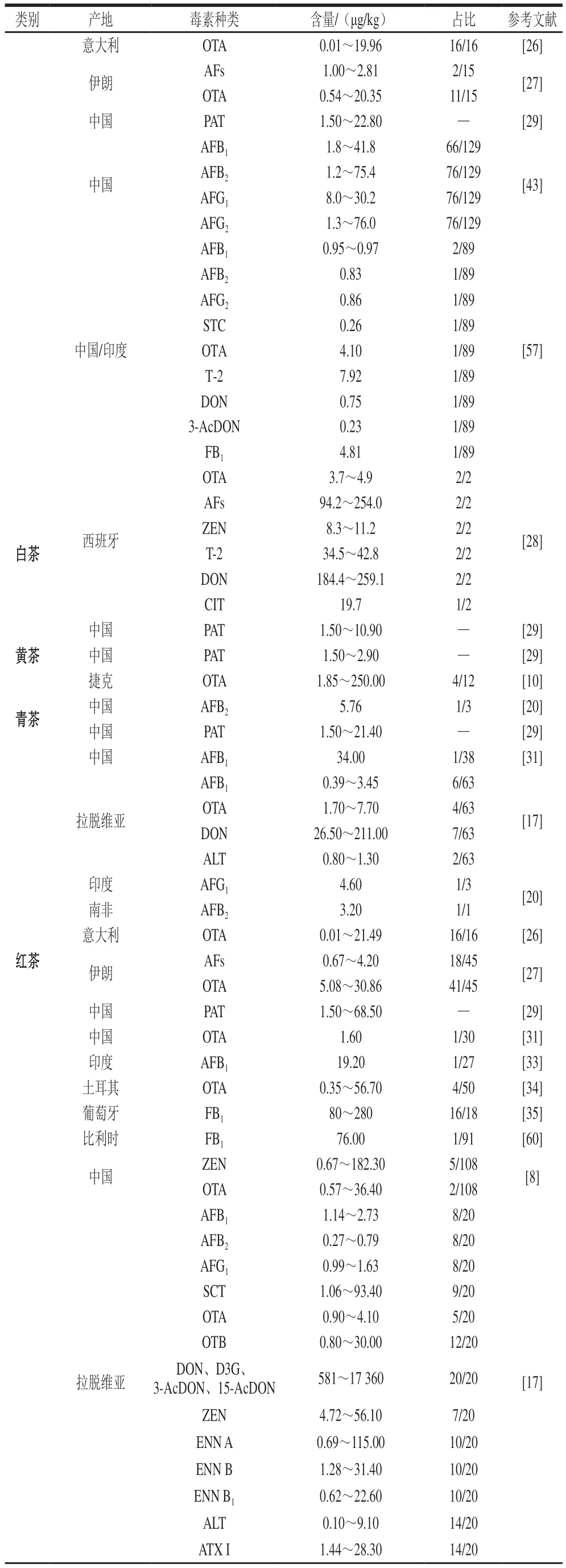
续表2
3 茶叶中霉菌毒素的检测方法
3.1 样品前处理技术
霉菌毒素是一类小分子的化合物,而茶叶则是一种复杂的食品基质,其丰富的内含物可能会干扰正常的分析检测过程,茶样需经过复杂的提取和净化程序才能进行分析[58,65]。在茶叶预处理过程中,消除基质效应是当前开展分析工作的主要挑战。目前,茶叶实际分析过程中需要结合下述分析方法进行前处理,以提高复杂基体的精密度和特异性[66]。茶叶毒素检测的提取方法主要包括固相萃取(solid-phase extraction,SPE)[67]、分散固相萃取(dispersive solid-phase extraction,DSPE)[31]、液-液萃取(liquid-liquid extraction,LLE)[68]、固相支撑液-液萃取(supported liquid extraction,SLE)[59]、分散液-液微萃取(dispersive liquid-liquid microextraction,DLLME)[16]、悬浮固化分散液-液微萃取(dispersive liquid-liquid microextraction based on the solidification of floating organic droplets,DLLME-SFO)[65]、基于同位素的快速、简单、廉价、有效、坚固和安全(quick-easycheap-effective-rugged and safe,QuE-ChERS)[69]、稀释进样(dilute and shoot,D&S)[68];净化方法主要有免疫亲和柱(immune affinity column,IAC)与多功能柱(multi-function columns,MFC)[70-71]等。
SPE和LLE是当前霉菌毒素残留常用的提取方法,常用于降低基质效应并提高灵敏度,但LLE存在有机溶剂用量大、耗时长等问题,而SPE费用昂贵,不符合绿色化学的要求[67-68];DLLME具有快速、简便、成本低、溶剂用量少、富集率高等优点已被广泛应用于霉菌毒素样品的处理[72]。DLLME在实际应用中还常与其他提取方法相结合,比如,Cina等[65]建立袋泡茶样品中OTA的分析提取和净化方法,将DLLME-SFO与高效液相色谱-电喷雾串联质谱法(liquid chromatography electrospray ionisation tandem mass spectrometry,LC-ESI-MS/MS)联用技术相结合定量评价,该分析技术具有生态友好、灵敏、选择性好、快速等特点;QuE-ChERS被广泛应用于食品基质(水果和蔬菜)中农药残留检测,现主要将QuE-ChERS与超高效液相色谱-串联质谱(ultra performance liquid chromatography tandem mass spectrometry,UPLC-MS/MS)相结合用于茶叶中的AFs与多种霉菌毒素的检测,该方法获得了令人满意的回收率(78.94%~121.00%)[58,64,69];目前解决基质效应的最新趋势是采用稀释进样技术,该方法的优点是简单、样品损失最小、吞吐量高、分析物种类多。但在茶叶霉菌毒素检测方面该技术仍处于方法建立阶段,还有待进一步开拓其在不同茶样中的应用[73]。
IAC是一种利用抗体与抗原特异性结合的净化方法,该方法净化后的霉菌毒素纯度高,已应用于大多数的样品检测当中,但由于抗体特异性、净化耗时长与柱子不可重复使用等原因均限制了IAC的应用[61,66]。MFC与IAC相比无需经过活化、淋洗和洗脱步骤,净化时间更短、操作更简单。MFC可以通过对茶叶样品的基质进行选择性地吸附,减少样品基质对待测霉菌毒素的干扰,但该方法对部分霉菌毒素的特异性差,存在吸附毒素本身的问题,造成回收率偏低[24,70]。目前,已有MFC-IAC联合净化法,该方法通常用于复杂的基质,具有优异的分离能力和较高的灵敏度和回收率(75%~120%),但该方法预处理过程复杂且昂贵,尤其是对茶叶而言[59,70]。
综上,未来应开发净化和预浓缩步骤,以提高方法的分析能力。其中,基于纳米材料、生物材料和合成材料的样品预处理和分析技术被认为是测定霉菌毒素的重要方法[64]。据报道,二氧化硅/石墨烯氧化物和多壁碳纳米管(multiwalled carbon nanotubes,MWCNTs)已成功应用于谷物和食品中AFs的检测。此外,已有研究报道了胺化多壁碳纳米管对茶多酚和叶绿素的去除能力,以及基于MWCNTs开发的AFs检测生物传感器[64]。虽然新的技术层出不穷,但也有学者指出茶在饮用方式上与其他谷物相比有着根本的差异,评价饮茶中摄入的霉菌毒素应该根据其饮用方式的不同做出相应调整[20]。
3.2 检测技术
基于侧向流试纸条(lateral flow test,LFT)、酶联免疫吸附测试(enzyme linked immunosorbent assay,ELISA)和液相色谱(liquid chromatography,LC)的霉菌毒素检测方法已被广泛采用,在检测常见的霉菌毒素方面已建立了良好的基础[62,66,74]。LFT可实现快速筛选且抗基质干扰,无需对样品进行复杂处理,但该方法线性范围不及现代仪器分析,且重现性较差[74]。ELISA具有操作简单、分析时间短等优势,但该方法需要制备特定的抗体,面临着开发难度大、重现性差、易出现假阳性等问题。例如,在ACT联合ELISA试验中,样品的预处理不仅费时,而且会存在假阳性的问题[62]。相比于LFT和ELISA,LC是目前应用最广的检测方法,LC包括高效液相色谱(high performance liquid chromatography,HPLC)和UPLC/MS/MS等。LC在提取上有试剂用量少、萃取体积小的优点;在结果上有灵敏度高、回收率高、选择性好、稳定性高和假阳性率低等优点,此外,LC还可以应用于同时检测多种霉菌毒素[31,66]。然而,LC的柱前或柱后衍生化需要大量的衍生剂(如三氟乙酸),这会对仪器造成损害。同时LC依赖于基质的电离抑制,因此想要准确定量目标分析物就需要进行耗时且复杂的矩阵匹配校正[69]。
一般情况下,由于强烈的基质效应,茶叶中霉菌毒素的平均回收率在80%左右[65]。但这些技术既耗时又会产生大量有机溶剂废物,不符合绿色化学的要求。考虑到OTA、AFs本身具有荧光性,Gonzalez等[59]基于并行因子分析(parallel factor analysis,PARAFAC)和多元曲线分辨率交替最小二乘法(multivariate curve resolutionalternating least squares,MCR-ALS)联合高效液相色谱-荧光检测法(high performance liquid chromatographyfluorescence detection,HPLC-FLD)进行检测,以极低的溶剂就可实现定量。Bogdanova等[58]建立二维液相色谱-飞行时间质谱(two-dimensional liquid chromatography with time-of-flight mass spectrometry,2D-LC-TOF-MS)同时检测出普洱茶中70 种霉菌毒素,该方法不仅能够快速准确地分析复杂基质样品中的霉菌毒素,而且在分离不同霉菌毒素时具有更好的效果,使得分析结果更清晰准确。同时,该方法还可检测到极少被关注的OTB。此外,利用HPLC与高分辨率串联质谱联用检测农药残留、霉菌毒素、吡咯里西啶和生物碱的方法已在小麦、韭菜和茶等食品中有所应用[75],未来利用高分辨率技术检测茶叶中的霉菌毒素将成为趋势。茶叶中霉菌毒素检测方法与评价指标见表3。
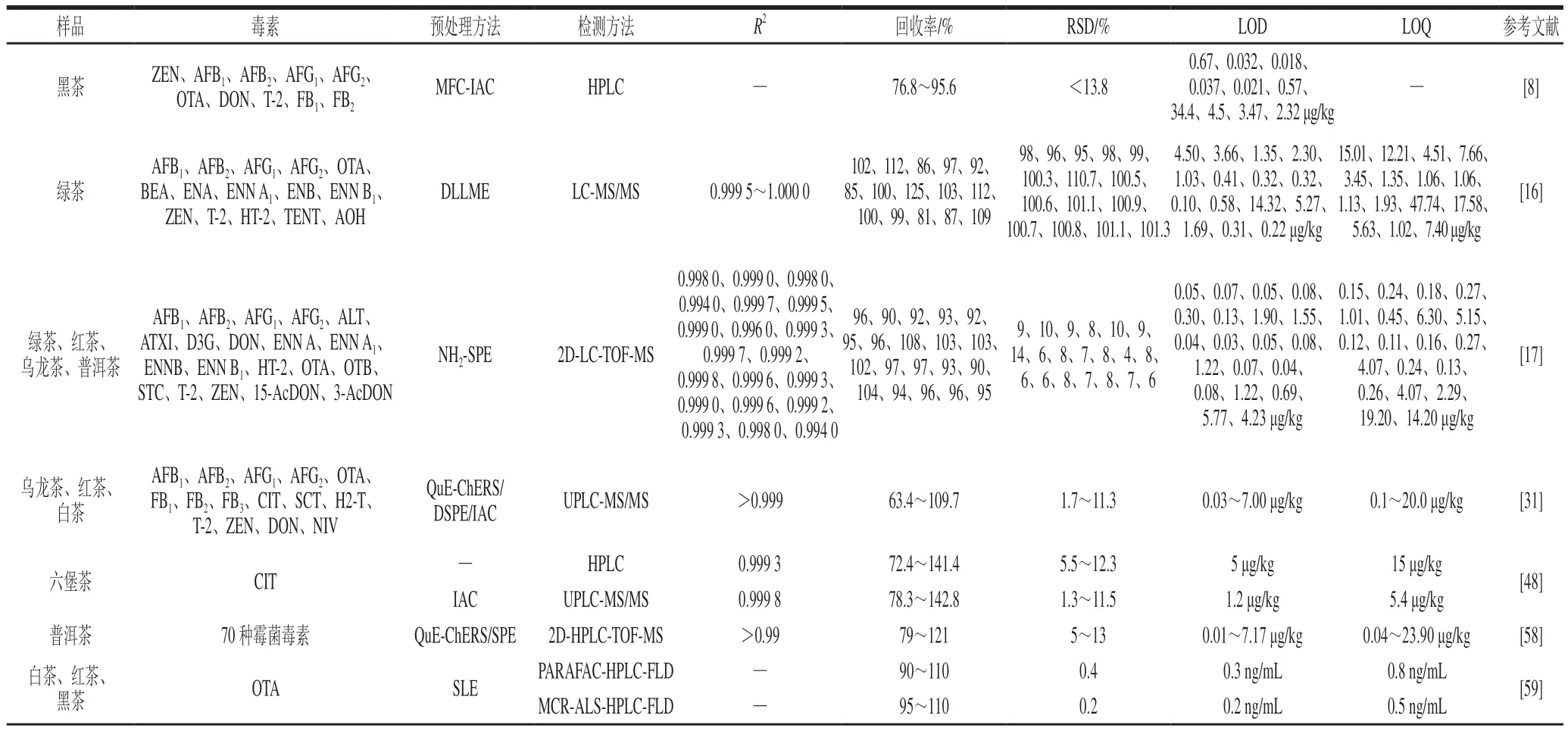
表3 茶叶中霉菌毒素检测方法与评价指标Table 3 Detection methods for mycotoxins in tea and their figures of merit
综上所述,茶叶中的霉菌毒素检测研究目前多集中在AFs、OTA、DON中,其他毒素(如STC、AHO和PAT)关注较少,而关注多种霉菌毒素的研究更少。在六大茶类中,针对黑茶的检测占据大多数,青茶、白茶和黄茶中较少涉及。值得注意的是,由于样品及测定方法不同,茶叶中的霉菌毒素的检测结果并不一致。针对茶叶基质中的霉菌毒素的快检技术研究较少,现有的定量分析方法不足以实现未知霉菌毒素的准确定性定量分析,是否存在假阳性的问题还有待深究。此外,这些研究中大多没有说明其检测样品的原始状态、具体来源和仓储状态等情况,这为霉菌毒素的科学风险评估带来难题。因此,建立一种可靠的、能有效降低茶叶基质干扰的霉菌毒素检测方法势在必行。
4 控制措施
4.1 育种与改良
在防止作物在收获前被污染方面,可以通过植物育种和基因工程增强抗霉菌基因,使用生防剂及针对霉菌毒素开发中的调控基因来提高宿主抵抗力[46]。在植物中基于基因工程开发宿主植物对霉菌毒素的抗性已有先例[76]。Solliman等[77]将从鹰嘴豆(Cicer arietinumL.)中分离的防御基因作为抗霉菌基因生产转基因番茄,增强了番茄的抗霉菌性能。Chen Qiming等[78]发现苹果抗再植病相关基因MdCERK1-2的超表达可以影响本氏烟草植物的多重防御反应并增加其对霉菌病原体的抗性。该研究还发现超表达MdCERK1-2增强了苹果对霉菌病原体的防御反应。然而,育种改良技术在茶树中的研究较少,但有望形成一种趋势,其中,有研究在大吉岭茶树中发现AV-2栽培品种在抗水疱病(病原菌为Exobasidium vexans)方面具有优势,可作为今后茶树选育的参考[79]。
4.2 控制加工条件
当前,茶叶质量控制所面临的挑战之一是在不影响原有品质的情况下消除危害因素。所以控制霉菌毒素的方法在很大程度上是预防性的,其中良好的农业实践和适应的加工方式对茶叶而言尤为重要[46]。我国国家标准要求在茶叶生产过程中严格遵守GB/T 20014.12—2013《良好农业规范: 第12部分 茶叶控制点与符合性规范》[80]、GB/T 32744—2016《茶叶加工良好规范》[81]和GB/Z 21722—2008《出口茶叶质量安全控制规范》[82]等,确保加工和仓库等场所保持干燥、通风和清洁,并设立防霉设施。茶叶在贮藏时应该符合GH/T 1071—2011《茶叶贮存通则》规定,即确保茶叶无霉变[83]。Zhang Xuanjun等[24]认为中国茶叶所选择的低温贮藏和真空包装的方式可有效避免霉菌污染。
此外,研究表明,对加工场所及加工的各个环节采取相关的措施可有效降低霉菌侵染的风险及霉菌毒素污染程度。比如,Tong Wei等[32]研究发现利用10 g/L NaClO溶液对鲜叶进行杀菌可有效降低鲜叶表面微生物丰度,但杀菌后所制成的红茶中总儿茶素和茶氨酸的含量降低。而传统的热杀菌技术在应用时也被发现会影响茶叶品质[84]。如今,随着技术的发展,利用辐照杀菌等技术进行产品杀菌能有效保证茶叶品质。Jayasinghe等[85]利用Co-60 γ辐照器对市售锡兰红茶进行辐照,发现5 kGy是有效确保微生物安全、保留市售锡兰红茶的物理参数和总多酚含量的最佳剂量。Hayashi等[86]研究发现绿茶在200 kV的加速电压和8 μA的束流条件下暴露15 min对其颜色和芳香成分没有影响,不会降低其商业价值,同时还可以净化茶叶,且没有显著的质量劣化。因此,在确保茶叶原有品质的基础上,探究适合鲜叶与成茶的杀菌技术及安全性是未来的研究热点之一。
4.3 完善限量标准
目前,关税同盟国家(亚美尼亚、白俄罗斯、哈萨克斯坦、吉尔吉斯斯坦和俄罗斯)就茶叶中的霉菌毒素制定了相关限量标准,规定生茶中AFB1的限量为5 μg/kg。此外,印度规定AFT在红茶中的限量为30 μg/kg,阿根廷规定凉茶冲泡原料中的AFB1和AFs限量分别为5 μg/kg和20 μg/kg。中国则暂未针对茶叶中的霉菌毒素制定相关的限量标准[2,24]。因此,为了评估霉菌毒素在茶中的安全风险,有必要参考上述国家对不同种类的茶叶进行霉菌毒素监管的代表性研究,并应选择其他食品的霉菌限制标准作为参考,建立适用于茶叶中霉菌毒素的限量标准[49]。
4.4 建立风险效益评估机制
根据茶叶的特殊性,其摄入方式不同于其他食品,饮茶者往往采用沸水冲泡干茶后饮入茶汤,弃去茶渣,但目前茶叶中的霉菌毒素风险评估机制主要参考食品中的评估机制,这不利于正确分析茶叶中的霉菌毒素风险。因此,只有在冲泡过程中进入茶汤的霉菌毒素(即“有效风险量”)才能造成健康风险[34]。建立风险效益评估机制,评估由饮茶诱发的霉菌毒素风险和茶叶的健康作用之间的关系,调查茶叶中霉菌毒素在茶汤中的转移情况,并对商品茶产品中是否存在多种霉菌毒素进行分析[46],完善风险评估机制,这将有助于指导政府制定食品政策和刺激消费者消费行为[47]。
5 结 语
茶叶中的霉菌病害作为一种严重的国际卫生问题已成为关注焦点,在茶叶种采、加工及流通过程中存在受霉菌污染的风险。如今,针对茶叶中霉菌及其毒素的定性定量与风险评估已成为研究热点。但仍然需要引起注意的是:首先,目前针对茶叶中的霉菌毒素的研究数据仍然有限,茶叶与霉菌接触后是否一定会产生毒素,毒素的转移率如何等问题目前尚未完全阐明;其次,针对茶叶中的霉菌毒素分析检测技术还有待进一步完善;最后,针对茶叶中的霉菌及其毒素的监督管理力度还不足,相关法律法规体系还不健全,专门针对茶叶霉菌的管理措施还有待进一步研究。因此,掌握茶叶中霉菌毒素的来源,研究茶叶中常见霉菌及其毒素的危害,制定相应的控制措施并完善分析检测体系,对提升茶叶质量具有重大意义。
