食源性活性肽递送系统的研究进展
2023-10-17陈梅香苏绿欣何建林洪碧红
陈梅香,张 洋,苏绿欣,何建林,洪碧红,*,张 怡
(1.福建农林大学食品科学学院,福建 福州 350002;2.自然资源部第三海洋研究所,海洋生物资源开发利用工程技术创新中心,福建 厦门 361005)
随着经济的发展和物质生活的丰富,人们逐渐意识到饮食对健康的影响。富含维生素、矿物质和其他生物活性物质(如黄酮、多酚、多糖、肽等)的食物在营养健康产业中越来越受到重视。食源性活性肽(foodderived bioactive peptides,FBPs)是指由食物蛋白水解产生的各种氨基酸序列片段,通常由2~20 个氨基酸组成,分子质量小于6 kDa[1]。FBPs不仅营养丰富,同时具有免疫调节、缓解疲劳、抗氧化、降血压等重要生理功效,在预防和减轻各种慢性疾病中起积极作用,引起了人们广泛的关注[2-3]。
目前,国内外对于FBPs的研究主要集中在制备技术和生物学功能等方面,并取得了不错的进展,但这些基础研究向实际应用转化率较低,主要原因有:1)FBPs多具有不良的味道特征,感官可接受性差;2)FBPs在加工、贮存和运输期间的稳定性易受外界环境因素的影响;3)FBPs口服进入体内后,在消化吸收过程中稳定性差且难以控制,吸收效率低[4]。这些问题严重阻碍了FBPs在食品领域中的应用,为了解决上述问题,研究人员探索了各种策略,其中递送系统被证明是一项行之有效的技术。递送系统将FBPs装载在载体基质中,在实现其持久稳定活性的同时控制FBPs的释放行为,从而提高FBPs的生物利用度。本文讨论了制约FBPs在食品工业中有效利用的主要因素,汇集分析了脂质体、乳液、聚合物纳米颗粒、水凝胶这4 种递送系统在包埋、保护和递送FBPs中的应用进展,总结了FBPs递送系统所面临的问题,同时对其未来研究重点提出建议。
1 FBPs的来源
FBPs在前体蛋白质结构中不活跃,需要经外源性蛋白或内源性蛋白酶水解、化学水解或微生物发酵等方式从食物蛋白质中释放出来才能发挥作用[5-6](图1)。目前,人们已经成功地从各种食物蛋白中制备和鉴定出多种FBPs。FBPs的蛋白来源丰富,根据蛋白属性可分为3 类——植物源、动物源和微生物源。植物源蛋白大多来自谷物和蔬果,研究较多的有玉米蛋白[7]、核桃蛋白[8]、大豆蛋白[9]、大米蛋白[10]等;动物源蛋白主要来自禽肉、蛋、乳制品、昆虫和海洋生物,如牛奶[11]、鸡肉[12]、罗非鱼[13]、牡蛎[14]、虾[15]等;来自微生物的FBPs相对较少,主要来自菌类和藻类,如酵母[16]、纳豆芽孢杆菌[17]、螺旋藻[18]等。由于蛋白结构的复杂性,不同蛋白来源FBPs的生物活性各不相同,这些FBPs具有安全性高、成本低等共同优点,是现代保健食品和药物开发不可或缺的组分。
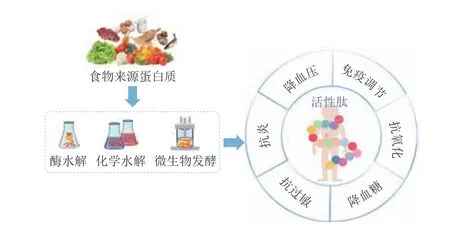
图1 FBPs主要的制备方法和生物活性Fig.1 Major preparation methods and biological activities of FBPs
2 FBPs在食品工业应用中面临的挑战
2.1 不良风味
食物蛋白水解后产生的FBPs呈甜味、鲜味、咸味和苦味等滋味,从而赋予产品丰富的口感和味道。其中,苦味在很大程度上影响了产品的感官品质,降低了消费者的接受度和购买意愿[19]。FBPs产生的苦味与多种因素有关。疏水性氨基酸是影响FBPs苦味的重要因素,二者呈正相关[20]。但疏水性氨基酸对FBPs的活性具有重要影响,大多数抗氧化肽和血管紧张素转换酶(angiotensin converting enzyme,ACE)抑制肽中通常含有丰富的疏水性氨基酸[21-22]。Mongkonkamthorn等[23]采用中性蛋白酶水解金枪鱼血得到的水解产物(tuna blood hydrolysate,TBHN)在体外有显著的抗氧化活性和ACE抑制活性,但具有强烈的苦味,通过分析TBHN的氨基酸组成发现,TBHN的疏水性氨基酸含量达总氨基酸含量的60%。
目前,降低FBPs苦味的方法包括进一步水解肽段、膜分离及色谱分离已知的苦味肽等[19]。但这些方法在一定程度上会破坏FBPs的生物活性,且在实际应用中存在生产成本过高等问题,产业化开发应用中可行性低。因此,需要寻求一种有效的工艺技术改善FBPs的苦味,以提高FBPs的适口性,拓展FBPs的应用范围。
2.2 加工及贮运的稳定性
在生产加工及贮运期间FBPs不可避免地暴露在各种环境条件下,其稳定性受到多种因素的影响(图2)。
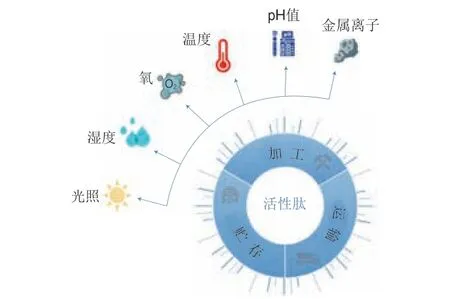
图2 一些影响FBPs稳定性的环境因素Fig.2 Environmental factors affecting the stability of FBPs
2.2.1 温度对FBPs稳定性的影响
热处理(如蒸煮、热灭菌和干燥等)是食品生产中的重要步骤,但高温会导致FBPs的结构和构象发生改变,使FBPs的生物活性降低。Wang Jing等[24]研究核桃肽的热稳定性时发现,核桃肽的ACE抑制活性在20~60 ℃之间保持稳定,在80 ℃时抑制活性为初始活性的80%以上,在100 ℃时则下降到70%左右。裴云成等[25]研究了杏鲍菇柄肽在20~100 ℃条件下的抗氧化活性变化规律,发现杏鲍菇柄肽的1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除活性随着温度的升高而下降。温度超过40 ℃后,杏鲍菇柄肽的抗氧化活性明显下降,当温度达到100 ℃时其DPPH自由基清除活性只保留了76%左右。
2.2.2 pH值对FBPs稳定性的影响
加工和贮运过程中溶液的pH环境是影响FBPs稳定性的另一个重要因素。一般来说,不同蛋白来源的肽具有不同的适宜pH值范围,在这个pH值范围内FBPs的结构和活性相对稳定;而在强酸或强碱溶液环境中,FBPs可能会进一步水解、发生消旋或脱酰胺反应[26]。刘晓艺等[27]研究红花籽抗氧化肽的pH值稳定性,发现溶液体系的pH值在6~8时,红花籽肽DPPH自由基清除率可达到初始值的98%左右,而在强酸或强碱环境下其清除率仅有初始值的40%左右。Liu Yuanyuan等[28]发现当pH值从2增加至10时,蚕蛾肽的氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)先升高后降低,其在pH值为4~8范围内的稳定性最好。
2.2.3 金属离子对FBPs稳定性的影响
FBPs在食品生产各个阶段中可能会接触到一些金属容器,或同其他富含金属离子的原辅料一起加工。金属离子的加入会改变FBPs溶液的电荷,诱导FBPs与其形成复合物,对FBPs的稳定性具有一定的影响。宋贤娟等[29]从辣木籽蛋白中分离鉴定出两个抗菌肽组分F2和F3,发现抗菌肽F2和F3在MgCl2溶液中的抑菌活性显著降低,其抗菌活性的保留率分别为初始值的43.04%和44.43%。郑昌亮等[30]研究了Cu2+、K+、Mg2+对鳙鱼肌原纤维蛋白源抗氧化肽稳定性的影响,发现这3 种金属离子均可抑制抗氧化肽的自由基清除活性,其中Cu2+的对抗氧化肽的稳定性影响最显著,在Cu2+质量浓度为250 µg/mL时,该抗氧化肽的DPPH自由基清除率约为初始值的48%。
2.2.4 其他因素对FBPs稳定性的影响
除了上述几个主要的影响因素外,氧气及环境湿度也是影响FBPs稳定性的重要因素。FBPs大多以喷雾干燥或冷冻干燥制备的粉末形式贮存,但这些干燥的粉末普遍具有较强的吸湿性,暴露在空气中容易吸湿,出现结块发黏、液化、腐败等现象,造成肽粉发生变质、营养损失、感官品质下降等不良后果[31]。Wang Ke等[32]在对海参肽粉(sea cucumber peptide powders,SCPPs)的风味及活性的研究中发现,SCPPs在贮存期间会迅速吸收水分呈现黏稠状,产生并积累其他异味物质,严重影响产品质量。不仅如此,SCPPs在贮存24 h和80 d后抗氧化活性降低,对羟自由基的清除率分别下降到初始值(44.17%)的30.59%和10.30%。Masum等[33]指出乳清水解物粉末吸湿性强,容易发生黏连,贮运稳定性差,导致乳清水解物在婴幼儿配方奶粉中的应用受限。因此,为了充分发挥FBPs在食品工业中的应用价值,有必要提高其在加工及贮运过程中的稳定性。
2.3 胃肠道消化吸收障碍
经口服摄入FBPs的方式具备便捷、可接受度高等优势[34]。研究指出FBPs口服摄入后须以完整的、具有活性的结构片段进入血液循环到达作用靶点,且积累到一定量时才能在体内真正发挥促健康作用[35]。然而,FBPs在这个过程中会受到一系列生化屏障和物理屏障的阻碍(图3),使得FBPs的结构和生物学特性发生不同程度的改变,最终导致其在体内的生物利用度较低。胃肠道中pH值及各种消化酶(淀粉酶、胃蛋白酶、胰蛋白酶、羧肽酶和氨肽酶等)是FBPs主要的生化屏障[36]。Qian Jingjing等[37]测定了酪蛋白源促睡眠肽YPVEPF的体外消化稳定性,发现YPVEPF对胃肠道酶不耐受,在消化结束后几乎完全被降解。Wong等[38]发现抗氧化肽WAFAPA的2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除活性经体外模拟消化后有所降低,其半抑制浓度(half maximal inhibitory concentration,IC50)比初始值提高了1.3 倍。研究表明西班牙火腿肽AEEEYPDL经人工胃、肠液处理后,被降解为四肽AEEY和三肽PDL,并失去其抗氧化活性[39]。
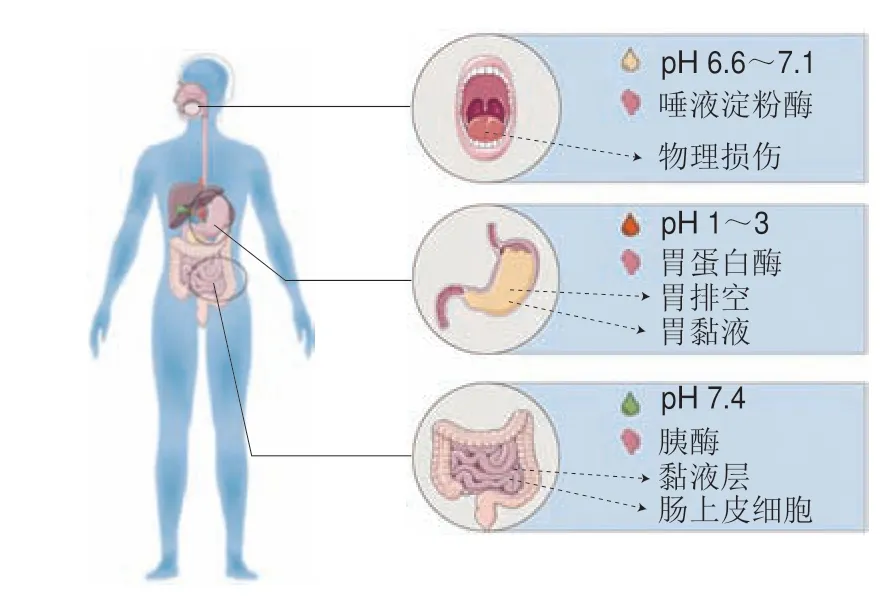
图3 FBPs口服后面临的主要吸收障碍Fig.3 Major absorption barriers faced by FBPs after oral administration
肠上皮屏障是影响FBPs吸收的重要物理屏障,FBPs被肠上皮细胞完整转运吸收的可能途径包括:1)细胞旁路转运,即肽分子经被动转运通过肠上皮细胞之间的细胞间隙,是带负电荷、亲水性肽的首选途径,如R L S F N P、V G P V 和G P R G F[40-41];2)跨细胞被动扩散,即肽分子从细胞内向基底外测膜扩散,该途径适用于某些带正电荷、疏水性肽。Schumacher-Klinger等[42]发现遮蔽环N-甲基化六肽的亲水性残基(精氨酸和天冬氨酸)有利于提高肽的跨膜通透性,进而提高肽的生物利用度;3)寡肽转运体1(oligopeptide transporter 1,PepT1)介导转运,PepT1是存在于肠上皮细胞的一种特异性载体蛋白,优选结合短链(二肽和三肽)、带中性电荷肽及疏水性寡肽,如ACE抑制肽IPP、LKP和IQW[43-44];4)胞吞转运,适用于一些长链、带正电荷、疏水性的肽,它们与肠上皮细胞细胞膜相互作用,形成囊泡转运进入细胞内,如油菜籽衍生肽YWDHNNPQIR[45]。尽管FBPs能够被肠上皮细胞完整转运吸收的途径多样,但其转运吸收能力普遍较弱[46]。Satake等[47]利用Caco-2单层模型测定酪蛋白源ACE抑制肽VPP的吸收率,发现能够被Caco-2细胞吸收的VPP仅有8%左右。玉米源五肽YFCLT和六肽GLLLPH易被肽酶降解为更小的肽或氨基酸[48]。因此,如何提高FBPs在胃肠道消化吸收中的稳定性成为FBPs研究及其高效利用中亟需克服的关键问题。
FBPs的转运机制和吸收效率除了受自身分子质量、疏水性和净电荷等因素的影响外,食品基质中共存的其他化合物也会影响FBPs的吸收。Lacroix等[49]研究发现将乳清蛋白源二肽基肽酶-IV(dipeptidyl peptidase IV,DPP-IV)抑制肽添加到含有无机盐和葡萄糖的基质中时,Caco-2细胞中的肽酶对DPP-IV的降解程度更高。另外,儿茶素被证明可以下调载体蛋白PepT1的表达,导致二肽VY转运吸收量减少[50]。
3 FBPs的胶体递送体系
递送系统的发展为FBPs稳态化应用提供了一种新途径,其在改善FBPs的分散性、稳定性及提高生物利用度方面展示出独特的优势[51]。每种递送系统的组成结构和功能特性不尽相同,研究者需要根据FBPs的性质和具体加工需求选用合适的递送系统。常见的FBPs递送系统类型如图4所示。表1列举了不同递送系统的制备方法和优缺点。
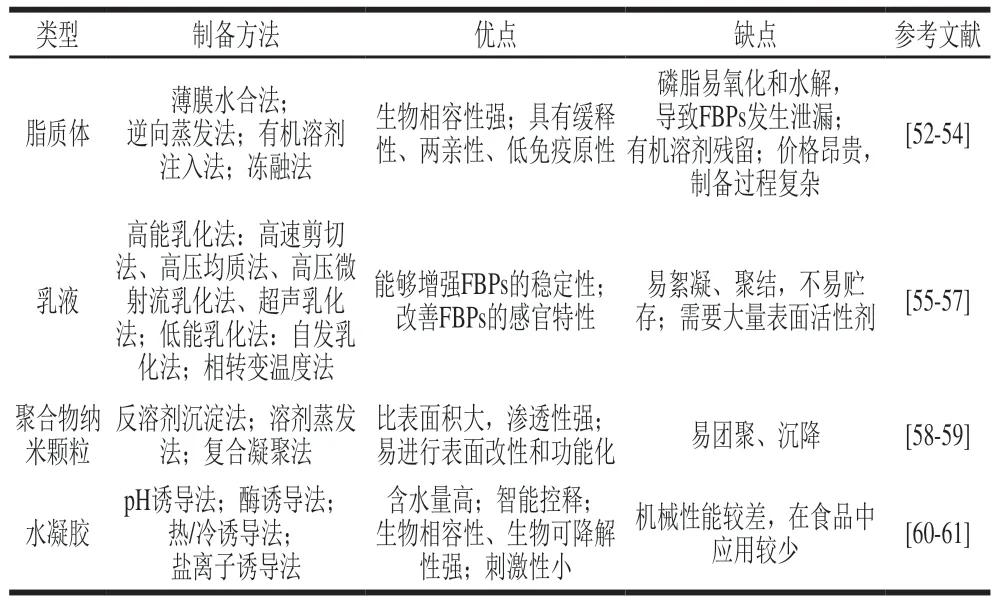
表1 不同FBPs递送系统的制备方法及优缺点Table 1 Preparation methods and advantages and disadvantages of different delivery systems for FBPs
图4 典型递送系统的结构示意图Fig.4 Schematic diagram of the structure of a typical delivery system
3.1 脂质体
脂质体是具有双层膜结构的小球囊泡体。磷脂是制备脂质体的主要材料,其结构包含一个亲水性头部和两个疏水性尾部。当磷脂分子分散在水溶液中时会产生疏水效应,疏水尾与极性环境保持屏蔽并聚集在一起而产生不同区域的极性差异,可用于包埋各种疏水性(磷脂双层膜中)、亲水性(极性水核心)和两亲性(磷脂双层膜与水相界面处)活性组分[62]。胆固醇是脂质体的另一种重要组成成分,其扮演着“缓冲剂”的角色,能够帮助调节磷脂膜的流动性和通透性,以此维持脂质体结构的稳定性。
脂质体作为FBPs的递送载体,能够保护FBPs免受金属离子、pH值和酶等不利环境因素的影响,延缓FBPs在体内的释放。脂质体的结构与生物膜相似,具有优异的生物相容性、低毒性和低免疫原性等特征,有利于FBPs被人体高效吸收。宋敬一[63]以蛋黄卵磷脂、胆固醇为原料,通过乙醇注入法制备包埋蛋清抗氧化肽EWPH的脂质体,EWPH的包埋率为65.7%。体外缓释实验结果显示,游离肽在胃液中消化2 h后的释放率达64%,而脂质体的释放率仅为48%。在肠液消化过程中,脂质体的释放率也始终低于同一时间的游离肽,表现出良好的缓释效果,提高了EWPH的生物利用度。Xu Jinjin等[64]采用薄膜水合法制备包埋牡蛎蛋白水解物(oyster peptide hydrolyate,OPH)的脂质体,明显改善了OPH的贮存稳定性,且包埋后OPH的DPPH自由基和ABTS阳离子自由基清除活性较游离的OPH均有显著提高。在体外缓释实验中,游离OPH在24 h内释放率超过83.06%,而脂质体中OPH仅释放约63.84%,释放速率减慢。Zhang Tao等[41]将乳源ACE抑制肽RLSFNP包埋在脂质体中,发现RLSFNP具有更高的表观渗透性系数Papp(包埋前Papp为8.29×10-7cm/s,包埋后Papp为1.72×10-6cm/s),表明脂质体可以提高RLSFNP的生物利用度。
然而,脂质体在实际应用中也存在着一些缺陷。如脂质体的磷脂膜对高温、离子强度和酶敏感,易发生氧化和水解,导致脂质体囊泡大量聚集、融合和破裂,使得FBPs从脂质体中泄漏[65]。除了添加天然的抗氧化剂外,另一种可行的方法是通过壳聚糖、果胶、聚乙二醇等聚合物对脂质体进行表面修饰,进一步提高脂质体的稳定性和缓释能力。Ramezanzade等[54]将带正电荷的壳聚糖吸附在脂质体表面,二者通过氢键和静电相互作用形成新的递送载体,用于包封虹鳟鱼抗氧化肽。结果表明,壳聚糖-脂质体在加工和贮存过程中的稳定性优于常规脂质体,且壳聚糖-脂质体的缓释能力受壳聚糖浓度调控:当壳聚糖浓度从0.2%增加到1.0%时,其缓释能力也逐渐增强。Lopes等[66]以大豆磷脂酰胆碱为原料制备装载乳链菌肽的脂质体,并研究果胶或聚半乳糖醛酸的修饰对脂质体性能的影响,其制备的果胶-脂质体和聚半乳糖醛酸-脂质体中乳链菌肽的包埋率分别为87.9%和84.0%,与常规脂质体相比,经果胶和聚半乳糖醛酸修饰后的脂质体缓释性和贮存稳定性明显提高。Jiang Xiaoxiao等[67]将乳源降胆固醇肽LQPE装载在经嗜酸乳杆菌CICC6074 S层蛋白(S-layer protein,SLP)修饰的脂质体中,与游离肽和常规脂质体相比,SLP-脂质体表现出更好的胃肠道耐受性和缓释性,跨上皮转运实验证明,LQPE被SLP-脂质体包埋后转运量显著增加。
3.2 乳液
乳液是由两种互不混溶的相以及乳化剂按适当比例形成的分散体系。根据乳液结构特点,分为单乳液(O/W、W/O)和双重乳液(W/O/W、O/W/O)[68]。乳液的性能主要受两相组成、乳化剂种类及乳化条件的影响。Giroux等[69]通过两步乳化法制备W/O/W乳液,研究不同油相(荷荷巴油、亚麻籽油、矿物油)对乳液中β-乳球蛋白水解物释放效果的影响。结果表明,β-乳球蛋白水解物在胃肠道中的释放速率与油相黏度相关,β-乳球蛋白水解物在以亚麻籽油为油相的乳液中生物利用度更高。Zhu Zhenbao等[70]分别以茶皂素、皂素和吐温-80作为乳化剂,考察不同类型乳化剂对乳液稳定性的影响。研究发现,以茶皂素为乳化剂的乳液在30~90 ℃、pH 3~9、NaCl浓度300~500 mmol/L条件下稳定效果最好。Ying Xin等[71]比较不同的乳化条件(1 000 r/min高速剪切3 min、1 000 r/min高速剪切13 min、1 000 r/min高速剪切3 min后100 bar高压均质3 次)对W/O/W乳液的粒径及乳液中大豆肽包埋率的影响,发现W/O/W乳液的平均粒径随着输入能量的增大显著减小,3 种乳化条件下依次为10.70、8.30、3.57 µm。但高强度的乳化条件会导致乳液液滴破裂,从而使大豆肽泄漏到外水相中,造成大豆肽的包埋率下降。
乳液在FBPs的保护性包埋、提高溶解性、缓释及风味改良等方面具有巨大的应用潜力。Jamshidi等[72]利用W/O/W双重乳液包埋鱼蛋白水解物,并将其用于生产营养强化型酸奶。发现鱼蛋白水解产物的稳定性和风味得到显著改善,含有鱼蛋白水解物乳液的酸奶感官特性与传统酸奶相似,无明显的苦味和腥味。应欣[73]以聚甘油蓖麻醇酸酯和变性淀粉为乳化剂成功制备了大豆肽乳液,其包埋率达80%以上。与游离大豆肽相比,大豆肽乳液的苦味值减小,且体外模拟消化实验显示大豆肽乳液能够抵抗人工胃液的消化,消化后大豆肽保留率高于70%。Yang Wen等[74]将牡蛎肽包埋在W/O/W双重乳液中,通过冷冻干燥得到乳液微胶囊粉末。研究发现,乳液微胶囊粉末有良好的复溶性,且电子鼻分析结果表明复溶乳液的腥味明显低于牡蛎肽溶液。
虽然乳液应用于FBPs递送系统的前景乐观,但其中所添加表面活性剂的生物毒性一直是食品工业中颇具争议的问题。而且乳液为非热力学稳定体系,长期放置后会出现絮凝、聚结和奥氏熟化等现象,不宜长期贮存。改变连续相的流变特性能够提高乳液的稳定,在乳液中添加蛋白质或多糖可以增加连续相的黏度,从而抑制乳液中相的迁移运动和液滴聚集[75]。另外,Pickering颗粒(如纤维素颗粒、疏水改性淀粉颗粒、脂质晶体、蛋白质/多糖颗粒、无机颗粒等)也常作为一种稳定剂,其在油相和水相中都具有适当的润湿性,但又不溶于任何一相,可以代替表面活性剂不可逆地吸附在油-水界面处[76]。Pickering乳液是乳液的重要分支,与常规乳液相比,Pickering乳液表现出更高的稳定性和更低的毒性,因此在包埋、保护和递送FBPs方面具有良好的应用前景。Cai Luyun等[77]从鲶鱼皮中分离鉴定出一种广谱抗菌肽Parasin I,通过壳聚糖包埋Parasin I作为Pickering颗粒,并以此制备O/W型Pickering乳液。结果表明,Pickering乳液可以保护Parasin I不被细菌代谢物降解,从而获得更高的抗菌性能。与游离Parasin I相比,Pickering乳液显著降低了Parasin I的细胞毒性和溶血性。
3.3 聚合物纳米颗粒
聚合物纳米颗粒是平均粒径范围在10~1 000 nm的固态胶体微粒。FBPs可以通过化学键合、物理吸附和包埋等方式存在于纳米粒子中,使其得到有效保护并抑制其降解。相比其他的FBPs递送系统,聚合物纳米颗粒的形状、结构、尺寸可调节性更强,表面易于功能化修饰,并且聚合物纳米颗粒体积小,有较大的比表面积,在提高FBPs溶解度、溶出度、黏膜渗透性及减轻其细胞毒性方面展现出独特的优势[78]。
聚合物纳米颗粒的制备有两种基本方法:一种是“Top down”法,即以机械力作为能量将较大的颗粒分解成较小的纳米级颗粒(物理过程);另一种方法是“Bottom up”法,即通过化学反应或聚合物的自组装产生(化学过程)[79]。在制备过程中,一些无毒且亲和性良好的载体材料更受研究者的欢迎,以多糖(如壳聚糖、淀粉、果胶等)和蛋白质(如明胶、牛血清白蛋白、大豆蛋白、酪蛋白等)两大类为主[80]。张碧莹[81]从蛋清蛋白中分离得到具有ACE抑制和肾素抑制活性的双重活性肽LAPYW,并将其包埋在牛血清白蛋白纳米颗粒中,得到平均粒径为165.37 nm、ζ-电位为48.78 mV的稳定纳米颗粒,LAPYW的包埋率为34.54%。采用Caco-2细胞单层膜模型测定LAPYW的吸收效率,发现LAPYW被包埋后在肠道中的吸收效率较游离LAPYW提高了约1.8 倍,其Papp为4.62×10-7cm/s。Zhu Yiqing等[82]将热诱导的溶菌酶-黄原胶纳米颗粒作为含硒肽的载体,结果显示粒子的平均粒径为153 nm,ζ-电位为-50 mV。对比游离的含硒肽,这种纳米颗粒结构可极大提升含硒肽的稳定性,增强含硒肽的Caco-2细胞渗透性,并表现出更低的细胞毒性。Danish等[83]通过离子凝胶法制备壳聚糖纳米颗粒,用于包埋鸡肉源ACE抑制肽LKP,所得纳米颗粒的平均粒径为200 nm,对LKP的包埋率为65%。体外消化实验结果表明,纳米颗粒能够有效保护LKP不被胃液破坏,拥有更好的时滞释放特性。同样,Auwal等[84]将鱼源ACE抑制肽包埋于壳聚糖中,获得平均粒径为162.47 nm、包埋率(75.36%)较高的纳米颗粒。与游离ACE抑制肽相比,包埋在纳米颗粒中ACE抑制肽的降血压功效显著提高,这与ACE抑制肽在自发性高血压大鼠体内的持续释放作用及其较高的肠道渗透性有关。
聚合物纳米颗粒由于制备方法和材料的不同,对FBPs的装载效率也存在一些差异。若仅以单一聚合物材料作为载体制备聚合物纳米颗粒存在包埋率低、稳定性差等不足。有研究指出,通过不同聚合物材料的组合能够提高纳米颗粒对外界环境的抵抗能力。崔敏[85]分别使用牛血清白蛋白和葡聚糖-牛血清白蛋白复合纳米粒子包埋蛋清肽,研究温度对其稳定性的影响。结果显示,70、80、90 ℃水浴加热30 min后,前者的粒径随着温度的升高而增大,而后者的粒径没有发生明显变化,表明葡聚糖与牛血清白蛋白联用提高了纳米粒子的热稳定性。
3.4 水凝胶
水凝胶是一种由亲水性聚合物通过物理(热、pH值、酶、盐)或化学交联(二硫键、氢键、疏水或静电相互作用等)方法形成的三维网络。水凝胶含有丰富的孔隙,能够吸收大量水(>90%)作为分散介质,有良好的延展性、柔弹性和溶胀性[86]。一般亲水性活性组分可以直接与聚合物溶液混合形成水凝胶,而疏水性活性组分则需要先装载在基于油脂基的疏水性载体中,再将其固定在水凝胶的网络结构中[87]。水凝胶是FBPs的理想载体,其具有组织刺激性小、可再生、生物相容性和生物降解性好等众多优点,在FBPs缓释、靶向输送方面的应用越来越广泛。
水凝胶的载体材料包括合成聚合物和天然聚合物。常见的合成聚合物材料有羧甲基纤维素、聚丙烯酸、聚甲基丙烯酸、聚乙二醇和聚L-谷氨酸等,这类材料制备的水凝胶主要被用在生物医学材料领域。而在食品领域中,主要选择天然聚合物作为水凝胶的基质成分,例如蛋白质(明胶、乳清蛋白、酪蛋白、大豆蛋白等)或多糖(淀粉、壳聚糖、海藻酸盐、果胶、纤维素等)[79-80]。近年来,研究者对在特定环境(温度、离子强度、pH值、酶、磁性等)具有刺激响应性的智能水凝胶产生了浓厚的兴趣。智能水凝胶能够实现FBPs的定点、定时和定量释放,例如Steichen等[88]设计出聚(甲基丙烯酸-共聚-N-乙烯基吡咯烷酮)接枝聚乙二醇(P((MAAco-NVP)-g-EG))的三元共聚物水凝胶。研究发现,P((MAA-co-NVP)-g-EG)水凝胶在胃的酸性条件下收缩,以保护多肽不被蛋白酶降解,而在小肠的中性环境中发生溶胀,使多肽从水凝胶的网状结构中快速且完全释放。类似地,Lu Sitong等[89]以巯基化壳聚糖碳酸钙纳米粒(CS-NAC(CaCO3))、海藻酸盐(alginate,ALG)为原料,制备具有pH值响应性的水凝胶,用于包埋罗非鱼皮胶原蛋白肽(tilapia collagen peptide,TCP)。CSNAC(CaCO3)/ALG/TCP水凝胶前体溶液接触胃酸后会释放出Ca2+,其产生的海藻酸钙交联的三维蛋壳结构可以保护TCP免受胃液破坏,并有效延长TCP在胃中的释放时间。通过乙醇诱导胃损伤小鼠模型并进行干预实验,观察到CS-NAC/ALG/TCP水凝胶具有较强的胃黏膜黏附性,可以促进小鼠的胃黏膜伤口愈合。
水凝胶含水量高的同时也存在一些不足,如凝胶网络分布不均、松散多孔,结构强度较弱,持水性以及热性能较差,这与天然生物组织中的水凝胶相差较大。为使水凝胶的机械性能和稳定性得到提高,可通过两种具有互补特性的聚合物形成双交联水凝胶。现已开发了由蛋白质-蛋白质、多糖-多糖或蛋白质-多糖组合的双交联水凝胶,并取得了良好的效果[90]。
4 FBPs递送系统存在的问题
4.1 技术和设备
目前,FBPs递送系统更多停留在实验室研究阶段,在工业化生产中的实践较少,要推进其实际应用,还需要解决诸多问题,包括荷载量低、粒径分布不均、批次间重现性差、产品长期稳定性不足和生产成本高等缺点。在实验室规模上,FBPs递送系统可以采用多种方法制备,但适用于工业化生产的技术却屈指可数。此外,如何把控关键工艺参数是实现FBPs递送系统工业化生产的另一大难题,实验室与工业生产设备不配套的矛盾也需解决。材料学、电子信息学、化学、医学等学科的融合和科技的进步为FBPs递送系统技术的创新优化和设备的研制带来了契机。研究者在兼顾原料、工艺带来成本问题的同时,不断寻求稳定、高效、质量可控、在生产上具有规模化发展性的“多能型”技术和设备,才能有效推动FBPs递送系统的工业化生产。
4.2 质量评价体系
递送系统的质量评价研究是保证FBPs稳定性和功能特性的基础[91]。FBPs递送系统的质量参数包括微观形貌、尺寸、电荷性质、分子内和分子间信息、生物利用度、感官特性等,相应的表征技术如图5所示。尽管这些技术已取得明显进步,但尚存在质量评价不完善的问题,特别是关于FBPs递送系统生物利用度的评价。目前,评价工作多聚焦在体外消化模拟研究和Caco-2细胞培养模拟研究中,这些研究揭示了FBPs递送系统在体外模型中的效果,但无法准确预测FBPs被包埋后在体内的行为和有效性,这是目前研究的重点和难点。综上,FBPs质量评价应该是一个多方位、综合的过程,未来需要建立一套完善的、规范的质量评价体系,从而助推FBPs递送系统的评价和研究,助力FBPs的高效利用。

图5 FBPs递送系统的主要表征技术Fig.5 Major techniques for the characterization of delivery systems for FBPs
4.3 安全性
尽管FBPs递送系统在包埋、保护、递送FBPs中的应用潜力已得到科学界的广泛认可,但其若在没有监管指南和标准化安全评价体系的情况下进入市场,则可能会给消费者带来潜在的隐患。因此,必须对此加以重视。目前无法明确证实包埋FBPs载体材料的安全性,关于FBPs递送系统作用于人体后所形成代谢物毒性的信息也不明晰,且制备工艺中多用到有机溶剂和大量表面活性剂,若被人体长期摄入并积累可能会增加额外的健康风险[92]。
研究人员一直专注于对FBPs递送系统安全性的分析,但仅局限于动物和细胞实验,尚未进行临床试验。因此,仍需开展临床研究,科学合理地评估FBPs递送系统的毒性和蓄积特征,并给出相关产品的推荐日摄食量和可耐受上限摄入量,特别是针对儿童和老人等特定人群。值得注意的是,FBPs递送系统的设计需要在食品理论框架中进行,必须遵循食品安全法规,并且生产者和监管者在这些新技术和产品进入市场之前应确保其安全性,从而提高公众对FBPs递送系统潜在积极影响的认可度。
5 结 语
FBPs具有良好的活性功能,是开发功能性食品和保健品的优质资源,但是FBPs存在风味不佳、稳定性差和生物利用度低等问题,影响其发展应用。幸运的是,国内外学者通过各种递送系统(如脂质体、乳液、聚合物纳米颗粒、水凝胶等)不同程度地改善了FBPs的感官特性和稳定性,并实现了体内FBPs的靶向和缓慢持续释放。在设计和选择合适的FBPs递送系统时,应充分考虑FBPs的理化特性、食品基质间的相容性和经济可行性。根据目前的报道来看,FBPs递送系统以脂质体和乳液的研究最为广泛。脂质体制备工艺相比于其他递送系统更加复杂,存在有机溶剂去除不彻底的风险,且脂质体的关键原料磷脂大多价格较为昂贵。相比之下,乳液不仅可以满足消费者的感官需求,且其面对复杂的食品体系(包括调味品、酱汁、酸奶和饮料)更具适用性,有利于FBPs在食品领域的应用,是FBPs递送系统后续的研究重点。递送系统的发展为富含FBPs产品的开发提供了更多的思路,但仍面临着诸如技术壁垒高、质量评价体系不完善、具有潜在毒性等问题,需要进行深入研究和探讨。随着递送系统应用于食品领域的技术不断发展和成熟,相信在不久的将来,优良的递送系统将为FBPs的应用开辟更新、更广阔的道路。
