手性内酯类化合物的来源及其制备方法研究进展
2023-10-17王靖宇任文彬白卫东
汪 薇,王靖宇,辛 璇,*,任文彬,*,白卫东,毛 悦
(1.仲恺农业工程学院轻工食品学院,广东 广州 510225;2.仲恺农业工程学院 广东省岭南特色食品科学与技术重点实验室,广东 广州 510225)
内酯是指羟基脂肪酸分子内脱去一分子水形成的产物。根据羟基脂肪酸上羟基位置的不同,可将其分为β-内酯、γ-内酯、δ-内酯等[1]。内酯天然存在于各种果蔬(如芒果、桃子和草莓)和动物产品(如肉类和牛乳)中,也是这些食品香气和风味的主要贡献者[2]。内酯类化合物具有较低的香气阈值,如γ-壬内酯、γ-癸内酯和γ-十二内酯在葡萄酒中的香气阈值分别为25 μg/L、0.88 mg/L和7 μg/L[3],在气味描述符上有明显的差别,如桃子果香、椰子香、奶油香和花香等[4]。一些内酯类化合物还兼具抗菌和消炎等生物活性[5-6],这些内酯类化合物已被作为食品添加剂和香料而广泛应用于食品和日化产品中。此外,内酯类化合物也被报道可作为绿色溶剂、燃料和各种高附加值化合物的合成前体物质,如γ-戊内酯[7]。内酯类化合物每年的市场销量达到数千万吨,价格在300~6 000 美元/kg之间[8]。大多数内酯类化合物具有手性结构,其分子的绝对构型通常决定了其香气特征和生物活性。深入了解手性内酯类化合物的来源、结构、香气特征和制备方法,有助于全面认识内酯类化合物,推动内酯类化合物在食品、日化用品等领域中的应用。然而,对于不同种类的手性内酯类化合物的天然来源和制备方法目前鲜见系统综述报道。因γ-内酯(五元环)以及δ-内酯(六元环)的环内角张力最小,是最为稳定的结构,所以γ-内酯和δ-内酯在食品、化妆品、医药和精细化工等领域中应用最为广泛[9]。因此,本文对食品中常见的7 种γ-和δ-手性内酯(γ-戊内酯、γ-己内酯、γ-癸内酯、γ-十二内酯、δ-癸内酯、δ-十二内酯和δ-茉莉内酯)的天然来源、结构、香气特征及其制备方法进行了综述,以期为手性内酯类化合物的应用和制备提供理论基础。
1 手性内酯类化合物的来源
食品中的风味与其原料中内酯类化合物及其前体物质有着密切的联系,而且内酯类化合物的化学结构决定了它们的香气特征和化学性质。手性内酯类化合物广泛存在于自然界中,例如草莓、桃、椰子、杏和茉莉花等,它们作为这些植物吸引捕食者的信号来促进授粉和种子传播[10-11]。红葡萄酒中富含(R)-马索亚内酯,在酒精发酵过程中该芳香内酯被还原为(R)-δ-癸内酯,从而使酒体具有独特的椰子香和无花果干香[12]。内酯类化合物被认为是桃子果香和甜脂香的主要特征香气化合物[13-14]。自然界中大多数内酯类化合物具有手性结构,如(S)-δ-癸内酯,天然存在于树莓中,而(R)-δ-癸内酯则天然存在于桃子、杏、油桃、椰子等[15]中。茉莉花的提取物中只含有(R)-δ-茉莉内酯,而在晚香玉中只合成(S)-δ-茉莉内酯[16]。茶叶中也富含各种手性内酯类化合物,白毫银针中不仅有(R)-γ-壬内酯,而且也有(S)-γ-壬内酯,白牡丹茶叶中有(R)-δ-辛内酯,寿眉中则富含(R)-δ-辛内酯和(S)-γ-辛内酯[17]。这些内酯类化合物因为手性中心的存在,不同的对映异构体间呈现出不同的香气特征和程度(感官差异)。以γ-十一内酯为例,(S)-γ-十一内酯具有脂香、醛香,甜的椰子香;(R)-γ-十一内酯则带有花香、类似于桃子的香气;(S)-γ-己内酯具有奶油香和木质香;(R)-γ-己内酯具有椰子香和甘草香气;(S)-γ-辛内酯具有脂类香气;(R)-γ-辛内酯则带有杏仁香;(S)-γ-壬内酯具有浓烈的脂类香气;(R)-γ-壬内酯则带有霉味[18]。
内酯类化合物在食品中含量低且成分种类繁多,而目前缺少对食品中内酯类化合物手性结构的研究,相关报道仍停留在对其种类和含量的确定分析方面。Niu Yunwei等[19]对浙江奉化玉露桃的香气物质进行了研究,发现内酯类化合物是其关键芳香活性化合物之一,包括γ-己内酯、γ-庚内酯、γ-辛内酯、δ-辛内酯、γ-癸内酯、δ-癸内酯、δ-十二内酯,其中γ-癸内酯(含量为618.53 μg/kg)和δ-癸内酯(含量为4 979.86 μg/kg)的气味活性值(odor activity value,OVA)最高,分别为61.9和49.8。Zhu Jiancai等[13]在5 种不同品种的桃子中也发现了相似的结果。Yoshinaga等[20]比较了黄油和人造黄油的内酯种类,发现γ-十二内酯、δ-癸内酯、δ-十二内酯、δ-十四内酯和δ-十六内酯是黄油的主要内酯类化合物,而人造黄油中主要的内酯为δ-癸内酯和δ-十二内酯。Chen Chen等[21]发现内酯类化合物对用牛乳制备而成的切达尔奶酪的整体风味具有重要的贡献,主要的芳香活性物质为γ-辛内酯、γ-十一内酯、γ-十二内酯、δ-辛内酯、δ-癸内酯和δ-十二内酯。γ-辛内酯在水中的香气阈值为6.5~24.0 μg/mL[22],而在切达尔奶酪中的质量浓度可达到130.0~170.0 μg/mL[23],远高于其香气阈值。δ-十二内酯的在水中的香气阈值极低,仅为0.46~53.00 μg/mL[22],但在切达奶酪中质量浓度可高达19.37~396.26 μg/mL[24]。Haase等[25]对4 种不同产地的新鲜可可果肉中的芳香活性化合物进行了定性分析,发现在测定的65 种芳香活性化合物中内酯类化合物是一类重要的香气物质,包括γ-辛内酯、γ-壬内酯、δ-壬内酯、γ-癸内酯、δ-癸内酯、γ-十二内酯、δ-十二内酯。风味稀释因子(flavor dilution factor,FD)越高,在食品中的风味贡献程度越大。以可可果肉为例,内酯类化合物是其中风味贡献程度最大的芳香化合物,随着产地的不同,其内酯类化合物的贡献度也不同。产自印尼和越南的可可果肉中具有焦糖味和花香味的γ-十二内酯的风味贡献最大,而产自喀麦隆和尼加拉瓜的可可果肉中具有椰子香味的δ-癸内酯的风味贡献最大[25]。除了果肉,一些果核中的种子也富含内酯类化合物,例如,γ-己内酯和γ-壬内酯是樱桃籽重要的香味赋予物。当经过烘烤后,樱桃籽中γ-己内酯和γ-壬内酯的质量分数从2.14%和0.88%分别增加到6.58%和4.20%,这与烘烤脱水增强了一些羟基脂肪酸的分子内酯化有关,从而使风味更佳[26]。γ-丁内酯也是凤凰单丛茶中主要的挥发性成分之一,具有玉兰香[27]。
除了植物,手性内酯类化合物也存在于其他生物体内,如霉菌、酵母和动物[8,28]。Li Guang等[29]对北美豪猪下背部脂质涂层中的挥发性化合物进行测定,发现具有豪猪气味特征的异构体为(R)-δ-癸内酯,并认为这种内酯化合物的生物学功能是作为一种警告气味,使捕食者产生厌恶感。Ômura等[30]也证实了雄性成年蝴蝶散发出的特殊气味是(R)-δ癸内酯。目前,已被报道的能够在体内自身从头合成内酯类化合物的微生物有丝状真菌梨孢镰孢菌(Fusarium poae)[31]、绿色木霉菌(Tr i c h o d e r m a v i r i d e)[32]、棉阿舒囊霉(Ashbya gossypii)[33]以及酵母臭孢子酵母(Sporobolomyces odorus)[34]。例如,Sarris等[31]使用麦芽肉汤培养基培养丝状真菌梨孢镰孢菌(Fusarium poae)时检测到培养基中含有8 种饱和γ-内酯(γ-戊内酯、γ-己内酯、γ-庚内酯、γ-辛内酯、γ-壬内酯、γ-癸内酯、γ-十一内酯和γ-十二内酯)、一种不饱和γ-内酯(顺-6-γ-十二烯内酯)和一种δ-内酯(δ-癸内酯)。未来需提高对食品和微生物中内酯类化合物的构型研究,通过生物法制备手性内酯类化合物,从而根据需求添加不同构型的香精,设计出感官特性更合理的食品。
表1总结了几种典型的手性内酯类化合物的化学结构、来源及其香气特征。
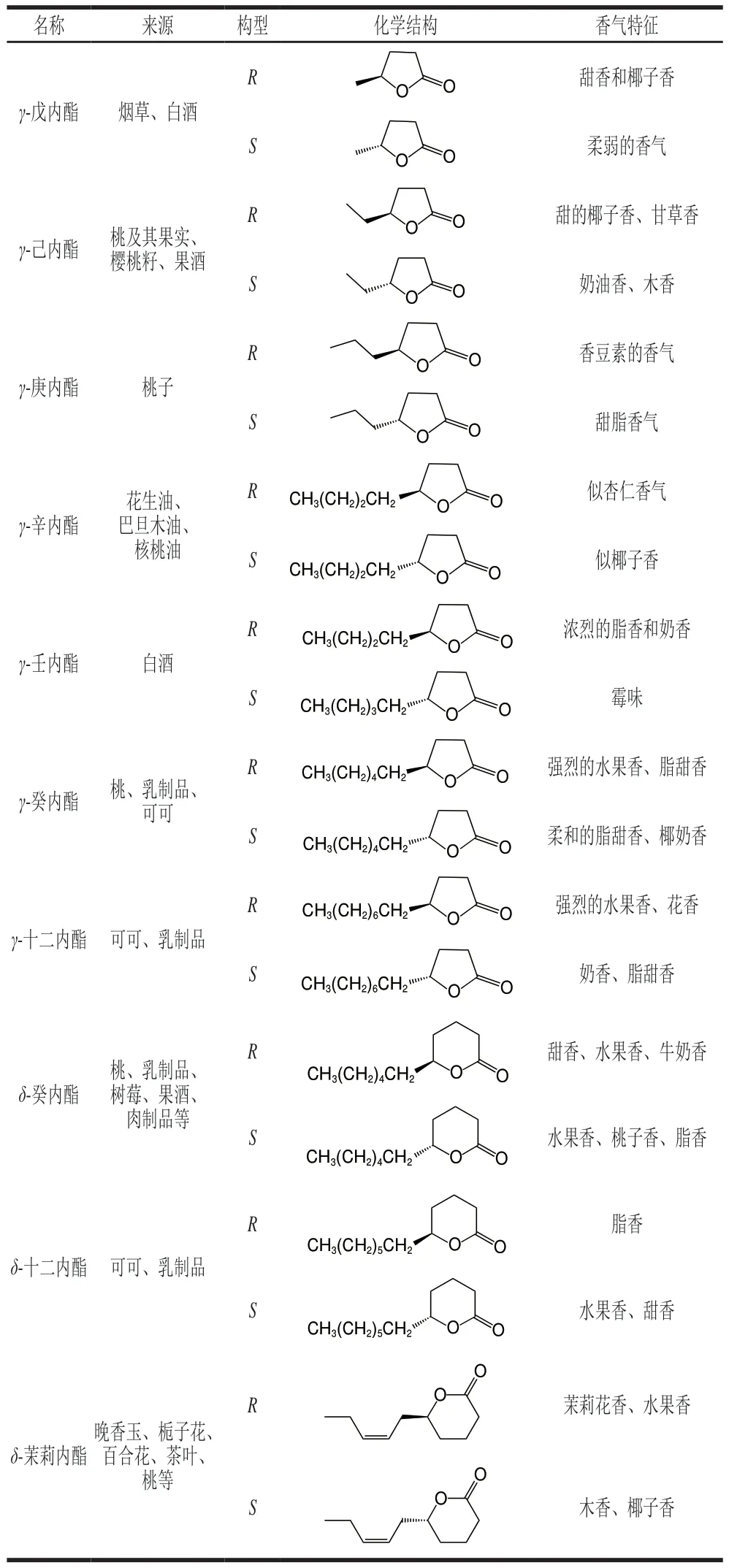
表1 几种典型的手性内酯类化合物Table 1 Several typical chiral lactone compounds
2 不同手性内酯类香料的制备
目前内酯类化合物的制备方法主要分为天然提取法、化学法和生物法。天然提取法主要是直接提取植物中的内酯类化合物,常用的方法为有机溶剂萃取法、压榨法、水蒸气蒸馏法和超临界二氧化碳萃取法等[18]。天然提取法的内酯类化合物香气虽更自然宜人,但由于天然存在的内酯类化合物含量少且提取成本高,难以满足日益增长的市场需求[35-36]。目前,内酯类化合物的制备以化学法合成为主,如化学合成的γ-癸内酯占据了90%的市场。然而,化学法合成的内酯类化合物多数为外消旋混合物,产物香味单一,且在合成过程中涉及大量有机溶剂的使用,容易造成有机溶剂残留[37]。而生物法合成可以避免化学法合成的缺点。生物法合成是指外源性化学物经过酶或微生物催化转化后化学结构发生改变的过程。已有研究表明,以羟基脂肪酸、非羟基脂肪酸和脂肪酸酯等为底物,经过微生物或酶催化转化可制备手性内酯类化合物[38-39]。利用生物技术制备的内酯类化合物与来源于植物的类似,也具有光学活性,被认为是天然同等香料,因此,采用生物法制备手性内酯类化合物具有更广阔的应用前景。
2.1 γ-内酯类化合物
γ-内酯类化合物是一类重要的呈香化合物,具有桃子、椰子等浓郁的水果香。此外,γ-内酯类化合物还具有抗菌、消炎等生物活性。例如,经过修饰的α-亚甲基-γ-内酯具有良好的抗菌活性,研究证实其对细菌(金黄色葡萄球菌、大肠杆菌和荧光假单胞菌)和真菌(酿酒酵母和黑曲霉)的生长均有抑制作用[40]。Eltom等[5]发现从鸵鸟油中分离得的γ-内酯(1.1 mg/kgmb,灌胃)能够减轻福尔马林诱导的大鼠足肿胀,且治疗效果优于对照药物双氯芬酸凝胶和布洛芬乳剂。因具有增香的作用和多种生物活性,γ-内酯类化合物已被广泛应用于食用香精、日化用品和医药领域中,如γ-戊内酯、γ-己内酯、γ-癸内酯和γ-十二内酯。
2.1.1γ-戊内酯
γ-戊内酯具有香兰素和椰子香味,主要用以配制桃、椰子、香草等型香精[41]。此外,γ-戊内酯也是一种重要的化学物质,可用于生产液体燃料、精细化学品合成的中间体和香精香料等[42]。(S)-γ-戊内酯香气弱,而(R)-γ-戊内酯则呈现出甜香和椰子香[18]。目前γ-戊内酯的合成以化学法合成为主,该方法是以乙酰丙酸(levulinic acid,LA)或乙酰丙酸烷基酯(alkyl latinate,AL)为底物经过催化氢化制备(图1),但γ-戊内酯的大规模合成受到LA和AL原料供应的限制。研究表明,LA和AL可以从碳水化合物或木质纤维素在酸性催化剂存在下经过在水或醇中水解或醇解得到,这使得γ-戊内酯的大规模生产变得更可持续性和更经济[43]。Qi Long等[44]利用果糖作为底物,先将果糖脱水生成羟甲基糠醛(hydroxy methyl furfural,HMF),然后在硫酸催化下将HMF复水生成LA,再利用进一步还原制备γ-戊内酯。类似地,以木质纤维素为底物,先将木质纤维素转化为LA,再一锅法合成γ-戊内酯,目标产物得率高[45]。与LA相比,AL能更为有效地从碳水化合物的酸催化脱水中制备得到,所以将AL作为底物可以为γ-戊内酯的生产开辟一条更有效的途径。Tukacs等[46]以乙酰丙酸甲酯(methyl levulinate,ML)和乙酰丙酸乙酯(ethyl levulinate,EL)为底物,通过连续加氢催化生成γ-戊内酯,底物转化率和时空产率分别为100%和0.45 mol/(g·h)。除了底物,发展新型高效、高选择性的手性金属催化剂也是合成手性物质的热点之一,研究人员对催化剂进行研究以期获得高稳定性和高催化活性的催化剂,从而实现高效制备γ-戊内酯。李文秀等[47]通过原位热解策略构建了钴基催化剂(Co@NC-800),该催化剂可实现LA定向转化合成γ-戊内酯,且产率达到99%以上。该催化剂还可催化EL转化制备γ-戊内酯,底物转化率和产率分别达到100%和97%,并且连续循环使用7 次仍能保持较高的催化性能。Melero等[48]合成Zr-Al-β分子筛为催化剂,以FAL为底物,2-丙醇为氢供体和溶剂,FAL与催化剂的质量比为1.2∶1.0,反应4 h后产率为88%,此外,将分子筛反应结束后经过550 ℃活化后仍可重复利用。Shende等[49]通过使用钌催化剂对LA进行连续氢化得到(R)-γ-戊内酯,转化率为99%,对映体过量值(enantiomeric excess,ee)为93%。糠醛(furfural,FAL)转化为γ-戊内酯涉及多步反应,这一系列反应中会使用到大量的酸、醇和金属催化剂,β沸石分子筛是一种多孔规则结构的高硅沸石,具有良好的酸催化性和结构稳定性[50]。对γ-戊内酯的合成机理深入了解,并设计出更为适合的催化剂是未来研究的突破点,微生物是各种酶的天然且经济的催化剂来源。
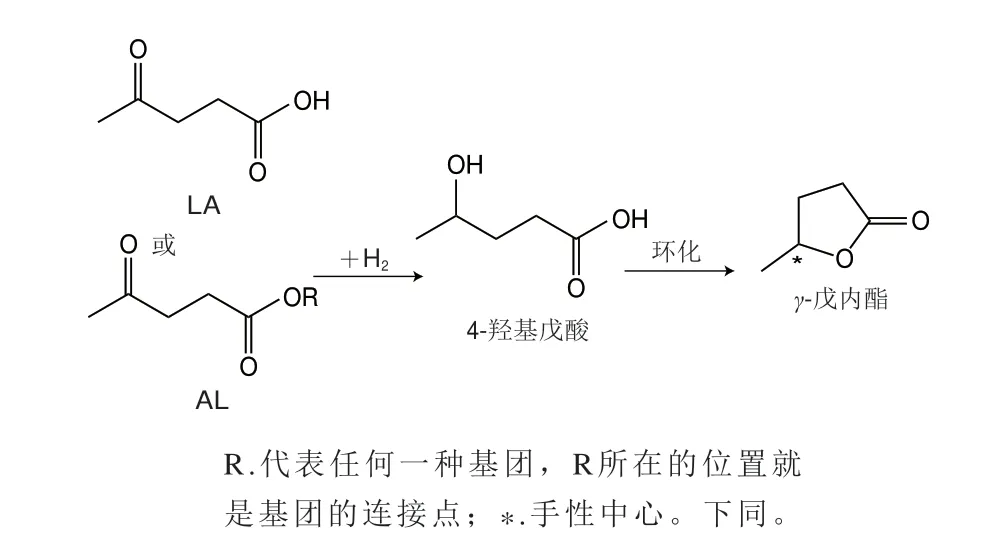
图1 催化氢化LA制备γ-戊内酯的途径Fig.1 Preparation of γ-valerolactone by catalytic hydrogenation of LA
目前使用酶参与的化学合成可以克服使用大量化学催化剂的缺点,特别是当需要合成手性γ-戊内酯时。O’Neill等[51]以聚(R)-3-羟基丁酸酯为底物,连续氢化得到(S)-3-羟丁酸乙酯,再利用酵母菌对其进行还原,最后环化为(R)-(+)-γ-戊内酯,总产率为32%。Lee等[52]以LA为底物,使用粪产碱菌(Alcaligenes faecalis)中的3-羟基丁酸脱氢酶对LA进行特异性还原,再使用硫酸将γ-羟基戊酸脱水环化为(R)-γ-γ-戊内酯,产率为100%,ee值>99%,与传统化学合成方法相比,该法在环化阶段采用更低浓度的硫酸(体积分数1%),反应条件更为温和。Götz等[53]使用LA在离子交换树脂上进行酯化,得到EL,再利用近平滑念珠菌(CPCR2)中的(S)-羰基还原酶将EL还原为(S)-γ-羟基戊酸,再使用南极假丝酵母脂肪酶B(Candida antarcticalipase B,CalB)将(S)-γ-羟基戊酸环化为(S)-γ-戊内酯,最终产率为90%,ee值>99%。将酶催化和化学催化相结合,利用两者的优势能够获得更为理想的结构。
不同构型的γ-戊内酯具有明显的气味差异,令人愉悦的香气阈值非常高,若质量浓度低于10-4mg/L,口感和香气强度相对于其他γ-内酯来说较差[41]。此外,目前γ-戊内酯的生产工艺仍有局限性,需添加大量的化学催化剂,不符合当下消费者健康消费观,因此γ-戊内酯更加适合作为生物质基平台化合物,或作为一种性能优良的溶剂。上述生物技术过程反应条件温和,故有利于使用微生物和酶,此外,可开发更多适合的底物(类似于一些木质纤维素农业废弃物),同时,这些生物技术过程可以根据所使用的每种生物催化剂进行优化,为后期实现工业化和产业化生产奠定基础。
2.1.2γ-己内酯
γ-己内酯化学名称为5-乙基二氢-2(3H)-呋喃酮、似香豆素,具有独特的药草香气和焦糖香气,常被添加于酒精饮料、茶饮料、面包、乳制品和黄油等食品中。此外,γ-己内酯也常添加在日化产品中以达到增香的目的[54]。(S)-γ-己内酯具有类似于香豆素的味道,但是(R)-γ-己内酯具有弱的甜香、椰子香和甘草味[18]。
γ-己内酯可从植物中直接提取。de Oliveira Barretto等[55]利用水蒸馏法和过氮气水蒸馏法结合固相微萃取技术对菠萝渣中的挥发性化合质量分数物进行提取和表征,发现含有大量的内酯类化合物(质量分数35%),包括γ-丁内酯、γ-己内酯、γ/δ-辛内酯、γ/δ-癸内酯和γ/δ-十二内酯等,其中γ-己内酯在这些内酯类化合物中含量最高,所以菠萝渣可作为提取γ-己内酯的原料。γ-己内酯也是芒果中重要的香气挥发物之一。Deshpande等[56]揭示了芒果中内酯类化合物可能的生物合成途径,发现在果实发育和成熟阶段中的9-脂氧合酶(Mi9LOX)、环氧化物水解酶2(MiEH2)、过氧化物酶、过氧化氢裂解酶和酰基辅酶A氧化酶与内酯的合成密切相关。并且将Mi9LOX和MiEH2重组表达于大肠杆菌后,发现Mi9LOX和MiEH2基因的过表达显著增加了大肠杆菌产γ-己内酯的能力,这为体外γ-己内酯的合成研究奠定了理论基础。此外,γ-己内酯也可以通过化学法合成:以1,2-环氧丁烷和丙二酸二乙酯钠盐为原料,经皂化、酸化和脱羧反应可制备得到[57]。然而,该法中所用原料1,2-环氧丁烷目前依赖于进口,所以利用此方法大规模生产γ-己内酯仍然受到了限制。此外,还可以以丙醛和丙烯酸为原料,经过电解还原、加成以及环化制备γ-己内酯,但该方法的产率仅约为20%,难以实现γ-己内酯的工业化生产。韩巧等[58]以正丁醛和丙二酸为底物,经过缩合重排以及内酯化等步骤制备合成γ-己内酯,产率达到76%。
由于化学合成的γ-己内酯为外消旋体,通过各种拆分的方法制备具有光学活性的γ-己内酯也备受科研人员的关注。目前实现手性化合物拆分的方法有很多种,如化学拆分、色谱拆分、膜拆分和酶法拆分等。与其他的拆分方法相比,酶法拆分手性化合物具有环境友好、操作简单、副产物少等优势,常用到拆分的酶为脂肪酶。合成手性γ-己内酯以外消旋体的拆分为主,因为酶无毒且温和绿色,使用酶催化拆分外消旋体是目前较为理性的选择。梁甜甜等[59]发现猪胰脂肪酶能够选择性地对γ-己内酯进行水解生成(S)-γ-己内酯,其中在最优的反应条件下转化率可达到46.5%,对映选择性为76.4%。
2.1.3γ-癸内酯
γ-癸内酯,化学名称为4-己基丁内酯,天然存在于桃子、杏仁、草莓、苹果、奶酪和果酒等食品中。由于γ-癸内酯具有浓郁的果香,稀释时具有桃子香气[60],因此在调味品和香精香料等领域中应用广泛。γ-癸内酯是手性分子,不同构型的γ-癸内酯具有不同的香气特征,如(S)-型γ-癸内酯具有水果香、香蕉香和茉莉花样的头香,且香气更饱满,甜香和花香较少;而(R)-型γ-癸内酯具有脂香、动物样的头香,适用于食用香精[18]。此外,γ-癸内酯在医药领域亦有巨大的应用潜力。Pflüger等[61]研究发现,γ-癸内酯可抑制人体中单胺氧化酶-B(帕金森病的药物治疗就包括使用单胺氧化酶-B抑制剂)的活性和降低人肝癌细胞的细胞毒性,且γ-癸内酯不具有遗传毒性,因此,γ-癸内酯具有治疗帕金森疾病的潜力。
目前,市场上90%以上的γ-癸内酯都是通过化学法合成的,应用最为广泛的是辛醛和丙二酸合成法[54]。该方法是先将辛醛和丙二酸脱水缩合,然后经脱羧以及内酯化制备得到γ-癸内酯,具有工艺简单、原料易得和产物收率高等优点。然而,化学法合成的γ-癸内酯多为外消旋体,这会影响食品香气的像真度。因此,研究制备具有高纯度光学活性的γ-癸内酯在香料领域具有重要的科学价值。
生物法合成γ-癸内酯可分为生物合成法、生物转化法和生物催化法。生物合成是指在生物体内所进行同化反应的总称,包括主要原料的从头合成和部分分解产物的可逆废物利用合成。许多研究证实γ-癸内酯是赋予桃强烈果香的最重要内酯类化合物[62-63]。微生物具有从头合成γ-癸内酯的能力。早在1972年,Tahara等[34]证实了具有特殊香气的鲑色锁掷酵母(Sporidiobolus salmonicolor)所产的香味成分为γ-癸内酯和γ-十二内酯。另外,Neuser等[64]在培养担子菌的发酵液(麦芽-酵母提取液)时也发现了γ-癸内酯的存在。生物转化法是指外源化合物在微生物体内经代谢通路中各种关键酶催化转化的过程。与能够从头生物合成内酯的微生物相比,能够将脂肪酸转化为内酯的微生物非常广泛。因此,生物转化法是生物法制备γ-癸内酯最为常用的方法,如首选系统解脂耶氏酵母(Yarrowia lipolytica),可利用羟基脂肪酸(如蓖麻油酸)作为前体进行催化转化制备γ-癸内酯。该方法的代谢机理如图2所示,蓖麻油酸先转运到线粒体中,通过线粒体中的4步β-氧化循环后,脱去8 个碳原子,生成4-羟基癸酸,再在脂肪酶等催化下内酯化得到具有高纯度光学活性的γ-癸内酯[65-66]。有专利报道了在300 L的发酵罐中使用Y.lipolytica发酵制备的γ-癸内酯质量浓度可高达12.5 g/L[67]。然而,这种生产方法存在局限性,如蓖麻油酸不是一种丰富的可再生的原料,且它的提取还存在若干健康、季节性和经济问题[68]。为了寻找新的简单易得和可再生的底物,Soares等[69]探究了Y.lipolytica和Lindnera saturnus酵母菌株利用粗甘油生产γ-癸内酯的能力,发现L.saturnus能利用100 g/L粗甘油产生5.8 g/L的γ-癸内酯。因为粗甘油是生物柴油工业的主要副产品,所以它是一种可持续的生物转化替代底物。此外,Marella等[70]对Y.lipolytica进行基因改造以期获得将非羟基脂肪酸转化为内酯的能力,发现导入来源于嗜麦芽寡养单胞菌(Stenotrophomonas maltophilia)的油酸-10-水合酶基因后,重组Y.lipolytica可以催化转化油酸制备γ-癸内酯。虽然与传统的羟基脂肪酸生物转化过程相比,重组Y.lipolytica生成的内酯浓度较低,但是向更加可持续的内酯生产迈进了一步。另一个需要考虑的重要因素是内酯对微生物的毒性[71]。研究表明,γ-癸内酯的质量浓度高于150 mg/L时会抑制Y.lipolytica的生长,使活细胞去极化并增加细胞膜的流动性[72]。这可能是γ-癸内酯与膜磷脂的酰基链疏水相互作用,导致无序程度逐渐增加,从而增加了细胞膜内的整体流动性[73]。为了减轻对酵母细胞的毒性抑制,原位产物分离发酵技术被应用于生物催化转化制备γ-癸内酯中,即将生成的γ-癸内酯与酵母细胞分离[74]。Rong Shaofeng等[75]探究了树脂(HZ-816)或环戊硅氧烷(DC345)两种“液-液”原位分离体系对酵母代谢的影响,发现这两种原位分离体系均能提高γ-癸内酯的产率(140%和175%),但DC345体系中的产率更高以及对酵母细胞的损伤更小,因此DC345体系具有作为一种生物转化生产γ-癸内酯新型分离系统的潜力。生物催化是指直接利用酶或生物有机体(包括整个细胞、细胞器、组织等)作为催化剂进行化学转化的过程。Ren Chunlei等[76]利用基因挖掘技术从酿酒酵母中克隆出羰基还原酶OdCR1基因,并在大肠杆菌中过表达,用于催化4-氧癸酸的不对称还原。研究结果表明,该基因工程菌对4-氧癸酸具有较高的立体选择性,可生成(R)-γ-癸内酯(99% ee),产率高达85%。该研究为利用酶催化的选择性还原酮酸(酯)制备γ-癸内酯提供了新的示例。
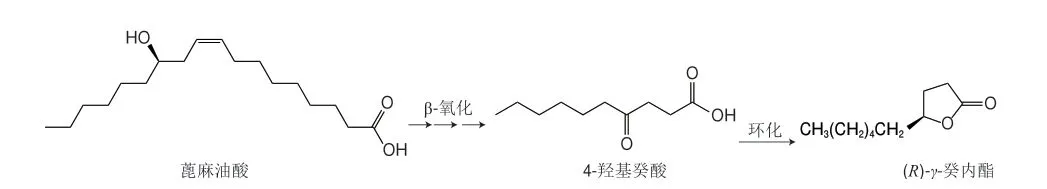
图2 蓖麻油酸制备(R)-γ-癸内酯的途径Fig.2 Preparation of (R)-γ-decalactone from ricinoleic acid
2.1.4γ-十二内酯
γ-十二内酯是一种天然的芳香化合物,具有浓郁的桃子味和奶油味,存在于杏、桃子、草莓、菠萝、芒果、梅子和针叶樱桃等水果中[77]。(R)-γ-十二内酯具有浓烈的花香,而(S)-γ-十二内酯则具有奶香味和甜脂香[78]。此外,研究表明γ-十二内酯具有良好的消炎作用[79]。
γ-十二内酯由于在植物中的含量少,且不易单独分离出来,所以目前市场上销售的仍主要是化学合成的无旋光活性产品。常见制备γ-十二内酯的化学合成方法主要是以正壬醇和丙烯酸(或丙烯酸甲酯)为底物,在引发剂和催化剂作用下经一系列化学反应生成羟基油酸,再环化成γ-十二内酯(图3)[80]。Matsumoto等[81]对外消旋长链1,2-二醇单基酸酯进行酶法拆分并得到(S)-2-乙酰氧癸基甲磺酸酯(收率为94%),再在溴化铜的催化下得到(S)-1-十三烯-5-醇(收率为81%),然后在酸性条件下内酯化合成了(S)-γ-十二内酯(收率为55%)。化学合成法方法由于原料易得、操作简单、产品收率高而成为研究的热点。
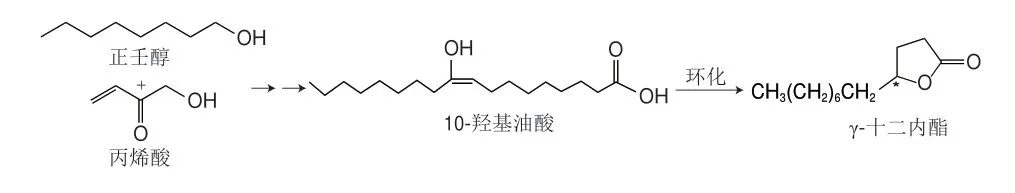
图3 以正壬醇和丙烯酸为底物产γ-十二内酯Fig.3 Preparation of γ-dodecolactone from n-nonanol and acrylic acid as substrates
目前生物法制备γ-十二内酯主要是通过微生物催化转化油酸获得,其生物合成途径如图4所示,以油酸为底物,经假单胞菌催化转化后产生10-羟基油酸,再以分离后的10-羟基油酸为底物,通过毕赤酵母的β-氧化和内酯化反应得到γ-十二内酯[82]。Marella等[70]以商品橄榄油为底物,利用解脂耶氏酵母催化,获得了质量浓度为(1.62±0.54)mg/L的γ-十二内酯,为以植物油作为底物生产内酯提供了参考。Boratyński等[82]从12 种细菌中筛选出的藤黄微球菌(Micrococcus luteusPCM525)可以以油酸为底物经发酵代谢直接将其转化为手性γ-十二内酯,转化率达到50%。这是第一个具有产消炎活性因子细菌的报道。微生物转化技术的研究为实现从羟基脂肪酸合成手性内酯化合物提供了新的发展方向。
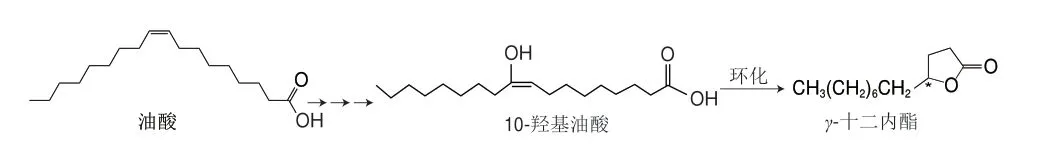
图4 生物转化催化油酸产γ-十二内酯Fig.4 Biotransformation of oleic acid to γ-dodecolactone
2.2 δ-内酯类化合物
δ-内酯类化合物在水果和乳制品中广泛存在,具有椰香、花香、奶香等香味,是一种高价值的香料香精。δ-内酯类化合物被广泛应用于饮料、雪糕、乳制品等食品中,此外还应用于日化产品中[83]。在食品中常见的手性δ-内酯类化合物主要为δ-癸内酯、δ-茉莉内酯和δ-十二内酯。
2.2.1δ-癸内酯
δ-癸内酯化学名称为5-戊基戊内酯,广泛存在于杏、油桃、覆盆子、树莓、马铃薯、切达干酪、羊肉、牛奶及奶制品等食品中[84]。(R)-构型的δ-癸内酯主要在桃和杏中形成,该构型在桃子中的ee值高达96%、在杏中的ee值为90%;而(S)-构型的δ-癸内酯主要存在于树莓中,其在树莓中的ee值为94%。此外,牛奶、黄油、切达干酪和椰子中的δ-癸内酯都以不同的对映体存在[85]。不同构型的δ-癸内酯也具有不同的香气特征,如(S)-(-)-δ-癸内酯具有甜香、水果香、桃子香、脂香和黄油香;(R)-(+)-δ-癸内酯具有甜香、水果香、牛奶香,其花香味比(S)-构型和外消旋体的香味更为强烈、浓郁[18]。δ-癸内酯不仅是一种高价值的香精香料,也可应用于害虫防治中。有研究表明,δ-癸内酯是驱蚊剂二乙基甲苯酰胺(N,N-diethylmeta-toluamide,DEET)和柠檬桉树油(p-menthane-3,8-diol,PMD)的潜在替代品[86]。
目前,δ-癸内酯的化学合成主要有2 种途径:第一种是先合成δ-羟基酸,再经内酯化得到δ-癸内酯[87]。该方法的原料不易获得且总得率低,难以实现工业化生产;第二种是先合成2-戊基环戊酮中间体,再经Baeyer-Villiger(BV)氧化得到δ-癸内酯[88]。该方法在BV氧化时所使用的催化剂易产生较多副产物,使得率较低。为了开发高效的催化剂,卜佳等[89]以环戊酮和正戊醛为原料经羟醛缩合、脱水和选择性还原生成2-戊基环戊酮,最后以聚乙二醇-600为催化剂,经BV氧化反应合成δ-癸内酯,产率为86.3%。此外,Alam等[90]提出了一种从废弃木质纤维素生物质(如甘蔗渣)生产δ-癸内酯的方法,为δ-癸内酯的合成向绿色和可持续方向发展奠定了理论基础。该方法具体的合成路径如图5所示,首先从废弃的甘蔗渣中发酵产生得到6-戊基-α-吡喃酮(6-amyl-α-pyrone,6PP),再进行氢化得到马索亚内酯(massoia lactone,ML),再在以甲酸为原位氢源的Pd/C催化剂上连续氢化转化为δ-癸内酯,其产率达到79%。羟基脂肪酸(hydroxy fatty acids,HFAs)是内酯生物合成的天然前体物质。因此,有必要提出针对HFAs的选择性合成方法,较为理想的方法是直接通过脂肪酸氧化获得。如图6所示,Manning等[91]利用一种来源于Tepidiphilus thermophilus的野生型细胞色素P450单加氧酶(CYP116B46)对癸酸进行羟基化生成(S)-5-羟基癸酸,再通过酸催化内酯化生成(S)-δ-癸内酯,以0.4 mmol/L的癸酸为底物,转化率为10%,且ee值>90%。
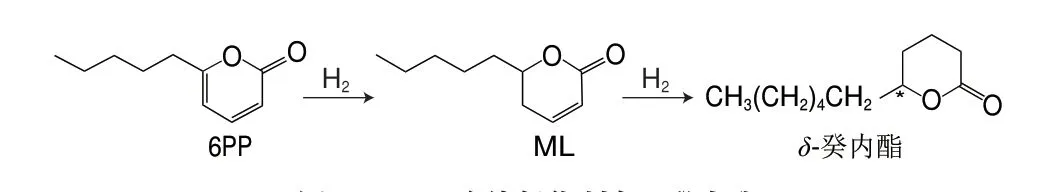
图5 6PP连续氢化制备δ-癸内酯Fig.5 Preparation of δ-decalactone by continuous hydrogenation of 6PP
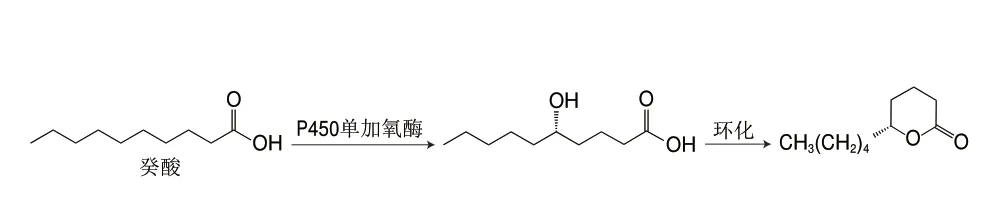
图6 癸酸转化制备(S)-δ-癸内酯Fig.6 Conversion of capric acid to (S)-δ-decalactone
以微生物为媒介转化产δ-癸内酯,常见的是以亚油酸作为底物进行微生物催化转化制备δ-癸内酯。例如,Kang等[92]以亚油酸为底物,先利用嗜酸乳杆菌中的亚油酸13水合酶将亚油酸转化为13-羟基9(Z)-十八烯酸,再通过解脂耶氏酵母全细胞催化转化为δ-癸内酯(图7),质量浓度为10 g/L亚油酸转化为1.9 g/Lδ-癸内酯,时空产率为106 mg/(L·h),这为以不饱和脂肪酸为底物生产δ-癸内酯提供了参考。在酶催化制备δ-癸内酯的研究中,Zhang Chao等[93]从粘质沙雷氏菌中克隆出一种羰基还原酶基因(SmCR),并在大肠杆菌中表达,该酶可对γ-和δ-酮酸/酯进行不对称还原,还原为(R)-羟基酸,再环化为光学纯(R)-γ-癸内酯(ee值为99%)和(R)-δ癸内酯(ee值为95%),2 种产物都具有较高的对映选择性,产率分别为72%和77%,转化率为98%。Szczepańska等[94]利用烯还原酶(OYE3)还原天然马尾松内酯产(R)-(+)-δ-癸内酯。为了提高产物的转化率,该研究者使用细胞固定化技术将细胞裂解物固定在水不溶性载体上进行反应,使底物转化率提高至99%。自然界中微生物资源丰富,因此酶的种类繁多,经过一定的分离纯化技术可实现内酯产业化生产。
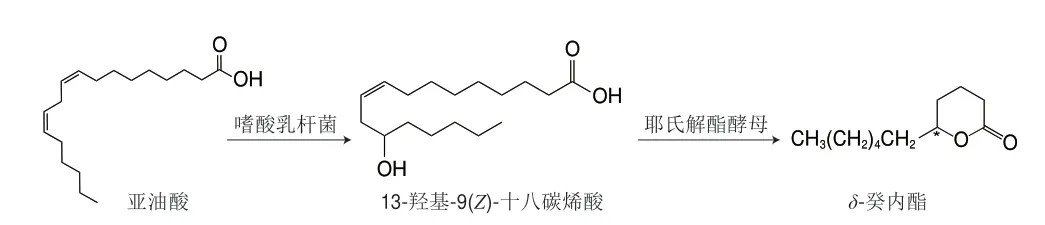
图7 亚油酸转化制备δ-癸内酯Fig.7 Conversion of linoleic acid to δ-decalactone
2.2.2δ-十二内酯
δ-十二内酯天然存在于椰子、覆盆子、黑莓和坚果等植物中,具有奶油香味。δ-十二内酯易溶于乙醇、植物油,但不溶于水,所以δ-十二内酯是调配奶油香精的主要成分[95]。除了作为食用香精,δ-十二内酯还具有良好的抗菌活性,可作为治疗阴道念球菌病和鹅口疮的推荐药物[96]。
目前,化学合成δ-十二内酯最为常见的方法是先合成中间体2-庚基环戊酮,再氧化闭环得到δ-十二内酯。徐俊等[97]以环戊酮和正庚醛为原料,在有机碱催化下得到2-庚烯环戊酮,随后在雷尼镍催化下加氢得到2-庚基环戊酮,最后在有机过氧酸的环境下发生BV反应得到δ-十二内酯,产物回收率为55.2%。该合成方法中使用有机碱为催化剂,此催化剂可重复使用,大大降低了成本,且以过氧酸钠和醋酐为BV反应中的氧化剂,相对于过去使用过氧乙酸为氧化剂更为安全且适合工业化生产。在合成过程中催化剂和氧化剂的选择尤为重要,国内外众多学者对此做了大量研究。Ma Qingguo等[98]以锡离子膨润土为催化剂,再以双氧水为氧化剂,将中间体2-庚基环戊酮氧化为δ-十二内酯。此外,还发现通过添加微量的甲基磺酸和十二烷基硫酸钠可以提高中间体的转化率,最后产物回收率高达81%[98]。
Murray等[99]使用溶剂辅助风味蒸发(solvent-assisted flavor evaporation,SAFE)和香气提取物稀释分析(aroma extract dilution analysis,AEDA)法鉴定了真菌斑柄乳牛肝菌(Suillus punctipes)的35 种气味成分,δ-十二内酯是其中一种主要的香气化合物。目前生物法制备合成δ-十二内酯以生物催化和生物转化2 种方式为主,以长链脂肪酸或脂肪醇为底物进行羟基化,再使用酸或者内酯酶进行环化。细胞色素P450单加氧酶(P450s)用途广泛,可催化多种脂肪酸产生芳香化合物,同时该酶还具有高度的区域选择性和立体选择性,Maseme等[100]使用细胞色素P450分别对十二酸和1-十二醇进行羟基化。十二酸经羟基化为5-羟基十二酸(24%区域选择性)再在酸环境下内酯化为δ-十二内酯,1-十二醇转化为1,5-十二烷二醇(55%区域选择性)再在乙醇脱氢酶转化为δ-十二内酯。由于植物油脂富含多种不饱和脂肪酸,且容易进行羟基化反应产HFA,许多研究者多以植物油脂作为底物进行生物转化制备δ-十二内酯。Zia等[101]以葡萄籽油为底物,利用乳酸乳球菌乳亚种(Lactococcus lactis lactis)和乳酸乳球双乙酰亚种(Lactococcus lactissub sp.diacetylactis)对其进行转化制备δ-十二内酯,最终产量为0.046~1.330 mg/L。目前生物转化δ-十二内酯的方法存在产量低的问题,不利于手性试剂将外消旋体中两种对映体的拆分,但仍为未来开发以植物油为底物生物转化产δ-内酯奠定了基础。以生物法合成手性内酯类化合物主要是以脂肪酸为底物,再通过微生物催化和转化为手性内酯,其存在一定的缺陷,例如底物需求量大、产量低(转化率低)、实现分离纯化的制备方法较少和可实现手性合成的微生物少等,因此,对于识别其构型有一定的困难。
2.2.3δ-茉莉内酯
δ-茉莉内酯主要存在于茉莉[102]、栀子花、晚香玉、芒果[103]和柑橘[104]等植物中,具有类似于乳、脂肪和蜡的香气,是国际公认安全的香精香料。(R)-δ-茉莉内酯具有花香和水果香,而(S)-δ-茉莉内酯则具有浓郁的椰子香和木香,类似于奶油味的脂类香气[18]。
目前,手性δ-茉莉内酯的合成主要是以化学法合成的。例如,Mase等[105]先利用L-苏氨酸在1,4-二氧己烷中催化环戊酮进行α-羟甲基化作用合成(S)-α-(羟甲基)环戊酮(ee值为82%),再以其为底物,经过间氯过氧苯甲酸选择性氧化和乙醇钠处理制备得到δ-茉莉内酯两种对映体的前体物质(一种二醇类化合物,产率为91%),最后内酯化可分别得到(S)-δ-茉莉内酯和(R)-δ-茉莉内酯。此外,还有学者使用化学拆分法对外消旋化合物直接拆分获得具有高光学纯度的δ-茉莉内酯。例如,Nohira等[106]以(1S,2R)-(+)-氨基-1,2-二苯乙醇作为拆分剂获得(R)-δ-茉莉内酯(ee值为70%),产率为79.8%。然而,化学拆分法存在化学试剂污染和过程繁琐等缺点,因此色谱拆分法成为首选方法。孙蕾等[107]使用填充柱超临界CO2流体色谱拆分外消旋δ-茉莉内酯,经过拆分条件优化后,在320 min内进样10 mg拆分得到6.6 mg 2 种高光学纯度的对映体产物(ee值为100%),回收率为66%,实现了δ-茉莉内酯毫克级别对映体纯品的快速制备。
了解内酯对映体的生物合成途径对于体外利用生物法制备具有高光学纯度的手性内酯类化合物是非常重要的。Haffner等[108]利用同位素标记法探究了酵母产δ-茉莉内酯的前体物质,发现手性δ-茉莉内酯的合成前体物质为亚麻酸(linolenic acid,LA)和13-羟基十八三烯酸。Zeng Lanting等[109]通过大肠杆菌表达和分离纯化获得脂氧合酶(CsLOX1)重组蛋白,并证实CsLOX1具有将LA转化为13-羟基十八三烯酸的能力,这对手性δ-茉莉内酯前体物质羟基脂肪酸的合成有重要的参考价值。
3 结 语
绿色、安全的生物法虽能弥补化学法合成的不足之处,但其制备的香精香料浓度较低,难以满足产业化需求,仍需进一步的研究和探索。因此,一种能高效制备具有高光学纯度内酯类化合物的绿色方法对提高手性内酯类香精产品的品质和推动其广泛应用有重要意义。尽管化学合成能够选用更为安全的化学催化剂和酶拆分方法,但化学合成的产品香气特征不鲜明,且光学纯度低。微生物是很好的酶制剂来源之一,因此生物法制备手性内酯类化合物是未来的发展趋势。此外,随着对一些植物中的内酯化合物合成机制和信号通路的进一步解析,更有利于合成更加绿色安全的手性内酯类香精。
化学合成手性内酯类香精香料虽然在香精香料领域表现出潜在的应用价值,但是由于手性配体存在对称性低、不易结晶、产量低的问题,合成和表征手性内酯类香精香料仍然存在很多困难,实现对框架结构的合理设计和精准调控仍然存在很多挑战。目前,生物法制备手性内酯类化合物实现产业化以合成(R)-γ-癸内酯为主,对于其他构型仍处于研究阶段。此外,其他内酯类化合物生物法制备存在产量低、产物种类繁多和难分离等问题。为了实现产业化生产,以大肠杆菌作为工程菌株,通过改造后进行生物转化,产物γ-内酯和δ-内酯具有高转化率和高光学纯度的优势,该生产技术将是未来发展趋势之一。
