枸杞多糖对高糖诱导的人视网膜色素上皮细胞中NLRP3 炎症小体/细胞焦亡信号通路的影响
2023-10-17梁念孩杜丽君夏会东窦凯凯
梁念孩, 杜丽君, 马 燕, 夏会东, 窦凯凯, 姚 青, 摆 茹
(1.宁夏医科大学基础医学院,银川 750004; 2.宁夏回族自治区第五人民医院,石嘴山 753000)
糖尿病视网膜病变(diabetic retinopathy,DR)是常见的糖尿病微血管并发症,是20~75 岁糖尿病患者视力下降或失明的重要原因[1-5]。DR 发病机制复杂,目前尚未完全明确。视网膜色素上皮细胞不具有再生能力,但具有支持作用,可为视网膜提供营养[6],细胞死亡后由相邻细胞补充空余位置。高糖刺激可使视网膜色素上皮细胞损伤并失去正常生理功能,长期高血糖可导致视网膜发生特征性病理改变,如视网膜微血管内膜增厚、血管通透性增加和新生血管化,最终导致视网膜病变,而视网膜色素上皮细胞屏障的破坏在DR 的发展中起着重要作用[7-10]。
NLRP3 炎症小体是组织细胞调控炎性反应的重要信号分子,主要由NOD 样受体热蛋白结构域相关蛋白3(NOD-like receptor protein 3,NLRP3)、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)及半胱氨酸蛋白酶-1(Caspase-1)组成[11]。NLRP3 炎症小体激活后,可诱导Caspase-1 前体裂解和活化,活化的Caspase-1 能裂解消皮素D(gasdermin D,GSDMD)并释放其N 端结构域,该结构域转移到细胞膜并形成孔,介导细胞内容物的释放,包括炎性细胞因子白细胞介素(interleukin,IL)-1β和IL-18,激活焦亡途径,诱导细胞焦亡[12-14]。研究[15-16]发现,NLRP3 炎症小体/细胞焦亡信号通路的激活参与DR 的发生与发展,高糖刺激NLRP3-Caspase-1-GSDMD 信号轴,可诱导人视网膜细胞以浓度和时间依赖性的方式在质膜中产生孔隙并分泌IL-1β 和IL-18。
枸杞多糖(lycium barbarum polysaccharide,LBP)是枸杞子的主要活性成分,具有抗氧化、调节免疫、抗肿瘤等多种生物活性,还具有抗衰老、细胞保护、神经保护和减缓炎性反应的作用[17-19]。研究[20]发现,LBP 能够抑制糖尿病小鼠视网膜内的血管新生、氧化应激和炎性反应。本研究通过观察LBP 对高糖诱导的人视网膜色素上皮细胞中NLRP3 炎症小体/细胞焦亡信号通路的影响,进一步探讨LBP 对糖尿病视网膜色素上皮细胞产生保护作用的分子机制。
1 材料与方法
1.1 主要试剂
人视网膜色素上皮细胞系ARPE-19(北京协和细胞资源中心)、LBP(宁夏沃福百瑞枸杞产业股份有限公司,LBP 含量为53.14%)、DMEM低糖培养基、胎牛血清(美国Hyclone 公司)、0.25%胰蛋白酶、青链霉素混合液(北京索莱宝科技有限公司)、全蛋白提取试剂盒(江苏凯基生物股份有限公司)、兔抗NLRP3 抗体、兔抗ASC 抗体、兔抗Caspase-1 抗体、兔抗GSDMD 抗体(美国Proteintech Group 公司)、兔抗β-actin 抗体、羊抗兔IgG(北京博奥森生物技术有限公司)、IL-1β 和IL-18 ELISA 检测试剂盒(上海江莱生物科技有限公司)、超敏ECL 化学发光试剂盒(苏州新赛美生物科技有限公司)、甘氨酸(北京百奥莱博科技有限公司)、1×无蛋白快速封闭液、10×电泳液、抗体稀释液、快速配胶试剂盒(上海雅酶生物医药科技有限公司)。
1.2 仪器
二氧化碳培养箱(上海力申科学仪器有限公司)、相差显微镜(宁波舜宇仪器有限公司)、低速冷冻离心机(安徽中科中佳科学仪器有限公司)、电泳仪(美国Bio-Rad 公司)、超净工作台(苏州安泰空气技术有限公司)、超净水仪(四川优普超纯科技有限公司)、1510 型多功能酶标仪(美国Thermo 公司)。
1.3 方法
1.3.1 ARPE-19 细胞培养和分组 ARPE-19 细胞培养于含10%胎牛血清、1%青链霉素的DMEM 低糖培养液(5.5 mmol·L-1葡萄糖)中,接种于6 孔板,每孔1.5×105个细胞。随机分为正常组(5.5 mmol·L-1葡萄糖)、高糖组(55.5 mmol·L-1葡萄糖)、LBP 低浓度组(55.5 mmol·L-1葡萄糖+100 μg·mL-1LBP)、LBP 中浓度组(55.5 mmol·L-1葡萄糖+200 μg·mL-1LBP)和LBP 高浓度组(55.5 mmol·L-1葡萄糖+400 μg·mL-1LBP)。正常组和高糖组细胞分别使用含5.5 mmol·L-1和55.5 mmol·L-1葡萄糖的DMEM 完全培养液进行培养。LBP 低、中、高浓度组细胞在含55.5 mmol·L-1葡萄糖的DMEM 完全培养液中分别加入100、200、400μg·mL-1LBP 进行培养。作用72 h 后,收集细胞和上清液进行后续实验。
1.3.2 免疫荧光检测细胞中NLRP3 蛋白的表达 取对数生长期细胞接种于6 孔板,每孔1.5×105个细胞,按照细胞分组,分别进行干预,培养72 h 后取出细胞爬片,4%的多聚甲醛室温固定30 min,PBS 洗3 次,0.2% TritonX-100 室温破膜20 min 后,山羊血清封闭30 min。配制NLRP3 一抗室温孵育1 h,羊抗兔IgG 二抗室温避光孵育1 h。DAPI 染核5 min,封片。荧光显微镜下观察并采图。使用Image J 软件进行平均荧光强度分析。
1.3.3 Western blot 检测细胞中NLRP3/细胞焦亡信号通路相关蛋白的表达 收集好72 h 干预过的各组细胞,按照全蛋白提取试剂盒说明,提取蛋白并定量后,加入Loading Buffer,变性10 min备用。取30 μg 蛋白上样,10%的胶电泳后进行转膜(PVDF 膜、湿转、220 mA)。用无蛋白快速封闭液封闭30 min 后,加入NLRP3(1∶3 000)、ASC(1∶1 000)、Caspase-1(1∶1 000)、GSDMD(1∶5 000)、β-actin(1 ∶1 000)一抗4 ℃孵育过夜。二抗(1∶5 000)室温孵育2 h,随后配制ECL 发光液(A 液∶B 液=1∶1)进行曝光,采图并数据处理。使用Image J 软件进行条带灰度值分析。
1.3.4 ELISA 检测细胞上清液中IL-1β 和IL-18的表达水平 收集好72 h 干预过的各组细胞上清液,12 000 r·min-1,4 ℃离心10 min,取上清,分别设置标准品孔、空白孔和样品孔。各孔中加入相应试剂或样品,按IL-1β 和IL-18 ELISA试剂盒说明书进行操作。酶标仪450 nm 处测各孔吸光度A。绘制标准曲线,并计算IL-1β 和IL-18 浓度。
1.4 统计学方法
用SPSS 26.0 软件对数据进行统计学分析,符合正态分布和方差齐性的计量资料用均数±标准差(±s)表示,两样本均数比较采用t 检验,多样本均数比较采用单因素方差分析。P≤0.05 为差异有统计学意义。
2 结果
2.1 LBP 抑制高糖诱导的人视网膜色素上皮细胞中NLRP3 蛋白的表达
免疫荧光图中可以看到,NLRP3 蛋白主要在视网膜色素上皮细胞胞质中表达,且与正常组相比,高糖组NLRP3 蛋白的表达水平升高(P<0.05);而与高糖组相比,LBP 中、高浓度组NLRP3 蛋白的表达水平均降低(P 均<0.01),而LBP 低浓度组中NLRP3 蛋白的表达水平差异无统计学意义,见图1。

图1 免疫荧光检测LBP 对高糖诱导的人视网膜色素上皮细胞中NLRP3 蛋白表达的影响
2.2 LBP 降低高糖诱导的人视网膜色素上皮细胞中NLRP3、ASC、Caspase-1 蛋白的表达
Western blot 结果显示,与正常组相比,高糖刺激后,人视网膜色素上皮细胞中NLRP3、Caspase-1、ASC 蛋白的表达均上升(P 均<0.05)。与高糖组相比,LBP 中、高浓度组细胞中NLRP3、Caspase-1、ASC 蛋白的表达均降低(P 均<0.05),而LBP 低浓度组中各蛋白的表达差异无统计学意义,见图2。

图2 Western blot 检测LBP 对高糖诱导的人视网膜色素上皮细胞中NLRP3、ASC、Caspase-1 表达的影响
2.3 LBP 对高糖诱导的人视网膜色素上皮细胞中GSDMD 蛋白表达的影响
与正常组相比,高糖组人视网膜色素上皮细胞中焦亡蛋白GSDMD 的表达上升(P<0.05)。与高糖组相比,LBP 中、高浓度组细胞中GSDMD 蛋白的表达均下降(P 均<0.05),见图3。
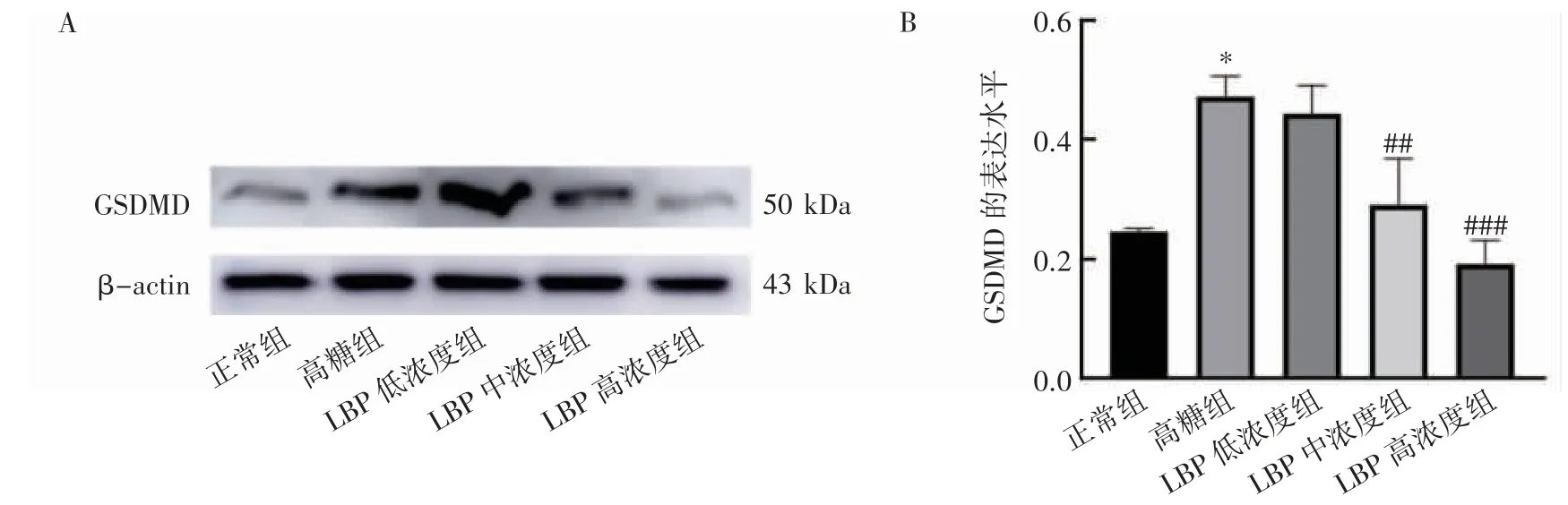
图3 Western blot 检测LBP 对高糖诱导的人视网膜色素上皮细胞中GSDMD 蛋白表达的影响
2.4 LBP 下调高糖诱导的人视网膜色素上皮细胞上清液中IL-1β、IL-18 炎性因子的表达
ELISA 检测结果显示,与正常组比较,高糖组人视网膜色素上皮细胞中IL-1β 和IL-18 的表达量均升高(P 均<0.05)。而与高糖组相比,LBP中、高浓度组的人视网膜色素上皮细胞中IL-1β、IL-18 的表达量均降低(P 均<0.05),但LBP低浓度组差异无统计学意义(P 均>0.05),见图4。
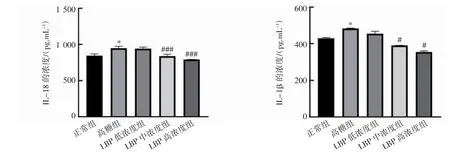
图4 ELISA 检测LBP 对高糖诱导的人视网膜色素上皮细胞上清液中IL-18 和IL-1β 表达的影响
3 讨论
NLRP3 炎症小体的激活参与DR 的发生与发展,抑制其活化,可发挥对视网膜的保护作用[21]。在糖尿病兔模型中,NLRP3 炎症小体识别激活信号后,活化IL-1β 和IL-18,三者共同参与糖尿病诱发的非感染性炎性反应[22]。而下调NLRP3/Caspase-1 通路表达,可抑制高糖诱导的视网膜组织炎症,减轻过氧化损伤,发挥对视网膜的保护作用,从而改善DR 症状[23-25]。
NLRP3 过度活化可导致细胞焦亡,经典的细胞焦亡通路特点包括Caspase-1 依赖、DNA 片段化、细胞膜完整性的快速丧失和炎性细胞因子释放,而GSDMD 蛋白是Caspase-1 的主要底物,是细胞焦亡的最终执行者[24,26]。NLRP3 炎症小体在糖尿病大鼠视网膜病变模型中被过度激活,NLRP3、ASC、Caspase-1 和GSDMD 等蛋白的表达显著上调[27-28]。张敏等[29]也证实了Caspase-1 依赖性的细胞焦亡促进了人视网膜色素上皮细胞的死亡。这表明NLRP3 炎症小体诱导的细胞焦亡促进了DR 的进展。本研究结果显示,与正常组比较,在高糖刺激的人视网膜色素上皮细胞中,NLRP3 炎症小体被过度激活,GSDMD 蛋白表达水平上升,也证实了NLRP3 炎症小体/细胞焦亡信号通路的过度活化在DR 的发病过程中具有重要作用。
LBP 具有多种生物活性,对视网膜色素上皮细胞具有保护作用。Liang 等[30]研究表明,LBP 可能通过调节H2O2诱导的视网膜色素上皮细胞凋亡途径中所涉及的蛋白质的表达,并激活核因子红细胞2 相关因子2(Nrf2)信号通路,减少氧化损伤和抑制细胞凋亡,从而对视网膜色素上皮细胞起到保护作用。本研究使用LBP 对高糖诱导的人视网膜色素上皮细胞进行干预,与高糖组比较,LBP 中、高浓度组中NLRP3、ASC、Caspase-1 及GSDMD 蛋白的表达下降,细胞上清液中IL-1β 和IL-18 的产生减少,表明LBP 对高糖诱导的人视网膜色素上皮细胞的损伤具有保护作用。但低浓度LBP 未显示其保护作用,可能与LBP 浓度过低有关。也有研究[31]报道,LBP 在较低浓度时对人视网膜色素上皮细胞的生长无显著影响。
综上所述,适当浓度的LBP 可对高糖刺激的人视网膜色素上皮细胞产生保护作用,其分子机制可能为LBP 通过抑制NLRP3 炎症小体的活化,下调GSDMD 而减轻细胞焦亡,同时抑制炎症因子IL-1β 和IL-18 的释放。本研究为进一步深入研究LBP 在DR 中的作用及其分子机制奠定了理论基础。但本研究仅通过细胞实验进行体外单层次验证,存在一定的局限性。
