蛋白质-香气化合物结合作用的研究方法及影响因素研究进展
2023-10-17周琪琪于海燕娄新曼田怀香
陈 臣,周琪琪,于海燕,娄新曼,李 永,田怀香*
(上海应用技术大学香料香精技术与工程学院,上海 201418)
香气是食品风味的重要组成部分,是食品特征风味的来源之一。香气化合物的分子质量相对较小(<400 Da),主要包括醛类、酮类、醇类、酯类、羧酸、含硫化合物、呋喃和吡嗪等[1]。蛋白质被公认为食品中的营养和功能成分,它不仅为人体提供必需的氨基酸,而且具有发泡、乳化、胶凝和风味结合等功能特性。除了作为食品的风味前体物质外,蛋白质可以通过物理截留方式抑制香气化合物的动态变化,或通过各种相互作用力影响食品中香气化合物的保留与释放[2]。
蛋白质与香气化合物之间的结合作用主要包括非共价键合、共价键合和传质效应,但由于食品组织结构的复杂性以及蛋白质和香气化合物的自身特性和结构差异,两者结合作用的本质与规律性研究仍是一个系统且复杂的过程。蛋白质对挥发性香气成分的结合作用主要取决于香气化合物和蛋白质自身的性质,但食品基质中调味用糖、油脂和盐等配料也会通过改变蛋白质的聚集状态和构象等特性,从而影响蛋白质-香气化合物的结合作用程度[3]。此外,香气化合物在食品热加工过程中容易与蛋白质发生解离,损失较快,从而导致风味强度减弱;食品中某些成分氧化产生异味物质与蛋白质发生结合,这些反应均会缩短产品的保质期[4]。由此可见,如何使蛋白质以最佳的形式结合和释放挥发性成分并保持产品理想的风味显得尤为重要。因此,了解蛋白基质与香气化合物的结合作用,开发新的方法或模型来稳定香气化合物的结合并控制释放,对保持食品的感官品质具有重要意义,同时也能为食品工业快速适应市场对营养、美味食品的需求提供技术基础。
基于此,本文综述了蛋白质与香气化合物的结合机制、测定方法和常用理论模型的研究进展,并探讨了影响蛋白质-香气化合物结合作用的主要因素。在此基础上,提出了改善风味与蛋白质结合能力的对策,以期为利用新工艺生产风味优良的健康食品提供思路。
1 蛋白质与香气化合物的结合作用机制
根据结合方式的不同,蛋白质主要通过非共价键合、共价键合和传质效应3 种方式实现对挥发性成分的吸附[5](图1),进而改变顶空中香气化合物的浓度。其中,蛋白质与香气化合物的非共价键合作用主要由疏水相互作用、范德华力、氢键和静电相互作用力来提供,这些作用方式均是可逆结合,常应用于减少加工过程的风味损失,并使风味成分在食用过程中重新释放[6]。Bi Shuang等[7]对3 种特定香气化合物与豌豆蛋白的结合类型进行研究,发现豌豆蛋白与正己醛的非共价键合作用主要是由氢键提供的结合作用力,而其与(E)-2-辛烯醛和(Z)-2-戊烯-1-醇的作用方式主要是疏水相互作用。对食品蛋白基质和关键香气贡献组分结合作用特性进行解析,可为富含蛋白食品风味的调控以及感官品质的提高奠定研究基础。
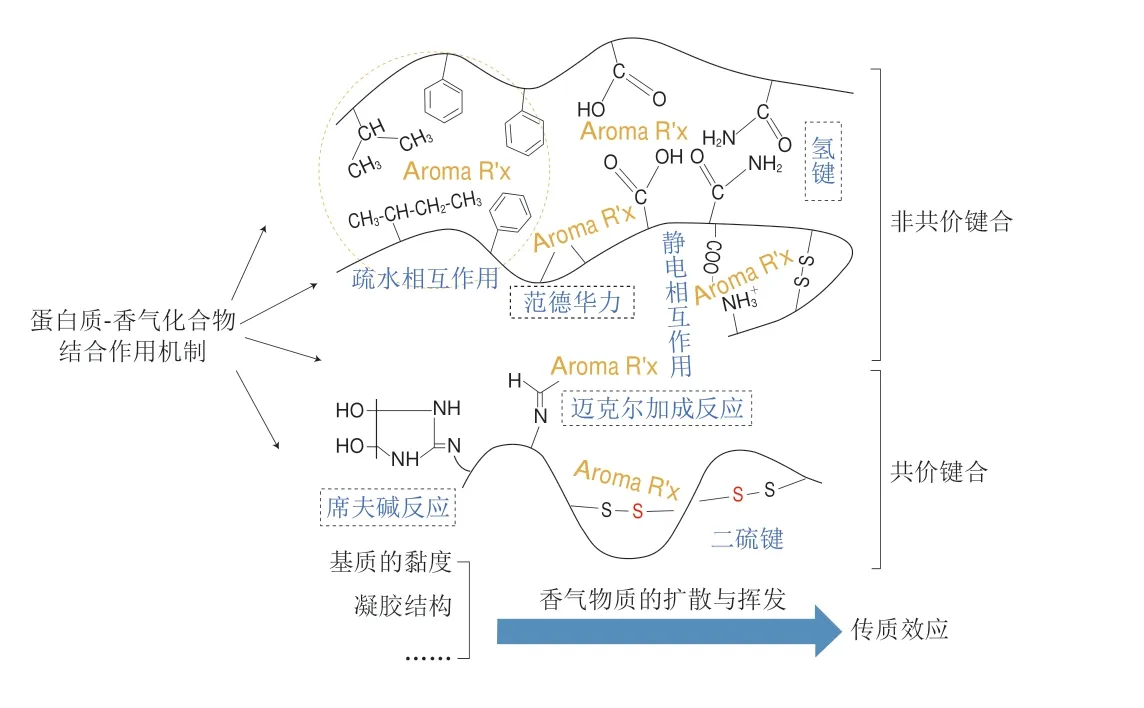
图1 蛋白质与香气化合物结合作用机制Fig.1 Binding mechanism between proteins and aroma compounds
蛋白质-香气化合物结合过程中存在可逆的非共价键合作用和不可逆的共价键合作用。共价键合作用主要包括醛基(—CHO)、羰基(C=O)与氨基酸残基(—NH2和—SH)的共价交联[8]。研究表明,随着胰蛋白酶含量的增加,肌球蛋白对醛、酮类化合物的吸附能力增强,主要是由于氨基活性、巯基含量的增加等导致蛋白质的二级结构展开,从而增强了蛋白与挥发性成分的结合行为[9]。含硫氨基酸中的巯基既可以参与维持蛋白质结构稳定的二硫键的形成,也可以与香气化合物发生共价结合[8]。另外,赖氨酸残基侧链的ε-氨基也会与醛类化合物通过形成席夫碱发生结合。Anantharamkrishnan等[10]研究发现,乳蛋白与醛类物质、硫醇和呋喃之间可通过席夫碱、二硫键的生成和迈克尔加成反应发生共价键合。此外,一些胺类挥发物与天冬氨酸、谷氨酸的末端羧基之间形成酰胺键,也属于共价键合[11]。这些结合作用的形成速度或慢或快,均能够导致食品风味特征的变化。
香气化合物在不同相之间的传质阻力会受到基质质地与微观结构的影响,进而导致分配系数和分子迁移率有所不同。蛋白基质黏度的增加或形成的凝胶结构均会产生传质效应,从而减缓香气物质在食用过程中的释放[12]。其中,增加黏度不仅会阻碍食品组分的混合,而且会阻碍香气化合物在口腔中的流动,从而降低挥发性物质释放到口腔的表面浓度[13]。此外,蛋白质发生凝胶化也会减少风味物质的释放,从而导致香气强度降低。不同种类的食品球状蛋白(如乳清蛋白和大豆球蛋白等)加热后发生变性,结构展开,通过暴露的活性位点相互作用,形成具有三维网络结构的凝胶,进而对香气化合物产生物理截留[14]。因此,通过改变挥发性成分的传质阻力可在一定程度上改变风味的整体平衡,最终对风味的释放产生有利影响。
2 蛋白质与香气化合物结合作用的研究方法与常用理论模型
依据分析原理,可将蛋白质-香气化合物结合作用的研究方法大致分为基于香气化合物顶空浓度、基于蛋白质构象变化以及基于蛋白分子与香气配体间结合位置的测定方法。其中,通过监测体系中香气化合物顶空浓度和蛋白质构象变化的测定方法往往需要理论模型加以辅助分析,进而反映蛋白质-香气化合物的结合作用程度。此外,新兴的分子对接模拟技术能够实现蛋白质-香气化合物结合作用位点和作用方式的可视化,从而直观地展现蛋白质与香气配体间的结合作用。因此,上述4 种研究方法与理论模型是定性和定量分析某种蛋白质和特定香气物质结合作用的方法基础。
2.1 基于香气化合物浓度的测定方法
香气化合物在顶空中的浓度可以预估人在进食过程中的风味感知程度,顶空分析法基于气-液分配系数,结合气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)分析被广泛应用于去香食品基质对香气化合物结合能力的研究。常用方法主要包括静态顶空(static headspace,SH)分析法和顶空-固相微萃取(headspace solid-phase micro-extraction,SPME)法[15]。
采用SH法对蛋白质-香气物质结合进行分析,基于香气化合物与蛋白质的结合亲和力(K1)以及气相与水相之间的风味分配系数(K2)。Xu Jiao等[16]通过SH法研究发现叶醇、柠檬烯以及丁二酮的保留率随大豆分离蛋白体系中所添加黄原胶浓度的增加而显著改变。Guo Jun等[17]利用SH法联合气相色谱测定香气化合物浓度,发现香茅醛、丙酸香茅酯、乙酸香茅酯和香茅醇浓度较高时(0.4~1.6 mmol/L)与大豆分离蛋白作用结合能较高,并产生新的结合位点,且两者为非线性结合。
SPME-GC/MS法能够测定食品中挥发性风味成分的浓度,并通过分析模型拟合,以计算出蛋白质内部结合位点个数(n)和结合常数(K)值,被广泛应用于研究蛋白质与香气化合物的结合作用。当香气物质与水溶液中的蛋白质结合时(图2),顶空中挥发物质的浓度发生变化,这可以通过色谱图中峰面积的变化来监测。Wang Haitang等[18]基于SPME-GC/MS方法研究了乙酯类物质(乙酸乙酯、丁酸乙酯、己酸乙酯和辛酸乙酯)与肌原纤维蛋白的结合作用。结果显示,随着肌原纤维蛋白浓度的增加,二者的结合能力显著增强,并且这4 种酯类物质与肌原纤维蛋白的结合能力依次为辛酸乙酯>己酸乙酯>丁酸乙酯>乙酸乙酯。Han Zhong等[19]借助该方法发现,肌原纤维蛋白与2-辛酮的结合能力显著高于2-庚酮和2-戊酮,这可能是由于香气化合物的碳链越长、结合位点越多,其与蛋白质的结合能力就越高。
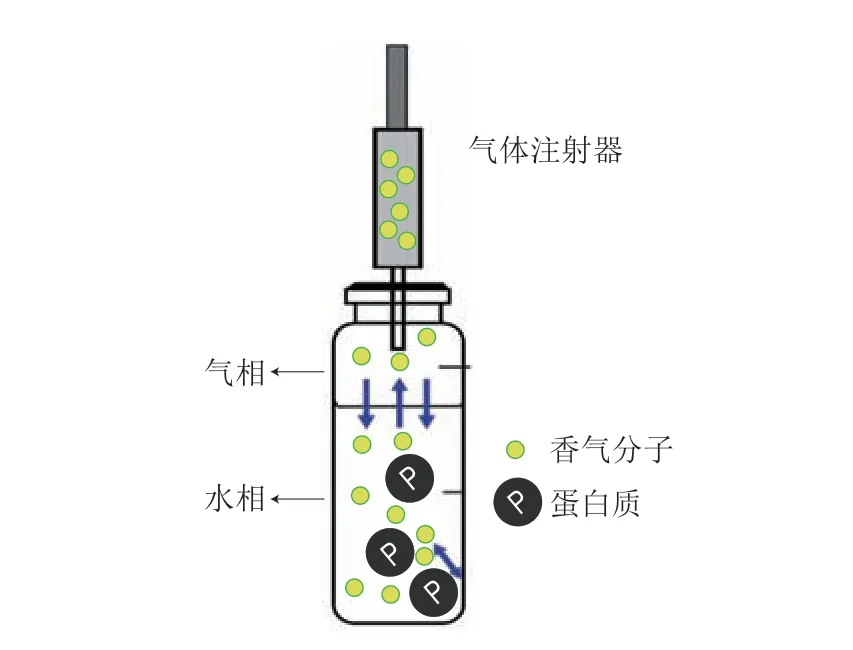
图2 基于顶空中香气化合物浓度测定蛋白质-香气化合物结合作用示意图[20]Fig.2 Schematic diagram of protein-aroma binding effect in the determination of aroma compound concentrations in headspace[20]
2.2 基于蛋白质构象变化的测定方法
当香气化合物分子带有极性基团时,在与蛋白结合时会引起蛋白质构象的改变。蛋白质与香气物质的结合作用通常采用结合位点n、结合常数K以及分配系数Ka、熵变ΔS、焓变ΔH和吉布斯自由能ΔG等热力学参数来表征。因此,可以使用多光谱技术来阐明活性结合位点和结合作用类型,常用技术主要包括紫外-可见吸收光谱、荧光猝灭光谱、同步荧光光谱、圆二色光谱、傅里叶变换红外光谱和拉曼光谱等技术(表1)。

表1 基于蛋白质构象变化的蛋白质-香气化合物结合作用的测定方法比较Table 1 Comparison of methods for determination of protein-aroma compound binding based on protein conformational changes
蛋白分子结合香气化合物前后的紫外-可见吸收光谱变化能够反映蛋白质的色氨酸和酪氨酸残基周围微环境的变化情况,从而可判断蛋白分子与香气化合物是否发生了结合作用。Yu Xia等[21]发现牛血清白蛋白使得茶黄素-3,3’-双没食子酸酯(theaflavin-3,3’-digallate,TFDG)的紫外吸收光谱增宽,可能是由于其与氨基酸残基存在特异性的非共价结合。Xiao Zuobing等[22]利用此法研究发现随着体系中百香果汁关键芳香化合物(二氢-β-紫罗兰酮和香叶醇)浓度的增加,索马甜蛋白在280 nm波长附近的吸收峰增强。这表明蛋白质的结构发生了变化,暴露了蛋白分子内封闭的色氨酸和酪氨酸残基的芳香杂环疏水基团,并且疏水相互作用得到增强,π-π*跃迁能量增加,证明它们都与索马甜蛋白发生了结合作用。
荧光猝灭光谱法常用于进一步研究蛋白质与香气化合物的结合模式,其中荧光强度能够反映蛋白质内部微环境亲水-疏水平衡的变化,进而结合Stern-Volmer方程对荧光数据进行分析,以计算得到结合位点和结合常数。其次,同步荧光光谱法可以反映特定氨基酸所处的微环境极性,也常用以分析蛋白质构象的变化[23]。根据前人的研究,荧光猝灭光谱法和同步荧光光谱法往往需要热力学方法辅助从而判断两者作用过程的主要驱动力,进一步探究蛋白质和香气化合物的结合机理。Li Hao等[28]通过荧光猝灭光谱法计算荧光猝灭速率常数(Ksv),以进一步了解肌原纤维蛋白与香气化合物(丁醛、辛醛、2-戊酮和2-辛酮)的结合作用,发现除丁醛外,其余Ksv均大于生物大分子与猝灭剂的最大散射碰撞猝灭常数。这表明丁醛对肌原纤维蛋白的荧光猝灭为静态猝灭,而其他化合物则同时发生动态猝灭和静态猝灭。Yu Xia等[21]通过联合荧光猝灭和同步荧光光谱法发现牛血清白蛋白与TFDG的结合使蛋白质的色氨酸和酪氨酸残基周围的微环境更具疏水性,且TFDG能够静态猝灭牛血清白蛋白的荧光,并诱导蛋白质的二级结构发生变化,该结论与傅里叶变换红外光谱分析结果一致。
不同于荧光光谱法,圆二色光谱法可以得到蛋白质中各二级结构的相对含量,进而推测出蛋白质构象的伸展与折叠,以及蛋白质内部氢键网络结构的变化情况[23]。Huang Pimiao等[29]通过圆二色光谱法探讨了3 种酚类化合物与鲢鱼肌原纤维蛋白的相互作用促进鱼腥味释放的机理,发现α-螺旋和β-折叠含量显著降低,而β-转角和无规卷曲含量显著增加,其变化程度与酚类化合物的浓度呈正相关。Ersöz等[30]借助该技术对不同pH值下β-乳球蛋白与异硫氰酸烯丙酯的结合机制进行研究,当pH值为3.0和6.5时,游离β-乳球蛋白的远紫外光谱显示典型的α-螺旋、β-折叠和无规卷曲结构占主导地位,并且随着pH值的升高,游离β-乳球蛋白的结构疏松,无序结构所占比例增加。
区别于上述光谱方法,傅里叶变换红外光谱法通常根据酰胺I(1 600~1 700 cm-1)、酰胺II(1 550 cm-1附近)和酰胺III(1 200~1 350 cm-1)谱带来表征蛋白质结构的变化,并且可用于分析不同的状态、浓度等环境下蛋白质二级结构及其内部氢键变化的情况[27]。He Yujia等[24]通过傅里叶变换红外光谱法观测到醛类化合物和温度对肌球蛋白的酰胺III带均有显著影响,通过特定波长下吸收峰的移动能够判断出肌球蛋白与己醛、辛醛和3-甲基丁醛相互作用均改变了蛋白质的构象。Zhu Lin等[25]利用傅里叶变换红外光谱发现高粱醇溶蛋白与阿魏酸(ferulic acid,FA)和四甲基吡嗪(tetramethyl pyrazine,TMP)结合能够促使高粱醇溶蛋白的二级结构发生变化,α-螺旋含量略有下降。
此外,拉曼光谱法能够获取蛋白质的主链构象,特别是酰胺I带、酰胺III带和C-N等的伸缩振动信息;也可以得到侧链基团微环境的变化情况以及计算蛋白质的二级结构含量[26]。Xu Yongxia等[31]利用拉曼光谱法研究热处理时间对鱼肌球蛋白与(E)-2-庚烯醛、1-辛烯-3-醇等香气化合物结合作用的影响,发现酰胺I带(1 600~1 700 cm-1)是主要的拉曼光谱带,主要包括α-螺旋、β-折叠、β-转角和无规卷曲4 种二级结构。肌球蛋白的α-螺旋含量在热处理前5 min显著下降,继续加热5~30 min后显著升高,这可能是肌球蛋白的热变性和展开,导致疏水基团和巯基的暴露;进一步延长热处理时间将导致疏水基团的嵌入并形成二硫键,从而能够稳定α-螺旋结构。Zhao Xiaocao等[32]通过拉曼光谱法检测出结合呋喃类香气化合物的肌原纤维蛋白中α-螺旋含量随着超声功率水平的增加先减小后增大,β-折叠和β-转角含量先增大后减小,且在500 W时变化最显著。此外,Cao Jinxuan等[34]根据拟合条带的积分来计算相应谱带的面积,由酰胺I带谱图确定蛋白质不同二级结构的相对含量,发现低浓度氧化剂(0~5 mmol/L H2O2)增加了羰基含量和表面疏水性,使巯基数量有所减少,并诱导G-肌动蛋白结构发生从β-折叠到α-螺旋、β-转角和无规卷曲的部分转变。
2.3 描述蛋白质与香气化合物结合作用的理论模型
香气化合物的顶空浓度、荧光强度以及猝灭速率常数并不能充分反映蛋白质-香气化合物的结合作用程度,因此,在研究二者结合能力时需要热力学理论模型加以辅助计算出结合常数K值和结合位点n值。描述蛋白质-香气化合物结合作用的理论模型对于定性和定量分析蛋白质与香气化合物的结合作用类型、作用位点个数和结合力大小是必不可少的。目前,分析蛋白质与香气化合物结合作用的模型通常分为3 种:1)Klotz方程,常用于分析结合位点固定、较低浓度的香气化合物与蛋白质的线性结合[35];2)Hill方程,适用于分析结合位点发生变化、浓度较高香气化合物与蛋白质的非线性结合[36];3)Stern-Volmer、Van’t Hoff或Kirchhoff方程,用来分析蛋白质构象变化,通过结合参数来表征蛋白-香气的结合作用[37]。
Klotz双倒数方程和Hill方程分别如公式(1)、(2)所示。
式中:m为每摩尔蛋白质结合的香气化合物的量;[L]为水溶液中自由香气化合物的浓度/(mol/L);K为结合常数/(L/mol);n为结合位点的个数;h为希尔系数,反映蛋白质结构改变的程度。
一般,m和[L]根据GC峰面积分别通过公式(3)、(4)计算可得。
式中:O为香气化合物总浓度/(mol/L);Cp为蛋白质浓度/(mol/L);[HS]p为含蛋白质样品的顶空香气化合物GC峰面积;[HS]c为不含蛋白质样品顶空香气化合物GC峰面积。
另外,基于蛋白质构象发生变化时,常使用的Stern-Volmer方程及其修正后可用于计算结合位点n值和静态猝灭平衡常数Ka的方程分别公式(5)、(6)所示。
式中:F0和F分别为不存在和存在猝灭剂时的荧光强度;Ksv为荧光猝灭常数/(L/mol);[Q]为猝灭剂的浓度/(mol/L);Ksv可以通过对F0/F与[Q]的线性回归关系曲线来确定。
采用的分析模型、香气化合物浓度、研究体系等不同,所获得的研究结果也不尽相同。刘璘等[38]基于热力学模型(Scatchard方程)的研究表明,肌球蛋白与白鲢鱼特征腥味物质的结合反应均是自发的(ΔG<0)。与直链醛(庚醛、辛醛、壬醛)相比,1-辛烯-3-醇和肌球蛋白的结合位点数(n)更多及结合常数(K)较大,且肌球蛋白对直链醛的结合能力随着链长的增加而有所降低。有研究表明,基于Klotz模型,香茅醛、丙酸香茅酯、乙酸香茅酯和香茅醇在低浓度时(0.04~0.16 mmol/L)与大豆分离蛋白的结合较小,两者为线性结合,而Hill模型分析结果则与之相反[33]。另外,基于构象变化,采用Kirchhoff方程能够计算熵变ΔS、焓变ΔH和吉布斯自由能ΔG,进而推导出结合常数K和结合位点n[39]。此外,利用Stern-Volmer方程,并根据猝灭速率常数也可以计算得到结合常数K值和结合位点n值[40]。由于大多数蛋白质-香气物质的作用都是可逆的非共价结合,研究者倾向于使用Klotz(或Scatchard)方程和Hill方程两种经典理论模型,在平衡条件下来描述香气化合物与蛋白质的结合能力。
2.4 基于蛋白分子与香气配体间结合位置的测定方法
分子对接是研究分子间(配体和受体)相互作用并预测其结合模式和亲合力的一种理论模拟方法。分子动力学模拟能够克服对接分析中严格的采样限制,利用计算机以原子水平的分子模型来模拟分子结构和行为,进而模拟分子体系的各种物理、化学性质。近年来,分子对接和分子模拟越来越多地被用于食品领域,为蛋白分子与香气化合物间的结合作用研究提供了一种新思路和新工具。Zhang Bin等[41]通过分子对接研究不同含氧官能团(羰基、醇羟基和醛基)与大豆分离蛋白的结合作用,发现辛醛与大豆分离蛋白的结合亲和力最高,其次是1-辛烯-3-醇和2-辛酮,这是因为醛类化合物与大豆分离蛋白之间形成了更强的氢键作用。根据Bi Shuang等[7]的研究,豌豆蛋白中的Leu-12和Lys-39残基有助于疏水相互作用的形成,其与己醛分子的距离分别为3.59 Å和3.29 Å,(E)-2-辛烯醛中的氧原子与Asn-336、Lys-482、Phe-483和Leu-484残基中的氢原子则通过长度分别为3.52、3.56、3.45 Å和3.20 Å的氢键相互作用。Wang Haitang等[18,40,42]基于分子对接和动力学模拟技术,进一步验证了多光谱方法的实验结果,结果表明氢键和范德华力是肌原纤维蛋白与辛酸乙酯、1-庚醇可逆结合的主要驱动力,而疏水相互作用是维持肌球蛋白-庚醛体系的稳定性的主要作用力。Liu Chengzhi等[43]利用分子动力学模拟探索玉米醇溶蛋白与表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG)的结合作用机理(图3)。图中残基的能量贡献小于-8.37 kJ/mol显示为橙色,能量贡献大于-8.37 kJ/mol显示为黄色,而左侧紫色虚线则代表氢键。分子动力学模拟结果表明,EGCG与Y171、Q174、L176和L205残基生成的玉米醇溶蛋白活性口袋结合。其中,静电相互作用和范德华力在EGCG与玉米醇溶蛋白的结合中起主导作用,这与傅里叶变换红外光谱和热力学分析的结果一致。此外,Han Ping等[44]综合利用分子动力学模拟和分子对接法测得肌球蛋白-芝麻酚复合物的均方根偏差值低于单个肌球蛋白,这说明肌球蛋白与芝麻酚结合后的结构变得更加稳定,且分子构象变化程度较小。
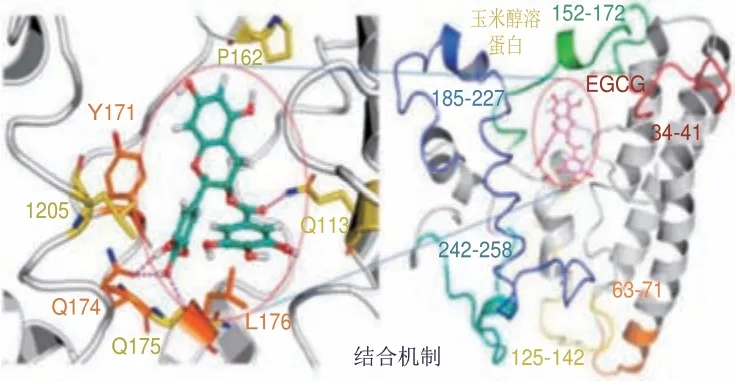
图3 玉米醇溶蛋白与EGCG的结合机制[43]Fig.3 Binding mechanism between zein and epigallocatechin-3-gallate(EGCG)[43]
3 蛋白质与香气化合物结合作用的影响因素
蛋白质-香气化合物的结合作用受到多种因素的影响,除了温度、pH值、离子强度和氧化条件等环境因素能够通过改变蛋白质结构来影响蛋白质与香气物质的结合作用,食品中的蛋白质、香气化合物及其他配料组分差异也会使蛋白质的结构和聚集状态发生变化,从而影响蛋白质的结合能力。目前,关于温度、pH值和蛋白质氧化等加工条件如何影响蛋白质-香气化合物结合能力的总结已较为系统全面,因此,本文主要围绕食品基质中蛋白质的种类与结构、香气化合物的浓度、种类与官能团以及食品中的配料成分差异对蛋白质-香气化合物结合作用的影响进行阐述,以深入解析二者结合作用机制。
3.1 蛋白质种类
目前对蛋白质与香气化合物结合作用的研究主要集中在动物蛋白,包括乳蛋白(β-乳球蛋白、α-乳白蛋白和酪蛋白)、牛血清白蛋白和肌原纤维蛋白。表2总结了近几年来发表的文献中所选择的香气化合物与不同蛋白质的结合作用。蛋白质种类的不同,特别是氨基酸残基、二级结构等均有所差异,能够影响其与香气化合物作用时所表现的结合能力强弱。
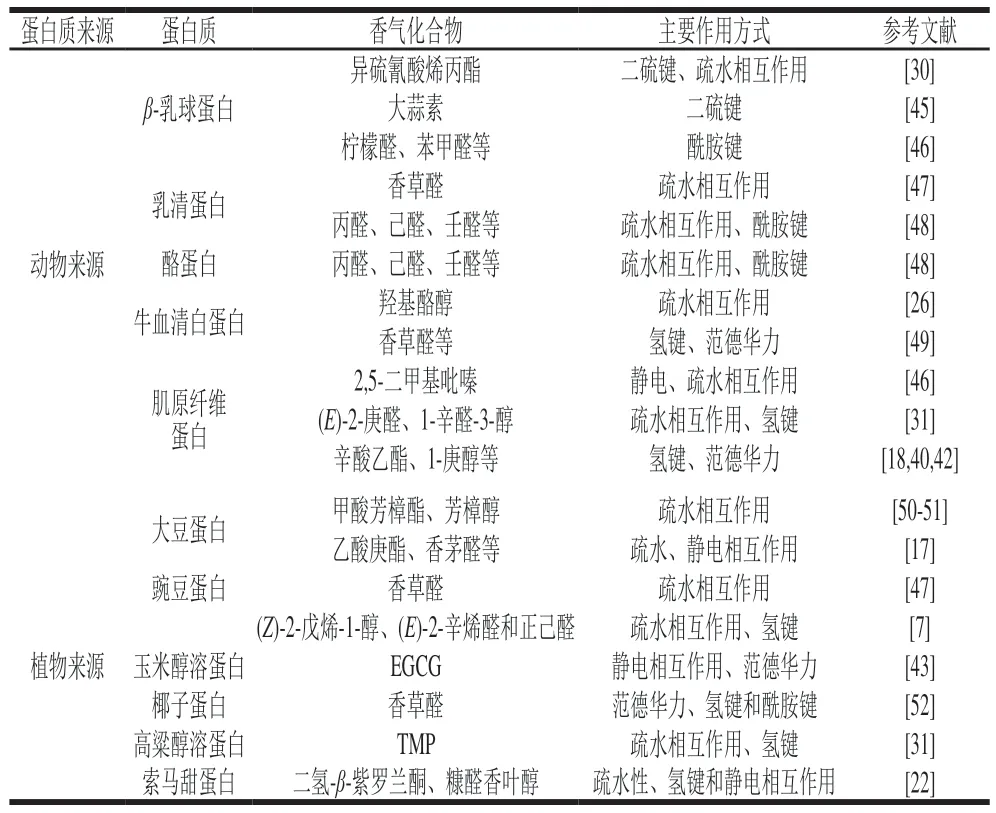
表2 食品中蛋白质与香气化合物的结合作用Table 2 Binding effect between proteins and flavor compounds in foods
乳蛋白主要包括酪蛋白和乳清蛋白,其中乳清蛋白主要由β-乳球蛋白(约80%)和α-乳白蛋白组成。由于β-乳球蛋白体积小、水溶性好、结构和性质明确,因此广泛作为模型用于研究香气化合物-蛋白质的结合作用。Tavel等[53]利用傅里叶变换红外光谱和2D核磁共振法进行分析,发现酮类、醛类、酯类和酚类香气物质与β-乳球蛋白既可以结合在同一位点,也可以结合在不同位点。酪蛋白由于自身结构的特殊性,有关其与香气化合物结合作用的研究较少,且一般都是在模拟体系中完成。Viry等[48]通过构建新的预测模型研究酪蛋白酸钠在5 ℃平衡24 h后与香气化合物的结合能力,发现酪蛋白酸钠与乙酸乙酯、苯甲醛和丙酮的结合是弱相互作用力。Yin Zhucheng等[54]认为酪蛋白比其水解物与矢车菊素-3-O-葡萄糖苷(cyanidin-3-O-glucoside,C3G)的结合能力更强,且酪蛋白与C3G的结合方式经酶作用后由范德华力或氢键转变为疏水相互作用。
肌肉蛋白是一种复合体系的蛋白质,研究较多的主要是肌球蛋白和G-肌动蛋白等肌原纤维蛋白。根据Cao Jinxuan等[34]的研究,0~1 mmol/L H2O2能够导致G-肌动蛋白在与醛类化合物结合时巯基位点数量减少,有利于香气化合物的释放;而1~20 mmol/L H2O2能够促进醛类物质的保留,这是由于G-肌动蛋白重建和聚集增加了疏水位点数量,进而易于形成蛋白质-芳香化合物复合物。Liu Huan等[55]认为肌球蛋白流变行为与肌球蛋白-醛分子结合作用之间的协同作用能够促进醛类化合物的保留,并采用分子对接模拟结合多光谱技术预测出Thr-125、Pro-128、Trp-131和Val-187是肌球蛋白和戊醛之间结合的关键位点。除此之外,当添加酮类化合物后,肌原纤维蛋白的构象发生了改变,α-螺旋含量相应减少,Tyr和Trp残基周围微环境的极性增强[56],这与Yang Qiuli等[57]的研究结果一致。
与动物蛋白不同的是,大豆蛋白因不良“草味”或“豆腥味”限制了其应用和消费。因此,许多研究都集中在了解大豆蛋白异味的释放和结合上。研究表明,醇类(如1-己醇)和醛类(如己醛)与干大豆蛋白的结合能力高于烃类(如己烷),这可能是由于大豆蛋白与醇、醛类化合物形成了氢键相互作用[58]。然而,除大豆蛋白外,对其他植物蛋白及其风味结合能力的系统研究还比较缺乏。Zhu Lin等[25]基于多重光谱和分子模拟研究了高粱醇溶蛋白(Kafirin)与FA和TMP的结合能力,发现疏水作用和氢键分别在Kafirin-FA和Kafirin-TMP复合物的形成中发挥了主要作用,且复合物的形成使Kafirin的结构更加紧凑。
3.2 蛋白质的结构
研究表明,蛋白质的结构,特别是其氨基酸序列、二级、三级和四级结构是影响其与香气化合物结合的重要因素。黄国等[59]研究中性条件下β-伴大豆球蛋白(7S)、大豆球蛋白(11S)与EGCG的结合作用。相比于7S蛋白,11S蛋白中疏水性和不带电荷的氨基酸含量较高,说明11S蛋白对EGCG的结合能力更强。α-乳白蛋白的致密结构含有26%的α-螺旋、14%的β-折叠和60%的无序结构,能够抑制疏水性区域的暴露,从而降低蛋白质与香气物质的结合能力[60]。甲基化、乙基化、二硫键断裂、糖基化和脱酰胺基等均会导致蛋白质肽链展开和聚集,从而引发其与香气化合物结合作用的改变。O’Neill[61]认为将蛋白质羧基侧链的乙基酯化和用亚硫酸钠还原二硫键对β-乳球蛋白进行化学修饰,能够形成大量的结合位点。Temthawee等[52]以香草醛-椰子蛋白为模型,研究了谷氨酰胺酶对椰子蛋白风味结合电位的影响,发现脱酰胺后椰子蛋白的整体结合亲和力降低,从而可以减少香草醛与蛋白质的结合行为。Wang Juan等[62]通过丙二醛模拟体系对大豆分离蛋白进行氧化改性,发现低氧浓度时,蛋白质结构展开,暴露疏水基团,从而增强了蛋白质与芳香化合物的结合作用;而在高氧浓度时,蛋白质与饱和醛类化合物结合能力将减弱。Zhao Xiaocao等[32]对肌原纤维蛋白进行超声处理,发现超声处理促进了蛋白结构解聚和去折叠,使其暴露出更多的疏水和氢键结合位点,同时肌原纤维蛋白与呋喃类化合物间的静电相互作用力也得到增强。综上,对蛋白质的可暴露疏水区域进行物理和化学修饰,可以提高其结合风味的能力。
3.3 香气化合物的浓度、种类和官能团
香气化合物浓度对自身与蛋白质作用的结合位点和结合常数有很大的影响。通过Hill模型分析可得,随着香气化合物浓度增大,其与蛋白质的结合能力增强,引起蛋白质去折叠或肽链展开,从而产生新的结合位点。例如,当己醛浓度为0.1~1.0 mol/L范围内时,随着己醛浓度增大,11S球蛋白和7S伴球蛋白与香气化合物结合位点数量增多,是熵驱反应[36]。当香气化合物为低浓度时,其与蛋白质结合能较低,一般难以真实地反映蛋白质内部对香气化合物的结合情况,特别是内部疏水区较封闭的大豆分离蛋白,蛋白质的构象并不会发生变化[36,63]。蛋白质内部结合香气化合物浓度通常较低,结合强度高,释放量较少,因此研究者常使用SPME-GC/MS方法测定顶空中香气化合物浓度,再通过数学模型拟合,进而得到蛋白质内部结合位点。
许多研究都更加关注香气化合物对蛋白质结合位点数量和分布的影响,其中香气化合物的种类和官能团对二者之间的结合作用具有显著影响。总体来看,研究者倾向于认为香气化合物与蛋白质的结合强度大小依次为醛类>酯类>酮类>醇类[20]。当香气化合物为同系物时,其与蛋白质的结合能力随着脂肪链长度的增加而增强[64]。Ma Yunjiao等[65]在水溶液中研究了吡嗪与牛血清白蛋白的结合作用,发现吡嗪中—CH3的位置和分布受体系中风味释放的显著影响,牛血清白蛋白的酪氨酸和色氨酸残基是烷基-吡嗪通过静电和疏水相互作用的主要结合位点。
3.4 食品中的配料成分
食品是包含多种成分的复杂体系,存在其他配料成分,如油脂、乳化剂、盐和调味用糖等,这些配料或多或少地会影响蛋白质的聚集状态和构象等特性,从而对蛋白-香气化合物的结合作用产生一定的影响。一般来说,蛋白质对挥发性风味物质的保留率远低于脂肪。Guichard[66]报道,油脂含量的增加会降低疏水性芳香化合物的挥发性,而对亲水性化合物(如双乙酰或短链醇)却只产生很小的影响。然而,在乳状液中,蛋白质在油-水界面的存在会对疏水性香气化合物的释放和感知产生显著性影响[67]。Rogacheva等[68]研究香气化合物在油-水体系与β-乳球蛋白的结合行为,认为油-水界面上蛋白质的存在可以提高芳香化合物的传质阻力,从而减缓香气物质释放到气相中的速率,以保证在食用过程中风味的持续性。此外,Wang Kun等[69]研究盐的种类和浓度对盐提取豌豆蛋白提取物(salt-extracted pea protein isolates,PPIs)与酮类化合物(2-己酮、2-庚酮和2-辛酮)结合的影响。相比于二价盐(CaCl2),较高浓度的NaCl(0.25~1.00 mol/L)能显著促进蛋白质与风味的结合,而较低浓度(0.05~0.10 mol/L)则会降低风味的保留。在不同条件下,PPIs和2-辛酮的结合能力均大于2-庚酮和2-己酮。Xu Jiao等[16]对多糖体系中大豆分离蛋白与香气化合物的结合作用进行研究,发现乙酸叶醇酯、丁二酮分别在大豆分离蛋白与羧甲基纤维素钠、黄原胶混合溶液中的保留率更高,柠檬烯在大豆分离蛋白与刺槐豆胶体系中的保留率则显著低于上述两种多糖体系。
4 结 语
蛋白质与香气化合物的结合作用会直接或间接影响食品的风味感知,进而影响消费者对食品的喜好程度。此外,食品工业中蛋白质-香气化合物反应会造成风味损失或者异味存留,从而缩短产品保质期,因此,了解蛋白质与香气化合物的结合作用机制及影响因素,为保持食品理想的风味和延长产品保质期提供了可能。
随着精密仪器与技术的不断发展,研究手段与方法的不断成熟,对蛋白质与香气化合物结合作用的认识也逐渐深入。然而目前还存在一些问题,需要在目前的认知基础上进一步强化。首先,目前蛋白基质与香气成分的结合作用研究一般都是在单一的模拟体系中完成,它们之间的结合类型与作用位点等作用方式尚不明确,且不存在统一的作用机制。因此,在研究单一基质的基础上,进一步研究复合体系和多组分食品基质与香气化合物的相互作用是未来研究的发展趋势之一。其次,关于蛋白质在加工时构象变化、不同结构的香气化合物共存条件下以及添加食品配料等对蛋白质与香气化合物结合作用影响等方面的研究仍有所欠缺,进而导致蛋白食品体系中风味平衡调控技术的缺乏。此外,随着消费者追求饮食中少盐、少糖,同时对低脂食品的需求增加,应加速探索开发植物性和“三减”食品的方法。但是“三减”食品的风味成分持续释放能力也会减弱,如何在这种情况下保持食品的风味也显得至关重要。如开发植物胶或以蛋白质为基础的脂肪替代品,并通过添加调味料或改变香气化合物的释放/保留模式来保持食品的风味特征,均是满足健康饮食需求的可选策略。与此同时,也需要深入研究感官评价和蛋白质-香气化合物结合作用程度之间的关系,以期在蛋白质与香气化合物结合作用机理的研究基础上揭示食品风味在体内和体外的释放机制。食品中蛋白基质与香气化合物的结合能力决定了食品的风味品质,随着蛋白质与不同香气化合物结合作用机理研究的不断深入,蛋白质-香气化合物的结合方式和特有的保留/释放模式将逐渐明晰,这对于挥发性香气成分的可控释放及感知并实现风味品质稳态化调控具有重要的意义。
