山楂多酚缓解苯并芘诱导的呼吸道上皮细胞炎性损伤活性
2023-10-17燕霞凤侯召勤张翠芬马燕飞王建军
燕霞凤,侯召勤,张翠芬,马燕飞,王建军,*
(1.东营市人民医院科教科,山东 东营 257000;2.深圳大学 呼吸疾病国家重点实验室深圳大学变态反应分室,广东 深圳 518060)
苯并芘(benzo(a)pyrene,BaP)是化石燃料、烟草等不完全燃烧产生的挥发性化合物,是主要的大气污染物之一[1],其也是肺癌、皮肤癌和肌肉减少症等多种疾病的诱因之一[2-4]。由于BaP主要存在于空气中,因此其最主要的危害是诱发呼吸道疾病。研究表明,BaP暴露会诱发呼吸道细胞氧化应激及炎症反应,进而造成呼吸道损伤[5],而呼吸道内皮细胞在诱发、调控哮喘疾病过程中有重要的作用[6]。
山楂不仅是中药,还是不可多得的保健食品,具有消食化滞、活血化瘀、降血脂、降血压等功效[7]。山楂中富含黄酮、三萜、有机酸类等化合物[8]。其中,山楂总黄酮为山楂中重要的活性成分,具有多种药理活性[9-10],能够降血脂、改善冠脉血流量及机体微循环状态等[10]。研究发现,山楂富含活性酚类化合物,具有良好的抗氧化、抑菌、抗炎能力[11-12],对内皮细胞损伤也有一定的保护作用[13]。Deng Jie等[14]发现,富含酚类化合物的山楂提取物具有抑制BaP遗传毒性的作用;同样地,Shin等[15]的研究表明,山楂的提取物具有预防过敏性气道炎症的功能,是过敏性哮喘的潜在治疗药物。但目前关于山楂对呼吸道的保护功能研究较少,同时这种保护作用是否与山楂多酚有关尚不明确。
本实验在研究BaP暴露损伤呼吸道上皮细胞潜在机制的同时,研究山楂活性酚类化合物对呼吸道上皮细胞的保护活性及潜在分子机制,以期为环境污染物暴露导致的哮喘的预防、治疗提供一定的借鉴。
1 材料与方法
1.1 材料与试剂
BaP 阿拉丁试剂(上海)有限公司;人支气管上皮(16HBE)细胞 中国科学院上海细胞生物学研究所;Annexin V-FITC细胞凋亡检测试剂盒、胎牛血清和青霉素-链霉素混合液、DMEM培养基、BCA蛋白质浓度测定试剂盒 上海碧云天生物技术研究所;芳香烃受体(aryl hydrocarbon receptor,AhR)、细胞色素p450家族1亚家族A成员1(cytochrome P450 family 1 subfamily A member 1,CYP1A1)、p-p65、p-IκBα、p-IKKα/β和β-actin的一抗抗体、山羊抗兔二抗和山羊抗鼠二抗 美国CST公司。
1.2 仪器与设备
R2487高效液相色谱(high performance liquid chromatography,HPLC)仪 美国Waters公司;3-30K高速台式冷冻离心机、2K15型低温高速离心机 美国Sigma公司;INCO2108型CO2培养箱 德国Memmert公司;液相色谱-质谱联用(liquid chromatography tandem mass spectrometry,LC/MS)仪 美国Agilent Technologies公司;SW-CJ-IC型超净工作台 苏州安泰空气技术有限公司;Ultra-Turrax®高性能分散机 德国IKA集团;Epics Altra型流式细胞仪 美国Beckman公司。
1.3 方法
1.3.1 山楂活性多酚分离、鉴定
新鲜山楂5 kg,粉碎并与10 kg水混合,超声提取3 次(功率1 000 W、温度10 ℃),每次1 h,过滤,合并提取液,减压浓缩(温度100 ℃、平均速率60 r/min)得浸膏798.4 g,向浸膏中加入3 kg水,依次用氯仿、乙酸乙酯萃取,回收溶剂后得氯仿萃取物(100.4 g)、乙酸乙酯萃取物(112.5 g)及水层物。基于构建的BaP暴露16HBE细胞模型,评价氯仿萃取物、乙酸乙酯萃取物及水层萃取物的细胞保护活性,将活性最佳部分收集并继续分离活性化合物。
将乙酸乙酯萃取物(100 g)经硅胶柱色谱(1 kg,200~300 目)分离,以氯仿-甲醇梯度洗脱(体积比100∶10→10∶100),经薄层色谱法(thin-layer chromatography,TLC)检测后合并得到10 个组分(组分A~J)。基于构建的BaP暴露16HBE细胞模型,评价这10 个组分的细胞保护活性,将活性最佳部分收集并继续分离活性化合物。组分D经Sephadex LH-20凝胶柱色谱分离,得到化合物1(HBP-1,221 mg)、化合物2(HBP-2,324 mg)和化合物3(HBP-3,228 mg);组分E经硅胶(300 g,300~400 目)柱色谱分离,以氯仿-甲醇梯度洗脱(体积比60∶40→10∶90),得到化合物4(HBP-4,114 mg)、化合物5(HBP-5,134 mg)和化合物6(HBP-6,158 mg);组分F经反相十八烷基硅烷键合硅胶填料(octadecylsilyl,ODS)柱色谱分离,以甲醇-水(体积比60∶40)洗脱,得到化合物7(HBP-7,192 mg)、化合物8(HBP-8,143 mg)、化合物9(HBP-9,133 mg)和化合物10(HBP-10,215 mg)。
1.3.2 细胞培养及细胞活力检测
100 μL/孔的16HBE细胞(1×105个/mL)接种于96 孔板中,于培养箱中培养过夜。空白组细胞不做任何处理,BaP组细胞培养基中分别加入终浓度为1、10、50、250、500、1 250 μmol/L的BaP培养24 h,或培养基中加入BaP(终浓度为10 μmol/L)分别培养12、24、48、72 h。使用CCK-8试剂盒检测16HBE细胞活力[16]。
100 μL/孔的16HBE细胞(1×105个/mL)接种于96 孔板中,培养过夜。空白对照组细胞不做任何处理,第2~12组细胞培养基中加入终浓度为10 μmol/L的BaP培养24 h后收集细胞,冷磷酸盐缓冲液(phosphate buffered saline,PBS)清洗2 次,第2组(BaP组)加入新的培养基继续培养24 h;第3~12组细胞清洗后,分别加入含有25 μmol/L的HBP-1~10或白藜芦醇的新鲜培养基并继续培养24 h。采用CCK-8试剂盒检测16HBE细胞活力。
参考文献[17]方法,采用噻唑蓝(methyl thiazolyl tetrazolium,MTT)法检测化合物HBP-1~10的细胞毒性。
1.3.3 16HBE细胞炎症因子及细胞内活性氧水平测定
100 μL/孔的16HBE细胞(1×105个/mL)接种于96 孔板中,培养过夜。空白对照组细胞不做任何处理,第2~4组细胞培养基中加入终浓度为10 μmol/L的BaP培养24 h后收集细胞,冷PBS清洗2 次,第2组(BaP组)加入新的培养基继续培养24 h;第3、4组细胞清洗后,分别加入含有5、50 μmol/L的HBP-1新鲜培养基并继续培养24 h。之后1 400 r/min离心5 min,收集上清液及细胞。参照肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、IL-18、IL-10、IL-6及ROS酶联免疫吸附试验(enzymelinked immunosorbent assay,ELISA)试剂盒说明书进行细胞上清液中炎症因子及细胞内活性氧(reactive oxygen species,ROS)水平检测。
1.3.4 流式细胞术检测细胞凋亡
100 μL/孔的16HBE细胞(1×105个/mL)接种于96 孔板中,培养过夜。空白对照组细胞不做任何处理,第2~4组细胞培养基中加入终浓度为10 μmol/L的BaP培养24 h后收集细胞,冷PBS清洗2 次,第2组(BaP组)加入新的培养基继续培养24 h;第3、4组细胞清洗后,分别加入含有10、50 μmol/L HBP-1的新鲜培养基并继续培养24 h。收集细胞,PBS清洗2 遍,根据Annexin V-FITC细胞凋亡检测试剂盒说明书操作,采用流式细胞仪检测16HBE细胞凋亡情况。
1.3.5 Western blotting检测相关蛋白的表达
将16HBE细胞密度调整为3×105个/mL,3 mL/孔接种于6 孔板中,参照1.3.4节方法分组处理,收集细胞,加入适量RIPA裂解液提取细胞总蛋白,参考文献[18]的方法采用Western blotting检测核因子(nuclear factor,NF)-κB信号通路、细胞AhR信号通路相关蛋白的表达。
1.4 数据统计与分析
HBPs的化学结构图采用ChemDraw软件绘制。采用SPSS 18软件进行数据分析,阴性对照、阳性对照使用独立样本t检验方法检验。P<0.05表示具有显著差异,P<0.01表示具有极显著差异,实验结果均以平均值±标准差表示,n=3。
2 结果与分析
2.1 HBPs的分离鉴定
基于活性追踪方法,本研究分离获得山楂活性酚类化合物HBP-1~10,并鉴定其结构(图1)。
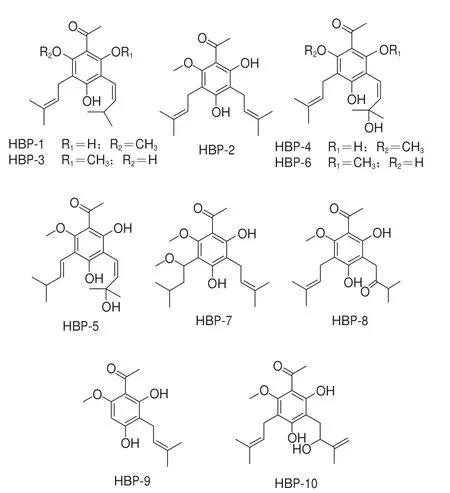
图1 化合物HBP-1~10的结构Fig.1 Structures of HBP-1 through 10
H B P-1:黄色油状物,高分辨电喷雾电离质谱(high resolution electrospray ionization mass s p e c t r o s c o p y,H R-E S I-M S)显示准分子离子峰m/z341.172 9 [M+Na]+(C19H26O4Na,理论计算值:341.172 3),确定分子式为C19H26O4。其1H NMR、13C NMR数据见表1。

表1 HBP-1、3、4、5、6的1H NMR、13C NMR数据Table 1 1H NMR and 13C NMR data of HBP-1, 3, 4, 5 and 6
HBP-2:黄色油状物,HR-ESI-MS显示准分子离子峰m/z319.190 4 [M+H]+(C19H27O4,理论计算值:319.190 4),确定分子式为C19H26O4,不饱和度为6。其1H NMR、13C NMR数据见表2。
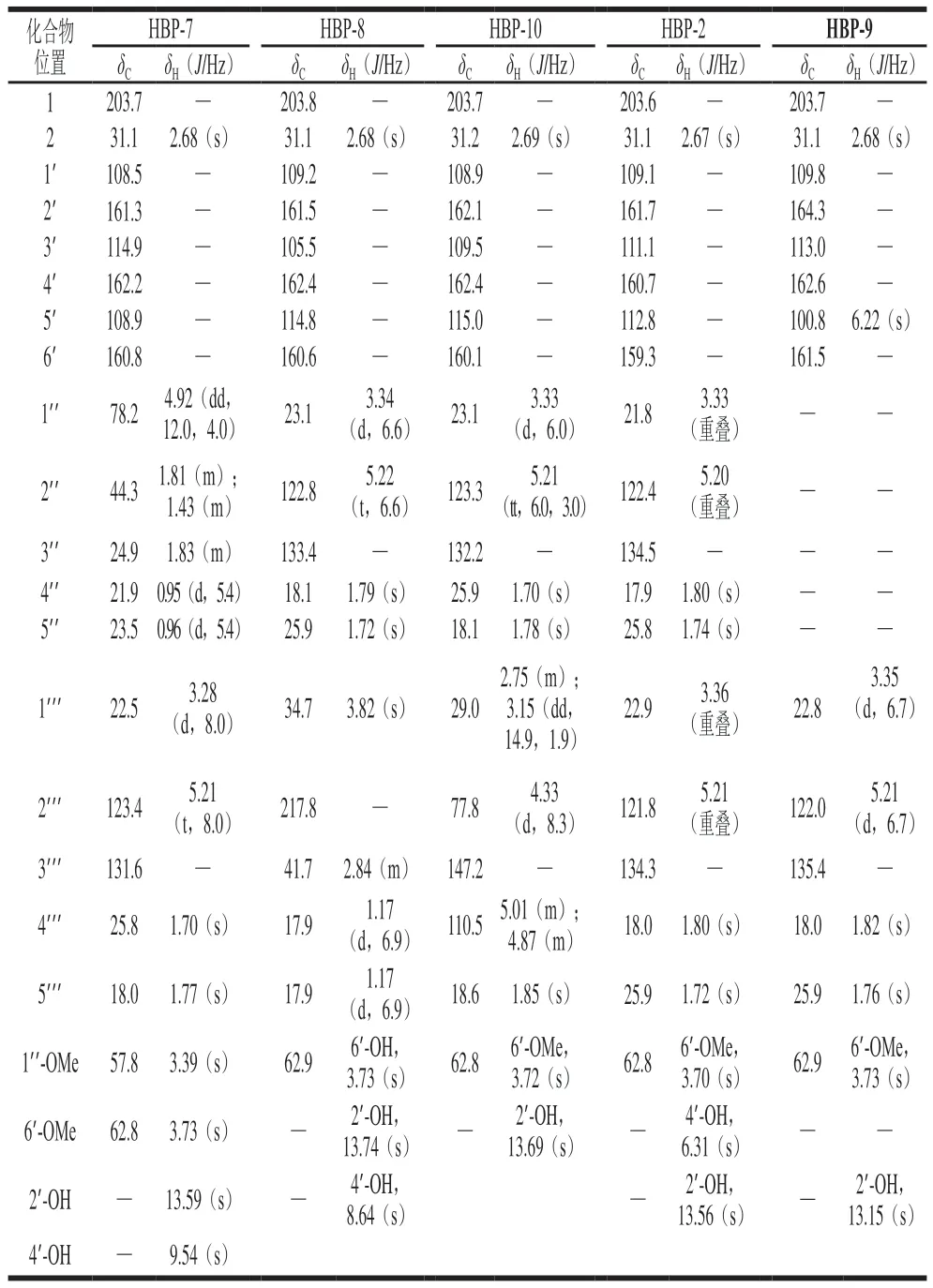
表2 HBP-2、7、8、9、10的1H NMR、13C NMR数据Table 2 1H NMR and 13C NMR data of HBP-2, 7, 8, 9 and 10
HBP-3:黄色油状物,HR-ESI-MS显示准分子离子峰m/z319.190 4 [M+H]+(C19H27O4,理论计算值:319.190 4),确定分子式为C19H26O4,不饱和度为7。其1H NMR、13C NMR数据见表1。
HBP-4:淡黄色油状物,HR-ESI-MS显示准分子离子峰m/z357.167 6 [M+Na]+(C19H26O5Na,理论计算值:357.167 2),确定分子式为C19H26O5,不饱和度为7。其1H NMR、13C NMR数据见表1。
HBP-5:淡黄色油状物,HR-ESI-MS显示准分子离子峰m/z357.167 8 [M+Na]+(C19H26O5Na,理论计算值:357.167 2),确定分子式为C19H26O5,不饱和度为7。其1H NMR、13C NMR数据见表1。
HBP-6:黄色油状物,HR-ESI-MS显示准分子离子峰m/z335.185 5 [M+H]+(C19H27O5,理论计算值:335.185 3),确定分子式为C19H26O5,不饱和度为7。其1H NMR、13C NMR数据见表1。
HBP-7:黄色油状物,HR-ESI-MS显示准分子离子峰m/z373.198 5 [M+Na]+(C20H30O5Na,理论计算值:373.198 5),确定分子式为C20H30O5,不饱和度为7。其1H NMR、13C NMR数据见表2。
HBP-8:黄色油状物,HR-ESI-MS显示准分子离子峰m/z335.186 2 [M+H]+(C19H27O5,理论计算值:335.185 3),确定分子式为C19H26O5,不饱和度为7。其1H NMR、13C NMR数据见表2。
HBP-9:白色粉末,HR-ESI-MS显示准分子离子峰m/z251.128 1 [M+H]+(C14H19O4,理论计算值:251.127 8),确定其分子式为C14H18O4,分子量为250,不饱和度为6。其1H NMR、13C NMR数据见表2。
HBP-10:黄色油状物,HR-ESI-MS显示准分子离子峰m/z357.167 3 [M+Na]+(C19H26O5Na,理论计算值:357.167 2),确定分子式为C19H26O5,不饱和度为7。其1H NMR、13C NMR数据见表2。
2.2 HBP-1~10的细胞保护活性
采用基于BaP暴露的16HBE细胞模型及CCK8法检测BaP对16HBE细胞的损伤情况,结果如图2A、B所示。BaP暴露使16HBE细胞活力降低,其中,10 μmol/L的BaP暴露24 h后16HBE细胞活力降低11.6%(P<0.01),说明BaP暴露使16HBE细胞受到严重损伤。实验结果显示,BaP对16HBE细胞活力的影响还具有一定的浓度及时间依赖性。
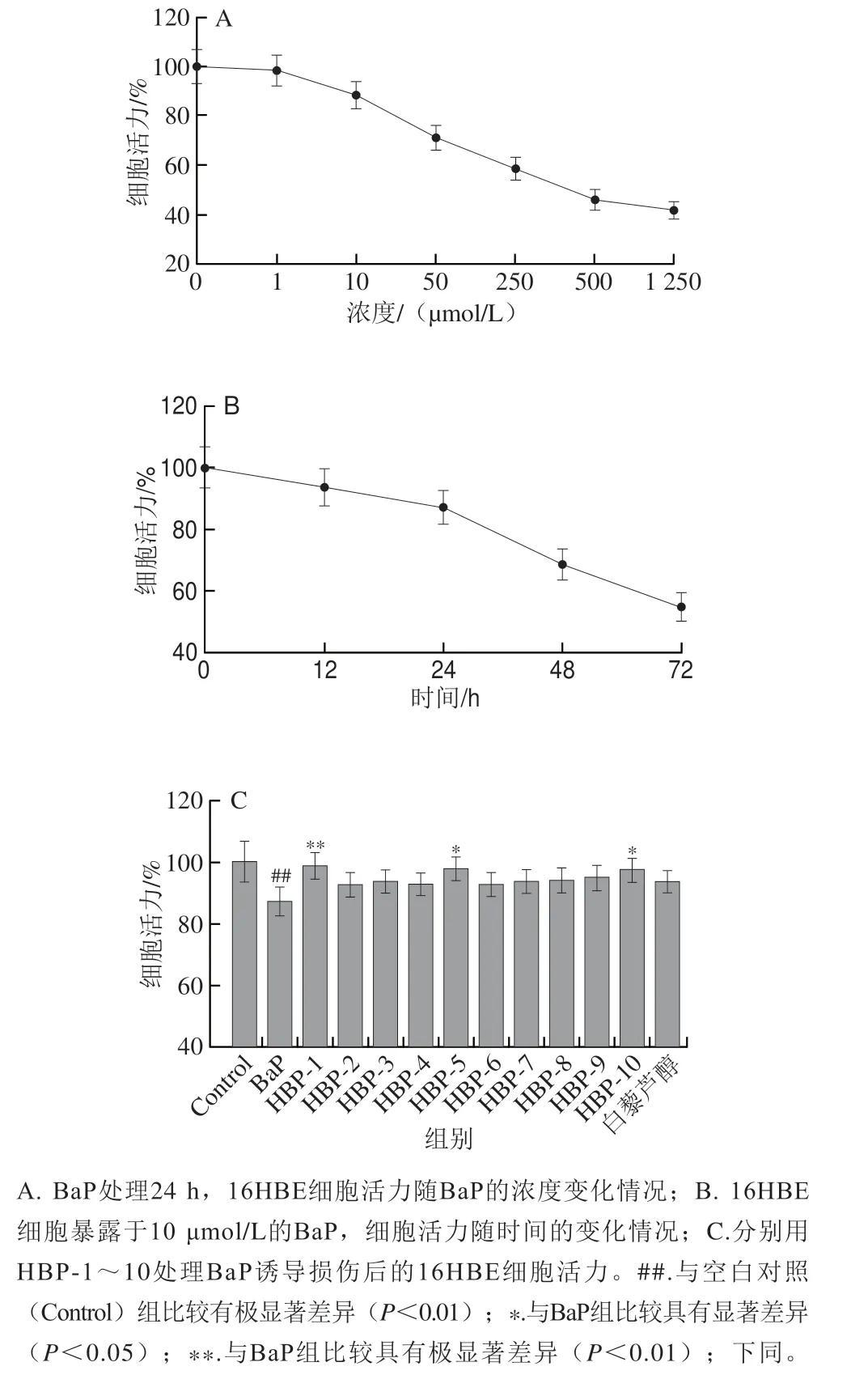
图2 HBP-1~10的细胞保护活性Fig.2 Cytoprotective activity of HBP-1 through 10
此外,本实验进一步检测了HBP-1~10抗BaP损伤16HBE细胞的保护活性(图2C)。与Control组相比,BaP组16HBE细胞活力降低12.2%(P<0.01),说明BaP暴露损伤16HBE细胞进而使细胞活力下降。而HBP-1~10对16HBE细胞具有保护作用;相比于BaP组,白藜芦醇组的细胞活力略高,但不具备显著性差异,而HBP-1、HBP-5及HBP-10组细胞活力分别提高11.5 个百分点(P<0.01)、10.3 个百分点(P<0.05)及10.1 个百分点(P<0.05),且其细胞保护活性均超过白藜芦醇。其中,HBP-1的细胞保护活性最佳,因此,接下来的实验以HBP-1为代表深入研究山楂活性酚类化合物发挥细胞保护活性的潜在机制。
采用MTT法检测化合物HBP-1~10对于16HBE细胞的毒性,结果显示化合物HBP-1~10在浓度低于1.2 mmol/L(48 h)时未损伤16HBE细胞。
2.3 HBP-1对BaP诱导16HBE细胞炎症因子及ROS水平的影响
如图3A~E所示,BaP暴露能够极显著诱导16HBE细胞炎症因子(TNF-α、IL-1β、IL-18、IL-10、IL-6)分泌。相比于Control组,BaP组TNF-α、IL-1β、IL-18、IL-10、IL-6分泌分别增加809%(P<0.01)、444%(P<0.01)、1 145%(P<0.01)、783%(P<0.01)及849%(P<0.01)。结合CCK8细胞活力的检测结果(图2C),推测BaP暴露诱发16HBE细胞炎症因子过量分泌,使细胞受到严重炎性损伤。而相比于BaP组,HBP-1处理后16HBE细胞炎症因子分泌减少;相比于BaP组,50 μmol/L HBP-1处理后,TNF-α、IL-1β、IL-18质量浓度分别减少59.9%(P<0.01)、65.9%(P<0.01)及67.4%(P<0.01)。说明HBP-1能够有效抑制BaP诱导的16HBE细胞炎症因子过量分泌,缓解BaP诱导的16HBE细胞炎性损伤。

图3 HBP-1对16HBE细胞炎症因子及ROS水平的影响Fig.3 Effect of HBP-1 on inflammatory factors and ROS levels in 16HBE cells
本研究进一步分析了BaP暴露对16HBE细胞内ROS水平的影响,结果如图3F所示,BaP暴露使16HBE细胞内ROS水平极显著升高。相比于Control组,BaP组细胞内ROS水平升高212%(P<0.01),推测BaP暴露诱导16HBE细胞产生氧化应激,进而导致细胞受到严重氧化损伤。而相比于BaP组,HBP-1处理后16HBE细胞内ROS水平显著降低;相比于BaP组,经过50 μmol/L HBP-1处理后,16HBE细胞内ROS水平降低51.7%(P<0.01)。说明,HBP-1能够有效抑制BaP诱导的16HBE细胞内ROS水平升高及细胞氧化损伤。
2.4 HBP-1对BaP诱导16HBE细胞凋亡的影响
本实验通过流式细胞术检测BaP暴露对16HBE细胞凋亡的影响。相比于Control组,BaP暴露使16HBE细胞凋亡率增加20.7 个百分点(P<0.01);而经HBP-1处理后,16HBE细胞凋亡率显著减少,相比于BaP组,10、50 μmol/L HBP-1处理后16HBE细胞凋亡率分别减少12.8 个百分点(P<0.05)及16.4 个百分点(P<0.01)(图4)。
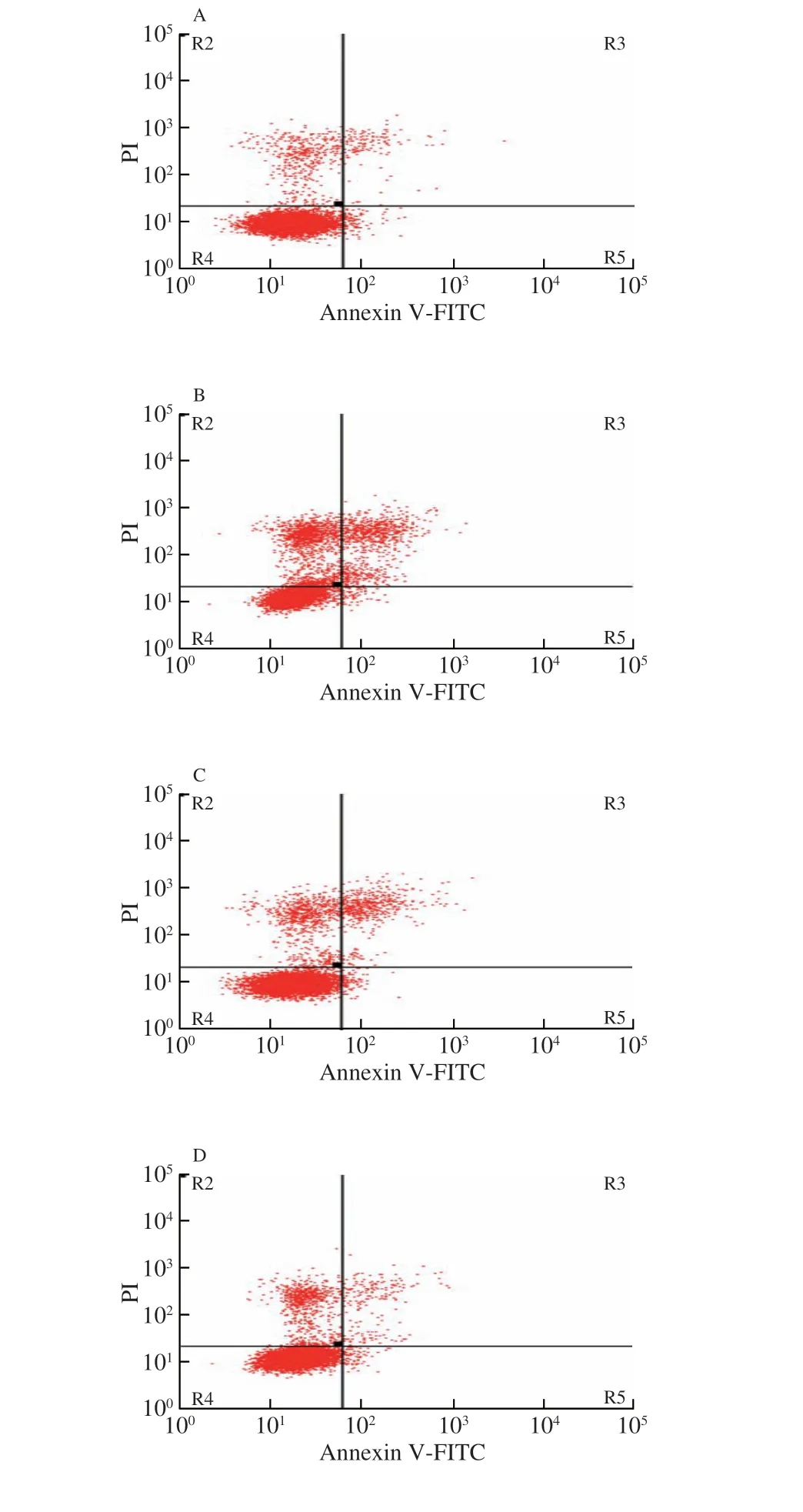
图4 HBP-1对BaP诱导16HBE细胞凋亡的影响Fig.4 Effect of HBP-1 on BaP-induced apoptosis in 16HBE cells
2.5 HBP-1对BaP诱导16HBE细胞NF-κB信号通路的影响
NF-κB信号通路在细胞炎症反应调节中具有重要的作用[19],因此,靶向NF-κB信号通路相关蛋白的表达是开发抗炎药物的重要方法[20-21]。为了研究NF-κB信号通路在HBP-1对BaP诱导炎症反应中的作用,本研究检测了BaP诱导的16HBE细胞中NF-κB信号通路相关蛋白的表达情况。如图5所示,HBP-1能够显著抑制BaP诱导的16HBE细胞p65、IKKα/β和IκBα蛋白的磷酸化,进而抑制BaP诱导的NF-κB信号通路激活。
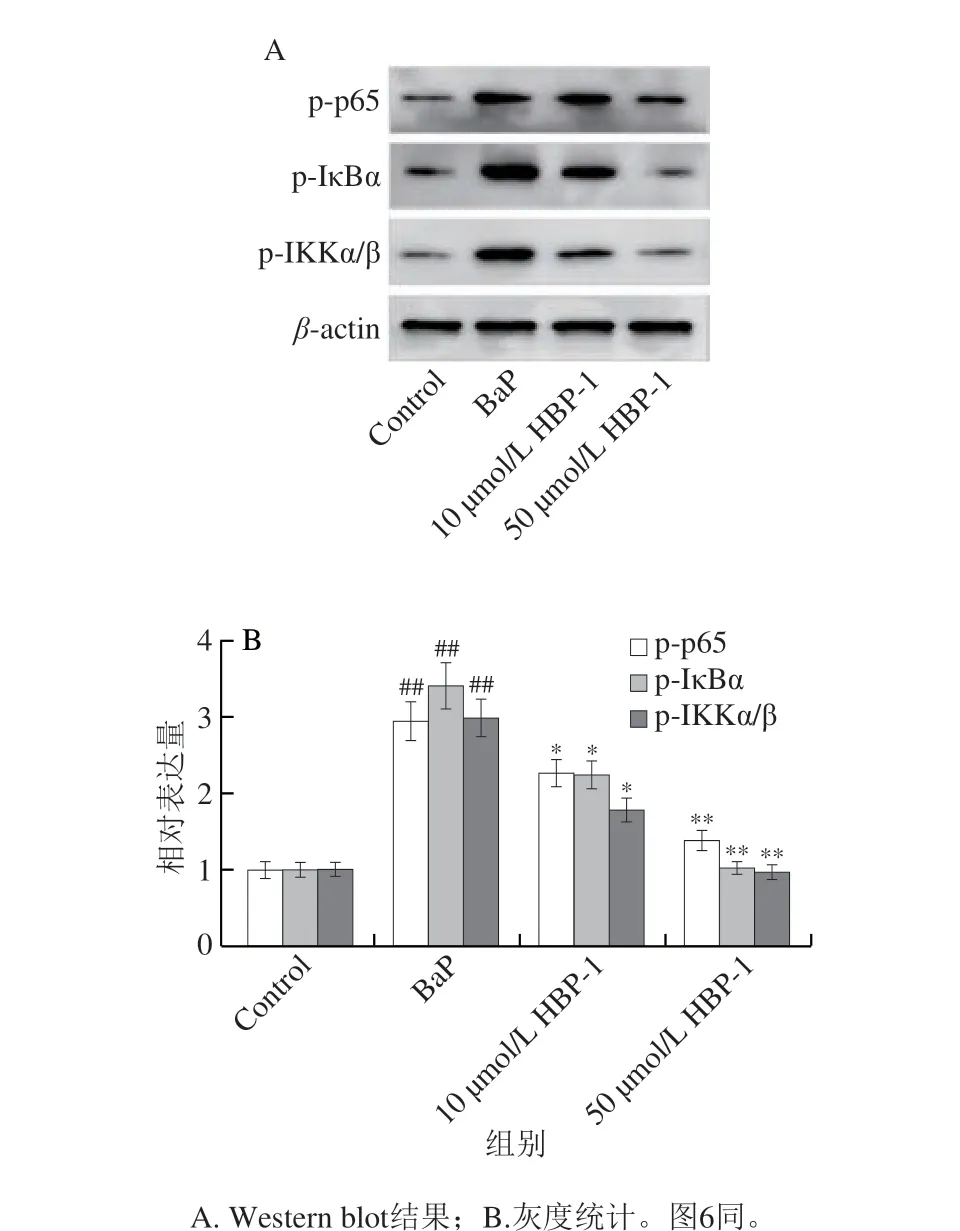
图5 HBP-1对BaP诱导16HBE细胞NF-κB信号通路相关蛋白表达的影响Fig.5 Effect of HBP-1 on NF-κB signaling pathway-related protein expression in BaP-induced 16HBE cells
2.6 HBP-1对BaP诱导16HBE细胞AhR信号通路的影响
BaP是细胞AhR的配体,细胞BaP暴露后能活化AhR,进而促进CYP1A1基因表达,代谢BaP产生有毒中间产物,动物实验证实BaP可以导致炎症和氧化应激,且经由AhR信息路径传递[22-23]。因此,本研究检测了HBP-1对AhR信号通路中AhR和CYP1A1蛋白表达的影响。如图6所示,BaP暴露诱导16HBE细胞中AhR和CYP1A1蛋白表达极显著升高。而经HBP-1处理后,BaP暴露诱导的16HBE细胞AhR和CYP1A1蛋白表达升高被抑制。Western blot结果表明AhR和CYP1A1信号分子对HBP-1抑制BaP诱导的16HBE细胞损伤发挥重要作用。
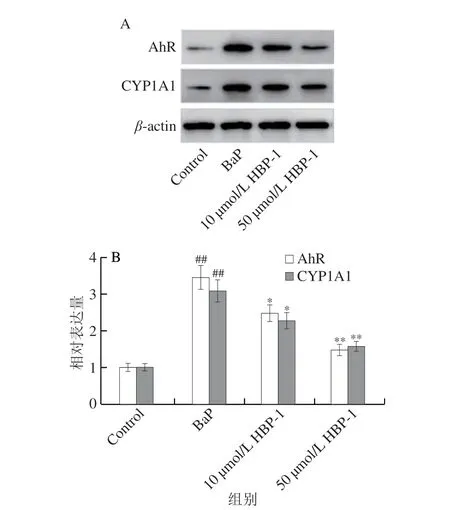
图6 HBP-1对BaP诱导16HBE细胞AhR信号通路相关蛋白表达的影响Fig.6 Effect of HBP-1 on AhR signaling pathway-related protein expression in BaP-induced 16HBE cells
3 讨 论
随着化石燃料的不断使用,BaP在大气中的含量逐年升高,给人们的身体健康带来了极大的危害。BaP的长时间暴露会诱发呼吸道炎症并进一步诱发呼吸系统疾病,如哮喘、肺部位炎症等[24-25]。研究表明,山楂多酚对哮喘引起的呼吸道上皮细胞损伤有一定的抗炎、抗氧化活性[12-13]。本研究通过活性追踪分离方法从山楂中分离出10 种具有细胞保护活性的酚类化合物(HBP-1~10)。本研究结果证实多环芳烃(BaP)暴露会诱导支气管上皮细胞氧化应激和炎症;同时,山楂酚类化合物能够抑制BaP诱导的支气管上皮细胞炎症和氧化应激。此外,本研究还检测了AhR和NF-κB信号通路在介导山楂酚类化合物细胞保护活性中的作用。
炎症是一种针对外源物入侵的先天免疫反应,在炎症过程中,巨噬细胞被激活,并产生炎症介质来抵御入侵的外源物(如病原体)[26-27]。本研究中,BaP暴露显著诱导16HBE细胞炎症因子(IL-1β、IL-6、IL-10、IL-18和TNF-α)过度释放,说明BaP暴露诱导了16HBE细胞炎症反应。而HBP-1对炎症因子(IL-1β、IL-18和TNF-α)的过度分泌有显著的抑制作用,表明HBP-1可通过调节炎症因子的分泌来发挥抗炎活性。
自由基的过度产生会扰乱细胞能量代谢平衡,诱发氧化应激,从而导致细胞内DNA、蛋白质损伤[28-29],进而诱导细胞凋亡,而ROS是导致细胞氧化损伤和炎症的重要介质[30]。本研究中,BaP暴露显著诱导16HBE细胞ROS的过量生成,而其在HBP-1干预后被显著抑制。推测BaP暴露诱导细胞产生大量ROS,进而导致细胞DNA和蛋白质等遗传、功能性分子氧化损伤,从而导致炎症因子的过度产生,HBP-1干预后BaP暴露诱导的氧化应激和炎症损伤得以逆转。
细胞凋亡对细胞的功能和生存至关重要[31],在本研究中,通过流式细胞术检测HBP-1对BaP诱导的16HBE细胞凋亡的抑制作用。本实验结果显示,HBP-1可抑制BaP诱导的16HBE细胞凋亡。呼吸道内皮细胞在维持呼吸道环境稳态中具有重要的作用,而炎症的暴发往往会导致呼吸道内皮细胞功能障碍[32]。高浓度炎症因子(如IL-1β、IL-18等)会诱发细胞凋亡,导致炎症性疾病[33]。结合HBP-1可抑制BaP诱导的16HBE细胞炎症因子过度分泌,说明HBP-1可通过抑制BaP暴露诱导的炎症及16HBE细胞凋亡发挥细胞保护活性。
体外实验表明,多环芳烃污染物可通过激活NF-κB信号通路诱导呼吸道上皮细胞炎症因子表达增加,进而诱导生成ROS中间体,并进一步激活NF-κB信号通路。同时,有研究报道,NF-κB信号通路的激活与炎症的发展及炎症因子(IL-10、IL-18等)分泌有密切关系[12]。本研究中,BaP暴露使NF-κB信号通路蛋白磷酸化极显著增加,说明BaP暴露激活了NF-κB信号通路。而经HBP-1处理后,BaP暴露诱导的16HBE细胞NF-κB信号通路蛋白磷酸化被显著抑制。推测HBP-1可抑制BaP暴露诱导的NF-κB信号通路激活,进而抑制炎症因子过量分泌,发挥细胞保护活性。
AhR是一种核转录因子,可被外源性及内源性配体激活。其中,AhR外源性配体中最为常见的是一些环境毒物,如2,3,7,8-四氯二苯并二噁英、BaP等[34]。AhR通过与配体结合被激活而发生核易位,并通过经典信号传导途径诱导表达可代谢多种化学异物或药物的代谢酶,如CYP1A1、CYP1A2和CYP1B1等[13]。目前多以CYP1A1基因表达上调与否来判断AhR是否被配体激活。BaP激活AhR后引起CYP1A1基因表达上调高达几百倍,进而引起后续的代谢激活。本研究中,BaP暴露激活16HBE细胞中AhR信号通路,而HBP-1处理抑制了BaP暴露诱导的16HBE细胞AhR信号通路激活,说明AhR信号通路在HBP-1抑制BaP诱导的16HBE细胞损伤时同样具有重要作用。
4 结 论
抑制呼吸道上皮细胞炎症对哮喘的治疗具有重要的意义,本研究发现山楂酚类化合物可抑制BaP诱导的16HBE细胞氧化应激、AhR及NF-κB信号通路激活、细胞凋亡及炎症因子(TNF-α、IL-1β、IL-18)等炎症因子过表达,从而抑制呼吸道上皮细胞炎症。本研究为山楂活性酚类化合物应用于缓解、治疗BaP暴露导致的呼吸道上皮细胞损伤等相关疾病提供了一定的实验依据。
