薏苡仁生物肽对高糖损伤人脐静脉内皮细胞保护作用
2023-10-17尹艳燕褚辉程梁劲杰韩晓佳陈祖君王灵芝
尹艳燕,赵 艺,褚辉程,梁劲杰,韩晓佳,陈祖君*,王灵芝,*
(1.北京中医药大学生命科学学院,北京 102400;2.中国航天科工集团七三一医院,北京 100074;3.中国医学科学院阜外医院,北京 100030)
糖尿病是一种以高血糖为特征的代谢性疾病,严重危害人类健康。2021年糖尿病导致670万人死亡,截至2021年,全球成年人糖尿病患病率高达10.5%,造成至少9 660亿 美元的卫生支出。中国糖尿病患者数量位居全球第一,该病的预防和治疗形势严峻[1]。血管内皮细胞是位于血管最内层的扁平鳞状细胞,不仅是血液与组织之间的屏障,同时在控制血管张力、保持血液正常流动和凝血、免疫等方面发挥着重要作用[2]。糖尿病患者常伴有心脏、脑、肾、视网膜等血管并发症,引发血管内皮功能障碍[3]。
糖尿病引发的内皮细胞功能障碍表现为细胞增殖失调、屏障功能改变、内皮-间充质转变、细胞黏附、炎症、氧化应激和对凋亡的敏感性改变等。高糖促使内皮细胞中线粒体产生过量活性氧(reactive oxygen species,ROS),从而激活下游多元醇/山梨醇/醛糖还原酶途径、二酰甘油/磷脂肌醇途径等进而引发各种血管并发症[4]。高糖环境下,血管内皮生长因子(vascular endothelial growth factor,VEGF)表达下调与肿瘤坏死因子(tumor necrosis factor,TNF)表达上调导致内皮细胞凋亡加剧[5]。长期高血糖可导致机体器官内皮细胞黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)表达量升高,同时增加内皮细胞对缺血和缺氧的易感性,进而促进ICAM-1的表达[6],形成恶性循环。此外,高血糖影响内质网代谢,使未折叠蛋白在内质网腔内积累,引发内质网应激,影响线粒体的功能并最终导致内皮损伤[7]。
薏苡仁(Coix lacryma-jobiL.var.ma-yuen(Roman.)Stapf)为临床常用利水渗湿类药物,具有抗肿瘤、降血压、免疫调节、降血糖、抗炎、抗菌、降血脂等活性[8],可药食两用[9]。Zhou Qilyu等[10]发现长期饲喂薏苡仁可减少结肠炎小鼠炎症因子的分泌,减轻氧化应激水平。Wang Qingyu等[11]研究发现薏苡仁多酚提取物可降低大鼠胆固醇水平,改善肠道菌群结构。以薏苡仁油为主要成分的康莱特注射液是临床抗癌药物,常用来治疗中晚期非小细胞肺癌[12]及原发性肝癌[13],或联合化疗治疗胃癌,对放疗、化疗有增效减毒的作用[14]。薏苡仁多糖能显著抑制免疫功能低下小鼠脾脏指数和胸腺指数降低,增强巨噬细胞吞噬指数及淋巴细胞增殖反应,提高血清半数溶血值,具有较好的免疫功能恢复作用[15]。薏苡仁糖蛋白能有效抑制Fe2+诱导的脂质过氧化,具有1,1-二苯基-2-三硝基苯肼(1,1-d i p h e n y l-2-picrylhydrazyl,DPPH)自由基、羟自由基和超氧阴离子自由基清除能力[16]。
本课题组前期研究表明,薏苡仁生物肽具有显著降压效果[17],同时对血管紧张素II(angiotensin II,AngII)损伤血管内皮细胞具有保护作用[18]。薏苡仁生物肽对高糖损伤血管内皮细胞是否具有保护作用鲜见报道,因此本实验针对高糖逆境下薏苡仁生物肽对血管内皮细胞保护作用及作用机制进行研究,以期为利用薏苡仁生物肽开发具有高糖损伤HUVEC保护作用类药物提供理论参考。
1 材料与方法
1.1 材料与试剂
薏苡仁生物肽[19]由本课题组制备与保存。
D-葡萄糖、I型胶原酶、二甲基亚砜(dimethyl sulfoxide,DMSO)、β-内皮细胞生长因子(betaendothelial cell growth factor,β-ECGF) 美国Sigma Aldrich公司;胎牛血清(fetal bovine serum,FBS) 美国Hyclone公司;双抗、M199培养基 美国Gibco公司;VIII因子抗体 美国Santacruz公司;3,3’-二氨基联苯胺(3,3’-diaminobenzidine,DAB)试剂盒、四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)、ROS检测试剂盒、Annexin V-荧光素异硫氰酸酯(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)细胞凋亡检测试剂盒 北京兰博利德商贸有限公司;钙黄绿素AM(calcium green-1 acetoxymethyl ester,CG-1 AM) 上海碧云天生物技术有限公司;NO测定试剂盒 南京建成生物工程研究所;NovoStart®SYBR qPCR SuperMix Plus试剂盒 上海近岸科技有限公司。
1.2 仪器与设备
FLC-3超净工作台 北京东联哈仪器制造有限公司;MCO-18AIC CO2培养箱 日本SANYO公司;TDL-50B低速台式离心机 上海安亭科学仪器厂;TE2000-S倒置显微镜 日本Nikon公司;CytoFLEX流式细胞仪 美国Beckman Coulter公司;Epoch酶标仪 美国Bio-Tek公司;QuantStudio6 Flex实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qPCR)仪美国Life Technologies公司。
1.3 方法
1.3.1 人脐静脉内皮细胞分离与培养
参考Medina-Leyte等[20]的方法分离人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)。新生儿脐带由中国航天科工集团七三一医院提供,无菌条件下取健康新生儿脐带20~30 cm,将1 g/L I型胶原酶注入脐静脉使血管充盈,转移至细胞培养箱37 ℃消化15 min,然后将消化液转移至相同体积的M199完全培养基(含10%(体积分数)FBS、1%(体积分数)双抗和1 μg/Lβ-ECGF,下同)的无菌离心管内。利用磷酸盐缓冲液(phosphate buffered saline,PBS)(0.01 mol/L、pH 7.4)冲洗残余的脐静脉,一并收集冲洗液和消化液,室温下1 000 r/min离心5 min,弃上清液,M199完全培养基重悬细胞,接种到包被鼠尾胶原细胞培养皿中,置于5% CO2、37 ℃、饱和湿度培养箱中静置培养,24 h后换液同时除去未贴壁细胞,观察并拍照培养24 h及48 h的细胞形态。
1.3.2 HUVEC免疫组化鉴定
利用免疫组化方法进行HUVEC细胞Ⅷ因子表面抗原的鉴定[20]。将第2代HUVEC以5×104个/孔密度接种于24 孔板,贴壁后用质量分数4%多聚甲醛溶液固定,体积分数3% H2O2溶液室温孵育以消除内源性过氧化物酶活性,0.3% Triton X-100通透细胞膜,5%牛血清白蛋白(bovine serum albumin,BSA)溶液37 ℃封闭30 min;正常组加入VIII因子一抗工作液(1∶100),阴性对照组加入5% BSA于湿盒内4 ℃孵育过夜;次日,吸弃一抗工作液或5% BSA,PBS冲洗,滴加辣根过氧化物酶标记的二抗工作液(1∶100),室温下孵育2 h,PBS冲洗;加入DAB显色液,显微镜下观察并采集图像。
1.3.3 细胞处理及分组
取第3~6代细胞进行实验。实验分为5 组:1)正常对照组(NG组):5 mmol/L葡萄糖;2)高糖损伤模型组(HG组):30 mmol/L葡萄糖;3)薏苡仁生物肽(coix peptide,CP)高、中、低剂量给药组:30 mmol/L葡萄糖+1×10-5mol/L CP(CP-H组)、30 mmol/L葡萄糖+1×10-6mol/L CP(CP-M组)、30 mmol/L葡萄糖+1×10-7mol/L CP(CP-L组)。
1.3.4 HUVECNO分泌量的测定
取对数生长期HUVEC细胞,经0.5 g/L胰酶消化后,调整细胞密度为1×104个/mL,接种于6 孔板,每孔1 mL,待细胞贴壁后分组及加药干预。分别培养7 、14 d后吸取细胞培养液,4 ℃、1 000×g离心15 min,采用硝酸还原酶法,利用NO测定试剂盒检测NO分泌量。
1.3.5 HUVEC ROS含量的测定
采用流式细胞术测定HUVEC中ROS含量[21]。取对数生长期HUVEC,以1×104个/mL密度接种于6 孔板,每孔1 mL,待细胞贴壁后分组及加药干预,培养7 d后弃旧培养基,PBS清洗细胞2 次,每孔加入1 mL H2DCFHDA(2 μmol/L)探针,37 ℃孵育30 min,PBS洗去未结合的探针。0.5 g/L胰酶消化HUVEC为单细胞状态,转移细胞于流式管中,利用流式细胞仪检测488 nm激发波长下的样品荧光强度,以此表征ROS含量。
1.3.6 HUVEC细胞凋亡的检测
采用Annexin V-FITC/PI双染法(细胞凋亡检测试剂盒)测定薏苡仁生物肽对高糖损伤HUVEC细胞凋亡的影响[3]。调整细胞密度为1×104个/mL,接种于6 孔板,每孔1 mL,分组加药处理7 d和14 d后,收集旧培养基,用预冷PBS洗涤细胞,加入600 μL不含乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)的0.5 g/L胰酶消化细胞,待多数细胞变圆时加入旧培养基终止消化,室温下1 000 r/min离心5 min,弃上清液,用预冷的PBS洗涤2 次,加入1 mL Binding buffer重悬细胞。取500 μL细胞液转移至流式管,加入5 μL Annexin V-FITC混匀,室温避光孵育10 min。加入10 μL PI溶液混匀,室温避光孵育5 min,上机(流式细胞仪)检测。
1.3.7 qPCR检测炎症基因相对表达量
药物处理细胞7 d后使用Trizol试剂分离总RNA,紫外光谱法进行核酸定量。使用promega GoScript RT System试剂盒将总RNA逆转录为cDNA。qPCR反应体系为10 µL:2×NovoScript®Plus 1st Strand cDNA Synthesis SuperMix 5 µL、上下游引物各0.2 μmol/L、cDNA 5 ng,加ddH2O补足10 µL。扩增条件为:95 ℃预变性1 min,95 ℃变性20 s,60 ℃延伸1 min,共43 个循环。各基因引物序列见表1。采用2-ΔΔCT法进行基因相对表达量的计算[3]。

表1 引物序列Table 1 Primer sequences used in this study
1.4 数据统计分析
采用SPSS 26.0统计软件对数据进行单因素方差分析,结果以平均值±标准差表示,P<0.05表示差异具有显著性。采用GraphPad Prism 8.0.2软件作图。
2 结果与分析
2.1 HUVEC形态学观察及鉴定
H U V E C 贴壁生长,细胞密度低时呈长梭形(图1A),随着细胞密度的增加,细胞呈铺路石状镶嵌排列,边界清晰,胞浆丰富(图1B)。采用免疫组织化学法进行细胞表面VIII因子相关抗原鉴定,显微镜下可见胞质内棕黄色颗粒,呈阳性反应(图1D)。

图1 HUVEC细胞形态学观察及鉴定(×100)Fig.1 Morphological observation and identification of HUVECs (× 100)
2.2 薏苡仁生物肽对高糖损伤HUVEC NO分泌的影响
由表2 可知,与N G 组相比,高糖处理7 d 后,HUVEC NO分泌量显著降低28.72%;与HG处理组相比,薏苡仁生物肽显著增加了细胞NO的分泌量,CP-H、CP-M、CP-L给药组NO分泌量分别为(8.60±0.22)、(10.25±0.22)μmol/L和(11.51±0.22)μmol/L;高糖作用细胞14 d后,HG组NO分泌量下降,薏苡仁生物肽给药组NO分泌量相比HG组显著增加(P<0.05)。

表2 薏苡仁生物肽对高糖损伤HUVEC NO分泌量的影响Table 2 Effect of coix seed biopeptide on NO secretion in high glucoseinjured HUVECs
2.3 薏苡仁生物肽对高糖损伤HUVEC ROS产生量的影响
HG培养7 d,HUVEC细胞ROS分泌量显著升高,相比NG组升高96.19%。薏苡仁生物肽处理显著降低了细胞ROS的分泌量(P<0.05),CP-H、CP-M、CP-L组的ROS分泌量分别为HG组的72.89%、68.05%、74.36%(图2)。
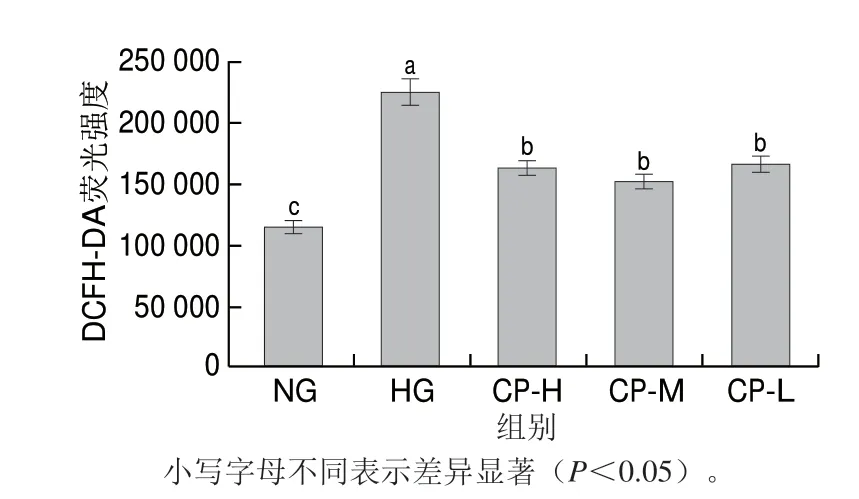
图2 薏苡仁生物肽对高糖损伤HUVEC ROS产生量的影响Fig.2 Effect of coix seed biopeptide on ROS production in high glucose-injured HUVECs
2.4 薏苡仁生物肽对高糖损伤HUVEC凋亡的影响
高糖作用HUVEC 7 d后,细胞凋亡率与NG组无显著差异(图3A~C),随着高糖作用时间的延长,作用14 d后HG组凋亡细胞数量显著增多,为NG组的1.61 倍(图3D~F)(P<0.05),表明长时间高糖损伤可诱导血管内皮细胞凋亡,因此在后续凋亡给药研究中,将药物作用时间调整至14 d,进行长期高糖损伤血管内皮细胞相关研究。

图3 长期高糖损伤对HUVEC细胞凋亡的影响Fig.3 Effect of long-term high glucose injury on cell apoptosis in HUVECs
高糖作用HUVEC 14 d后显著降低了正常细胞的比例,细胞凋亡率显著增加(P<0.05);与HG组相比,CP-H、CP-M、CP-L显著降低了细胞的凋亡率(图4)。
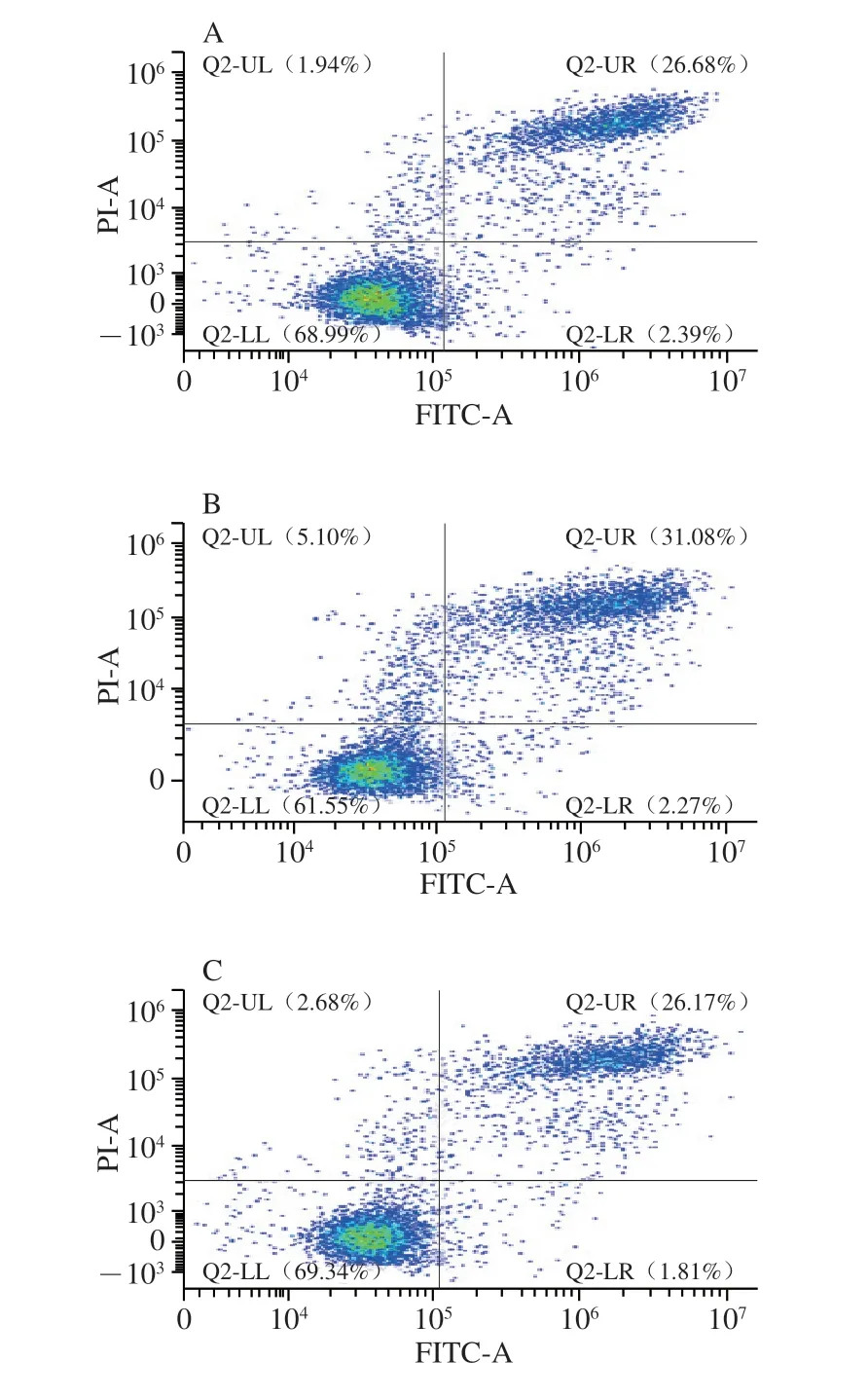
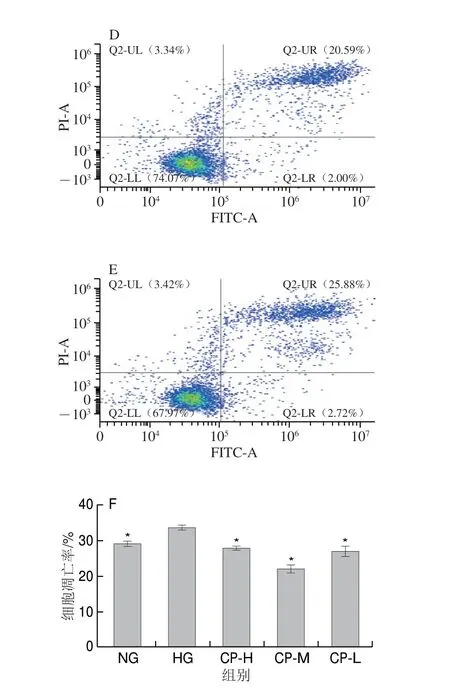
图4 薏苡仁生物肽对长期高糖损伤HUVEC凋亡的影响Fig.4 Effect of coix seed biopeptide on cell apoptosis in HUVECs with long-term high glucose injury
2.5 薏苡仁生物肽对长期高糖损伤HUVEC炎症基因表达的影响
与NG组相比,高糖处理HUVEC 7 d后,ICAM-1、IL-6、MCP-1和VCAM基因表达量显著增加,分别为NG组的2.17、4.41、6.08 倍和2.08 倍(P<0.05)。与HG组相比,CP-H、CP-M、CP-L组HUVECIL-6和MCP-1基因表达量显著降低,CP-L组VCAM基因表达量显著降低,为HG组的23.76%(P<0.05),ICAM-1基因表达量也明显下降(图5)。
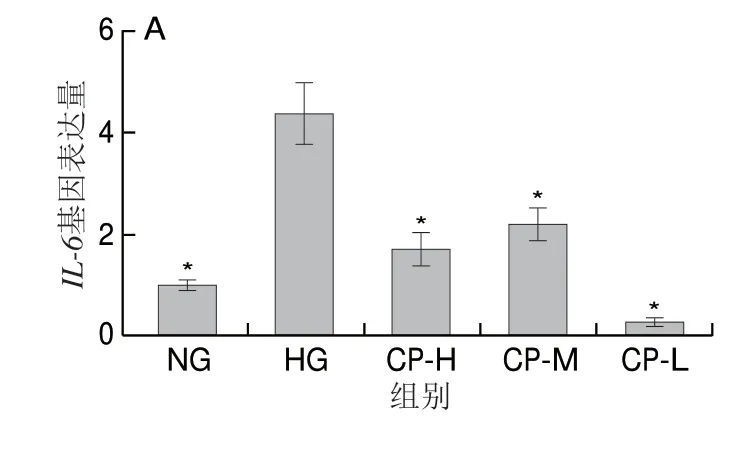
图5 薏苡仁生物肽对长期高糖损伤HUVEC炎症基因表达量的影响Fig.5 Effect of coix seed biopeptide on expression of inflammationrelated genes in HUVECs with long-term high glucose injury
3 讨 论
高糖引起内皮功能障碍的作用机制是高糖可诱导线粒体产生过量ROS,进而通过多元醇、二酰甘油(diacylglycerol,DAG)/蛋白激酶C(protein kinase C,PKC)、己糖胺通路或者非酶糖基化产物形成引起内皮细胞发生氧化应激,引发内皮功能障碍[4]。同时,氧化应激通过Caspase 3、细胞外信号调节蛋白激酶(extracellular signal-regulated protein kinases,ERK)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)/应激活化蛋白激酶(stress-activated protein kinase,SAPK)、Akt激活、线粒体凋亡等通路诱发内皮细胞凋亡[22]。高糖可促进NADPH氧化为NADP+,加快NAD+还原为NADH,NADP+、NADH可降低NO的生物利用度,增强氧化应激[23]。NO是重要的舒血管因子,可激活鸟苷酸环化酶,介导环磷酸鸟苷(cyclic guanosine monophosphate,cGMP)调控的血管舒张,同时激活核因子-κB(nuclear factor kappa,NF-κB)信号通路,使VCAM、MCP-1表达量降低,减少白细胞黏附从而达到抗炎效果[4,24]。高糖可干扰线粒体电子传递链,使辅酶Q氧化作用增强,从而促进过氧化亚硝酸盐的产生,最终导致细胞凋亡和坏死的发生[25]。研究表明,糖尿病患者Ang II表达量表达上调[26];Ang II作用于内皮细胞表面血管紧张素II 1型受体(angiotensin II type 1 receptor,AT1R)进而产生NF-κB和ROS,随后激活黏附分子(如选择素、VCAM-1和ICAM-1)、趋化因子(如MCP-1、IL-8)、细胞因子(如TNF-α和IL-6)、血管内皮和血小板衍生的生长因子等导致内皮功能障碍[27]。AngII主要通过黄嘌呤氧化酶、脂氧合酶、NAD(P)H氧化酶促进ROS的产生[28]。目前已从天然动植物中分离出具有内皮细胞保护功能的多肽类物质。袁小燕等[29]研究发现胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)可改善高糖诱导的HUVEC凋亡,且可能与磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)/Akt/内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)通路的表达上调相关;Guo Lixin等[30]研究发现GLP-1可降低高糖处理内皮细胞ICAM-1、VCAM-1和磷酸化JNK蛋白的表达,减少ROS生成和JNK-Bax信号通路激活;师岩等[31]发现肌肽能够抑制高糖诱导的HUVEC凋亡。糖尿病在中医上一般按消渴证阴虚燥热型论治,临床上以脾虚湿滞为常见[32]。薏苡仁粉具有降糖、降脂功效[33]。脾虚湿滞型糖尿病患者在常规治疗基础上服用薏苡仁,可缩短血糖控制所需时间,改善血糖指标,降低给药量,避免发生低血糖等不良事件[34];薏苡仁多糖可改善糖尿病患者空腹血糖、糖化血红蛋白、餐后血糖[35]。薏苡仁多糖可能通过调节葡萄糖激酶活性进而改善实验性2型糖尿病大鼠胰岛素抵抗,并明显降低动物血糖[36-37]。孟利娜[38]发现薏苡仁蛋白可通过降低小鼠PTEN和FOXO1基因的表达水平和提高PI3K、GLUT4基因的表达水平,促进机体对葡萄糖的吸收,降低血糖浓度。
本研究结果表明,薏苡仁生物肽可抑制高糖损伤内皮细胞ROS的产生,促进NO的分泌,降低细胞凋亡比例,同时可下调IL-6、VCAM、MCP-1基因的表达,提示薏苡仁生物肽可能通过影响NF-κB信号通路发挥保护作用。本研究表明有望利用薏苡仁生物肽开发具有高糖损伤HUVEC保护作用类药物,为降糖药物研发提供新的候选药物。
