改良1,9-二甲基亚甲基蓝法定量检测岩藻多糖
2023-10-14赵薇萍齐艺惠李晶晶宋爽翟睿杜茜茜
赵薇萍 , 齐艺惠 , 李晶晶,2 , 宋爽 , 翟睿 , 杜茜茜
1.大连工业大学食品学院,辽宁 大连 116034;2.北京市计量检测科学研究院,北京 100029;3.中国计量科学研究院国家市场监管技术创新中心(质谱)前沿计量科学中心,北京 100029
岩藻多糖(fucoidan)又名岩藻聚糖硫酸酯、褐藻糖胶,主要来源于海参体壁和褐藻细胞壁等,是一类主要由L-岩藻糖和硫酸基团组成,并含有其他多种单糖(如半乳糖、甘露糖、木糖、葡萄糖醛酸和阿拉伯糖)的水溶性杂多糖[1]。研究表明,岩藻多糖具有多种生物活性,如抗炎[2]、抗肿瘤[3]、增加肠道益生菌丰度[4]、抗氧化[5]、免疫调节[6]、抗凝血[7]和抗病毒[8]等,其开发和利用备受关注,已被应用于医药和食品行业,并显示出了广阔的应用前景。
1,9-二甲基亚甲基蓝(DMMB)比色法常用于检测酸性多糖含量,也是岩藻多糖定量检测的方法之一,具有方便快速、操作简单等优势[9]。DMMB是一种醌亚胺类阳离子染色剂,在酸性介质中,亚甲基蓝的杂环氮原子因质子化而带正电,以阳离子状态存在,因此能够与带负电荷的岩藻多糖形成可溶于水的异染变色配合物,导致溶液的颜色发生变化[10-11]。目前,常用的DMMB检测方法是将4 mL浓度为10.7 mg·mL-1、pH 3.3的DMMB显色液与0.18 mL岩藻多糖待测溶液混匀后测定[12]。但是,该方法在岩藻多糖的实际检测中,存在岩藻多糖样品和显色液用量较大、可检测浓度范围窄、灵敏度差、易受杂质干扰等问题,影响了该方法的推广应用,亟需进一步改良。
本研究对DMMB法的检测条件进行了优化,在保证检测灵敏度和精密度的前提下,简化了操作步骤,缩小了反应体系,节省了检测时间,拓宽了线性范围,以期为岩藻多糖产品的质量控制和研究开发提供快捷可靠的定量分析检测手段。
1 材料与方法
1.1 材料与设备
1.1.1 实验材料 岩藻多糖购自山东日照洁晶集团股份有限公司;DMMB购自Sigma公司;三羟甲基氨基甲烷(Tris)购自上海生工生物工程有限公司;岩藻糖标准品购自Fluka公司。
1.1.2 实验设备 多功能酶标仪购自Tican公司;紫外可见分光光度计购自上海舜宇恒平科学仪器公司;0111DF-101S集热式恒温加热磁力搅拌器购自巩义市予华仪器有限责任公司;AIR troller通风橱购自深圳朗飞气流控制系统公司;Lambda 35紫外可见光谱仪购自PerkinElmer公司;XW-80A漩涡混合器购自上海精科有限公司。
1.2 实验方法
1.2.1 紫外光谱测定 配制岩藻多糖-DMMB溶液,在室温避光和不避光条件下放置0、10、20、30 min。以0.2 mL的去离子水为对照溶液。使用Lambda 35紫外-可见光谱仪在波长范围为450~700 nm下进行扫描,测定样品的紫外光谱变化。
1.2.2 DMMB溶液浓度的优化 DMMB染色液浓度分别设置为10.7、21.4、32.1、42.8、53.5 mg·L-1。分别加入0、0.05、0.10、0.15、0.20、0.25、0.30 mg·L-1岩藻多糖溶液10 μL于96孔酶标板中,再分别加入上述浓度的DMMB溶液200 μL,振荡,于525 nm处测吸光度值。
1.2.3 DMMB溶液pH的优化 确定DMMB染色液浓度,将pH分别设置为2.3、2.8、3.3、3.8、4.3。分别加入1.2.2中不同浓度的岩藻多糖溶液10 μL于96孔酶标板中,再分别加入上述不同pH的DMMB溶液200 μL,振荡,于525 nm处测吸光度值。
1.2.4 其他物质的影响 在岩藻多糖溶液中分别加入不同质量的NaCl、乳清蛋白、鱼胶原蛋白、海藻酸钠,将其配成0、0.10、0.15、0.20、0.30 mg·mL-1杂质-岩藻多糖溶液,混匀,取混合后溶液10 μL于96孔酶标板中,加入DMMB溶液,于525 nm处测吸光度值。
1.2.5 线性范围的确定 分别加入0、0.0125、0.0250、0.0500、0.0625、0.0750、0.1000、0.1500、0.2000、0.2500、0.3000、0.3500、0.4000、0.5000 mg·mL-1岩藻多糖溶液10 μL于96孔酶标板中,加入42.8 mg·L-1、pH 3.3的DMMB溶液200 μL,振荡,于525 nm处测吸光度值。标准曲线的相关系数大于0.99,表示具有良好的线性关系。
1.2.6 加标回收率实验 取2种不同浓度的岩藻多糖样品(样品1、2中岩藻多糖浓度分别为0.033 mg·mL-1、0.018 mg·mL-1),加入2种不同水平的岩藻多糖标准品,按公式(1)测定其加标回收率(3个重复)。加标前后浓度均应在标准曲线线性范围内。
式中,P表示加入标准物质的回收率(%);X1表示加标样品测定值(g),X0表示原样品测出的含被测成分量(g),m表示加入标准物质的质量(g)。
1.2.7 精密度实验 精确称取6份岩藻多糖样品,测定平行样品间的岩藻多糖含量,计算相对标准偏差(relative standard deviation, RSD)。组内相对标准偏差不超过10%。
1.2.8 定量限和检出限实验 当信噪比达到S/N=10时,此时测出的样品的最小浓度值为定量限。当信噪比达到S/N=3时,此时测出的样品的最小浓度值为检出限。
1.2.9 数据分析 实验结果均以平均值±标准偏差表示,并采用SPSS 17.0统计学软件进行单因素方差分析和独立样本t检验。P<0.05认为组间存在统计学意义。
2 结果与分析
2.1 DMMB溶液浓度的优化
为了确定DMMB显色法中显色液的最佳浓度,本实验对不同浓度DMMB-岩藻多糖显色液的吸光度值和线性范围进行了检测。实验结果如图1所示,当岩藻多糖样品浓度在0~0.3 mg·mL-1范围内,DMMB显色液的浓度增大至42.8 mg·mL-1和53.5 mg·mL-1时,该方法显示出了良好的线性关系(R2≥0.99)。根据中国药典相关规定[13],使用紫外分光光度计测定样品吸光度时,要求测得的吸光度在0.2~0.8之间,以保证定量检测的灵敏度,缩小检测误差。因此,DMMB显色液的最佳浓度为42.8 mg·mL-1。

图1 DMMB显色液浓度对标准曲线的影响Fig. 1 The effect of DMMB concentration on standard curve
2.2 DMMB溶液pH的优化
本实验使用2.1优化出的最佳DMMB浓度(42.8 mg·mL-1)进一步确定DMMB显色法中显色液的最佳pH。通过改变DMMB显色液的pH,观察DMMB-岩藻多糖显色液的吸光度和线性范围,以确定最佳的显色条件[14]。实验结果如图2所示,当岩藻多糖样品浓度在0~0.3 mg·mL-1范围内,DMMB溶液pH为3.3、3.8和4.3时,DMMB-岩藻多糖显色液的吸光度值显示出了良好的线性关系(R2≥0.99)。由于DMMB溶液的pH为3.8和4.3,岩藻多糖样品浓度大于0.25 mg·mL-1时,DMMB-岩藻多糖显色液的吸光度值大于0.8,不能保证检测的灵敏度和准确性。因此,最终选定DMMB显色液的最佳pH为3.3。

图2 DMMB溶液pH对标准曲线的影响Fig. 2 The effect of DMMB pH on standard curve
2.3 最佳测量波长的确定
为了确定检测方法的最佳测量波长,研究光照对DMMB-岩藻多糖显色液吸光度值的影响,本实验使用不含岩藻多糖的DMMB溶液作为空白对照,在0~30 min时间范围内对避光和不避光的DMMB-岩藻多糖显色液的紫外光谱进行检测。实验结果如图3所示,DMMB-岩藻多糖显色液与空白对照组在波长为525 nm处的紫外吸收差值最大,因此选定525 nm为DMMB-岩藻多糖显色液的最佳测量波长,与刘红英等[15]的结果一致。由实验结果还可看出,在相同时间下,避光放置的显色液的吸光度在525 nm处的降低程度明显高于未避光的显色液,因此,应在避光条件下完成DMMB-岩藻多糖显色液的检测。
2.4 最佳检测时间的选择
由于DMMB溶液和聚阴离子间的相互作用是可逆的,在实际的检测过程中,随着放置时间的延长,DMMB-岩藻多糖显色液的吸光度值会逐渐降低[16-17]。为了确定最佳的检测时间,本实验在DMMB与岩藻多糖混合后的30 min内,对显色液的吸光度在525 nm处进行监测。如图4所示,随着放置时间延长,DMMB-岩藻多糖显色液的吸光度值呈明显的降低趋势。为了保证检测的灵敏度和准确性,应尽快完成检测。此外,为了将误差控制在1%以内,建议在岩藻多糖溶液与DMMB溶液混合后10~15 min完成吸光度检测。

图4 显色液的吸光度变化Fig. 4 Absorbance change of chromogenic solution
2.5 方法学结果考察
本实验采用改良后的DMMB法对不同浓度的标准品中岩藻多糖含量进行了线性范围检测,并选取2种样品进行回收率和精密度考察。结果表明,在0.0125~0.3000 mg·mL-1浓度范围内的标准工作曲线为y=1.3275x+0.443,R2=0.9913,其相关系数大于0.99,即显示出了良好的线性关系。由表1可知,改良后的检测方法加标回收率均符合2015年颁布的中国药典[13]相关规定,即回收率在90%~108%以内。2种样品的组内相对标准偏差均不超过10%。因此可证明改良后的检测方法具有良好的稳定性和重复性。改良后DMMB法的反应体系减小,可在节约岩藻多糖样品的同时简化实验操作,节约检测时间;其线性范围较原方法的0~0.1 mg·mL-1相比,扩宽了3倍。

表1 回收率和精密度考察结果Table 1 The results of recovery and precision
2.6 杂质对DMMB法检测岩藻多糖的影响
在实际检测过程中,岩藻多糖样品中可能存在可溶性盐、蛋白质以及海藻酸钠的干扰[18]。因此,本实验考察了氯化钠、海藻酸钠、乳清蛋白和胶原蛋白这些岩藻多糖中常见杂质对检测结果的影响。如图5A所示,氯化钠浓度≤0.3 mg·mL-1时,不影响检测结果。图5B中,在海藻酸钠浓度≤0.01 mg·mL-1时,其吸光度值没有显著性差异;而当样品中海藻酸钠浓度大于0.01 mg·mL-1时,其吸光度值明显升高。这种现象是由于海藻酸钠也是一种酸性多糖,在溶液中可以与DMMB发生特异性异染现象从而导致溶液的颜色变化,这与Richardson等[19]研究结果一致。因此,改进后的检测方法几乎不能排除海藻酸钠杂质的干扰,只可对低海藻酸钠杂质含量的样品进行测定。如图5C~D所示,向岩藻多糖样品中分别添加不同含量的乳清蛋白和胶原蛋白后进行显色反应,当样品中胶原蛋白含量是岩藻多糖含量的2倍时,其最终测定的吸光度值没有显著性差异。由上述实验结果可以看出,改良后的检测方法可在样品中的蛋白质杂质含量低于或等于岩藻多糖含量时,完成待测样品中岩藻多糖含量的精确测量。超出该范围可能会导致测量结果低于该样品中岩藻多糖的实际含量。因此,改良后的检测方法不会受样品中氯化钠杂质的影响,而当样品中乳清蛋白杂质的添加量超过溶液中岩藻多糖含量的1倍(>0.2 mg·mL-1)时,其吸光度值会有一定的降低。因此在采用DMMB法检测岩藻多糖时,应预先除去海藻酸钠,以免对实验结果产生误差。
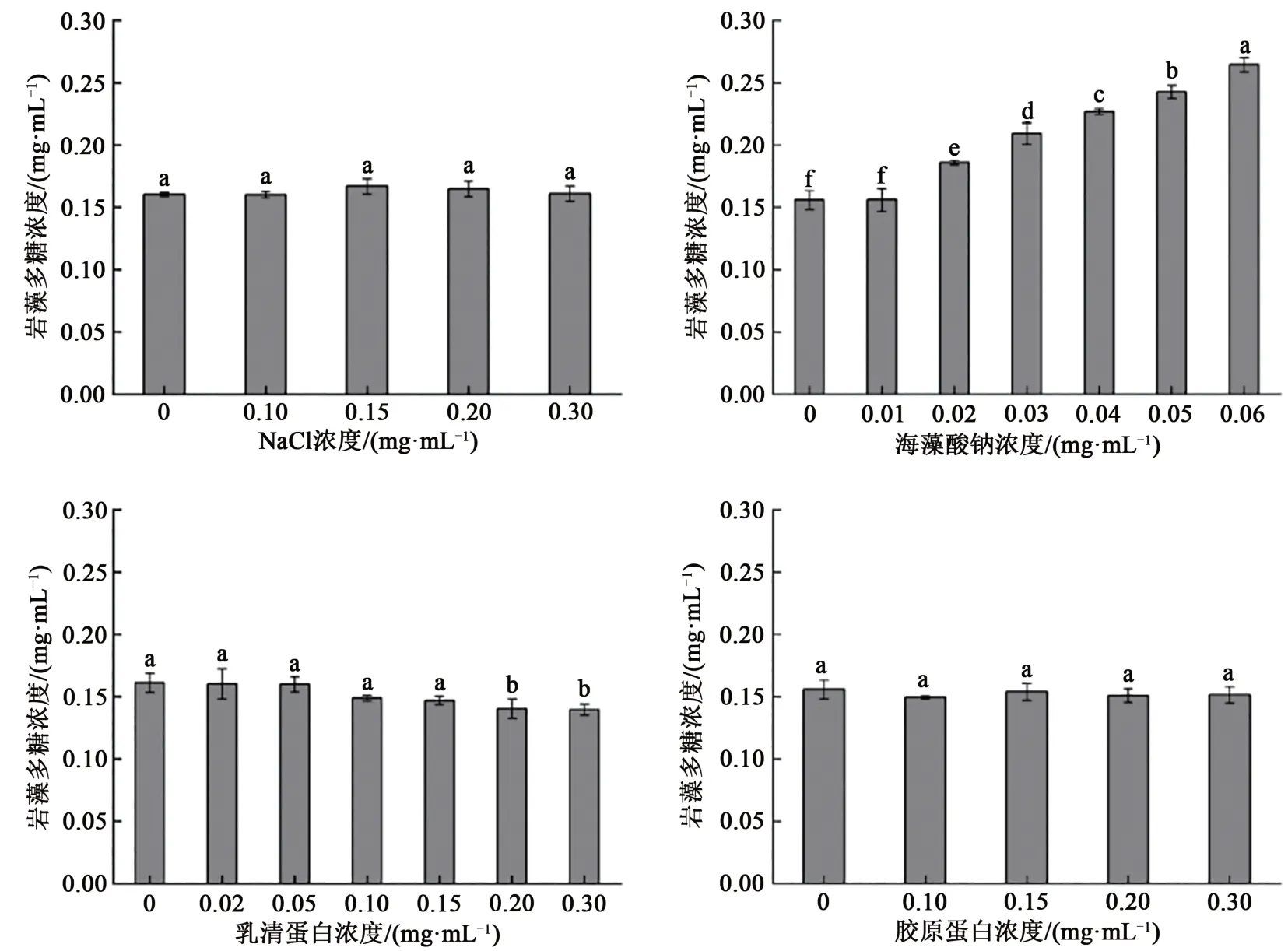
图5 杂质对DMMB法检测岩藻多糖的影响Fig. 5 The effects of impurities on DMMB method for determination of fucoidan
3 讨论
岩藻多糖是一种具有多种生物活性的海洋活性多糖[20]。由于岩藻多糖来源广泛,具有多种生物活性且易提取,有望被开发成为21世纪的新药原料[21]。岩藻多糖含量是评价岩藻多糖产品质量的重要指标,现今常用的岩藻多糖定量检测方法是DMMB显色法和HPLC法。DMMB比色法是一种常用的检测酸性多糖含量的方法,相比于HPLC法具有方便快速,操作简单等优势,已被广泛应用于酸性多糖的检测中[22]。目前常用的DMMB检测方法操作步骤复杂、线性范围较窄(0~0.1 mg·mL-1)、精密度差、反应体系大,容易造成样品的浪费,存在一定的局限性,不能实现岩藻多糖的快速定量检测。因此,对现有定量检测方法进行改良是十分必要的。本研究对DMMB法检测岩藻多糖含量的方法条件进行了改良。与原方法相比,DMMB溶液浓度提升至42.8 mg·mL-1,在保持pH 3.3的同时,反应体系明显减小;避光反应在10~15 min内进行检测,可在节约岩藻多糖样品的同时,简化实验操作,节约检测时间。该方法还将检测的线性范围扩宽至0.0125~0.3000 mg·mL-1,是原方法的3倍。除此之外,还对改良后的方法进行了方法学分析,结果表明改良后检测方法的加标回收率在90%~108%之间,相对标准偏差均在10%以下,符合中国药典的相关规定,满足检测要求。
综上,本研究建立了一种简便、快捷,可实现岩藻多糖含量快速检测的方法。改良后的检测方法能够更好地满足岩藻多糖高效定量的需求,助力岩藻多糖的产品质量控制和研究开发,为岩藻多糖的进一步研究和开发奠定了理论基础。本研究虽然对岩藻多糖的定量检测方法进行了改良,具有较好的线性关系。然而,岩藻多糖提取过程中是否有其他杂质会对后序测定产生干扰,仍需要进一步深入研究。
