特应性皮炎患儿与健康婴儿肠道菌群的差异性分析
2023-10-13吴卓璇陈金波王向东
吴卓璇 李 蒙 陈金波 胡 枫 王向东 覃 莉
武汉市第一医院皮肤科,湖北武汉,430022
特应性皮炎(atopic dermatitis,AD)是以湿疹样皮损为临床表现,伴有剧烈瘙痒的慢性炎症性皮肤病。大多数AD患者在婴幼儿时期发病,并持续到青春期甚至成年期[1-3]。早期发病是影响AD过敏性进程和发展为中重度AD的高危因素。近来研究表明,婴儿肠道早期菌群紊乱与机体特应性、IgE相关湿疹和哮喘发展之间具有关联性[4],推测肠道菌群可能在AD的发展中发挥重要作用。本研究将探讨AD婴儿和健康婴儿肠道菌群在组成以及属、种方面的差异性,对今后AD治疗提供指导意义。
1 对象和方法
1.1 病例来源 收集2019年7月至2020年12月到武汉市第一医院皮肤科门诊就诊的1~12个月龄AD患儿。病例纳入标准①符合Hanifin和Rajka诊断AD标准[5,6];②1~12个月龄足月产婴儿;③无其他皮肤疾病;④无其他系统性疾病(除外过敏性结膜炎、过敏性鼻炎、过敏性哮喘、过敏性胃肠炎);⑤无精神疾病、残疾、智力障碍;⑥近1个月未使用抗生素;⑦未服用含益生菌等微生物制剂。对照组来自武汉市1~12个月龄,无皮肤及其他系统疾病,未服用抗生素和益生菌的健康足月产婴儿。
符合纳入标准的AD组患儿,男21例,女12例,平均年龄(7.55±3.01)个月;对照组,男17例;女13例,平均年龄(8.06±3.25)个月。2组入选者年龄、性别、分娩方式、喂养方式、家族史、生活环境均无统计学意义。本研究获得武汉市第一医院医学伦理委员会的批准,研究对象的家长或监护人均知情同意。
1.2 样本采集 取受试者粪便标本(>1 g)储存于-80℃冰箱。干冰运至武汉百易汇能生物科技有限公司进行检测与测序分析。
1.3 实验方法 粪便样本提取总DNA后采用Nanodrop对DNA进行定量,并通过0.8%琼脂糖凝胶电泳检测DNA提取质量。采用两步PCR的方法进行扩增,扩增区域是V1-V9,引物是27F: AGRGTTYGATYMTGGCTCAG和1492R:RGYTACCTTGTTACGACTT,同时对扩增结果进行质控。应用武汉希望组生物科技有限公司使用PacBio Sequel测序仪对研究对象粪便细菌的16SrRNA基因V1-V9区进行高通量测序及分析。
1.4 统计学方法 α多样性主要分析菌群的丰富度和多样性,其中Chao1和Observed species指数表示丰富度,Shannon和Simpson指数表示多样性,Faith’s PD 指数表示基于进化的多样性,Pielou’s evenness 指数表示均匀度,Good’s coverage指数表示覆盖度;β多样性使用PCoA图,其中距离算法是Bray-Curtis分析;LEfSe (LDA Effect Size)分析是一种非参数统计方法,同时使用了Kruskal-Wallis以及Wilcoxon秩和检验,结合线性判别分析(Linear discriminant analysis,LDA),在两组中在丰度上有显著差异的物种,LDA值代表了显著差异物种的影响大小,LDA效应量>2且P<0.05为有统计学差异。
2 结果
2.1 两组婴儿肠道菌群在门和属水平上的组成 两组肠道菌群在门水平上的物种相对丰度排列前5位的菌门为放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia),见图1。两组肠道菌群在属水平上的物种相对丰度排列前5位的菌属为双歧杆菌属(Bifidobacterium)、拟杆菌属(Bacteroides)、梭状芽孢杆菌属(Clostridium)、韦永氏球菌属(Veillonella)、埃希氏杆菌属(Escherichia),见图2。
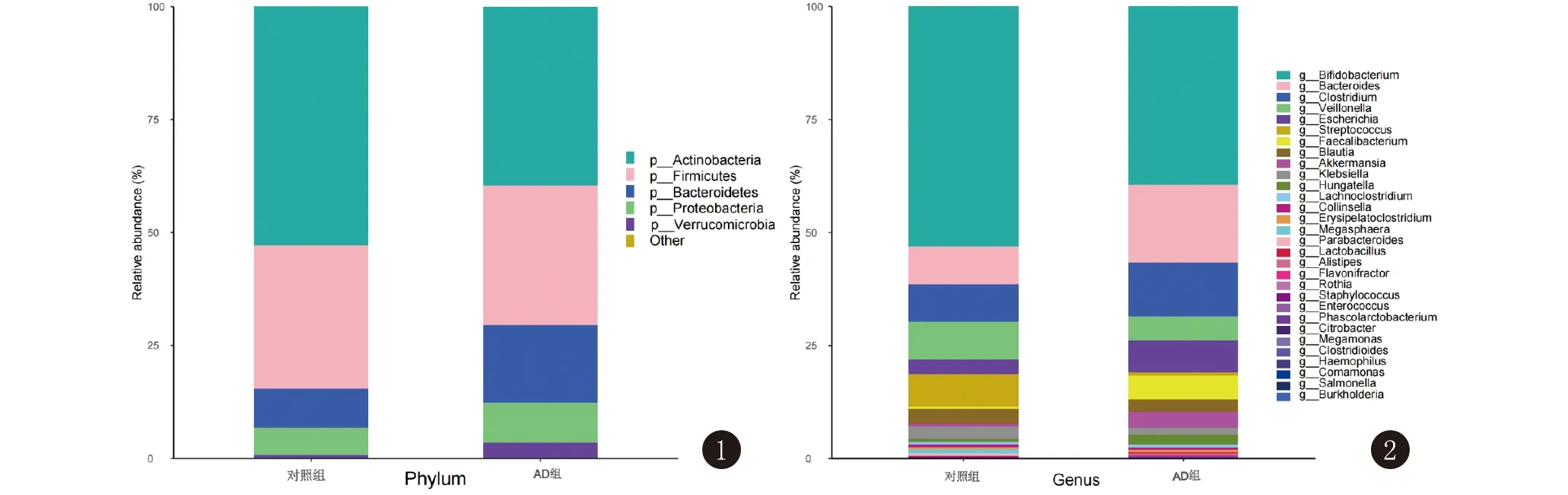
图1 特应性皮炎婴儿与健康婴儿肠道菌群在门水平上的物种相对丰度 图2 婴儿期特应性皮炎患儿与健康婴儿肠道菌群在属水平上的物种相对丰度
2.2 α多样性指数 研究环境中微生物的多样性,通过alpha多样性分析能较全面地评估菌群落的丰度及多样性,其中Observed species指数和Shannon指数,这两组指数显示AD组较对照组丰度、多样性、均匀度中位数偏低,Good coverage值表示AD组覆盖度偏高,但无统计学意义(P>0.05),见图3。
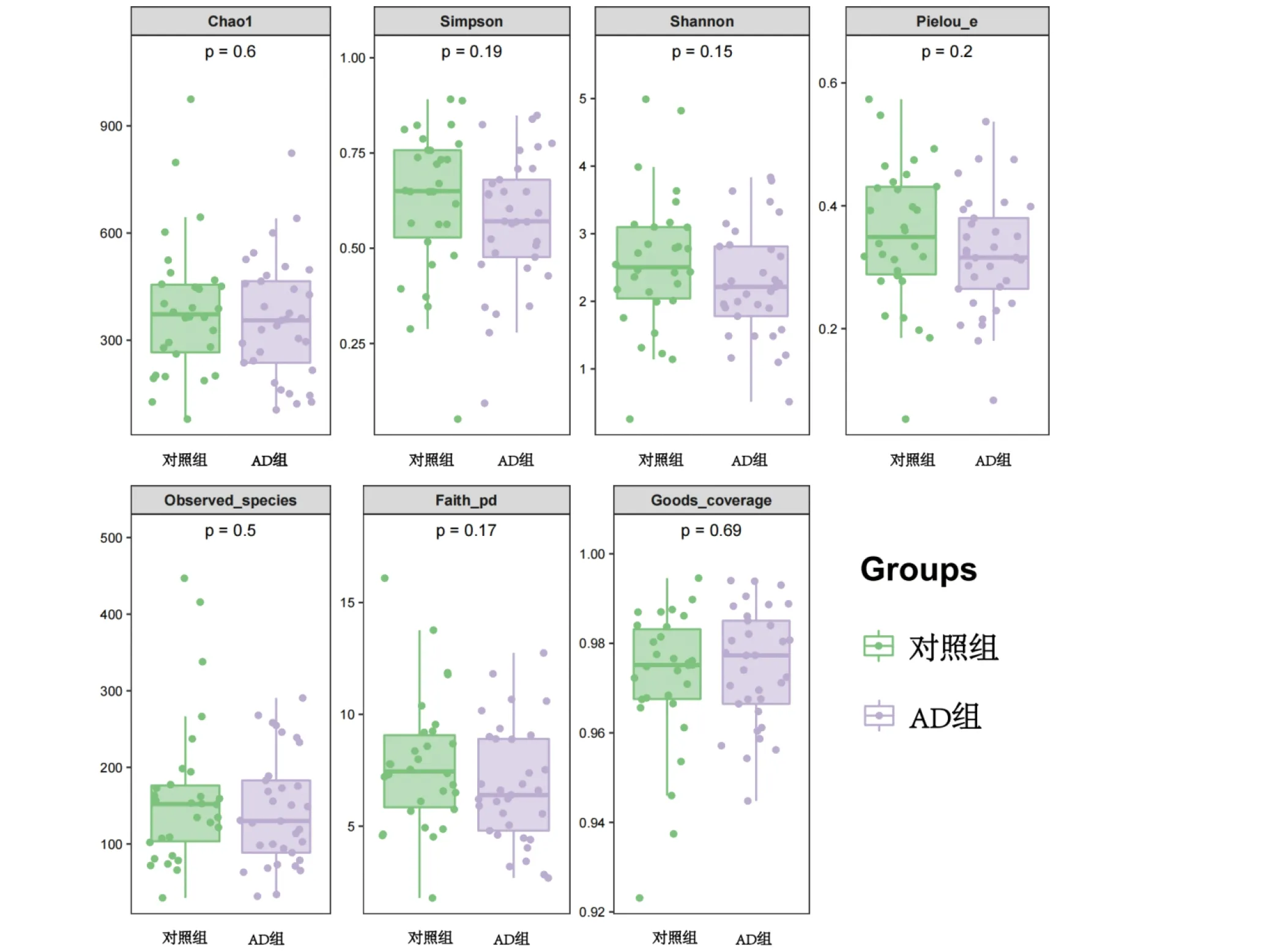
每对箱线图对应一种α多样性指数,在其顶端灰色区域标识。每个箱线图中,横坐标为分组标签,纵坐标为相应α多样性指数的值。箱线图中,各符号含义如下:箱的上下端线,上下四分位数(Interquartile range,IQR);中位线,中位数;上下边缘,最大最小内围值(1.5倍的IQR);在上下边缘的外部的点,表示异常值。多样性指数标签下的数字为Kruskal-Wallis检验的P值。AD组:特应性皮炎婴儿;对照组:健康婴儿图3 婴儿期特应性皮炎患儿与健康婴儿肠道菌群的α多样性指数
2.3 β多样性分析 研究不同生境间多样性的比较,从图中可以看出,两组之间有明显的不一致性,使用PERMANOVA检验(P=0.032),提示两组间菌落有显著性差异,见图4。
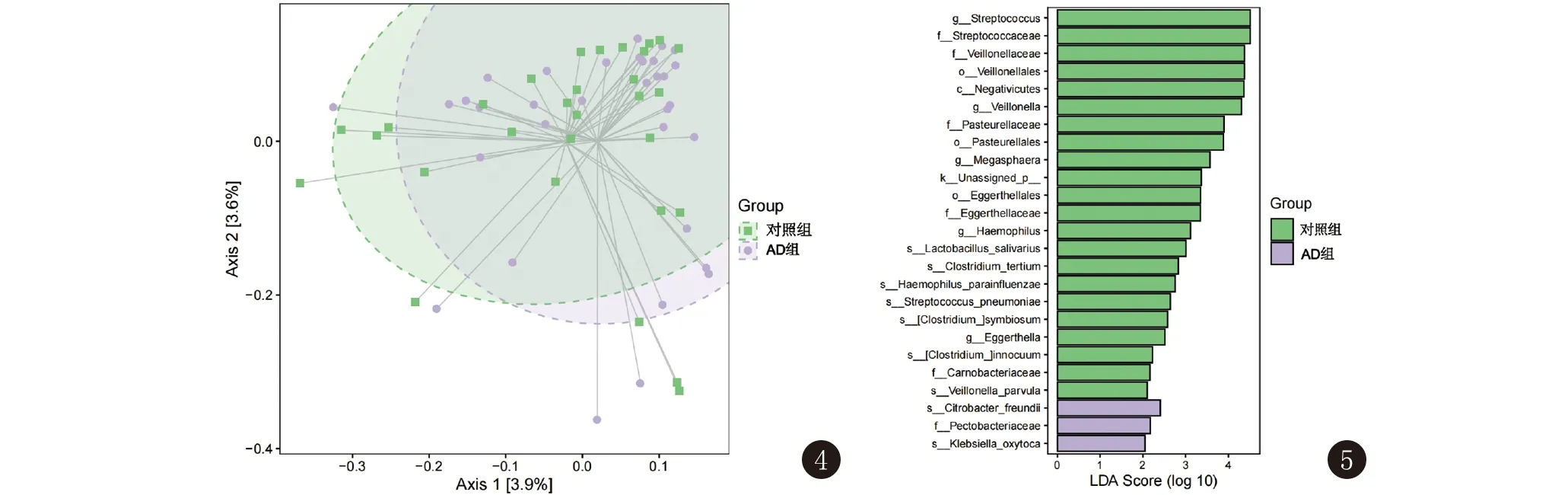
图4 婴儿期特应性皮炎患儿与健康婴儿肠道菌群的PCoA图 图中每个点代表一个样本,不同颜色的点指示不同的组。坐标轴括号中的百分比代表了对应的坐标轴所能解释的样本差异数据(距离矩阵)的比例。两点在坐标轴上的投影距离越近,表明这两个样本在相应维度中的群落组成越相似。椭圆形虚线圈为95%置信椭圆。AD:特应性皮炎婴儿;对照组:健康婴儿 图5 婴儿期特应性皮炎患儿与健康婴儿肠道菌群的LEfSe图 纵坐标为组间具有显著差异的分类单元,横坐标则以条形图直观地展示各分类单元的LDA分析对数得分值。分类单元按照得分值大小进行排序,以此描述它们在样本分组中的特异性。长度越长表明该分类单元的差异越显著,条形图的颜色指示了该分类单元所对应的丰度最高的样本分组。AD组:婴儿期特应性皮炎患儿;对照组:健康婴儿
2.4 LEfSe分析 采用LEfSe分析发现AD组肠道菌群中,弗氏柠檬酸杆菌(LDA=2.430)、产酸克雷伯菌(LDA=2.211)显著性增加,对照组链球菌属(LDA=4.517)、韦荣氏球菌属(LDA=4.311)、巨球形菌属(LDA=3.592)、唾液乳酸杆菌(LDA=3.510)、副流感嗜血杆菌(LDA=3.108)、埃格特菌属(LDA=2.871)、第三梭状芽胞杆菌(LDA=2.850)、肺炎链球菌(LDA=2.651)、共生梭菌(LDA=2.588)、无害芽胞梭菌(LDA=2.262)、小韦荣氏球菌(LDA=2.260)显著高于AD组,见图5。
3 讨论
约有45%的AD发生在婴儿期前6个月,研究表明AD婴儿肠道菌群与健康婴儿肠道菌群具有差异性,提示婴儿肠道菌群定植在AD的发展中起着重要的作用[7-8]。婴幼儿早期肠道微生物组的组成、功能和代谢产物与AD的自然进程有关[9-10]。肠道中丰富的胎粪代谢组与菌群组成可以减少过敏性疾病发生的风险,且菌群结构和过敏表型之间具有显著关系[11-12]。婴儿期肠道菌群的不平衡可能是特应性病程发展的重要条件[13]。
目前,国内关于AD婴儿肠道菌群定植的报道甚少。本研究通过16S rRNA测序、α多样性指数、β多样性及LEfSe分析,比较患有AD的婴儿与健康婴儿肠道菌群的差异性。研究结果显示,两组肠道菌群在门水平上的物种相对丰度排列前5位的分别是放线菌门、厚壁菌门、拟杆菌门、变形菌门、疣微菌门;在属水平上的物种相对丰度排列前5位的有双歧杆菌属、拟杆菌属、梭状芽孢杆菌属、韦永氏球菌属、埃希氏杆菌属,与国外研究一致[11,13]。两组肠道菌群在组成结构上有显著性差异(P=0.032);AD组的菌群物种丰度和均匀度指数较对照组偏低,但无统计学意义(P>0.05);采用LEfSe分析方法发现在属和种水平上,AD组中弗氏柠檬酸杆菌、产酸克雷伯菌较对照组显著性增加,对照组中链球菌属、韦荣氏球菌属、巨球形菌属、唾液乳酸杆菌、副流感嗜血杆菌、埃格特菌属、第三梭状芽胞杆菌、肺炎链球菌、共生梭菌、无害芽胞梭菌、小韦荣氏球菌较AD组有显著性增加。上述结果表明,健康对照组婴儿肠道中益生菌与致病菌以共生形式存在,其菌群多样性较AD组明显增多,而AD组婴儿肠道菌群较为单一,这可能是引发AD的原因。有学者研究发现AD患儿肠道大肠杆菌、金黄色葡萄球菌、梭状芽孢杆菌的比例升高[7,14,15],而本研究中AD组婴儿肠道中弗氏柠檬酸杆菌、产酸克雷伯菌的相对丰度显著高于健康对照组,提示上述两种菌可能在AD发生发展中发挥重要作用。有研究报道发现,经剖宫产出生婴儿的肠道菌群中弗氏柠檬酸杆菌、产酸克雷伯菌等定植显著相关,推测可能是哮喘和过敏患病率增加的原因[16]。克雷伯氏菌在肠道定植发生在生命早期,作为肠道生态系统中的共生菌群在机会条件下致病,在3个月龄湿疹婴儿的肠道中发现明显富集,炎症性肠病小鼠模型研究中也描述了克雷伯氏菌和婴儿肠道早期炎症的发生有关[17]。特应性湿疹婴儿的微生物组和代谢组进行了分析通过肺炎克雷伯菌的富集,与粪便增加相关d-葡萄糖浓度和相关毒力因子基因表达增加有关[18]。
综上所述,AD婴儿肠道菌群相对丰度及生物多样性与正常婴儿存在差异性。肠道菌群的组成和比例差异与AD的发展相关,肠道菌群可通过免疫、代谢和神经内分泌途径促进AD的发展,影响其持续性和严重性[19]。因此,关注AD婴儿早期肠道菌群定植,对AD预防和治疗具有重要意义,但因肠道菌群受地域、环境、饮食等诸多因素影响而发生变化,其对疾病和过敏进程的影响还需进行更深入地前瞻性研究加以证实。
