糖原累积症患儿的围术期麻醉管理策略
2023-10-13王蓓朱智瑞
王蓓 朱智瑞
糖原是由多个葡萄糖组成带分支的大分子多糖,是体内糖的贮存形式,其在体内酶促作用下的合成和分解可精准地控制人体血糖水平。糖原累积症(glycogen storage disease,GSD)是一种基因突变导致人体不能有效合成或分解糖原的遗传代谢性疾病,相关酶的先天性缺陷使得患儿无法维持正常稳定的血糖水平,不仅容易出现低血糖,还会在肝脏、心脏、肌肉、肾脏等器官组织的细胞中出现糖原蓄积现象,从而影响多种脏器及系统的功能。GSD 发病率极低,目前中国尚缺乏流行病学统计数据,但已于2018 年5 月收录于国家卫生健康委员会等5 部门联合制定的《第一批罕见病目录》中。近年来,随着相关酶替代疗法、酶增强疗法、基因治疗的应用与研究进展[1-3],GSD 患儿存活率逐渐提高,更多的GSD 患儿有外科手术的需求。该疾病的代谢紊乱使得围术期风险明显增加,给麻醉医师带来非常大的考验与挑战,但迄今为止,国内外关于GSD 患儿的围术期管理或麻醉管理的报道较少,部分对正在接受诊疗的GSD 患儿进行肌肉活检术或深静脉置管术的麻醉报道由于手术刺激较小,对循环、代谢、呼吸等管理缺少指导意义。因此,本研究对该类疾病患儿的围术期管理要点作一综述,旨在提高麻醉医师对该疾病的围术期认知,预防围术期并发症及提高临床转归。
1 GSD 分类
目前,GSD 根据突变基因的不同有多种分类方式,根据受累器官的不同,可主要分为肝-低血糖型GSD 和肌-能量障碍型GSD。前者包括0、Ⅰ、Ⅲ、Ⅳ、Ⅵ、Ⅸ及Ⅺ等亚型,主要临床表现为肝肿大、低血糖,其中Ia 型最常见;后者包括Ⅱ、Ⅴ、Ⅶ型,主要表现运动不耐受、肌无力或肌病,其中Ⅱ型最常见,且仅Ⅱ型中的婴儿型表现为婴儿心肌病[4]。见表1。
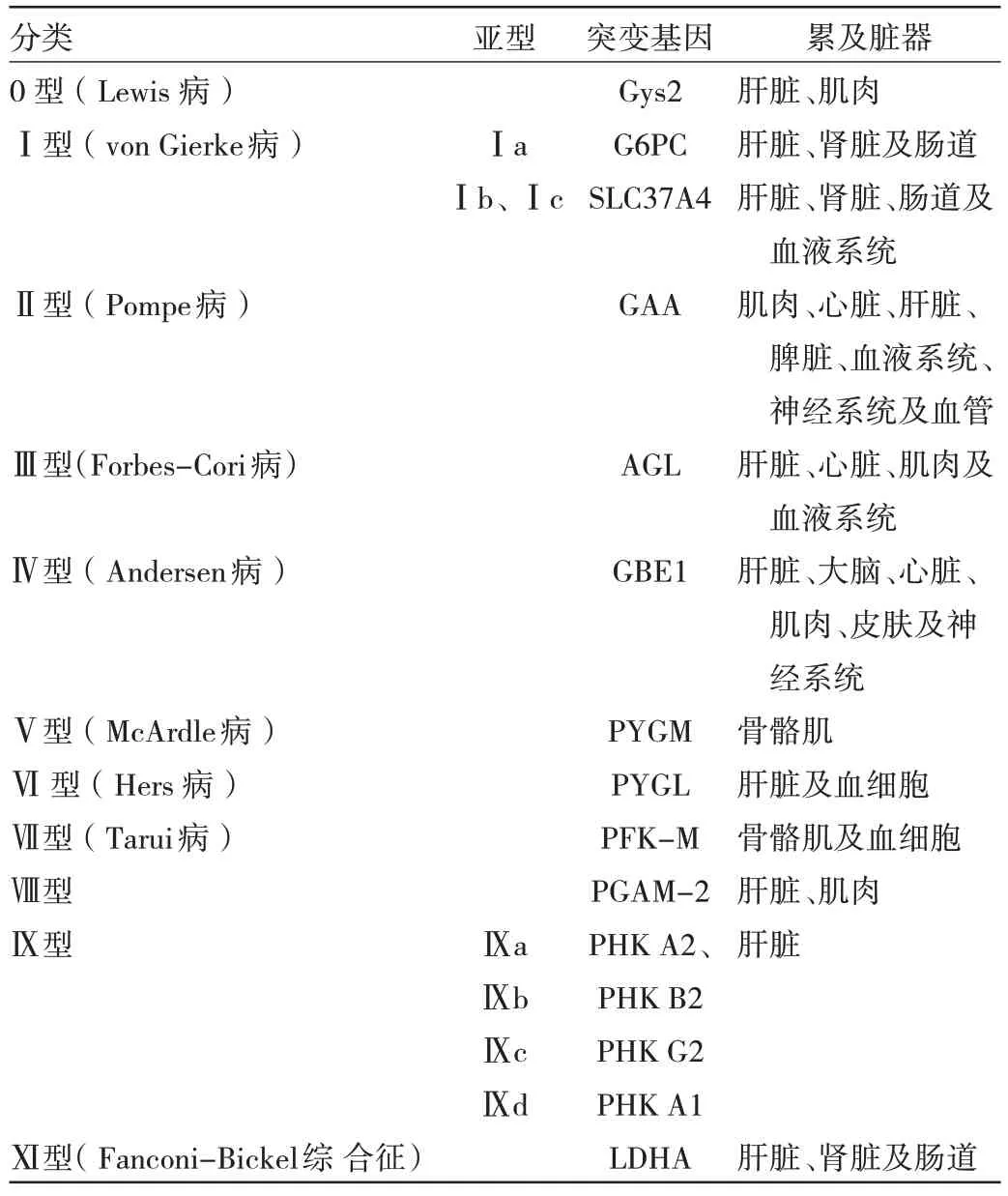
表1 GSD 各分型、突变位点以及主要累及脏器
2 术前评估
GSD 分型繁多且残余糖原合成分解相关的酶活性程度各不相同,因此不同患儿疾病的严重程度和临床表现都不尽相同,术前评估的主要关注点也需根据疾病具体情况而进行调整。
2.1 肝型GSD 肝型GSD 患儿由于肝脏不能合成或分解糖原导致反复发作低血糖或高血糖,易出现生长速度缓慢、肥胖症及神经系统损害症状(如运动、认知功能发育障碍等)[4-5]。患儿实际发育状况的评估对于术前准备至关重要,涉及到气管导管型号的选择、术前沟通、麻醉前后的医患配合等多个环节。此外,肝脏GSD 引起的肝肿大抬升膈肌,可干扰呼吸时胸廓的运动功能。肝肿大和腹部内容物移位带来的另一种风险是麻醉诱导时可能出现的胃食管反流和误吸,需做好相关的预防措施,如麻醉诱导前备好吸引器等。
肝脏受累的患儿除伴有不同程度的禁食性低血糖外,实验室检查中糖代谢产物也随之发生变化,血中酮体和阴离子间隙升高,乳酸、尿酸和丙氨酸水平则降低。部分Ⅳ型患儿甚至会进展为肝硬化,需注意到该类患儿可能会有转氨酶升高、凝血功能障碍等肝功能受损的表现。针对GSD 患儿获得性血管性血清因子异常引起的凝血功能异常,围术期提倡使用去氨加压素促进止血[6-7]。肝脏受累者B 超和CT 检查可发现肝腺瘤[8],肿大的肝脏在影像学检查时也可表现为膈肌上抬,肺部空间受到压缩。
2.2 肌型GSD 肌型GSD 患儿由于肌糖原在肌肉活动中分解障碍而表现出易疲劳、肌痛、痉挛等症状,通常下肢近端和椎旁躯干肌最先受累,导致脊柱侧后凸、肌肉纤维化等畸形。有研究统计约有33% Pompe病(Ⅱ型GSD)患者合并脊柱侧凸,并且与非脊柱侧凸患者相比该类患者肺功能持续下降,对呼吸辅助措施的需求比例更高(44.0%比27.2%)[9]。麻醉医师有必要对所有Pompe 病患儿的脊柱侧凸状况进行关注,尤其需注意对呼吸系统相关肌肉的肌力及肺功能状态进行评估。膈肌和呼吸肌受累可引起肺活量下降导致呼吸衰竭,特别是仰卧位,肺功能进一步下降,患儿易出现慢性睡眠通气不足、慢性二氧化碳潴留[10]。有呼吸道症状的肌型GSD 患儿,尤其是躯干肌受累伴有脊柱侧凸症状,不能简单地假定为限制性通气功能障碍。有研究报道了1 例GSD 患儿在肝活检麻醉期间发生了心脏、呼吸骤停,复苏后支气管镜检查显示双侧远端气管和支气管严重狭窄[11],提示该类患儿术前有必要采用影像学检查进行气道评估。计算机断层血管造影(computed tomography angiography,CTA)是一种评估主要气道和血管的快速成像方式,甚至可三维重建气道表征,检查速度快且无需麻醉药物镇静,可作为优先选择。合并有严重心肌病的经典婴儿型GSD患儿也可能因心脏压迫气道而发生肺大叶塌陷[12],因此术前对年龄较大的患儿(6 岁以上)进行坐姿和仰卧位的肺活量测定,对年龄较小的患儿术前进行多导睡眠监测非常重要。
舌骨骼肌的糖原浸润可导致巨舌畸形,在麻醉诱导、术后复苏期间可引起气道阻塞。有研究报道1 例GSD Ⅲ型患儿气道张口度检查显示MallampatiⅡ级[13],另1 例GSDⅡ型患儿在未使用肌松剂的情况时喉镜下仅能看到会厌,无法看到声门(Cormack-Lehane 分级3级),两次尝试后才能插入气管插管[14]。GSD 患儿在诱导和使用神经肌肉阻滞剂后,舌体肥厚可能导致插管困难和(或)面罩通气困难。
肌肉受累患儿由于持续的肌肉损伤,磷酸肌酸激酶(creatine phosphokinase,CPK)水平升高,严重者出现肌球蛋白尿。术前评估需注意患儿的肢体运动功能是否适应术中体位的摆放,不适当的体位可能会增加术中发生横纹肌溶解甚至急性肾衰竭的风险[15]。肌电图检查显示肌张力性/肌痛性改变[16],偶尔有混合肌病和神经病变。肌肉活检显示肌细胞内糖原积累和去支化酶缺乏。
2.3 心肌型GSD 心肌受累患儿出现心肌肥厚导致左心室顺应性差,易发生舒张性心力衰竭、左心室舒张末期压(left ventricular end-diastolic pressure,LVEDP)升高,最终可发展为收缩性心力衰竭和左右心共同衰竭。术前重点评估心脏受累的程度和心功能不全的程度。心电图检查示PR 间隔缩短、QRS 波高尖是肥厚性心肌病的特征性证据。此外,还应对心脏节律、心室腔容积、左心室射血分数(ejection fraction,EF)、左心室质量指数(left ventricle mass index,LVMI)等心功能状况进行详细评估。该类患儿心肌的向心性肥厚导致心脏在收缩期左心室腔隙闭塞,通过心超检查测量的EF 值很可能正常甚至升高。因此,对于心肌受累的GSD 患儿,单纯依靠左心室收缩功能作为心功能评判参数,可能会在麻醉管理中产生失误。通过心超检查数据计算获得的二维左心室质量指数(two dimensional-LVMI,2D-LVMI)和心室腔容积等非常规变量指标,在临床上更具有指导性[17]。有研究表明LVMI>350 g/m2与典型心肌受累患儿的死亡率之间呈明显的正相关性[18]。
3 术前禁食
肝型GSD 患儿多次少量进食不仅能够预防低血糖症状,还能避免多余的碳水化合物加重肝脏糖原储积,因此该类患儿饮食间歇时长通常具有严格限制。空腹并伴有低血糖易诱发酮症,对于饮食间歇期较短的患儿,临床医师需要考量患儿术前禁食时长对禁食期间血糖的影响,术前和术中都应及时监测血糖并补充含糖溶液[19]。由于生玉米淀粉较其他碳水化合物更能持久地维持血糖稳定,因此该类患儿可有口服生玉米淀粉的喂养史。病史询问中患儿的饮食特殊性不可或缺,这有助于医师更好地判断患儿对禁食时长的耐受能力。如果情况允许,该类患儿的择期手术应尽量安排在手术日首台,以减少长时间禁食对血糖及内环境的干扰。
心肌受累患儿的择期手术均应延迟至患儿已接受酶替代疗法并已有效地减少左心室质量,从而降低围术期风险。为确保心室充盈充分和有效的冠状动脉灌注,手术前夜禁食、禁饮期间需及时根据循环监测结果进行静脉补液[18]。
4 术中监测
4.1 循环 心肌受累患儿随着心肌肥厚程度的增加,其心肌缺血的潜在风险也随之增加,心率较快、舒张期冠状动脉灌注时间较短和舒张压较低的患儿风险尤甚。麻醉药物增加心肌缺血的风险,因此该类患儿更需维持正常的血压以确保冠状动脉灌注,需更精确地监测血压和ST 段变化。既往研究发现,心肌受累患儿心脏骤停多出现在麻醉早期和手术之前[18,20],因此诱导前置入动脉导管及时监测血压变化并快速纠正相对低血压是预防心肌缺血的重要措施。糖原可在窦房结和房室结等心脏传导系统积聚,导致传导速度异常,如室性和室上性心动过速。回顾性研究也表明,婴儿型Pompe 病伴有不同类型的心律失常[21]。有研究报道了1 例无任何心血管临床症状的GSD Ⅲ型患者既往超声心动图检查提示轻度非梗阻性肥厚型心肌病,且瓣膜系统正常,双心室动力学良好,射血分数75%,在一次动态心电图检查中出现类似室性心动过速的扭曲波形随后演变成心室颤动,最终意识消失抢救无效死亡[22]。基于上述担忧,即使是非心肌受累的其他型GSD 患儿,术中和术后都应使用5 导联心电图监测。
如果围术期患儿具有明显血容量改变的倾向和(或)患儿本身有心力衰竭症状,中心静脉压也是必要监测目标,且持续监测到术后。有条件时通过监测心输出量,如每搏量、每搏量指数、全身血管阻力、收缩指数和心脏指数观察血流动力学变化,可以更安全地指导GSD 患儿的围术期管理[23]。
4.2 呼吸 在正压通气的吸气阶段,胸腔内压力升高导致右心房压力升高,最终影响右心室充盈和心输出量下降[24]。临床上观察到新生儿和婴儿平均气道压降低可增加心输出量[25],表明机械通气时与正压通气相关的较高平均气道压可进一步减少心室充盈和心排血量。而GSD 患儿由于限制性通气障碍胸壁顺应性较低,在扩张相同容量的胸腔时需要更多的胸腔内压力,从而导致更大程度的心输出量减少。因此,机械通气时需根据循环和呼吸状况及时调整潮气量与吸气压力的设置。
4.3 体温 有研究报道了1 例GSD 0 型患儿3 岁时接受七氟醚全麻行腭成形术,术中出现代谢性酸中毒、低血糖、发热,体温达40 ℃,术后CPK 水平升高[26],提示GSD 是代谢性肌病中的一种,对怀疑肌肉受累的GSD 患儿应考虑存在恶性高热的风险[27]。使用卤化吸入麻醉药时,应注意观测患儿体温和呼气末二氧化碳分压的变化。寒战或手术刺激引起的肌肉收缩易增加肌肉受累GSD 患儿细胞溶解的风险,对该类患儿推荐监测体温,并采用输液加温、保暖毯等措施以避免寒战,必要时哌替啶可用于控制寒战。时刻关注患儿在手术台上的体位,避免极端和反生理体位引起肌肉收缩。同理,避免选用间歇性加压的血压袖带,以避免触发肌肉缺血导致的损伤从而引起肌红蛋白尿,放置导尿管以便随时进行尿色监测(如有肌红蛋白尿则表现为红褐色或酱油色尿)。如果检测到因止血带或其他形式压迫引起的肌红蛋白尿,及时使用呋塞米甚至甘露醇强制利尿,防止继发性急性肾衰竭。
4.4 血糖 正常情况下,失血、手术创伤等应激反应使机体发挥抑制胰岛素分泌和促使胰高血糖素释放增加等机制升高血糖,术中肾上腺素糖皮质激素的应用也有升高血糖作用。GSD 特有的低血糖及肝肾功能损害则易出现不同的代谢紊乱和药物代谢异常[28],且在麻醉实施过程中,麻醉药物对应激反应的抑制作用也可能使血糖进一步降低。血糖作为大脑的主要能量来源,麻醉苏醒需要相关脑神经元兴奋和一定的能量消耗,低血糖可造成短暂性的神经功能抑制使麻醉后苏醒延迟,抑或在苏醒后出现类似癫痫样发作等症状[29],甚至严重的低血糖可引起脑发育关键时期婴幼儿的永久性神经损害[30]。需警惕代谢缺陷引起的空腹低血糖会导致典型的继发性代谢异常(如高甘油三酯血症、高乳酸血症、高尿酸血症)[31]。有研究报道1 例4 岁GSD Ⅰ型患儿在接受扁桃体切除术后继发急性胰腺炎,提示Ⅰ型患儿有继发于高甘油三酯血症的胰腺炎的风险[32]。
血糖代谢的不稳定性及严重后果极大地增加了手术和麻醉的风险,因此围术期血糖的动态监测对麻醉的决策有重大意义。一旦发现低血糖及时补充含葡萄糖溶液,迅速阻断低血糖所继发的各种代谢紊乱从而减轻临床症状。术后给予含糖液体,并定时监测血糖直至患儿能够耐受口服喂养。
4.5 乳酸 血乳酸浓度是反映组织代谢、末梢循环状态以及组织氧供氧耗平衡的间接指标,乳酸浓度增高是组织氧供-氧耗失衡、组织灌注不良、氧债增加的标志之一。肝型GSD 患儿糖原累积在肝脏使得本身就可能伴有高乳酸血症,而60%的乳酸需要通过肝脏来清除,肝功能异常可导致乳酸清除障碍,进一步加重乳酸酸中毒[33]。4 例接受重大手术的GSD 患儿术中发生了自限性、短暂的代谢性酸中毒[34],术中建议维持液体选择复方电解质液。术中贫血、过度通气等也会引起乳酸清除障碍,因此,术中注意维持呼吸循环稳定、减少乳酸产生,同时加强对乳酸的监测和对酸中毒的处理,应在保持组织灌注的前提下分次纠正酸中毒,有利于改善预后。
5 麻醉药物
肝型GSD 患儿易出现肝肾功能异常,应避免使用通过肝肾代谢的药物。全麻诱导后,肝脏血流灌注减少,在肝功能受损的GSD 患儿中,药物代谢和意识恢复可能会延迟,术前应合理预估药物的剂量和作用半衰期进行。非急诊手术患儿围术期采取相应的肝保护治疗措施可以减少相关并发症的发生,如术前进行保肝药物治疗,术中给予维生素K 且避免凝血功能异常导致失血,围术期避免血压波动过大保持肝脏灌注的稳定性等。
5.1 镇静药物 心肌受累的GSD 患儿,由于心室肥厚导致左心室顺应性差、LVEDP 升高、心室容量降低,造成心输出量减少从而增加心内膜下缺血的可能性。基于此生理学变化,需要足够的血容量和前负荷来提供心输出量以确保舒张压高于LVEDP,才能维持足够的冠状动脉灌注压。心脏的冠状动脉灌注对舒张压的突然变化会非常敏感,心率增加28%,舒张压降低16%,这在普通儿科患儿中可能没有显著的临床意义,但可打破GSD 心肌受累患儿的心肌氧供和需求的临界平衡甚至引起心脏骤停[35]。心肌肥厚和已经不稳定的冠状动脉灌注压,再加上可能受累的心脏传导系统,使得婴幼儿型GSD 患儿尤其容易发生室性和室上性心律失常,需保证复苏药物及除颤设备及时可用。需警惕麻醉药物降低冠状动脉灌注压和增加心律失常的风险。异丙酚会迅速降低全身血管阻力和舒张压,引起心肌肥厚患儿的后负荷降低和心肌缺血,可导致严重甚至致命的心律失常[18],故不建议在未经治疗的心肌病婴儿中使用异丙酚。依托咪酯由于具有稳定的血流动力学安全特性,理论上可用于未接受治疗的重度心肌受累患儿的麻醉诱导。但遗憾的是,目前缺乏将依托咪酯用于心肌病患儿的研究或大型病例系列研究,因此目前无法对其的使用提出确切建议。七氟醚对该类患儿而言是一种可接受的麻醉剂,但应注意高浓度七氟醚可引起全身血管阻力降低和直接心肌抑制,因此将其作为唯一的麻醉剂并不是一种安全的选择,仅当其他药物无法对患儿产生足够的镇静效用时方建议协同应用七氟醚,且必须保持较低的浓度以避免出现低血压。Wang 等[18]回顾了139 例Pompe 病患者在麻醉期间的不良事件,其中9 例患儿在异丙酚和(或)七氟醚全麻诱导后出现严重心律失常或心脏骤停,甚至有2 例患儿因心律失常在术中死亡。总之,对心肌受累的患儿进行麻醉诱导应特别注意避免使用异丙酚或高浓度七氟醚。
5.2 镇痛药物 氯胺酮通过刺激交感神经直接增加心肌收缩力和全身血管阻力,从而增加心输出量和血压[36],对前负荷干扰小且能够更好地支持冠状动脉灌注和心肌氧供。1 例患儿初次麻醉时接受七氟醚吸入诱导,异丙酚泵注和40% NO2吸入维持后发生心脏骤停[35],在电除颤和两次肾上腺素静脉推注复苏恢复窦性心律后暂停手术。第2 次择期手术的麻醉中,麻醉方案改用氯胺酮联合芬太尼静脉诱导,氯胺酮泵注维持麻醉,最终成功完成手术。建议使用氯胺酮作为诱导的基础药物,联合芬太尼和低浓度七氟烷作为心肌受累患儿的首选诱导方案。然而,氯胺酮直接刺激交感神经的一个常见不良反应是心动过速,同时为了减少气道分泌物,氯胺酮通常需要与抗胆碱药物联合使用,而抗胆碱药的抗毒蕈碱作用本质上也会增加心率。对于有缺血风险的心肌,保持足够慢的心率以保证充分的舒张充盈和冠状动脉灌注也很重要。因此,在使用氯胺酮时须密切关注ST 段变化,备好β-受体阻滞剂如艾司洛尔等其他抗心动过速药物,以便发现心肌缺血时随时应用。此外,在已知患儿伴有左心室流出道梗阻时,氯胺酮应减量和需要更积极的液体维持,以防止肥大的心肌造成梗阻加重。右美托咪定具有镇痛、镇静、血流动力学稳定和减少对其他麻醉药的需求等优势,右美托咪定联合氯胺酮对心肌受累或肝脏受累的GSD 患儿均有益[10]。瑞芬太尼作为麻醉维持药物之一,对术中循环干扰较小,理论上可作为该类患儿的选择方案,但尚未在GSD 患儿尤其是心肌受累型患儿中进行较多尝试,有必要在这一高危人群中对这些药物进行进一步研究。
5.3 肌松药物 虽然顺式阿曲库胺的代谢方式为不经过肝肾代谢的hoffman 消除,但是考虑肌力减低的患儿对非去极化肌松剂的敏感性增加,肌松效果持续时间延长,因此GSD 肌型患儿可能需要减小剂量和延长给药间期,必要时使用肌松监测技术来监测神经肌肉阻滞剂的给药量,并优先考虑短、中效肌松药[13]。对于单纯肌型GSD 患儿的肌松药也可以选罗库溴铵,其优势在于可以被舒更葡糖钠拮抗来迅速逆转肌肉松弛效应[15]。
5.4 区域神经阻滞 区域麻醉技术也可以用于GSD婴幼儿手术,镇静/非镇静麻醉复合神经阻滞可以平衡全身麻醉、心律失常和通气需求的风险,但需注意选择较低浓度的药物以避免自主神经阻滞和潜在的后负荷降低[37]。外周神经阻滞也可以作为复合全麻的一部分,以缓解全麻引起的心脏抑制,还可预防阿片类药物引起的呼吸抑制和气道阻塞等并发症[23]。
6 液体管理
肝型GSD 患儿更容易出现有机酸血症,3 例肝移植患儿术中未输注乳酸林格液仍出现代谢性酸中毒,在术后24 h 内恢复正常,具有自限性和短暂性[33]。部分患儿术中使用乳酸林格液,未见明显酸碱失衡[34]。也有术中未输注乳酸林格液,酸碱值维持正常范围[13]。目前关于GSD 患儿围术期酸碱变化以及乳酸的相关数据仍较缺乏,常规使用乳酸钠林格液是否会加重潜在的代谢性异常并诱发围术期酸中毒尚不清楚,仍有待进一步探讨。
GSD 患儿心肌肥厚可导致左心室流出道(left ventricular outflow tract,LVOT)梗阻,在低血容量的情况下会更严重。研究表明低血容量引起的LVOT 梗阻可随着血管内血容量的恢复而消除[35]。因此,围术期及时足量的补液提供正常甚至较高的体循环阻力和足够的前负荷,尤其是手术前夜禁食、禁饮期间需要进行静脉输液[18],以确保心室充盈充分和有效的冠状动脉灌注,避免发生心内膜下缺血和心脏骤停或室性心律失常的风险,同时有助于减少LVOT 梗阻的可能性。然而,过度积极的补液可能导致LVEDP 升高患儿发生肺水肿。当患儿脱离正压通气时,这一点可能更加明显。有研究报道Pompe 病患儿接受脊柱侧后凸矫正手术,术前心超检查提示心功能正常。在中心静脉压评估下,估计术中失血量为1.1 L,术中补液为血制品450 mL,乳酸钠林格液2.3 L,这在一般人群中为可接受补液量。但该患儿术后第2 天出现轻度双侧胸腔积液伴轻度呼吸困难,应用利尿剂和吗啡后逐渐好转,考虑是术中液体稍超负荷所致[10]。提示即使GSD 患儿术前心功能检查未见明显异常,也可能存在潜在的心功能轻度紊乱。在该类患儿中,心肺之间的相互影响会变得更加密切。
7 术后镇痛管理
良好的术后镇痛可明显提升临床预后。出于对GSD 患儿围术期凝血功能异常的担忧,术后镇痛可能会慎重选择椎管内镇痛。阿片类药物的代谢障碍也限制了其应用,而外周神经阻滞不仅可为GSD 心脏受累患儿提供无阿片类药物的麻醉,也能缓解术后疼痛[23],如连续竖脊肌平面阻滞可明显改善GSD Ia 型患儿肝移植手术的镇痛效果[38]。
8 小结
GSD 患儿根据酶缺陷种类的不同而病情轻重不一,同时发病率较低导致临床医师经验有限,使得围术期管理非常困难。GSD 患儿的围术期管理应纳入到小儿内科医师、小儿外科医师和小儿麻醉科医师的多学科协作团队中,这对于确定手术时机、麻醉方案和围术期护理至关重要。根据不同亚型不同受累器官全面仔细进行术前评估,审慎选择麻醉药物,密切围术期监测,维持患儿良好的心功能和血流动力学指标稳定,保持血糖等内环境稳定,同时缓解焦虑、无呼吸抑制、合理有效镇痛和减少术后寒战等都是改善预后的重要措施。对于这类患儿,仍需要有更多的病例分享或进一步开展更大规模的研究,来提供更多的指导经验。
