藜麦RBOH基因家族的鉴定及表达模式分析
2023-10-12韩建玮杨冬冬郭善利尹海波
韩建玮,杨冬冬,曹 萌,张 侠,郭善利,2,尹海波
(1.烟台大学生命科学学院,山东 烟台 264005;2.青岛农业大学草业学院,山东 青岛 266109)
植物为了适应环境变化,进化出多种保护机制以抵抗各种生物和非生物逆境胁迫,其中一种是产生活性氧(ROS),如超氧阴离子(O2-)、过氧化氢(H2O2)等。ROS在生物体内具有双重作用,一方面逆境下过度产生的活性氧对细胞具有毒害作用,另一方面,ROS可作为信号分子参与植物的生长发育和胁迫响应。NADPH氧化酶(NOXs)是产生ROS的关键酶,NADPH氧化酶gp91phox在哺乳动物吞噬细胞中被首次鉴定[1],与植物、真菌中发现的各种gp91phox同源物组成NOX家族,在植物中又被称为呼吸爆发氧化酶同源物(respiratory burst oxidase homologue,RBOH)[2]。RBOH蛋白活性与其结构密切相关,以往研究发现RBOH具有相同的功能结构,包括NADPH-Ox结构域(NADPH-Ox domain),类似于铁还原酶的跨膜成分(Ferric-reduct),FAD结合结构域(FAD-binding domain),NAD结合结构域(NAD-binding domain)和两个EF-hand保守基序。
植物中第一个被鉴定出来的gp91phox同源物为水稻OsRbohA[3],随后陆续在其他植物物种中鉴定出了更多的RBOH基因,如拟南芥[4]、水稻[5]、大麦[6]、苹果[7]和葡萄[8]中分别存在10个、9个、6个、9个和7个基因家族成员。据报道,植物呼吸爆发氧化酶同源物在植物发育、防御反应和激素信号转导中起着重要作用。以深入研究的模式生物拟南芥为例,鉴定出了10个AtRbohs(AtRbohA—AtRbohJ),AtRbohD和AtRbohF不仅在植物防御反应[9]和盐胁迫下Na+/K+稳态调节发挥重要作用[10],而且还参与重金属离子胁迫下的气体交换和离子稳态调节。通过使用CdCl2处理野生型和Atrbohs突变体拟南芥,发现AtRbohs基因功能丧失导致根系伸长区Cd2+流入升高,影响其气孔传导、蒸腾和抗氧化反应,在AtRbohD和AtRbohF突变体中最为明显[11]。除此之外,AtRbohD和AtRbohF还在拟南芥ROS依赖性ABA信号传导中起重要作用[12]。其他AtRbohs同样在拟南芥生长发育过程中扮演重要角色,如:AtRbohB是拟南芥种子发芽过程中ROS的主要生产者,在种子成熟后发挥重要作用[13];AtRbohC参与根毛或花粉管的尖端生长[14]。目前已对拟南芥RBOH基因的相关研究较为深入,而对其他植物RBOH基因的研究刚刚起步。
藜麦(ChenopodiumquinoaWilld.)属于苋科藜属,原产于安第斯山脉的一年生作物,是世界上最古老的栽培作物之一。藜麦种子富含氨基酸、脂质、维生素和矿物质等营养元素[15],而且具有耐盐碱、耐干旱等优良的抗逆性,近年来成为植物抗逆领域的研究热点材料之一。藜麦在抗逆和粮食安全方面展现出了巨大潜力,但未发现有CqRBOH基因功能研究的相关报道。本研究对藜麦9个CqRBOH基因的特征和功能进行分析,为进一步深入研究CqRBOH在非生物胁迫下的响应模式和信号通路作用机制提供一定的理论基础。
1 材料与方法
1.1 CqRBOH基因家族鉴定及理化性质分析
从藜麦基因组数据库(http://www.cbrc.kaust.edu.sa/chenopodiumdb/)中下载基因组文件。从Pfam(http://pfam.janelia.org/)网站中下载RBOH蛋白特征性的保守域[16],包括NADPH-Ox(PF08414)、Ferric-reduct(PF01794)、FAD-binding-8(PF08022)和NAD-binding-6(PF08030)的HMM模型,通过HMMER3.0软件在藜麦全基因组蛋白序列中搜索(E-value=1×e-10)候选蛋白。利用NCBI的Batch CD-Search工具(https://www.ncbi.nlm.nih.gov/cdd/)对候选RBOH蛋白保守结构域进行鉴定,去掉错误和重复成员。利用ExPASy(https://web.expasy.org)预测CqRBOH蛋白理化性质,通过Protcomp(http://linux1.softberry.com/berry)进行亚细胞定位预测。
1.2 CqRBOH蛋白系统进化分析
分别从拟南芥(https://www.arabidopsis.org/)、水稻(http://rice.uga.edu/)、玉米(https://maizegdb.org/)数据库下载RBOH基因编码的蛋白质序列,使用MEGA7中的ClustalW程序比对藜麦等4个物种的RBOH蛋白序列,比对结果通过邻近法(neighbor-joining,NJ)构建进化树,bootstrap值设为1000。
1.3 CqRBOH基因结构及其编码蛋白的保守基序、序列比对分析
利用基因结构显示工具GSDS2.0(http://gsds.cbi.pu.edu.cn/)对CqRBOH基因进行作图分析,确定其外显子-内含子结构;将鉴定出的CqRBOH蛋白序列导入MEME在线网站(http://meme-suite.org/tools/meme)进行保守基序(Motif)搜索,Motif个数设置为8个;采用DNAMAN v.8.0软件进行CqRBOH氨基酸多重序列比对。
1.4 CqRBOH基因顺式作用元件分析
通过藜麦参考基因组的基因组序列文件和基因注释信息文件,提取转录起始位点上游2000 bp的启动子序列,输入到PLANTCARE[17](http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测CqRBOH基因启动子的顺式作用元件分布和种类。
1.5 CqRBOH基因染色体定位及共线性分析
藜麦CDS和GFF和基因组序列数据来自ChenopodiumDB,利用共线性扫描工具包MCScanX[18]进行运行分析,使用TBtools工具绘制circos图[19]。
1.6 CqRBOH基因表达模式分析
藜麦RNA-Seq数据来源于NCBI中Sequence Read Archive(SRA)藜麦转录组测序结果(http://www.ncbi.nlm.nih.gov/sra),包括多种组织(登录号:SRP226463、SRP116149)和干旱、高温和盐胁迫下的根和芽(登录号:SRS1538629)。将TPM(每百万读取转录本)形式的RNA-seq数据进行归一化并进行log2转换,使用TBtools生成热图。
2 结果与分析
2.1 CqRBOH基因家族鉴定及理化性质分析
通过生物信息学方法从藜麦全基因组中鉴定筛选出9个CqRBOH基因(表1)。所编码蛋白的氨基酸数量在815(CqRBOH7)~955(CqRBOH8)aa之间;分子质量为93.58(CqRBOH7)~108.39(CqRBOH8)kU;等电点在8.98(CqRBOH7)~9.37(CqRBOH5)均大于7,判定为碱性蛋白;不稳定系数分析发现,只有CqRBOH7为稳定蛋白(系数小于40);平均亲水系数结果表明CqRBOH均为亲水蛋白(系数小于0)。通过Protcomp预测蛋白亚细胞定位,发现CqRBOH均定位于质膜上。
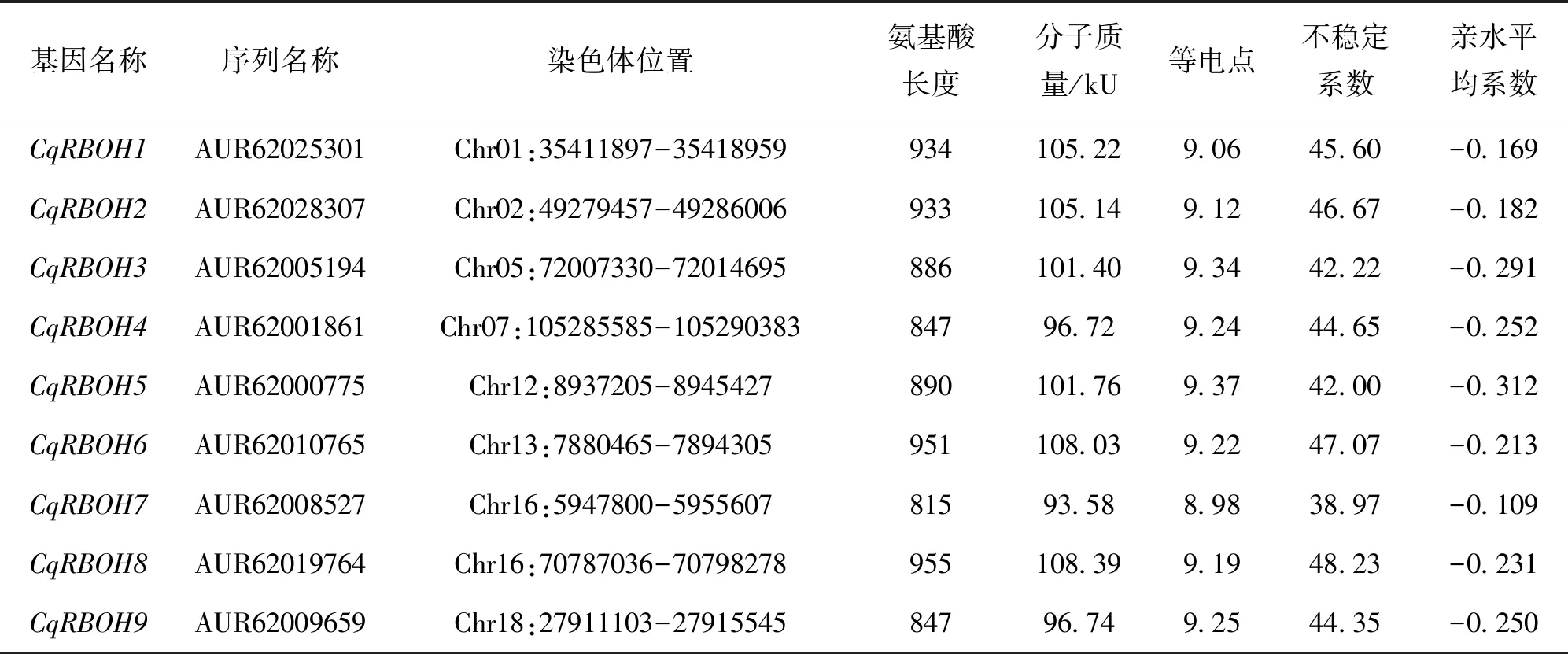
表1 CqRBOH基因及编码蛋白的基本特征
2.2 CqRBOH蛋白系统进化分析
为了研究CqRBOH蛋白与其他植物RBOH蛋白的进化关系,利用MEGA7.0对藜麦、拟南芥、水稻和玉米共43个RBOH蛋白序列构建NJ系统发育进化树(图1)。系统发育进化树将9个CqRBOHs、10个AtRBOHs、9个OsRBOHs、15个ZmRBOHs聚类为6个亚组(Class Ⅰ、Class Ⅱ、Class Ⅲ、Class Ⅳ、Class Ⅴ和Class Ⅵ),Class Ⅰ包含2个CqRBOH成员(CqRBOH3、CqRBOH5);Class Ⅳ包含3个CqRBOH成员(CqRBOH6、CqRBOH7、CqRBOH8);Class Ⅴ包含2个CqRBOH成员(CqRBOH4、CqRBOH9);Class Ⅵ包含2个CqRBOH成员(CqRBOH1、CqRBOH2);Class Ⅱ、Class Ⅲ不包含CqRBOH成员,推测可能是藜麦进化过程中谱系特异性基因缺失引起的。除CqRBOH7,其他CqRBOH成员在同一分支中成对存在,且拥有很高的bootstrap值,组成4组旁系同源蛋白,这主要是由于异源四倍体藜麦在进化过程中发生了全基因组复制而导致的。
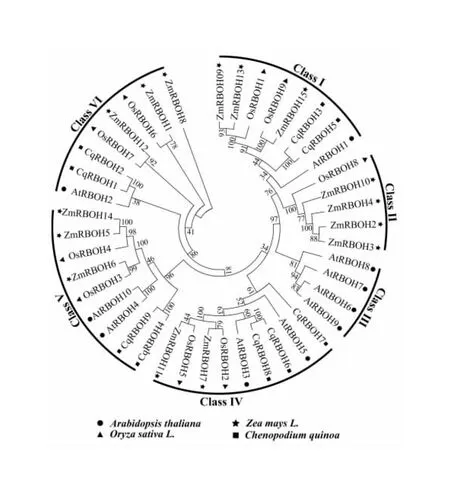
图1 藜麦和其他植物RBOH蛋白系统发育进化树
2.3 CqRBOH基因结构及其编码蛋白的保守基序、序列比对分析
根据内含子-外显子结构模式,将CqRBOH基因家族分为4个亚家族(红、蓝、黄、绿)(图2(a))。除CqRBOH7,进化树每一分支的RBOH基因成对存在,每一分支基因结构相似且内含子与外显子数量一致,表明同一分支中两个RBOH基因同源性很高。CqRBOH基因长度在4443 kb(CqRBOH9)~1 3841 kb(CqRBOH6)之间(图2(b)),不同的CqRBOH基因家族成员结构存在一定差异,除一个分支(CqRBOH3和CqRBOH5)RBOH基因外显子数量为10个,其他CqRBOH基因外显子数量均为14个。在一些CqRBOH基因中,外显子数量的增加似乎是内含子插入外显子区域的结果,而不是获取额外的外显子。CqRBOH蛋白保守基序(图2(c))分析表明,每个CqRBOH蛋白都包含8个Motif且种类数量一致,证明CqRBOH蛋白在进化过程中较保守。利用(图2(d))进一步分析保守基序序列,在确定的8个Motif中,Motif 1为FAD-binding结构域的一部分;Motif 3、5和8为NAD-binding结构域的一部分,该结构域与超氧化物的生成有关;Motif 2、4和7是类似于铁还原酶Ferric-reduct的一部分;Motif 6包含两个EF-hands基序,与Ca2+依赖的磷酸化有关,逆境胁迫下Ca2+作为第二信使,通过与EF-hand结合使RBOH激活,进而产生ROS,作为信号分子调控植物生长发育和胁迫应答反应。
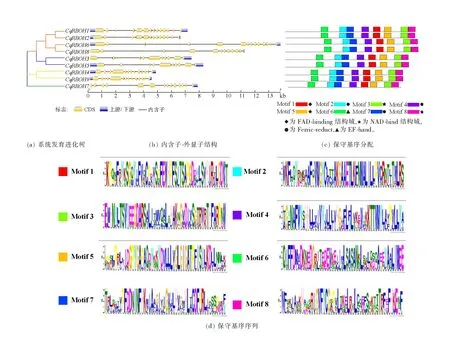
图2 CqRBOH基因结构及其编码蛋白的保守基序分析
对9个CqRBOH蛋白进行多重序列分析(图3),结果分析表明这些序列高度保守,包括N端区域的两个Ca2+结合EF-hands、6个跨膜结构域(TM1-6),以及C端区域的黄素腺嘌呤二核苷酸(FAD)、NAD-腺嘌呤(NADPH-adenine)和NADP-核糖(NADPH-ribose)保守结合位点。6个跨膜结构域(TM1-6)与拟南芥、水稻、玉米、大麦、马铃薯和烟草等植物Rbohs以及哺乳动物gp91phox中识别的结构域相对应,两个跨膜结构域(TM3和TM5)分别包含两对组氨酸残基(红色圆球标出)。研究发现,这些由两对间隔组氨酸残基组成的类似基序对人gp91phox蛋白中的血红素配位结合非常重要[20]。
2.4 CqRBOH基因顺式作用元件分析
顺式作用元件存在于基因启动子区域,可与转录因子结合调控下游基因的特殊基序。本研究分析了9个CqRBOH基因起始密码子上游2000 bp基因序列,鉴定出了多种顺式作用元件,详细信息见表2。结果显示,CqRBOH基因的光响应元件多达20多种,如GT1-motif、chs-CMA2a、AE-box、Box4等。除此之外,鉴定了9种激素响应元件,包括TATC-box、P-box、GARE-motif、ABRE、TGA-element、AuxRR-core、TCA-element、CGTAC-motif、TGACG-motif,分别反映了藜麦对赤霉素、脱落酸、生长素、水杨酸和茉莉酸甲酯的响应;还有一些关于非生物胁迫的响应元件,如MBS、LTR、TC-richrepeats、ARE和WUN-motif,它们与干旱、低温、防御和应激、无氧诱导和创伤应激有关。某些顺式作用元件还具有明显的特异性,如CAT-box、GCN4-motif分别参与藜麦分生组织和胚乳表达。总之,CqRBOH基因可能参与藜麦生长代谢和激素、胁迫应答,不同的CqRBOH启动子中存在不同种类和数量的顺势作用元件,表明在不同非生物胁迫和不同植物激素下存在不同的调控机制。
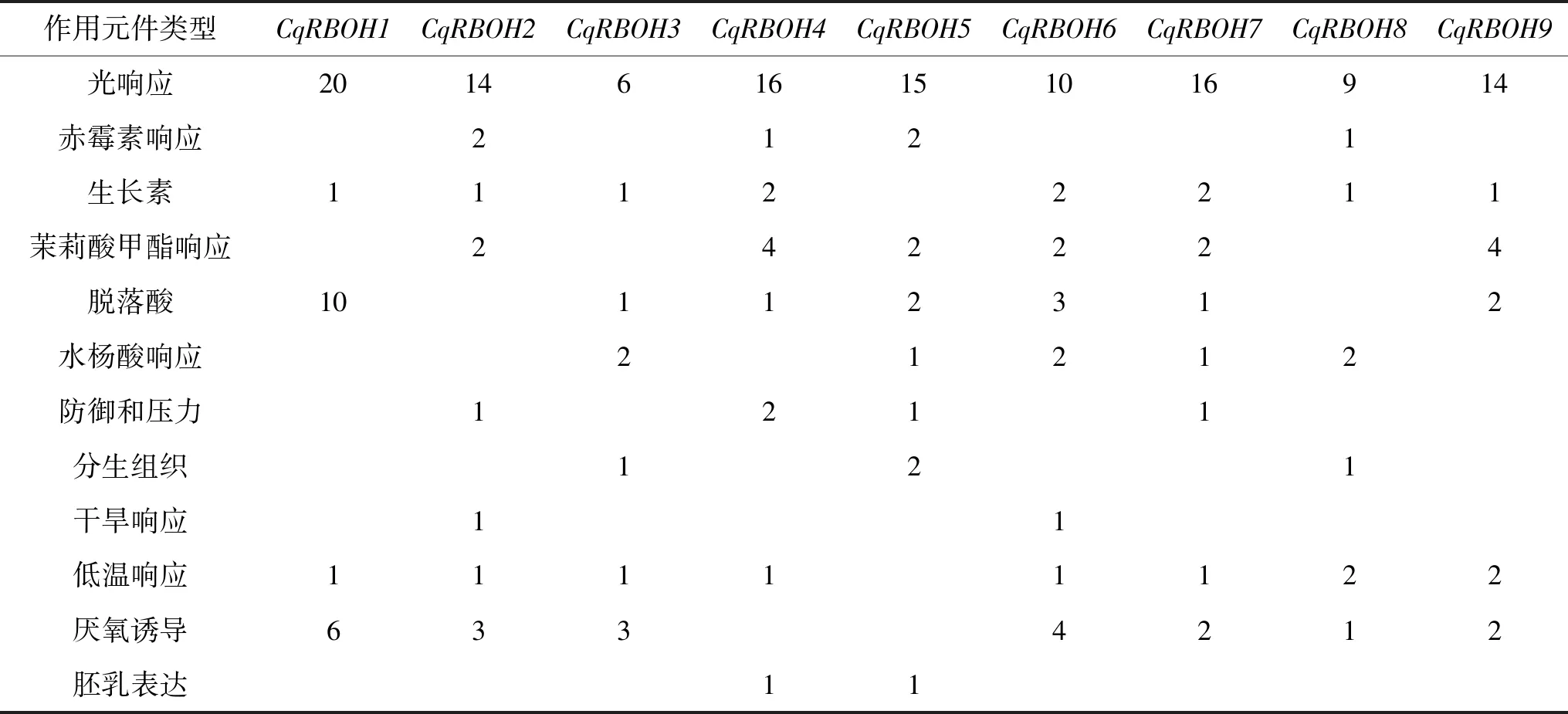
表2 CqRBOH基因启动子区顺式作用元件的种类和数量分布
2.5 CqRBOH基因染色体定位及共线性分析
通过共线性分析确定了CqRBOH基因在染色体上基因组位置和潜在的基因组复制事件。结果表明,9个CqRBOH基因分布在8条染色体上,其中Chr16包含两个CqRBOH基因(图4)。多倍体化、串联复制和片段复制是促进基因组进化和基因家族扩张的主要方式[21]。经共线性分析,3个基因共线性对(CqRBOH1/CqRBOH2、CqRBOH3/CqRBOH5、CqRBOH6/CqRBOH8)参与了片段重复,没有发现串联重复事件。此外,我们计算了这3对共线性基因的Ka和Ks之间的比例,进行选择压力分析(表3)。结果显示,Ka/Ks的值均小于1,表明CqRBOH基因受到纯化选择作用。
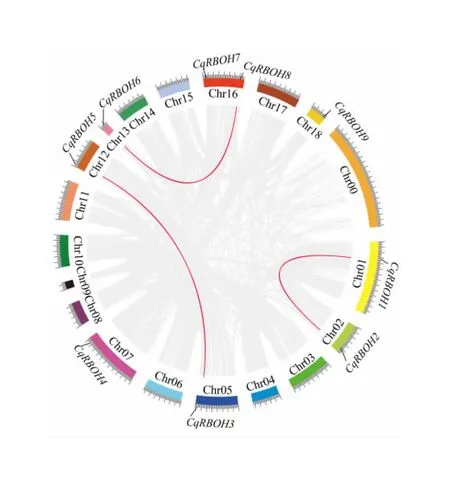
注:Chr00为未组装到藜麦亚基因组染色体的scaffolds

表3 CqRBOH基因的Ka/Ks
2.6 CqRBOH基因表达模式分析
为初步了解CqRBOH基因的功能,探究CqRBOH基因在藜麦生长发育中的作用,基于RNA-Seq数据分析了9个CqRBOH基因在不同组织器官表达情况(图5)。发现同一分支中的CqRBOH基因表达模式相似。两对CqRBOH基因(CqRBOH3/CqRBOH5、CqRBOH6/CqRBOH8)表达量达到可检测水平,CqRBOH3和CqRBOH5在不同器官组织中均有表达,尤其在藜麦幼苗中表达量极高,推测CqRBOH3和CqRBOH5是调控藜麦生长发育的关键基因。CqRBOH6和CqRBOH8在叶柄中中几乎不表达,但是在其它组织中表达量较高;CqRBOH4和CqRBOH9在所有组织器官中几乎不表达;CqRBOH5在顶端分生组织和叶柄中表达量较低,但是在其它组织中表达量很高,表明CqRBOH基因具有组织表达特异性。CqRBOH基因对干旱、高温和盐胁迫响应模式分析结果如图5所示,在地上部分(图6(a))中,CqRBOH5和CqRBOH7在干旱、高温和盐处理下表达水平均下降,CqRBOH3仅在干旱处理下表达水平下降。在地下部分中(图6(b)),CqRBOH3和CqRBOH5基因表达水平很高,但是对干旱、高温的响应不明显,CqRBOH4在高温处理下表达水平上升。CqRBOH6、CqRBOH7和CqRBOH8在干旱高温处理下表达水平均上调,但在盐胁迫下无明显变化。

图5 CqRBOH基因在不同组织中的表达模式分析
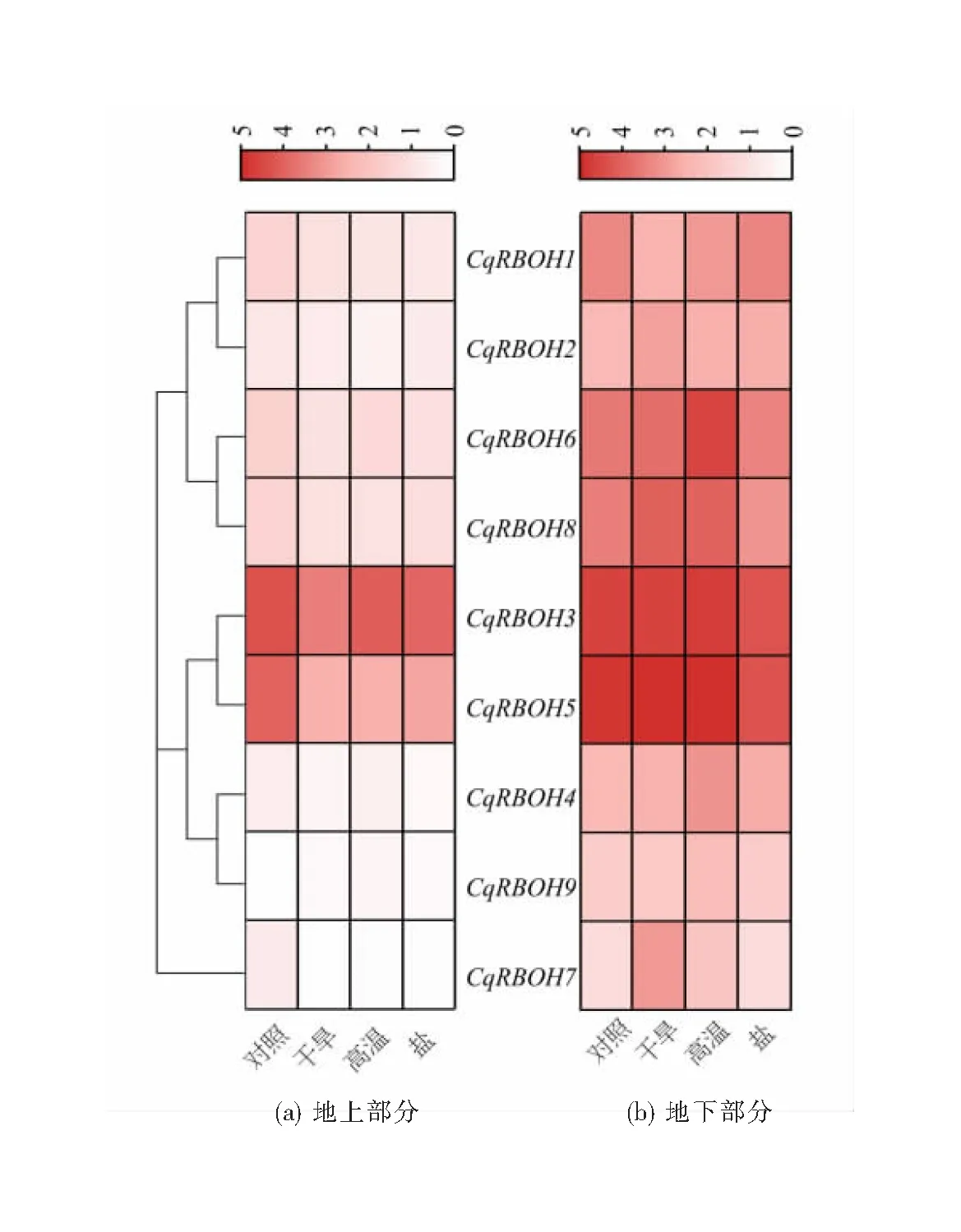
图6 非生物胁迫下CqRBOH基因在不同组织中的表达
3 讨 论
本研究从藜麦基因组中鉴定出9个CqRBOH基因,分布在Chr01、Chr02、Chr05、Chr07、Chr12、Chr13、Chr16和Chr18这8条染色体上,3对基因对参与片段重复,表明片段复制在CqRBOH基因家族扩张中起到重要作用。Ka/Ks被认为是决定选择压力类型[22]的指标,藜麦共线性基因对间Ka/Ks均小于1且比例不同,说明这些基因在复制后经历了不同程度的纯化选择。亚细胞定位预测结果显示,藜麦与拟南芥和水稻相同,所有RBOH基因都定位在质膜上。在拟南芥、水稻、大麦中,除了AtRbohD包含8个外显子和OsRbohD包含15个外显子,大多数植物RBOH基因外显子数量在10~14之间,这与藜麦内含子-外显子结构模式一致。不同植物RBOH蛋白的系统发育树显示,CqRBOH与AtRBOH亲缘关系更密切,这与它们同是双子叶植物的事实一致。此外,聚集在同一组中的同源物可能涉及相似的功能,这需要进一步的实验分析来证实这一点。氨基酸多重序列比对分析发现均存在2个EF-hands,6个TMs和FAD、NADPH结合位点,这些结构同样也存在于其他植物物种中。有关研究发现[23],哺乳动物吞噬细胞gp91phox缺少EF-hand结构,因此植物NADPH氧化酶的调控途径与哺乳动物吞噬细胞不同,植物RBOH蛋白的调节主要通过翻译后修饰来进行调控,如Ca2+与EF-hand基序结合并磷酸化依赖性蛋白激酶[24]、丝裂原活化蛋白激酶[25]。从顺式作用元件预测结果来看,9个CqRBOH基因的启动子均含有大量光响应元件。除CqRBOH5外,其他CqRBOH启动子均含有生长素响应元件。CqRBOH1启动子含有10个脱落酸响应元件(ABRE),表明CqRBOH1可能在藜麦脱落酸信号传导中起着重要作用。
对9个CqRBOH基因组织表达特异性和非生物胁迫下表达模式进行分析。CqRBOH基因表现出组织表达特异性,CqRBOH3和CqRBOH5在幼苗中有极高表达,但在叶柄中表达不显著。据报道,玉米、水稻等其他物种中RBOH基因也存在组织表达特异性。如OsRbohD在愈伤组织中高表达,但是在穗中的表达十分微弱[26];ZmRbohF在初生根显示出高表达,而在顶端叶表达量非常低[27]。值得注意的是,CqRBOH3和CqRBOH5在藜麦未成熟种子中有高表达,并且它们与AtRbohB(本文将该基因命名为AtRBOH1)具有高度同源关系(图1),有人认为AtRbohB产生的ROS在蛋白质氧化和通过细胞壁松动而引起的种皮和胚乳机械破裂中起到重要作用,因此推测CqRBOH3、CqRBOH5与AtRbohB的功能相似,它们与藜麦种子萌发密切相关[28],这一结果与麻风树JcRbohB在种子中高度表达一致[29]。除此之外,CqRBOH3在白甜藜花中显著表达,而在苦黄藜花中表达不显著,表明CqRBOH在同一物种不同品种的表达模式存在一定多样性。在高温胁迫下,CqRBOH4和CqRBOH6在地下部分表达水平显著上调,CqRBOH2和CqRBOH7在干旱处理下显著上调,说明它们可能参与藜麦地下部分对高温、干旱胁迫的响应。RBOH基因除了响应高温、干旱胁迫外,还参与低温胁迫下的调控[8]。在低温胁迫下,草莓FvRbohA和FvRbohD对冷胁迫反应迅速,转录水平提高;草莓幼苗NADPH氧化酶活性在早期急剧上升,随后略有下降,但与0 h相比仍保持较高水平。
本实验综合分析了CqRBOH基因的理化性质、基因结构和蛋白基序、系统发育关系、转录表达模式等,为CqRBOH基因功能研究奠定理论基础,对藜麦分子育种和遗传改良具有指导意义。
