基于DNA桥连氧化石墨烯的Fpg荧光检测
2023-10-12杜佳原,邢逸飞,赵慧敏
杜 佳 原, 邢 逸 飞, 赵 慧 敏
(大连理工大学 环境学院 工业生态与环境工程教育部重点实验室,辽宁 大连 116024 )
0 引 言
紫外线、电离辐射等外源因素和脂质过氧化产物、甲基化剂等内源因素[1]均会导致机体发生氧化应激,引起活性氧(ROS)的异常产生与释放[2].而过量的ROS会攻击脱氧核糖核酸(DNA)的化学结构,造成一定程度的DNA氧化损伤.其中,在碱基修饰中研究最为广泛的是鸟嘌呤(G)损伤,这一过程是将鸟嘌呤转变为8-氧鸟嘌呤(8-oxoG).如果不对其进行修复,在DNA复制过程中就无法保证基因组的完整性[3-5].这样不仅会引起细胞衰老和死亡,甚至会造成细胞的癌变[6-7].然而,细胞会分泌DNA糖基化酶,特异性地识别并切除特定的受损碱基[8-10].其中,甲酰胺嘧啶DNA糖基化酶(Fpg)可以特异性识别并切除8-oxoG碱基.但Fpg活性的失常会导致8-oxoG碱基切除受阻,因此,对Fpg的酶活性和浓度进行测定与评估可以反映鸟嘌呤受损程度,为污染物毒性效应评价提供技术手段.
Fpg的常规定量检测方法有酶联免疫吸附法[11]、高效液相色谱法[12]、彗星实验[13]和凝胶电泳法[14]等.目前已经开发出其他简便快捷的方法,例如比色法[15]、电化学法[16]和荧光法[17-19]等.其中荧光检测Fpg的方法具有较强的特异性和选择性等优点,已得到广泛应用.但该方法仍存在需要多酶协同、反应较为复杂、耗时较长和背景值高等不足之处.
近几年来,氧化石墨烯在荧光传感领域被广泛应用[20-21].单链DNA可通过π-π堆积作用及静电作用固定在氧化石墨烯表面,且两者相互作用力较强.由于氧化石墨烯具有较大的比表面积和较强的荧光淬灭性能,可以提供更多的附着位点,从而连接大量单链DNA并淬灭单链DNA上标记的荧光染料(如FAM基团),因此本文利用氧化石墨烯固定单链DNA作用力强度不同的原理,构建简单快速灵敏的检测Fpg的荧光传感方法.
1 实验材料与方法
1.1 实验试剂与仪器
(1)实验试剂
浓硫酸(H2SO4,>98%)、石墨粉(化学纯)、高锰酸钾(KMnO4,分析纯)、硝酸钠(NaNO3,≥99%)、过氧化氢(H2O2,30%)购于天津市大茂化学试剂厂,三(羟甲基)氨基甲烷(Tris,>99%)、氯化钠(NaCl,≥99%)、六水氯化镁(MgCl2·6H2O,≥98%)、核糖核酸酶A(RNase A)购于生工生物工程(上海)股份有限公司,甲酰胺嘧啶DNA糖基化酶、尿嘧啶DNA糖基化酶(UDG)、人源脱嘌呤脱嘧啶核酸内切酶1(APE 1)、核糖核酸酶Ⅰ(RNase Ⅰ)、10× NEBuffer 1(10 mmol/L双(2-羟基乙胺基)三(羟甲基)甲烷盐酸盐、10 mmol/L MgCl2、1 mmol/L二硫苏糖醇)、10 mg/mL牛血清蛋白(BSA)均购于New England Biolabs公司.胎牛血清购于美国Gibco公司.实验所用的Tris-HCl缓冲溶液含有20 mmol/L Tris、200 mmol/L NaCl、10 mmol/L MgCl2·6H2O(pH=7.0).实验所用超纯水均为科瑞峰实验超纯水系统产生.实验所用器材与用水均通过蒸汽灭菌锅灭菌.寡核苷酸链购于生工生物工程(上海)股份有限公司,其序列为5′-C*G*A*CCGGCTCGGAGTA/i8oxodG/GA*A*T*G-FAM-3′,并将其命名为T1链.
(2)实验仪器
通过扫描电子显微镜(SEM,Hitachi,S-4800)对氧化石墨烯的表面微观形貌进行表征;通过傅里叶变换红外光谱仪(FTIR,ThermoFisher 6700)对材料的官能团进行表征;采用荧光光谱仪(Hitachi,F7000)检测反应体系的荧光强度;采用CBS可调式单/双面垂直电泳槽(美国C.B.S.公司)对核酸进行凝胶电泳,并通过多功能激光成像仪(Amersham Typhoon)进行凝胶成像.
1.2 氧化石墨烯的制备
本实验采用Hummers法制备氧化石墨烯,主要过程如下:将23 mL浓硫酸置于锥形瓶中并搅拌,将1 g石墨粉与0.5 g NaNO3混合后加入锥形瓶中,再将3 g KMnO4分多次加入锥形瓶中,在低于20 ℃下反应2 h,升温至35 ℃反应30 min;向锥形瓶中加入46 mL H2O,升温至98 ℃,反应20 min,溶液变为棕黄色,再向锥形瓶中加入5 mL H2O2,溶液呈亮黄色,室温下搅拌30 min,最后用水离心洗涤数次,直至上清液呈中性且不含硫酸根.
1.3 Fpg的检测
具体的实验方案如下:将T1链(50 nmol/L)加入不同浓度的Fpg在37 ℃下恒温反应100 min,反应结束后加入氧化石墨烯的水溶液(15 μg/mL),振荡混匀,室温下混合10 min,反应总体积为100 μL.将反应后溶液与Tris-HCl缓冲溶液进行混合,转入石英比色皿中,测量其荧光强度.设置激发波长为494 nm,记录发射光谱在504~600 nm的数据,将激发和发射的狭缝设置为10 nm.所有荧光实验均重复3次,并计算误差棒.具体实验原理如图1所示.
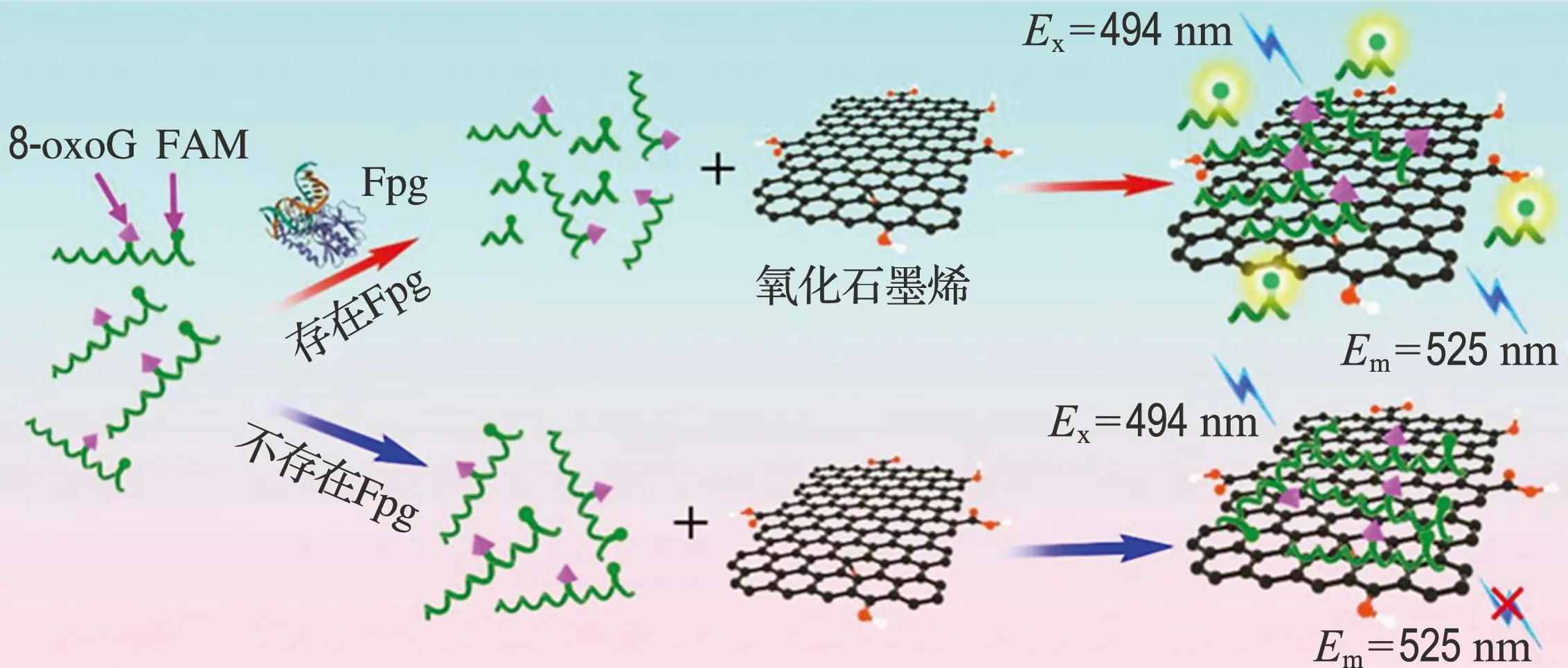
图1 Fpg荧光传感原理示意图
1.4 凝胶电泳分析
为验证实验原理的可行性,将4 μL 1 μmol/L的T1链与不同浓度梯度的Fpg(20、40、60、80、100 U/mL)、5 μL 10× NEBuffer 1、5 μL 1 mg/mL BSA进行混合,37 ℃反应1.5 h,反应总体积为50 μL.反应结束后,取10 μL酶切产物进行15%非变性聚丙烯酰胺凝胶电泳,在预先配制的1× TBE缓冲溶液(9 mmol/L Tris-HCl,9 mmol/L H3BO3,1 mmol/L EDTA,pH 8.0)中以及在恒电流36 mA条件下电泳90 min.电泳结束后,采用Amersham Typhoon凝胶成像系统对凝胶进行成像,观察酶切产物的条带.
2 结果与讨论
2.1 氧化石墨烯形貌表征


(a) 所选区域的SEM图

图4 氧化石墨烯的EDS谱图

图5 氧化石墨烯的FTIR谱图
2.2 检测原理分析
将带有8-oxoG碱基的单链DNA与Fpg进行反应.Fpg能够特异性识别并切除8-oxoG碱基,从而产生两条酶切产物链,其中一条连接了FAM染料且碱基数目较少.反应结束后加入氧化石墨烯.由于短链DNA(5个碱基)对氧化石墨烯的连接能力较弱,携带荧光基团的短链DNA将被释放出来,且不能被氧化石墨烯淬灭,从而表现出较强的荧光信号.
为证明上述检测原理,首先对DNA+GO、DNA+Fpg+GO与空白缓冲溶液进行荧光检测.各样品的荧光强度F如图6所示.其中DNA+GO荧光强度较低,DNA+Fpg+GO荧光强度较高,而空白缓冲溶液基本没有荧光信号.荧光强度测试结果表明,Fpg可以切除8-oxoG碱基,使得T1链断裂为两部分,带有FAM基团的短链片段对氧化石墨烯的连接能力较弱,不能将其荧光淬灭.

图6 不同反应体系的荧光光谱图
随后,对酶切产物进行电泳分析,其电泳结果如图7所示.结果表明随着Fpg浓度(A(Fpg))的逐渐增大(由20 U/mL增大到100 U/mL),T1链(图中第一行条带)的浓度逐渐减小,酶切反应后释放的带FAM基团短链片段(图中最后一行条带)浓度逐渐增大.而第一列只含有T1链的条带,均表明Fpg能够特异性识别并切除8-oxoG碱基,产生带FAM基团的短链片段.电泳结果与荧光检测结果保持一致,进一步证实了荧光基团通过DNA桥接氧化石墨烯实现Fpg定量检测的机理.

图7 不同Fpg浓度下酶切产物的非变性聚丙烯酰胺凝胶电泳分析
2.3 反应条件优化
为达到更好的检测效果,本文对氧化石墨烯的浓度和酶切反应时间等关键因素进行优化.
因为实验利用了氧化石墨烯高效淬灭FAM荧光基团的能力,所以优化氧化石墨烯的浓度(ρ(GO))至关重要.首先对氧化石墨烯浓度进行优化,将不同浓度(5~30 μg/mL)的氧化石墨烯加入总体积为100 μL的反应体系中,测量混合物的荧光强度.如图8(a)所示,在氧化石墨烯浓度为5~15 μg/mL内,荧光淬灭效率(F0-F1)/F0随着氧化石墨烯浓度的增大而增高.当氧化石墨烯浓度为15 μg/mL时,荧光淬灭效率达到0.85以上,随后基本保持不变,因此在后续实验中将氧化石墨烯浓度设定为15 μg/mL.

(a) 氧化石墨烯浓度
由于酶切反应直接影响荧光响应,而酶切反应时间为关键因素,因此对酶切反应时间进行优化,测量不同酶切反应时间下混合物的相对荧光强度Fr,如图8(b)所示.结果表明随着酶切反应时间的增加(20~100 min),样品的荧光信号逐渐增强.考虑到快速检测的需求,将酶切反应时间设定为100 min.
2.4 Fpg定量分析
在最佳实验条件下,对该传感器的检测性能进行测试.向体系中加入不同浓度的Fpg,并检测其荧光强度.如图9所示,在Fpg浓度为0~20 U/mL时,体系中的荧光强度随着Fpg浓度的增大而增高.这是由于Fpg的浓度越大,在一定时间内被切割的T1链越多,释放出的T1链的3′端携带FAM基团的片段就越多.因为短链片段对氧化石墨烯的连接能力非常弱,这些片段上的FAM基团就不会被氧化石墨烯所淬灭,只有未被切割的T1链能够被氧化石墨烯所淬灭,所以造成体系的荧光信号逐渐增强.实验发现当Fpg的加入量在0~0.4 U/mL时,Fpg的浓度与荧光强度呈线性关系(图9插图).经拟合后得到的线性回归方程为y=1 181x+703.4,相关系数R2为0.988,其中y代表荧光强度,x代表Fpg的浓度(U/mL).经计算,该荧光传感方法的检出限(LOD)为0.014 U/mL.与已有的Fpg检测文献相比(表1),本文构建的传感器的LOD低于滚环扩增(RCA)和磁性纳米探针协同荧光法[18]、DNAzyme循环切割分子信标(MB)级联放大荧光法[23]、含有8-oxoG:PdC碱基对的双链探针荧光法[24]和精胺钌为探针的电化学发光法[25].

表1 DNA桥连氧化石墨烯基荧光传感器与其他检测方法的性能对比
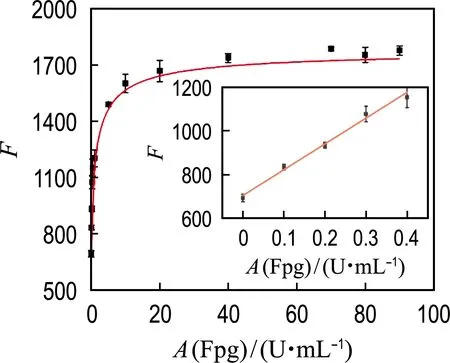
图9 荧光强度与Fpg浓度的关系
2.5 特异性分析
选用RNase A、UDG、APE 1、RNase Ⅰ来评价该方法对检测Fpg的特异性,RNase A能催化降解RNA,UDG能水解单链或双链上的尿嘧啶,APE 1能够水解断裂AP位点,RNase Ⅰ可以去除DNA中的腺嘌呤核糖核苷酸(rA).在体系中加入相同浓度(60 U/mL)的上述各种酶,测量混合体系的相对荧光强度.由图10可知,仅加入Fpg时,荧光强度显著增强,其他对照组的荧光信号均较低.这表明仅有Fpg可以识别并切除8-oxoG碱基,由于T1链3′端携带FAM基团的短链片段对氧化石墨烯的连接能力弱,从而使得这些短链片段游离在溶液中,造成溶液的荧光信号显著增强,从而实现Fpg的定量检测.结果表明,本实验对Fpg的定量检测具有良好的选择性和可靠性.
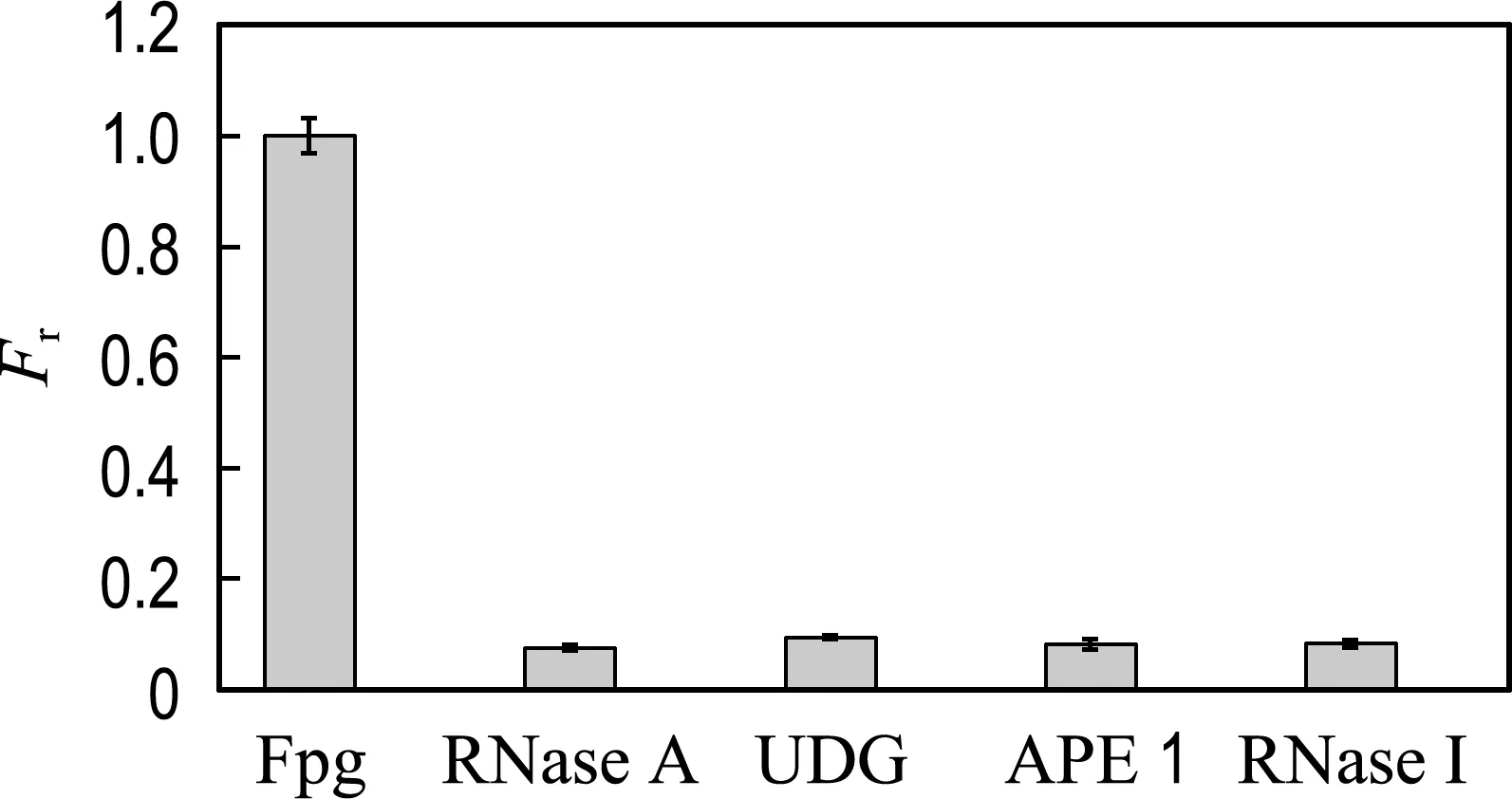
图10 不同干扰物质对Fpg检测的影响
2.6 实际样品中Fpg检测
采用加标回收法对稀释后胎牛血清中Fpg进行检测,将不同浓度的Fpg加入稀释的胎牛血清体系中.如表2所列,在线性检测范围内Fpg的回收率为93.5%~111%,相对标准偏差为1.7%~2.5%,表明该方法能够较为可靠地检测Fpg活性.

表2 稀释胎牛血清中Fpg活性的检测
3 结 语
本文基于不同长度单链DNA桥连氧化石墨烯能力不同的原理构建了一种快速、简便的Fpg荧光传感方法.利用SEM、EDS和FTIR等技术对Hummers法合成的氧化石墨烯进行表征,荧光法和电泳法证明反应机理.随后对氧化石墨烯的浓度和酶切反应时间进行优化.在最佳反应条件下对Fpg进行定量检测,该传感器检测的线性范围为0~0.4 U/mL,检出限为0.014 U/mL,且具有较高灵敏度.采用加标回收法对稀释后胎牛血清中的Fpg进行检测,回收率为93.5%~111%,相对标准偏差为1.7%~2.5%.该方法的建立为Fpg的简便灵敏检测提供了新方法,为评价DNA氧化损伤、污染物毒性提供了技术支持.
