关节腔注射负载Dickkopf-3 的温敏羟丁基壳聚糖水凝胶对大鼠骨关节炎的影响
2023-10-12赵之栋高划一李众利
郭 正,赵之栋,高划一,李众利
解放军总医院第一医学中心骨科,北京 100853
骨关节炎(osteoarthritis,OA)是一种以关节软骨退变、滑膜炎症、骨赘形成和软骨下骨重塑为特征的慢性退行性疾病,是造成关节疼痛和功能丧失的主要原因[1-2]。软骨细胞的改变是OA 进展的核心,暴露于炎性细胞因子等不利因素的肥大软骨细胞释放基质金属蛋白酶-13(matrix metalloproteinase-13,MMP-13)、血小板反应蛋白解整合素金属肽酶-5(a disintegrin and metalloproteinase with thrombospondin motifs-5,ADAMTS-5)等细胞外基质分解酶打破软骨基质合成与分解的平衡,导致软骨组织的破坏[3]。有证据表明,Wnt 信号通路的过度激活是OA 进展的关键因素之一[4]。
Dickkopf 相关蛋白3(Dickkopf-3,DKK3)是一种Wnt 通路抑制剂,已被报道在不同程度的OA 患者异常重塑的软骨下骨中与Wnt 通路的核心蛋白β-连环蛋白发挥拮抗作用,且在OA 软骨、滑膜、滑液中的水平均有升高[5-6]。有研究发现DKK3 抑制炎性细胞因子介导的人和牛软骨外植体蛋白聚糖和胶原蛋白的损失,并认为DKK3 在疾病中的上调可能是抵消疾病相关细胞信号通路失调的防御机制[6]。总的来说,DKK3 有治疗OA 的潜力,但缺乏直接作用于生物体内改善OA 的证据。全身使用DKK3 可能造成未知的不良反应,为了验证其在OA 进展中的治疗作用,迫切需要开发合适的制剂和使用方法。
关节腔为关节囊滑膜层与关节面共同围成的密闭腔隙[7]。针对OA 的治疗,关节腔注射可以减少药物脱靶,避开生理屏障,提高生物利用度。然而,药物在关节腔内被迅速清除至作用浓度以下,为了取得理想的效果需要频繁进行注射,感染风险随之增加[8]。原位凝胶是一类以溶液状态给药后,立即在用药部位发生相变,转变为半固态凝胶的制剂。负载其中的药物缓慢释放,将药物浓度保持在治疗窗口内,从而减少给药频率,提高患者依从性[9]。原位凝胶制剂常选用状态随着环境变化而变化的聚合物材料来制备。
壳聚糖是一种正电性天然多糖,具有良好的生物相容性、生物降解性、抑菌性,无毒性,低免疫原性,在药物递送领域受到广泛关注[10]。常温下,壳聚糖既不溶于水,也不溶于普通的有机溶剂,限制了其应用[11]。羟丁基壳聚糖(hydroxybutyl chitosan,HBC)是对壳聚糖分子链的羟基和氨基进行羟丁基化的衍生物,除壳聚糖的固有属性外,还具有水溶性和温敏性,环境温度低于相变点时为透明溶液,环境温度高于相变点时形成水凝胶,具备极佳的载药和药物缓释能力[12-13]。
本研究将DKK3 装载于HBC 温敏凝胶系统中用于大鼠膝关节腔注射,使其缓慢释放,评估其对骨关节炎的改善作用。
材料与方法
1 实验动物、仪器与试剂 雄性SD 大鼠购于维通利华。重组DKK3 和抗体购于ABclonal 公司,磷酸盐缓冲溶液(phosphate buffered solution,PBS)和多聚甲醛购于Servicebio 公司,酶联免疫实验(enzyme-linked immunosorbent assay,ELISA)试剂盒购于Cloud-Clone 公司,Ⅱ型胶原酶购于Sigma公司,胎牛血清和α-MEM 培养基购于Gibco 公司,Cell Counting Kit-8(CCK-8)购于Dojindo 公司,显微计算机断层扫描(micro-computed tomography,Micro-CT)设备购于Siemens 公司。
HBC 水溶液由惠众国际医疗器械(北京)有限公司提供,其制备方法如下。将壳聚糖碱化,分散在异丙醇-水中,并与1,2-环氧丁烷混合。在室温下反应96 h 后,除去过量的烷化剂和未反应的部分,用丙酮彻底洗涤样品并在50℃真空中干燥。最后,将样品溶解在去离子水中以制备2 wt%HBC 水溶液,并在4℃储存直至使用。4℃温和搅拌下,将浓缩的DKK3 添加到HBC 溶液中以产生负载DKK3 的HBC(DKK3-loaded HBC)溶液(250 ng/mL),4℃保存以备使用。
2 评估凝胶形成时间 将装有DKK3-loaded HBC溶液的离心管分别浸泡在17℃、22℃、27℃、32℃、37℃、42℃恒温水浴中,观察到没有可流动液体表明DKK3-loaded HBC 溶液成功形成凝胶,记录所需时间。
3 DKK3-loaded HBC 水凝胶的体外释放 将3 mL DKK3-loaded HBC 溶液加入6 孔板中,于37℃固化,将DKK3-loaded HBC 水凝胶浸入3 mL PBS中作为释放介质,并在37℃环境孵育。分别在1 h、6 h、24 h、48 h、72 h、96 h、120 h、144 h、168 h后收集3 mL 释放介质,并使用新鲜PBS 替换以保持体积恒定。根据制造商说明进行ELISA 测定每个时间点DKK3-loaded HBC 水凝胶中DKK3 的释放,并计算体外累积释放量。
4 细胞毒性实验 使用Ⅱ型胶原酶消化接受全膝关节置换术OA 患者的胫骨平台宏观正常区域以获得原代人软骨细胞。使用添加15%胎牛血清的α-MEM 培养基于5% CO2、37℃恒温培养箱培养软骨细胞,每2 d 更换1 次培养液。
将HBC 溶液以1∶4 的比例浸入α-MEM 培养基中24 h,收集其上清液作为100% HBC 浸取液,并分别稀释为25%和50% HBC 浸取液。使用DKK3(250 ng/mL)或不同浓度的HBC 浸取液培养黏附在96 孔板(104/孔)的软骨细胞,并在1 d、3 d、5 d 和7 d 后使用20 µL CCK-8 溶液和180 µL培养基替换,37℃孵育1 h 后,使用酶标仪测量其在450 nm 波长的光密度(optical density,OD)并计算相对增长率(实验组与未经DKK3 或HBC 浸取液处理组的平均OD 值的比值;relative growth rate,RGR)[14]。
5 动物模型制备 将24 只8 周龄的雄性SD 大鼠(维通利华)随机分为4 组:假手术组(Sham)、OA 模型组(OA Model)、OA+DKK3 组和OA +DKK3-loaded HBC 组,每组各6 只。腹腔注射2%戊巴比妥钠(45 mg/kg)麻醉并切开关节囊后,对OA Model、OA +DKK3 和OA +DKK3-loaded HBC 组大鼠右膝关节行前交叉韧带离断术,抽屉试验阳性是造模成功的标志。术后4 周,假手术组和OA 模型组大鼠关节腔注射0.1 mL PBS,OA +DKK3 和OA+DKK3-loaded HBC 组大鼠关节腔注射0.1 mL DKK3 或DKK3-loaded HBC。所有4 组大鼠每周注射1 次,持续3 周。
6 大鼠步态分析 使用步态分析系统CatWalk XT(Noldus)评估大鼠的运动功能。训练大鼠自发通过玻璃跑道向终点移动,步态分析系统检测并记录大鼠脚印,从而计算与脚印大小、时间和脚印之间距离等相关的统计信息。
7 Micro-CT 扫描大鼠膝关节 使用戊巴比妥钠(100 mg/kg)腹膜内过量麻醉处死大鼠,分离右膝关节并通过4%多聚甲醛固定后使用micro-CT 扫描样本。参数:电压70 kV,电流114 µA,分辨率25 µm/pixel。
8 组织学分析大鼠膝关节切片 将样本脱钙后嵌入石蜡块中,冠状位切片(5 µm)。进行苏木精-伊红(hematoxylin and eosin,HE)染色。使用国际骨关节炎研究学会(Osteoarthritis Research Society International,OARSI)评分量化关节软骨退变和破坏[15]。所有样本由2 名骨科专业观察者独立打分。
使用免疫组织化学(immunohistochemical,IHC)技术对MMP-13、Ⅱ型胶原α1(collagen typeⅡ alpha 1,COL2A1)、ADAMTS-5 和蛋白聚糖(aggrecan,ACAN)进行染色并计算其阳性面积比例以指示其表达水平。
结 果
1 DKK3-loaded HBC 溶液在37℃快速凝胶 环境温度为4℃时,HBC 和DKK3-loaded HBC 为澄清透明的溶液。37℃时,HBC 转变为透明凝胶,DKK3-loaded HBC 为乳白色凝胶(图1)。17℃恒温水浴下,DKK3-loaded HBC 溶液经过约1 min转变为半固态;升高温度缩短了凝胶时间,37℃时仅用时约10 s(图2),即关节腔中DKK3-loaded HBC 溶液可以在10 s 内形成水凝胶。

图1 4℃溶液状态和37℃水凝胶状态的HBC 和DKK3-loaded HBCFig.1 HBC and DKK3-loaded HBC in solution state at 4℃ and in hydrogel state at 37℃
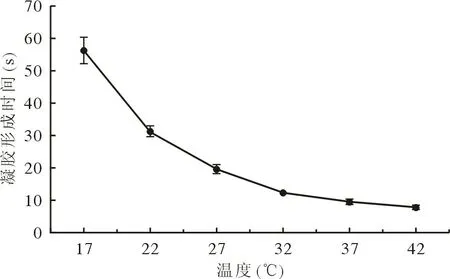
图2 温度对DKK3-loaded HBC 水凝胶形成时间的影响Fig.2 Effect of temperature on the DKK3-loaded HBC hydrogel formation
2 DKK3 从水凝胶中平稳释放 如图3 所示。DKK3 在24 h 内快速释放约40%,72 h 释放约60%,接下来释放速率趋于平稳,168 h 时90%的DKK3 从HBC 水凝胶中释放出来。结果表明,DKK3被有效包封在HBC 凝胶中,在24 h 内快速释放并平稳释放168 h。

图3 DKK3 从HBC 水凝胶中随时间的累积释放Fig.3 In vitro cumulative release of DKK3 from DKK3-loaded HBC hydrogel
3 HBC 浸取液不影响软骨细胞活力 培养1 d、3 d、5 d 和7 d 后,暴露于DKK3 或HBC 浸取液的所有软骨细胞RGR 均大于90%(图4)。结果表明,DKK3 和HBC 浸取液仅有极轻微的细胞毒性,对软骨细胞活力无显著影响。
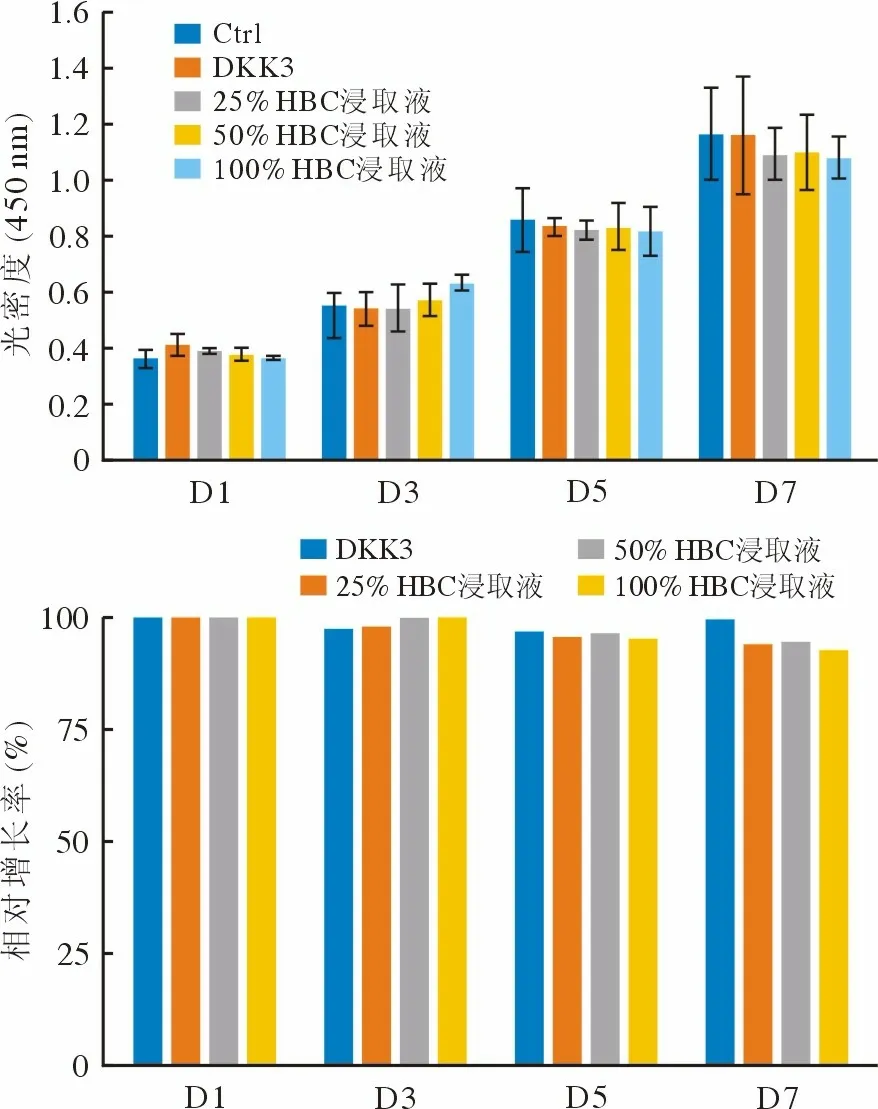
图4 DKK3 或HBC 浸取液干预的软骨细胞活性Fig.4 Chondrocyte viability treated by DKK3 or HBC extraction solution
4 DKK3-loaded HBC 改善OA 大鼠步态 DKK3和DKK3-loaded HBC 对ACLT 诱导的大鼠步幅的缩短有着程度相当的改善(P<0.0001);DKK3-loaded HBC 提高了大鼠通过跑道的平均速度(P<0.05)。DKK3-loaded HBC 相比DKK3 更大程度地改善了造模引起的大鼠后爪与地面接触时间的缩短(P<0.05)(图5)。
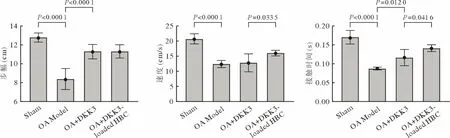
图5 DKK3-loaded HBC 治疗对OA 大鼠步态的影响Fig.5 Effect of DKK3-loaded HBC treatment on gait of OA rats
5 DKK3-loaded HBC 减少OA 大鼠骨和软骨破坏 Micro-CT 显示造模导致关节表面粗糙,软骨下骨和髌骨似骨质溶解表现,大量骨赘产生,半月板损伤,这些改变被DKK3 和DKK3-loaded HBC不同水平地抑制(图6)。
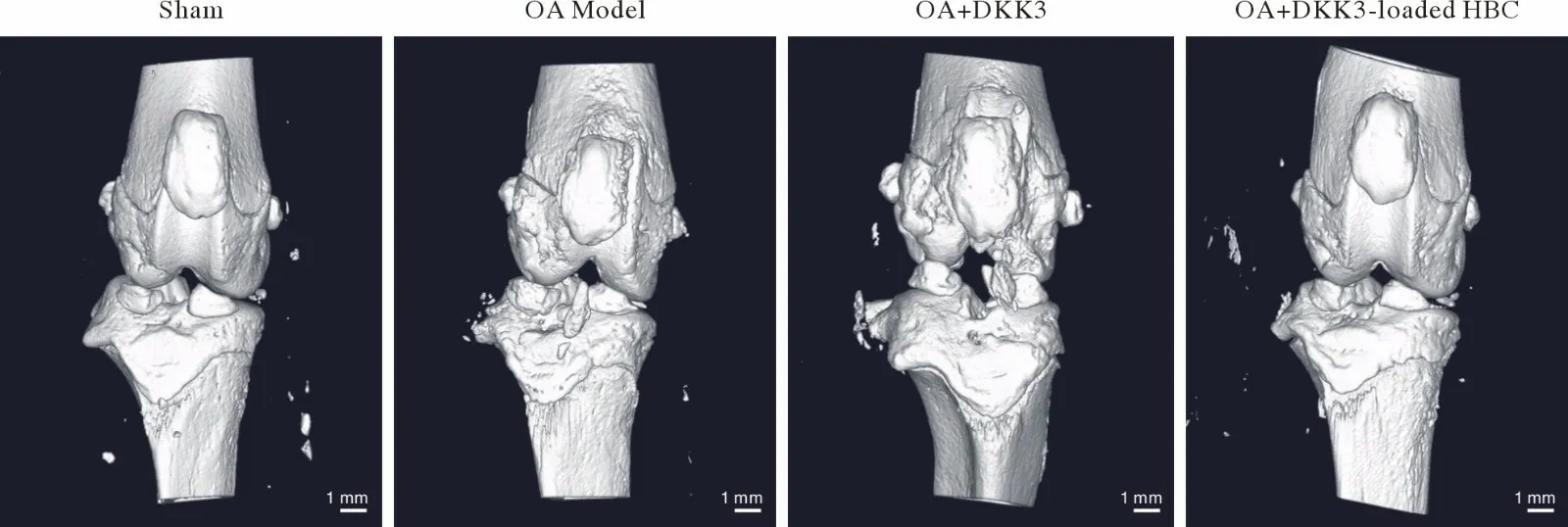
图6 膝关节矢状位3D 图像(比例尺=1 mm)Fig.6 3D Micro-CT images of the knee joints on the sagittal views (bar=1 mm)
HE 染色显示,假手术组关节面光滑;软骨细胞在软骨基质内均匀分布,同源细胞群呈特征性单层纵向排列;潮线完整连续,与钙化层软骨分界清晰。与之形成鲜明对比的是,经过造模的关节,其光滑的软骨表面消失,可见部分因损伤而骨化;肥大软骨细胞数量异常增多;潮线不连续,与钙化层软骨分界不清。DKK3 和载有DKK3的HBC 抑制了软骨的退行性表现(图7),降低了OARSI 评分(P<0.05)(图8),但HBC 的参与带来了轻微的炎症反应。
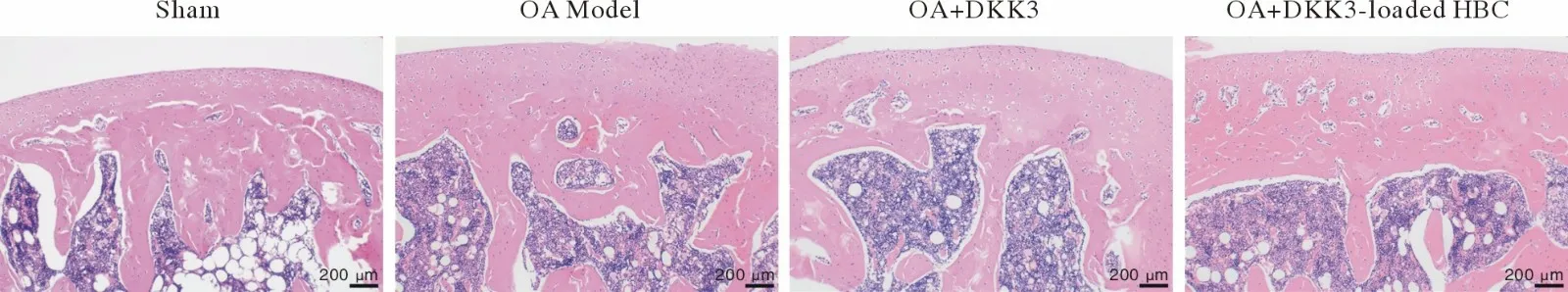
图7 HE 染色(比例尺=200 µm)Fig.7 HE staining results (bar=200 µm)
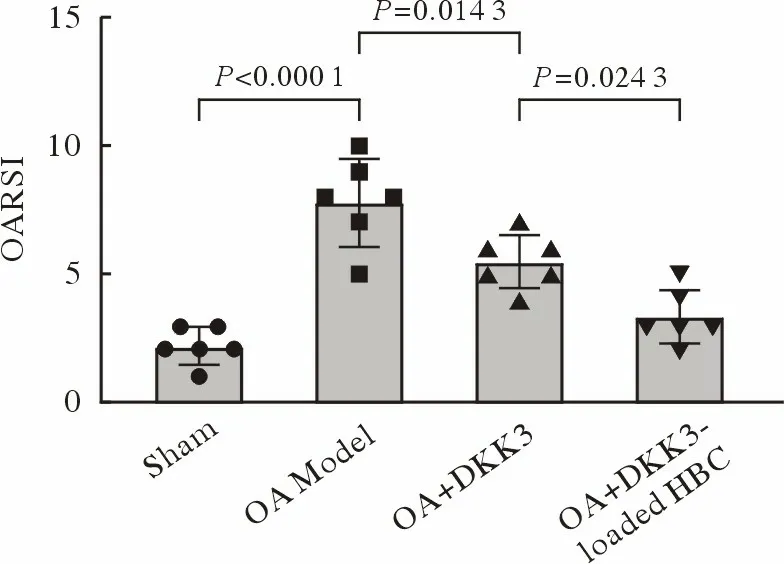
图8 OARSI 评分Fig.8 OARSI score
6 DKK3-loaded HBC 抑制MMP-13 和ADAMTS-5 的表达并减少COL2A1 和ACAN 的损失 相比假手术组组,OA 模型组软骨基质成分COL2A1和ACAN 急剧减少(P<0.0001),相应的,MMP-13 和ADAMTS-5 表达显著增加(P<0.0001)。这些改变被DKK3 和DKK3-loaded HBC 不同程度地恢复(P<0.05) (图9),表明它们对OA 软骨的分解代谢具有强烈的抑制作用。

图9 膝关节软骨免疫组化染色(比例尺=200 µm)Fig.9 IHC stain results of the cartilage of OA knees (bar=200 µm)
讨 论
OA 的治疗仍是一个临床难题。探索用于关节腔新药物的同时,需要开发合适的材料,缓慢释放包载其中的药物,同时提供适宜软骨生长的微环境。正常的关节软骨是具有双相性质的液固结构,软骨细胞包埋在以Ⅱ型胶原为主的胶原原纤维交织排列形成网状结构,嵌入带负电荷的蛋白聚糖构成的软骨基质中[16]。壳聚糖的单体与蛋白聚糖主干透明质酸的单体一致,在关节腔内不会产生排异反应,其正电性使其可以很容易地包载负电性的蛋白质类药物,以保护其免受酶的降解,延长蛋白质药物在体内的生物活性[17]。但其难溶的性质阻碍了更广泛的应用,通过合适的改性,使壳聚糖衍生物具有良好的溶解性,进一步构建水凝胶,是一种使其得到更广泛应用的有效策略。
HBC 是对壳聚糖分子链的羟基和氨基进行羟丁基化的衍生物,在细胞和动物中均表现出了较好的生物相容性[12,18]。在低温下,HBC 为黏度较低的液体,方便与药物混合,在关节腔注射过程中侵入较小,并且可以精准注射至病变较重部位,进入关节腔后,负载药物的HBC 在10 s 内凝胶,转变为半固态的药物贮库,方便应用于临床。该凝胶系统不需要添加额外的交联剂,因而毒性较小,在溶胀状态下,水凝胶柔软呈橡胶状,在很大程度上与活组织相似,提供几乎正常的软骨细胞生长环境,包载其中的药物在扩散作用和水凝胶崩解的双重作用下缓慢释出,将局部的药物浓度长期平稳保持在治疗窗口内,避免了峰谷现象。
本研究中,DKK3 和HBC 浸取液在体外对软骨细胞的生存率几乎不造成影响,奠定了其用于关节腔的基础。DKK3-loaded HBC 水凝胶表现出了在第1 天迅速释放并在7 d 内持续释放的优良性能,且未观测到常见药物缓释系统中突释的现象。
内侧间室最常在膝OA 中受累,表现为内翻畸形和内收力矩增加,为了减轻内侧间室的负荷,患者倾向于向外旋转腿部,降低步行速度[19-21]。疼痛和结构性异常共同作用于步态,患者往往因疼痛减少支撑时间并缩短步幅[22]。在本研究中DKK3 和DKK3-loaded HBC 对这些指标不同程度的改善反映了其对骨关节炎结构性病变的延缓和对疼痛的改善。
Micro-CT 和HE 染色从软骨、软骨下骨、髌骨面的平整程度和半月板的损伤等方面反映了治疗组骨OA 的延缓。为了更确切地反映软骨基质的改变同时挖掘这种改变的成因,我们进行了免疫组化实验。结果显示,ACAN 和COL2A1 在OA 进程中的剧烈减少被DKK3 挽救,HBC 的参与放大了这一作用。MMPs 是炎症性和退变性关节疾病组织破坏的重要调节因子,MMP-13 在整个MMPs 家族中,作用底物最广,对Ⅱ型胶原的降解能力最强,在正常滑膜、软骨组织中无表达或极少量表达,其表达量与关节软骨的组织破坏程度一致[23-24]。IHC 显示DKK3-loaded HBC 对OA 模型中MMP-13 升高的抑制效果优于DKK3,可能是HBC 的缓释作用使DKK3 的局部浓度长期保持在治疗窗口内导致了这一结果。ADAMTS-5是关节软骨内降解ACAN 的主要因素,其表达水平在OA 进展过程中显著增加,是OA 潜在的治疗靶点[25-26]。有趣的是,在本实验中,虽然DKK3-loaded HBC 对ACAN 的保护相较于DKK3 显示出了有统计学差异的优化,但两者对ADAMTS-5 表达的抑制没有显著差异,可能是由于单体结构与ACAN 相似的HBC 为ACAN 的生成和保护提供了适宜的微环境。
本研究仍有一些局限性:(1) HBC 在体内和体外的特性可能存在差异,在关节腔内凝胶的DKK3-loaded HBC 可能随着运动和酶的降解缓释作用削弱,使DKK3 的释放快于预期;(2)尽管HBC 有着相当可靠的生物相容性,我们仍可从部分切片中看到轻微的炎症反应,提示需要对制剂进一步优化。总的来说,本研究的数据表明HBC有着优秀的载药和缓释能力,在前交叉韧带离断术诱导OA 的大鼠关节腔注射DKK3-loaded HBC可能通过减少MMP-13 和ADAMTS-5 等软骨基质分解酶的表达延缓骨关节炎的进展,改善大鼠的疼痛和运动表现。关节腔注射DKK3-loaded HBC是一种有前景的OA 治疗方法。
作者贡献李众利:策划总体研究目标和目的;郭正、赵之栋、高划一:设计并完成实验,收集数据,撰写论文。
利益冲突所有作者声明无利益冲突。
数据共享声明本篇论文相关数据可依据合理理由从作者处获取,Email:guozcn@foxmail.com。
