肺鳞癌三级淋巴结构特征及其对预后的影响
2023-10-12翟今朝卯云烨李金凤董周寰王玲兄葛祥伟才巨星秦嘉沛汪进良
翟今朝,卯云烨,李金凤,董周寰,王玲兄,郑 轩,葛祥伟,卢 迪,盛 舒,才巨星,秦嘉沛,王 安,胡 毅,汪进良
1 解放军医学院,北京 100853;2 解放军总医院第五医学中心肿瘤医学部肿瘤内科,北京 100071;3 解放军总医院第五医学中心肿瘤医学部研究所,北京 100853;4 解放军总医院第一医学中心病理科,北京 100853
肺癌是世界上最致命和最常见的癌症类型之一[1]。早期的肺癌患者以手术治疗为主,但相当一部分患者会出现肿瘤的复发和转移,从而影响患者生存。围术期传统的铂类化疗相比单纯手术治疗对ⅠB~ⅢA 期非小细胞肺癌(non-small cell lung cancer,NSCLC)患者的总生存期(overall survival,OS)提高仅约5%[2]。免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)出现之后,基于对晚期肺癌患者的显著疗效,早期可手术患者也可给予术前新辅助免疫治疗[3-5]。三级淋巴结构(tertiary lymphoid structure,TLS)是在慢性炎症(包括肿瘤)部位的非淋巴组织中发育的异位淋巴器官[6-7]。在肿瘤微环境(tumor microenvironment,TME)中TLS具有招募、活化和增殖T 淋巴细胞、B 淋巴细胞的功能,是肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)的重要来源,可有效支持抗原呈递和淋巴细胞活化[7-8]。TLS 的存在与多种癌症的复发风险降低、生存期延长以及提高对ICIs 的反应有关[6,9-10]。有回顾性研究分析结直肠癌、乳腺癌、肉瘤和 NSCLC 的ICIs 治疗前肿瘤样本,具有成熟TLS 患者肿瘤客观缓解率和OS 得到提高[11]。但目前通过组织学评估的TLS 并未显示ICIs 应答者的TLS 密度增加(与无应答者相比)[12]。本研究通过组织学分析手术切除的肺鳞癌(lung squamous cell carcinoma,LUSC)组织样本,研究其TLS 特征,并分析其与LUSC 患者生存预后及新辅助免疫治疗的关系,为TLS 预测患者生存预后及新辅助免疫治疗疗效提供参考。
资料与方法
1 临床资料 该研究是一项回顾性队列研究,纳入2015-2022年解放军总医院18 例经新辅助免疫治疗后经根治性切除的LUSC 患者临床资料,同时纳入2010-2018年解放军第一四八医院24 例未经新辅助治疗经根治性切除的LUSC 患者临床资料。本研究通过解放军总医院伦理审查委员会审核同意(伦审第S2019-228-02 号)。纳入标准:(1)行LUSC 根治性切除术且病理诊断为原发性LUSC;(2)术前未行化疗、放疗;(3)经新辅助免疫治疗患者术前接受标准化疗联合抗PD-1/PD-L1 抑制剂2 周期以上。排除标准:(1)小细胞肺癌、肺腺癌和其他癌症;(2)医疗记录和随访信息不完整。
3 TLS 定义及特征分析 TLS 定义为非淋巴组织部位的异位淋巴结构,最小可接受直径200 µm,最小可接受所含淋巴细胞100 个,最小可接受淋巴细胞密度0.005/µm2[淋巴聚集体中所含淋巴细胞数/淋巴聚集体面积(µm2)]。记录TLS 中淋巴细胞密度、TLS 最大面积和TLS 密度(切片组织TLS数量与组织面积比值)等TLS 相关特征,并根据形状将其分为圆形/椭圆形和非规则形状两类。
4 分析指标 (1) TLS 特征:根据软件细胞分类分析TLS 细胞密度、平均TLS 密度、TLS 面积、高/低细胞密度TLS 密度(0.0097/µm2)、圆形/椭圆形TLS 密度、非规则型TLS 密度等。以中位数划分高、低组比较临床指标的差异。(2)新辅助治疗疗效与TLS 特征的关系:以肿瘤最佳缓解深度[肿瘤退缩程度(%)]评价疗效。(3) OS 与TLS 特征的关系。患者随访时间自手术日开始至患者死亡或最后一次随访结束(2022年12月)。
5 统计学分析 采用SPSSAU 23.0 在线应用软件[14-15]和R (4.2.1)版本中R 包stats (4.2.1)、car、ggalluvial (0.12.3)进行统计分析,采用χ2检验分析TLS 特征与临床指标的关系,采用Wilcoxon 秩和检验分析组间差异性,生存分析采用Kaplan-Meier 分析,结果用ggplot2 (3.3.6)包对数据进行可视化,P<0.05 为差异有统计学意义。
结 果
1 患者一般资料 本研究纳入42 例接受LUSC根治性切除术的患者。中位年龄65(范围:50~81)岁,男性40 例(95.24%),女性2 例(4.76%)。中位随访时间23.5(4~83)个月,其中新辅助免疫治疗患者18 例。见表1。

表1 患者的临床特征(例,%)Tab.1 Baseline characteristics of the patients (n,%)
2 癌组织细胞分析 通过QuPath 软件分析检测细胞、人工注释及训练分类将检测细胞分为肿瘤细胞、免疫细胞、其他细胞(包含纤维细胞、坏死区细胞、红细胞及其他基质区细胞)和可忽略细胞(组织异常污染区、软骨细胞和未被纳入检测的细胞)。病理组织细胞分类以柱状图呈现,经新辅助免疫治疗患者相比未经新辅助治疗患者的TLS 所含免疫细胞明显增多。见图1。
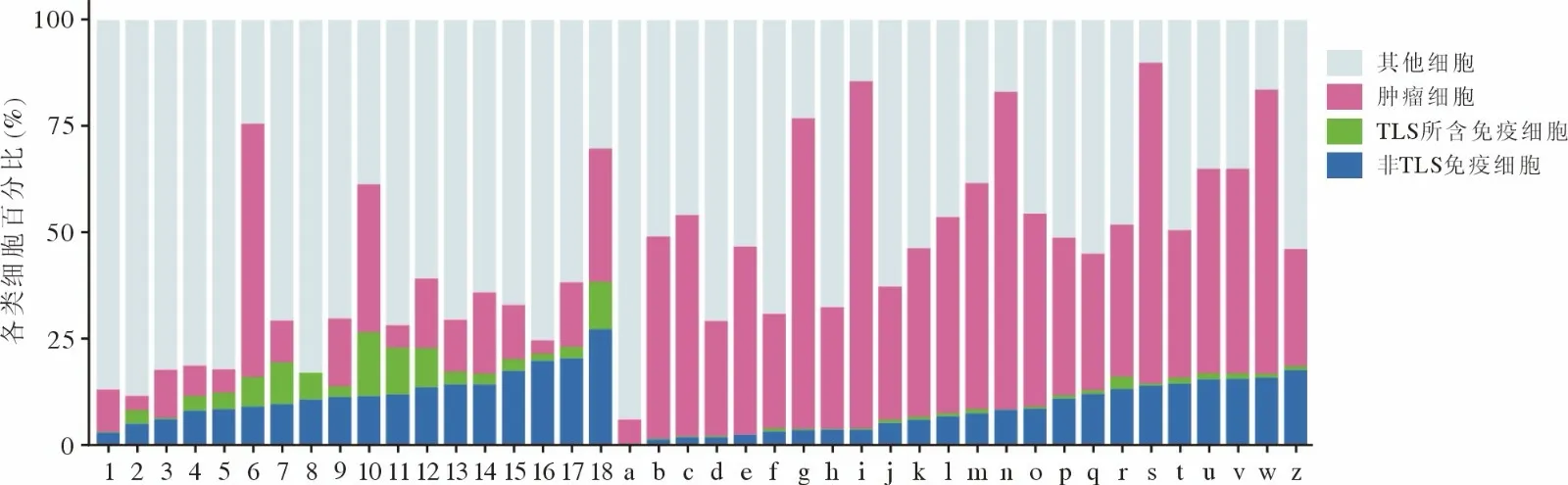
图1 细胞分类柱状图1~18 为经新辅助免疫治疗患者,a~z 为未经新辅助治疗患者Fig.1 Cell classification histogram Serial numbers 1 to 18 represented cells from patients treated with neoadjuvant immunotherapy,a to z represented cells from patients without neoadjuvant treatment
3 TLS 特征与临床指标的关系 以肿瘤组织检测TLS 密度(0.088/mm2)、圆形/椭圆形TLS 密度(0.013/mm2)、高细胞密度TLS(0.013/mm2)、最大TLS 面积(0.20 mm2)的中位数,将对应的资料/患者进行两分类/分组,分别列示于表2、表3、表4、表5。经比较知:较高的TLS 密度与新辅助免疫治疗具有相关性(P<0.001),并与新辅助免疫治疗缓解深度≥60%组具有相关性(P=0.007)(表2);圆形/椭圆形TLS 密度在N 分期(P=0.025)、M 分期(P=0.038)方面有统计学差异,且密度>0.013/mm2组与新辅助免疫治疗具有显著相关性(P=0.013)(表3);3 周期以上的新辅助免疫治疗与较低密度的高细胞密度TLS 有关(P=0.024)(表4);年龄<65 岁组最大TLS 面积大于年龄≥65 岁组(P=0.019),并且最大TLS 面积在肿瘤分化程度中的差异有统计学意义(P=0.047)(表5)。
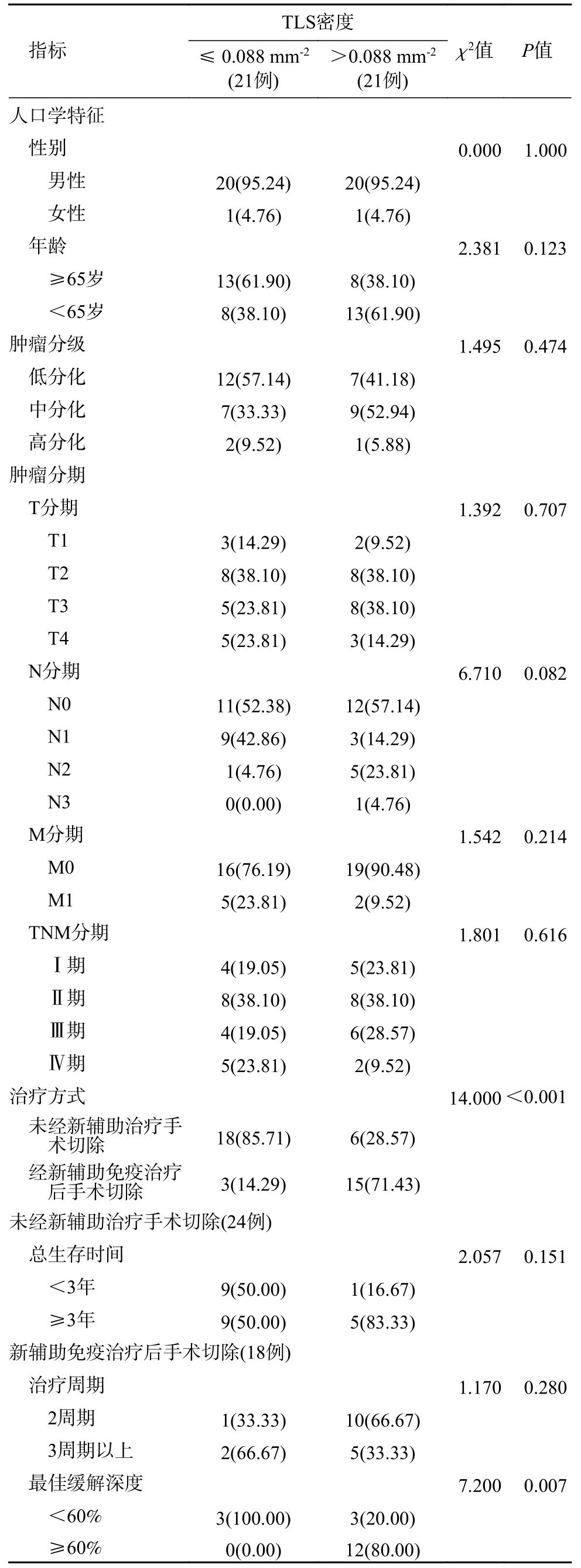
表2 TLS 密度与患者临床指标的关系(例,%)Tab.2 Relationship between density of TLS and clinical indicators (n,%)
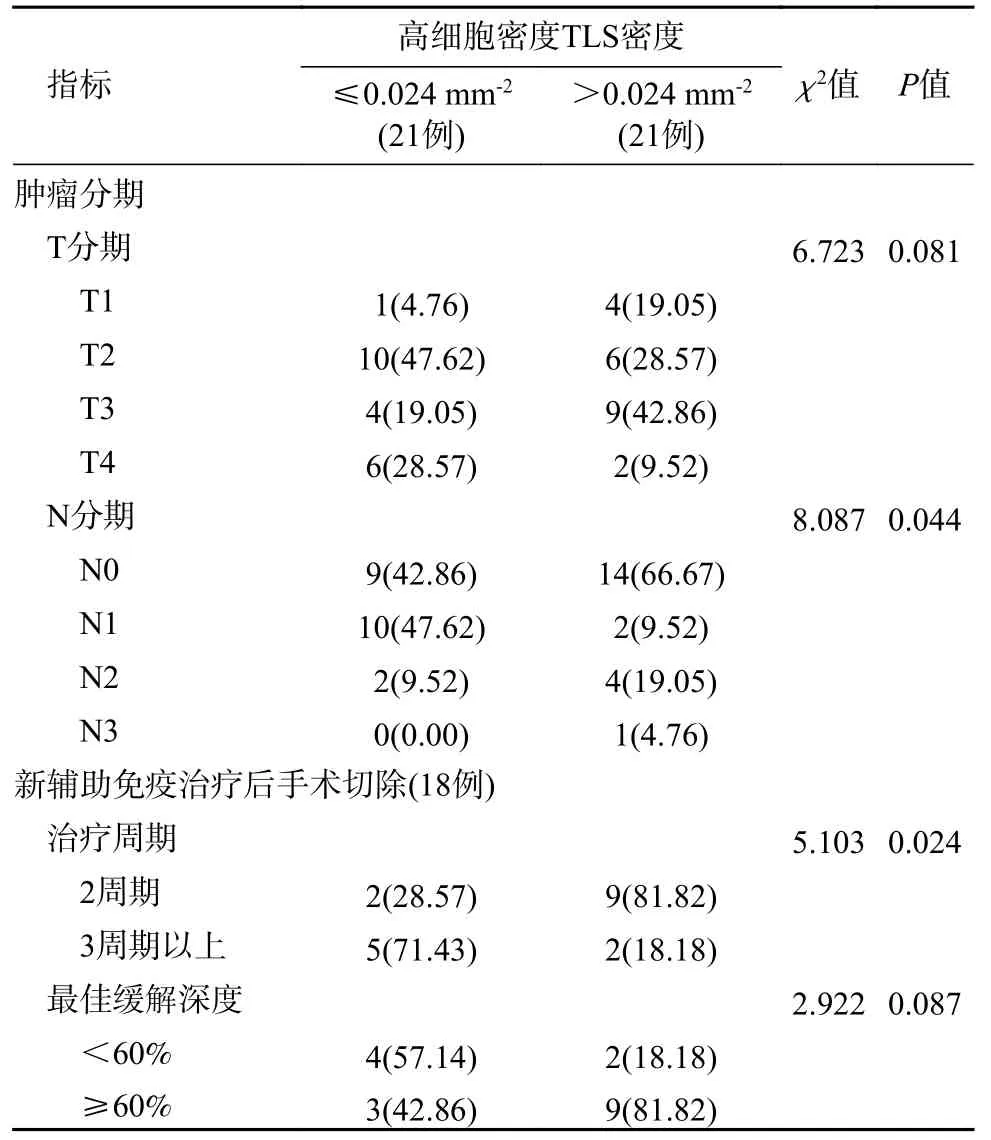
表4 高细胞密度TLS 与患者临床指标的关系(例,%)Tab.4 Relationship between high-cell-density TLS and clinical indicators (n,%)
4 免疫治疗疗效与TLS 的关系 LUSC 患者经2 周期以上新辅助免疫治疗患者1 例达完全缓解(complete response,CR)、13 例为部分缓解 (partial response,PR)、4 例为疾病稳定 (stable disease,SD),7 例术后行辅助免疫治疗,3 例出现疾病复发,无死亡事件发生。
肿瘤最佳缓解深度≥60%相比<60%者,TIL密度(792.13/mm2vs410.56/mm2,P=0.032)、TLS 密度(0.20/mm2vs0.09/mm2,P=0.018)、TLS 中位面积(70010 µm2vs47040 µm2,P=0.014)显著增高,低细胞密度TLS(0.106/mm2vs0.032/mm2,P=0.001)、非规则TLS(0.164/mm2vs0.064/mm2,P=0.014)同样显著增高;同时TLS 平均细胞数(1111vs629,P=0.083)、高细胞密度TLS(0.113/mm2vs0.020/mm2,P=0.206)、圆形/椭圆形TLS 相对增高(0.039/mm2vs0.013/mm2,P=0.083)。见图2。
由电机通过齿轮带动顶部的盘面回转,一组模子放置在盘面的边缘;为使模子可方便地翻转从而取出限阳极板,采用如下方式:模子两边各带一个轴头,轴头分别装入带座轴承,并随之固定在盘面上,另外设置一个不连接的支点,这样既可使模子保持水平,又可方便地翻转模子。在设计过程中,还采用了其它各种措施,使得回转盘结构紧凑,且运行平稳。
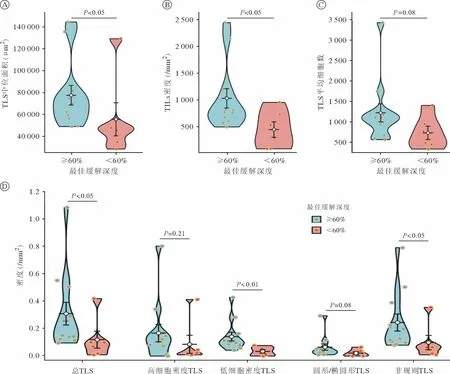
图2 经新辅助免疫治疗患者TLS 特征分析(小提琴图)Fig.2 Characterization of TLS in patients treated with neoadjuvant immunotherapy (violin plot)
5 未经新辅助治疗患者TLS 特征与生存分析 未经新辅助治疗的患者中23 例达到死亡终点,失访1 例,中位OS 为40 个月;OS≥3年患者相较于<3年患者,TLS 密度(0.078/mm2vs0.052/mm2,P=0.042)、圆形/椭圆形TLS 密度(0.015/mm2vs0.005/mm2,P=0.046)更高。Kaplan-Meier 生存分析显示TLS 密度较高组相较于较低组死亡风险降低36%[mOS:40 个月vs23.5 个月;HR(95%CI):0.64(0.26~1.54) ;P=0.316],圆形/椭圆形TLS 密度较高组相较于较低组具有相对更好的预后[mOS:53.5 个月vs25.0 个月;HR(95%CI):0.44(0.18~1.06);P=0.069],最大TLS 面积高组相较于低组具有相对更佳的预后并降低死亡风险54%[mOS:50.0 个月vs25.0 个月,HR(95%CI):0.46(0.19~1.08) ;P=0.074]。见图3。
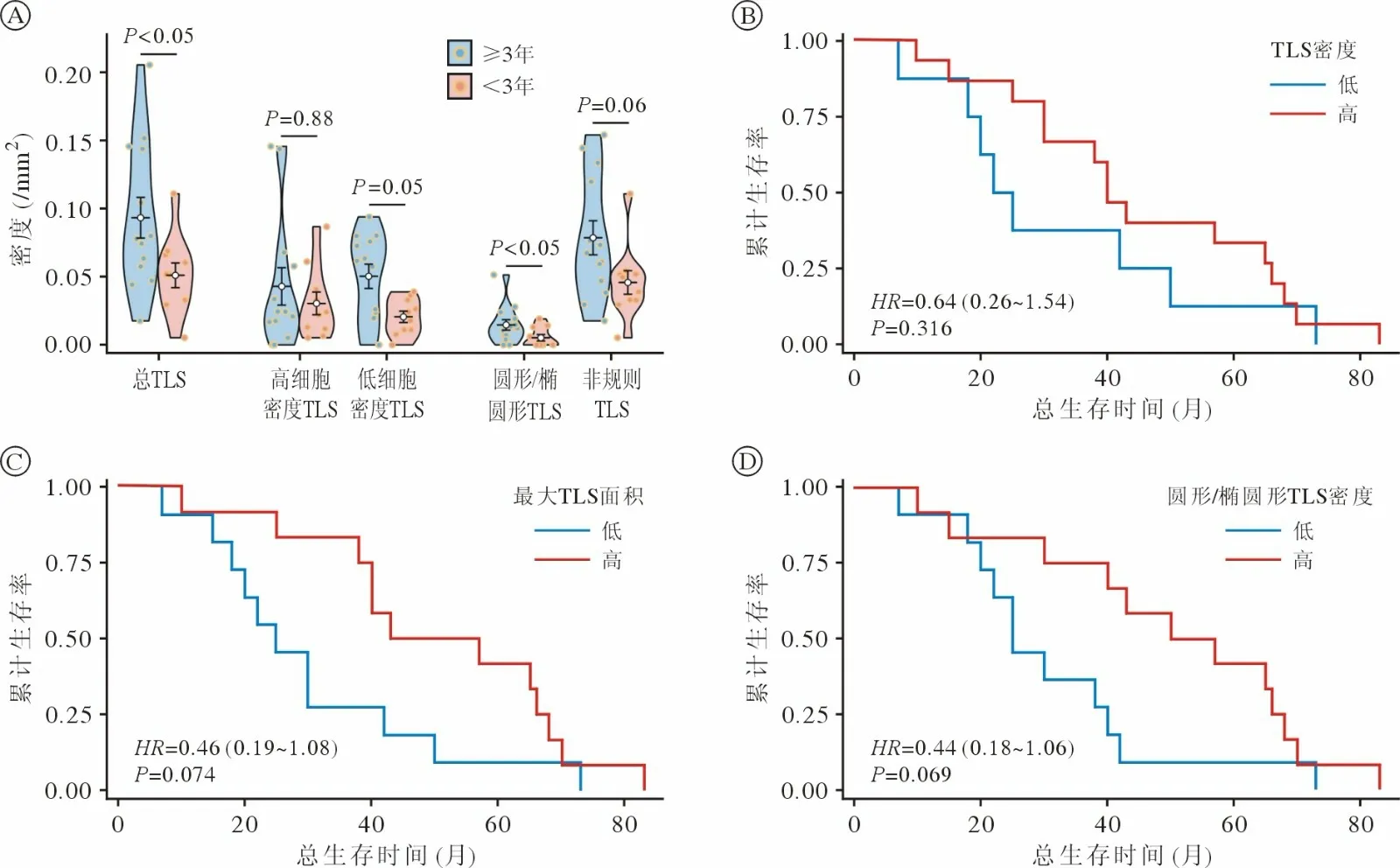
图3 不同TLS 特征组生存分析A:OS≥3年与<3年患者TLS 特征分析(小提琴图) ;B、C 和D:TLS 密度(B)、最大TLS 面积(C)、圆形/椭圆形TLS 密度(D)的Kaplan-Meier 生存分析Fig.3 Survival analysis by TLS characteristics A:Analysis of TLS characteristics in patients with OS≥3 years vs OS<3 years (violin plot);B,C and D:Kaplan-Meier analysis of the density of TLS (B),the area of maximum TLS (C),and the density of round/elliptical TLS (D)
讨 论
TLS 是慢性炎症和免疫刺激下发生在非淋巴组织(如TME)中的淋巴样新生[9,16],对TLS 的检测主要通过对病理切片的免疫组织化学(immunohistochemistry,IHC)进行分析,这对于明确TLS 的存在很有价值。然而,IHC 的TLS 切片分析也存在一些局限性,如临床样本资源消耗过多、定量分析不便、TME 联合分析复杂等[6,17]。既往研究是根据高内皮小静脉、树突状细胞和其他标志物的表达来确定TLS 的密度,但根据我们的诊断经验,这可能低估了TLS 的密度。因此我们的研究使用HE 染色的组织病理学载玻片和开源组织病理学图像分析软件QuPath 分析接受新辅助免疫治疗LUSC 患者的TLS 特征变化。本研究首次针对TLS 特征分类,并对高/低细胞密度TLS、最大TLS 面积和TLS 密度等特征进行数据分析。
既往研究证明,TLS 中的某些细胞亚型在黑色素瘤和肾细胞癌免疫治疗反应中起重要作用,其中免疫治疗应答组中参与B 细胞功能和TLS 密度变化的基因表达显著增加[18]。包括NSCLC、结肠癌、乳腺癌在内对免疫治疗应答的患者具有更高的肿瘤TLS 特征,而具有高TLS 特征的患者具有更高的总生存率[11,19]。在本研究中同样证明生存3年以上的患者TLS 密度、圆形/椭圆形TLS 密度、最大TLS 面积患者相对更高,降低了死亡风险。
有研究表明最大TLS 直径与预后存在相关性,可以作为预后指标[20],但在实际研究中发现,最大TLS 直径可能受限于非规则型TLS 的形状,无法特异性代表TLS 特征。本研究中发现新辅助免疫治疗3 周期以上患者相较于新辅助治疗2 周期患者高细胞密度TLS 密度相对降低;一项瑞士的研究表明,在未经治疗的LUSC 患者中,TLS 密度是最强的独立预后标志物。然而在新辅助化疗后,并没有发现TLS 密度的增加,反而造成生发中心(germinal center,GC)形成受损,导致TLS 密度的预后价值丧失[18]。另外一项来自中国的研究同样表明,重复使用5-氟尿嘧啶会影响肿瘤免疫环境,而长期化疗会损害抗肿瘤免疫力[21]。本研究首次将LUSC 新辅助免疫治疗患者纳入TLS 分析中,并且发现对免疫治疗应答患者TLS数量和密度显著增加、TLS 细胞密度增高、最大TLS 面积增高等特点,但因无法获得治疗前标本,故不能排除在治疗前TLS 已形成。
本研究采用半自动化分析细胞,标记组织淋巴聚集区,在我们的研究中TLS 最小纳入密度为0.005/µm2,所有TLS 平均淋巴细胞密度0.011/µm2,这远高于非TLS 免疫细胞浸润密度,与既往研究基本相符[22]。经新辅助免疫治疗患者的肿瘤微环境有大量免疫细胞浸润,其中参与形成TLS 的免疫细胞比例显著增加,促进TLS 形成。与此同时,新辅助免疫治疗与更高的TLS 密度、最大TLS 面积、TLS 平均细胞密度等特征有显著相关性。
TLS 在实体瘤中的形成和功能尚未得到彻底解释。既往研究中,TLS 被认为是成熟且紧密堆积的淋巴细胞,形成具有光滑圆形轮廓的离散实体,并且可以处于不同的成熟阶段(即淋巴聚集体或具有GC 的聚集体)[7,12,23]。本研究将TLS 按照形状分类,分为圆形/椭圆形和非规则形,圆形/椭圆形TLS 平均淋巴细胞密度为0.012/µm2,高于非规则TLS 细胞密度0.010/µm2,研究表明对新辅助免疫治疗具有较高应答的患者圆形/椭圆形TLS 密度显著增多,比例显著提高。
在一项来自伦敦大学的研究中,以HE 染色载玻片为基础,将TLS 区域淋巴细胞密度纳入研究,提出应将TLS 最小面积、TLS 最小淋巴细胞数量、淋巴细胞密度作为TLS 定义标准[24]。本研究中发现新辅助免疫治疗缓解深度≥60%患者相较于缓解深度<60%患者具有更高的TLS 密度、TLS 中位面积、TLS 平均细胞数、低细胞密度和非规则TLS 密度,在研究过程中发现非规则TLS 具有直径长、周长长、面积大、细胞密度相对低等组织学特点,这样的特点在一定程度上增大了TLS 与肿瘤组织的接触面积和接触机会,同样在肿瘤免疫微环境中发挥重要作用。
TLS 是抗肿瘤免疫反应的主要参与者,其在肿瘤进展过程中的相互关系和各自的动力学也有待破译。TLS 的存在或其在癌症治疗后的诱导形成通常与有利的临床结局相关并可预测治疗效果。对TLS 及其在ICIs 治疗中的积极作用的认识在不断提高,对于TLS 形成和构成的深入研究将有助于进一步阐明TME 中的分子机制。目前,TLS 的B 细胞相关通路,即CXCL13/CXCR5 轴和CCL19/CCL21/CCR7 轴,被广泛研究[22,25-26]。诱导TLS 的形成和通过TLS 抑制肿瘤发生有望成为未来研究方向。通过各种药理学方法诱导TLS 形成并联合ICIs、肿瘤疫苗、溶瘤病毒、局部瘤内抑制剂或干预疗法等已成为增加冷肿瘤对ICIs 敏感性的新型手段。相反,在有强烈慢性炎症、血管生成和纤维化基质的TME 紊乱热肿瘤中,使用抗血管生成联合ICIs 治疗可能有助于使TME 质地正常化,有利于TLS 形成和提高对ICIs 的治疗疗效。TLS 和相应B 细胞通路可能成为T 细胞治疗革命时代的新型抗肿瘤靶点代表[27-29]。
总体而言,尽管用于量化TLS 的方法存在异质性,但大多数研究发现TLS 密度与多种不同类型癌症患者的生存期具有相关性。我们的研究也证实对于免疫治疗应答较好的患者具有更高TLS 密度,但因本研究中18 例经新辅助免疫治疗手术切除患者仅有3 人达到疾病复发,因此本研究缺少新辅助免疫治疗生存分析结果证明TLS 密度对免疫治疗生存预后的预测作用。
本研究具有一定的局限性:(1)因新辅助免疫治疗方式的局限,研究的病例数量较少;(2)作为回顾性研究,对于进一步的研究,有必要通过积累大量多中心病例来阐明新辅助免疫治疗促进TLS 成熟的机制,如对TLS 形态学的研究、GC样结构的分析、TLS 位置与肿瘤边缘关系、TLS形成与高内皮静脉的关系等;(3)对于TLS 密度的定义和量化仍缺少科学证据,需进一步研究探索。
致谢特别感谢中国人民解放军总医院肾脏疾病实验室对实验给予的特别协助,感谢陈彤和张王静怡给予的宝贵意见和无私帮助。
作者贡献翟今朝:课题实施,研究结果验证,软件处理,可视化数据处理,文章撰写;汪进良:课题主要设计、研究目的、研究结果审核,文章的评阅和修订工作;胡毅:课题主要设计、研究结果审核,研究思路,文章的评阅和修订工作;卯云烨:统计学分析,数据呈现,修改初稿;李金凤:收集临床数据信息,随访;董周寰:组织切片的染色和分析;王玲兄:切片数据分析及可视化;葛祥伟、秦嘉沛:细胞分类标识,构建细胞分类器,TLS 标记的审阅与修正;卢迪:图像的特异性标记,统计分析;盛舒:初始数据的提取和整理;才巨星:初始数据的维护、筛选、随访;王安:临床数据的分析与整理;郑轩:数据分析和可视化的审核。
利益冲突所有作者声明无利益冲突。
数据共享声明本篇论文的关联数据有意使用或查验者须向作者提供数据访问申请,得到作者授权或同意后,才能获取数据文件。Email:zhai jinzhao301@foxmail.com。
