双硫死亡及其与肿瘤关系的研究进展
2023-10-11王燕青杨林成春锋陈东风冼绍祥方红城
王燕青, 杨林, 成春锋, 陈东风, 冼绍祥, 方红城
(1. 深圳市中西医结合医院心血管科, 广东 深圳 518104; 2. 广州中医药大学基础医学院, 广东 广州 510006; 3. 广州中医药大学第一附属医院心血管科, 广东 广州 510405)
硫是一种机体不可缺少的微量元素。机体内硫元素主要存在于L-半胱氨酸和L-蛋氨酸这两种氨基酸中,两者完全来源于膳食蛋白质。其中,半胱氨酸是蛋白质中含量最少且高度保守的氨基酸残基,具有调节催化、氧化还原敏感性和金属离子转运等多种功能[1]。人类蛋白质组有214 000个半胱氨酸残基以硫醇、二硫化物和锌指的形式存在[2]。在人体细胞质内,最丰富的硫醇形式是谷胱甘肽[3],它参与保护蛋白质硫醇免受氧化和交联、降解蛋白质的二硫键等细胞过程[4]。硫醇-二硫化物蛋白质组可分为两组,一组是氧化还原信号硫醇组,在细胞信号传导中起作用;另一组是氧化还原感应硫醇组,在氧化还原状态下起作用[5]。硫醇是活性氧的靶标,其氧化主要产生二硫化物和二硫键[6]。细胞质内二硫键的积累可破坏细胞氧化还原状态的平衡,进而诱导双硫应激和细胞毒性[7]。
2023年2月甘波谊教授团队[7]在NatureCellBiology杂志首次报道了一种新的细胞死亡方式,即在葡萄糖饥饿状态下,NADPH供应不足,癌细胞高表达胱氨酸转运体溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11;也称为xCT)诱发二硫化物(如胱氨酸等)在细胞内异常积累,导致细胞死亡。因此种细胞死亡方式具有二硫化物应激的特点,故命名为“双硫死亡”(disulfidptosis)。在该研究中,敲除调控细胞凋亡与铁死亡的关键基因后,该种细胞死亡过程仍发生,但使用硫醇类还原性试剂三(2-羧乙基)膦[tris(2-carboxyethyl)phosphine,TCEP]可以抑制细胞的死亡。从机制而言,由于葡萄糖饥饿导致NADPH供应不足,细胞将胱氨酸还原为半胱氨酸的过程受阻,肌动蛋白分子间产生大量二硫键,诱导双硫应激,从而激活Rac/WAVE调节复合物(WRC)-7亚基肌动蛋白相关蛋白2/3(Arp2/3)信号通路造成细胞骨架的紊乱,最终诱导细胞发生双硫死亡[7]。目前,关于双硫死亡的研究多集中于SLC7A11高表达且处于葡萄糖饥饿状态的癌细胞株[8-9]。因此,本文针对硫在机体的代谢、二硫键依赖性细胞死亡方式及在肿瘤中的调控作用作一综述。
1 硫在机体内代谢过程和生理功能
人类和其他动物体内所有硫的主要来源为膳食蛋白质。与其他营养素一样,经胃肠消化后的硫通过门静脉循环直接进入肝脏,肝脏将含硫分子排泄至外周循环。在人体内,硫主要存在于半胱氨酸和蛋氨酸这两种氨基酸中。硫在维持氧化还原稳态或在抗氧化防御系统中发挥重要作用[10]。硫的化学性质,特别是其可逆地采用多种价态的能力,是其在许多生物分子中具有独特功能的基础[11],这种性质允许硫残基在一些蛋白质内部或蛋白质之间形成可逆的二硫键[10]。硫在生物学电子转移渠道中的应用广泛,密切参与氧化还原反应。因此,硫可能最常用来直接改变细胞内氧原子氧化状态[10]。在用于蛋白质合成的半胱氨酸和蛋氨酸的活性形式中,硫处于完全还原状态。硫在半胱氨酸中以硫醇形式存在,在蛋氨酸中以硫醚形式存在。蛋氨酸经由机体从食物中获得的含硫营养素合成,半胱氨酸可以通过转硫途径由蛋氨酸合成。与蛋氨酸相比,半胱氨酸更易于与过氧化氢反应而具有调节氧化还原的特性。同时,半胱氨酸也是细胞中谷胱甘肽、硫化氢和铁硫簇等生物合成的前体。
半胱氨酸作为组成蛋白质或谷胱甘肽结构的一类氨基酸,有助于维持氧化还原稳态以及调节细胞内和细胞间的信号传导[12]。此外,半胱氨酸作为“代谢枢纽”参与细胞中其他含硫小分子生物合成[13-14]。大多数半胱氨酸作为氧化还原感应硫醇以响应氧化还原变化。从结构来看,半胱氨酸的功能大多源于其反应性巯基。半胱氨酸在细胞外不稳定,易被氧化为胱氨酸[15],同时细胞外半胱氨酸浓度通常较胱氨酸低。因此,大多数细胞在很大程度上依赖胱氨酸转运蛋白来获得细胞外胱氨酸,再通过在胞质中利用二硫键还原生成两个半胱氨酸分子。半胱氨酸随后被用于合成谷胱甘肽以及其他生物分子[16]。
硫代谢稳态对细胞内氧化还原状态的维持至关重要。在机体生理活动中,细胞主要以胱氨酸形式从细胞外环境获取半胱氨酸,小部分半胱氨酸由蛋白质降解产生。在一些细胞和组织中,从头生物合成细胞内半胱氨酸(其中同型半胱氨酸可以通过转硫途径转化为半胱氨酸)[17-18]。负责转运胱氨酸的转运蛋白是一种异二聚体,由二硫键连接的轻链亚基SLC7A11和重链亚基溶质载体家族3成员2(SLC3A2,也称为4F2hc或CD98)组成[19]。SLC3A2是一种单一跨膜蛋白的伴侣,可维持SLC7A11蛋白的稳定性和适当的膜定位;该转运蛋白以1 ∶1的比例输入细胞外胱氨酸和输出细胞内谷氨酸[20]。半胱氨酸作为硫代谢中主要参与的氨基酸,其在细胞中的合成转化也极其重要。
分泌蛋白或膜蛋白中半胱氨酸的获得或缺失以及胞质蛋白硫醇S-亚硝基化修饰导致硫代谢失调,与色盲[21]、血管性血友病[22]等遗传性疾病以及帕金森病[23]、阿尔茨海默病[24]等获得性疾病有关。
2 双硫死亡的发现及机制
双硫死亡与凋亡[25]、铁死亡[26]、焦亡[27]、坏死性凋亡[28]和铜死亡[29]等细胞程序性死亡有不同的诱因和检测指标(表1)。甘波谊团队发现分别敲除铁死亡蛋白ACSL4和凋亡关键诱导蛋白BAX/BAK并不能逆转细胞死亡,给予细胞活性氧清除剂也不能抑制双硫死亡[7]。此外,通过透射电子显微镜分析SLC7A11高表达细胞死亡并非由于胱氨酸晶体毒性导致[7]。再者,SLC7A11高表达癌细胞ATP水平较对照组升高,排除了细胞死于ATP耗竭的可能性[7]。最终,甘波谊团队确定该种细胞死亡方式是双硫死亡。在癌细胞胞质中,有害的二硫键形成是双硫死亡的基础,双硫应激是诱发双硫死亡的关键过程。

表1 不同细胞死亡方式的诱发因素及关键检测指标
2.1 细胞质二硫键形成是双硫死亡的基础
二硫键是通过半胱氨酸或其他物质的两个巯基残基氧化形成的共价键,在蛋白质折叠和增强蛋白质稳定性方面发挥重要作用[30]。这种二硫键的形成主要发生在内质网、线粒体膜间隙等特殊的隔室中[31],而细胞质中的二硫键形成是在应激条件下和一些病毒感染的超嗜热细胞中[32]。绝大多数蛋白质半胱氨酸残基中的巯基酸度系数(pKa)>8.0,并且在细胞质的还原环境中和在生理pH下保持质子化。因此,细胞质蛋白通常不含二硫键[33]。当还原性半胱氨酸硫醇遇到活性氧、氮或氯物种时,会形成亚磺酸,继而迅速与附近的半胱氨酸相互作用,形成分子间或分子内二硫键[34-35]。细胞质中二硫键的堆积容易诱发双硫应激进而导致双硫死亡。这种有害的二硫键可通过胞质硫氧还蛋白系统[硫氧还蛋白还原酶-1(TRXR1)]和谷胱甘肽系统[谷胱甘肽还原酶(GSR)]两种不同的还原途径清除[36-37]。这两种还原途径以NADPH作为其还原能力的原料控制二硫键的形成。因此,在SLC7A11高表达的癌细胞中,切断葡萄糖供应导致细胞质中形成大量的二硫键是双硫死亡的基础。
2.2 双硫应激促进细胞双硫死亡
尽管2023年首次提出“双硫死亡”的命名,但关于双硫应激的相关研究却始于更早。硫醇特异性氧化还原系统在保护细胞免受有毒氧的侵害,维持细胞内硫醇-二硫化物平衡以及为关键还原酶(如核糖核苷酸还原酶)提供还原能力等方面发挥着重要作用[38]。H2O2将硫醇氧化为亚磺,然后氧化为亚磺酸或磺酸,并促进亚磺和硫醇之间形成二硫化物;而二酰胺特异性触发硫醇之间的二硫化物产生氧化应激,也称为双硫应激[39]。近期研究发现,细胞内二硫化物(如胱氨酸)的异常积累会诱导二硫化物应激,并对细胞产生高度毒性[8]。在双硫死亡中,由于细胞内大量二硫分子积聚,造成双硫应激,从而诱导细胞死亡。
3 双硫死亡与肿瘤的关系
代谢重编程是癌症的重要特征之一,它通常导致癌细胞对生物合成和能量代谢中重要营养素的摄取增加,如葡萄糖和谷氨酰胺等[40],主要通过上调葡萄糖和氨基酸摄取的转运蛋白的表达水平来实现。相应地,当葡萄糖或氨基酸来源受限时,一些癌细胞会发生细胞死亡,但正常细胞却能够存活。这种营养依赖性为癌症的靶向治疗提供了潜在的代谢脆弱性[41]。甘波谊团队的研究表明,SLC7A11高表达促进癌细胞代谢脆弱性导致的双硫死亡可能是治疗肿瘤的有效策略[7]。
3.1 SLC7A11高表达促进肿瘤细胞代谢脆弱性导致双硫死亡
由于癌细胞处于高水平氧化应激状态[42],通过从头合成或蛋白质分解代谢提供半胱氨酸通常无法满足癌细胞对抗氧化防御的高需求,因此癌细胞主要依赖于高表达SLC7A11从细胞外环境中获得胱氨酸。此外,高表达SLC7A11可增加抗氧化剂谷胱甘肽的生物合成[41]。多项研究表明,在胱氨酸充足状态下,SLC7A11高表达的癌细胞通过摄取胞外胱氨酸,促进谷胱甘肽合成从而抑制脂质过氧化产物堆积,最终抑制细胞铁死亡促进肿瘤生长[43-45]。相反,将细胞培养基中胱氨酸去除或通过基因消融或药物抑制使SLC7A11失活可在多种癌细胞中诱导强有力的细胞死亡[43,46]。由此可知,应激诱导的SLC7A11高表达可通过抑制癌细胞铁死亡促进肿瘤生长[47]。
根据上述结论,研究人员最初假设SLC7A11高表达可能保护细胞免受葡萄糖饥饿引发的死亡。令人惊讶的是,研究结果表明,SLC7A11过表达显著促进葡萄糖饥饿诱导的细胞死亡,而SLC7A11失活显著抑制葡萄糖饥饿下的细胞死亡[48-49]。甘波谊教授团队探究其机制发现,葡萄糖可通过磷酸戊糖途径提供NADPH以还原有毒的胱氨酸[8]。在葡萄糖饥饿条件下,给予细胞补充2-脱氧葡萄糖以提供NADPH可以显著阻止SLC7A11高表达癌细胞双硫死亡和氧化还原缺陷[8]。因此,癌细胞SLC7A11高表达增强自身对葡萄糖的依赖性[50],并使癌细胞对葡萄糖缺乏诱导的双硫死亡更敏感。同时,SLC7A11过表达也增强癌细胞对谷氨酰胺的依赖性。谷氨酰胺是一种重要氨基酸,参与细胞能量和生物合成过程,并维持癌细胞的氧化还原平衡[51]。SLC7A11高表达促进谷氨酸输出,导致细胞内谷氨酸的部分耗竭,然后通过解除反馈抑制并激活谷氨酰胺酶驱动细胞摄取更多的谷氨酰胺以补充谷氨酸。Timmerman等[52]研究表明,乳腺癌基底细胞和claudin-low三阴性乳腺癌细胞对谷氨酰胺缺乏的敏感性与SLC7A11表达水平和胱氨酸消耗率相关,此研究支持SLC7A11高表达癌细胞对谷氨酰胺依赖这一观点。
双硫死亡的发现颠覆了SLC7A11高表达促进肿瘤生长这一传统观点,即SLC7A11在促进双硫死亡过程中起着重要作用。SLC7A11在癌细胞中的高表达在降低细胞发生铁死亡风险的同时,又增加细胞发生双硫死亡的风险,它在调节癌细胞的氧化还原平衡和营养依赖性方面起着双刃剑的作用[41]。另外,谷胱甘肽生物合成减少是细胞发生铁死亡的关键因素,同时也在双硫死亡中发生。由此推断,由于SLC7A11和谷胱甘肽的共同参与,双硫死亡与铁死亡间存在相关串扰,具体机制见图1。
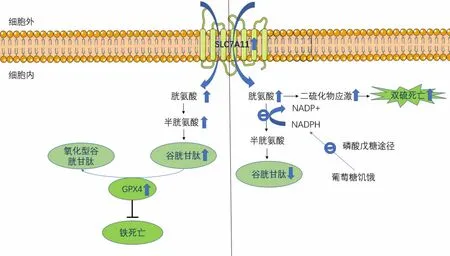
:上升;:下降;:中断;SLC7A11:溶质载体家族7成员11;NADP+:氧化型辅酶Ⅱ;NADPH:还原型辅酶Ⅱ;GPX4:谷胱甘肽过氧化物酶4图1 SLC7A11高表达癌细胞中铁死亡与双硫死亡机制示意图
3.2 靶向双硫死亡及SLC7A11/SLC7A11相关代谢脆弱性的癌症治疗策略
多项研究表明,SLC7A11是多种癌细胞系中葡萄糖缺乏导致细胞死亡的关键决定因素[48-49,53]。SLC7A11在恶性胶质母细胞瘤[53]、肾细胞癌[54]、肺癌[55]、肝癌[56]和胰腺癌[57]等癌症中呈高表达,其高表达通常与患者预后不良相关。研究表明,Slc7a11敲除鼠是可存活的,Slc7a11敲除在主要器官中未出现明显的表型[58]。因此,SLC7A11有望成为癌症治疗中一个有前景的治疗靶点。
既往研究多聚焦于直接抑制SLC7A11转运体活性诱导癌细胞死亡。目前,Erastin、Erastin咪唑酮衍生物、柳氮磺胺吡啶、索拉非尼和HG106已被鉴定或表征为SLC7A11抑制剂[59-60]。然而,由于Erastin代谢稳定性差和在体内溶解度低,其不能用于动物研究[59];Erastin咪唑酮衍生物可用于动物实验[61],但未进入临床试验阶段;虽然索拉非尼和柳氮磺胺吡啶已经获得美国食品药品监督管理局批准,但索拉非尼在肿瘤治疗中作为多激酶抑制剂发挥抗癌作用,而柳氮磺胺吡啶可以阻止前列腺素合成,均不能确认二者在任何特定环境下的抗癌作用确实是由SLC7A11抑制和铁死亡诱导引起的;尽管HG106最近被鉴定为SLC7A11抑制剂[60],但其具体机制还有待进一步研究。总之,尽管临床前研究已确定抑制SLC7A11活性的治疗策略,但仍需进一步确定有效且特异的SLC7A11抑制剂,研究其作用机制,进行临床试验,并最终应用于临床。
最近,研究人员提出靶向癌症中SLC7A11相关代谢脆弱性(葡萄糖或谷氨酰胺依赖性)诱导双硫死亡来制定癌症的治疗策略[19]。Liu等[8]研究发现,与SLC7A11低表达癌细胞相比,葡萄糖转运体(glucose transporter,GLUT)抑制剂更容易诱导SLC7A11高表达癌细胞发生双硫死亡。在细胞系异种移植物和肺癌患者来源的异种移植物中使用KL-11743(强效的泛GLUT1和GLUT3抑制剂),可以选择性地抑制SLC7A11高表达肿瘤生长[44]。与此同时,SLC7A11高表达癌细胞也表现出谷氨酰胺依赖性。出现Kelch样ECH关联蛋白1(Kelch-like ECH associated protein 1,KEAP1)基因突变的癌症表现为核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,NRF2)过度激活和SLC7A11高表达[62]。与KEAP1野生型细胞系相比,谷氨酰胺酶抑制剂CB-839对KEAP1突变细胞系或患者来源的异种移植物肿瘤生长的抑制作用更强[63-64]。此外,SLC7A11高表达可作为生物标志,用于选择癌症患者进行谷氨酰胺酶或GLUT抑制剂治疗。双硫死亡的发现有望针对癌症代谢的弱点,为癌症的代谢治疗提供一种新的途径。
然而,并非所有肿瘤都呈SLC7A11高表达,一些肿瘤(如ARID1A缺陷型肿瘤或具有p53功能获得突变的肿瘤)甚至呈SLC7A11低表达[65-66]。值得注意的是,甘波谊团队在葡萄糖饥饿条件下,向SLC7A11低表达的人肾透明细胞腺癌786-O细胞的培养基中添加额外的胱氨酸可耗尽细胞内NADPH,诱导肌动蛋白细胞骨架蛋白中的二硫键形成和F-肌动蛋白收缩,并引发细胞死亡[7]。由此可见,SLC7A11低表达细胞诱导双硫死亡相关机制仍需要深入研究,同时,非癌细胞中是否发生双硫死亡也有待进一步研究。
4 总结与展望
综上所述,硫、含硫的半胱氨酸及硫醇有助于维持细胞内氧化还原稳态。细胞氧化还原状态失衡时,胞质内硫醇氧化易形成有害的二硫键。细胞质中的二硫键在NADPH供应不足时无法被清除,继而诱发双硫应激导致双硫死亡。
已证明SLC7A11高表达可抑制癌细胞铁死亡。双硫死亡是一种在葡萄糖饥饿的状态下,由SLC7A11高表达的癌细胞胞质内二硫键大量生成诱导双硫应激介导的硫依赖性细胞死亡,这一新发现表明铁死亡与双硫死亡之间有一定的相关性。因此,后续有必要研究通过干扰SLC7A11促进铁死亡的治疗是否也会抑制双硫死亡的发生;同时,研究如何在癌症的靶向治疗中避免该现象。
