VSD联合羟基积雪草苷促进慢性创面愈合和血管生成的机制研究
2023-10-11李凡曾黎刘朝东唐悦
李凡 曾黎 刘朝东 唐悦




[摘要]目的:探究负压封闭引流(Vacuum sealing drainage,VSD)联合羟基积雪草苷促进慢性创面修复愈合和血管生成的作用及机制。方法:以不同剂量羟基积雪草苷处理慢性创面模型大鼠进行预实验,通过检测创面愈合时间筛选羟基积雪草苷最佳作用剂量。将SD大鼠随机分为对照组、模型组、羟基积雪草苷组、VSD组、羟基积雪草苷+VSD组、ML385组、羟基积雪草苷+VSD+ML385组,每组10只,除对照组外其余各组大鼠构建慢性创面模型,以药物分组处理后,检测各组大鼠创面愈合率及微循环血流灌注值(Microcirculation perfusion value,MPD);免疫组织化学染色检测各组大鼠创面微血管密度(Microvessel density,MVD);酶标仪检测各组大鼠血清内皮细胞生长因子(Vascular endothelial growth factor,VEGF)、促血管生成素1(Angiopoietin 1,Ang1)及创面组织活性氧(Reactive Oxygen Species,ROS)、丙二醛(Malondialdehyde,MDA)、环氧化酶-2(Cyclooxygenase 2,COX-2)、白细胞介素-6(Interleukin-6,IL-6)水平;免疫印跡检测各组大鼠创面组织VEGF、Ang1与Nrf2/血红素加氧酶-1(Heme oxygenase-1,HO-1)通路蛋白表达。结果:与对照组相比,模型组大鼠创面MPD及MVD、血清VEGF及Ang1、创面组织VEGF及Ang1、Nrf2、HO-1蛋白表达降低(P<0.05),创面组织ROS、MDA、COX-2、IL-6水平明显升高(P<0.05)。与模型组相比,羟基积雪草苷组、VSD组、羟基积雪草苷+VSD组大鼠创面愈合率、MPD及MVD、血清VEGF及Ang1、创面组织VEGF及Ang1、Nrf2、HO-1蛋白表达升高(P<0.05),创面组织ROS、MDA、COX-2、IL-6水平降低(P<0.05),且羟基积雪草苷和VSD联合应用作用比单独应用更强;ML385组各指标变化与羟基积雪草苷+VSD组相反,且ML385可逆转羟基积雪草苷和VSD联合应用对模型大鼠各指标变化的作用。结论:VSD和羟基积雪草苷两者联合可协同上调Nrf2/HO-1信号通路蛋白表达,进而促进慢性创面修复愈合和血管生成。
[关键词]负压封闭引流;羟基积雪草苷;核因子E2相关因子2;慢性创面;愈合;血管生成
[中图分类号]R751.05 [文献标志码]A [文章编号]1008-6455(2023)09-0048-06
Mechanism of VSD Combined with Madecassoside in Promoting Chronic Wound Healing and Angiogenesis
LI Fan,ZENG Li,LIU Chaodong,TANG Yue
(Department of Plastic Surgery and Burn Repair Surgery,West China Guang'an Hospital,Sichuan University,Guang’an 638000,Sichuan,China)
Abstract: Objective To explore the effects and mechanism of vacuum sealing drainage (VSD) combined with madecassoside in promoting slow wound healing and angiogenesis. Methods Treatment of chronic wound model rats with different doses of madecassoside and screening of the optimal dosage of madecassoside by detecting wound healing time. The rats in each group were constructed with chronic wounds models, and after grouping with drugs, the wound healing time of the rats in each group was detected. SD rats were randomly grouped into control group, model group, madecassoside group, VSD group, madecassoside+VSD group, ML385 group, and madecassoside+VSD+ML385 group, 10 rats in each group. Except for the control group, the rats in the other groups were constructed with chronic wound models, and after grouping with drugs, the wound healing rate and the microcirculation perfusion value (MPD) of the rats in each group were detected, immunohistochemical staining was used to detect wound microvessel density (MVD) of rats in each group, the microplate reader was used to detect the levels of endothelial cell growth factor (VEGF), angiopoietin 1 (Ang1) in serum, and reactive oxygen species (ROS), malondialdehyde (MDA), cyclooxygenase-2 (COX-2), and interleukin-6 (IL-6) in wound tissue in each group, and Western blot was used to detect the expressions of VEGF, Ang1 and Nrf2/HO-1 pathway proteins in wound tissue of rats in each group. Results Compared with the control group, the expressions of MPD and MVD in the wound tissue, the levels of VEGF and Ang1 in serum, the protein expressions of VEGF and Ang1, Nrf2, and HO-1 in the wound tissue of the rats in the model group were decreased (P<0.05), the levels of ROS, MDA, COX-2 and IL-6 in the wound tissue were obviously increased (P<0.05). Compared with the model group, the wound healing rate, MPD and MVD, the levels of VEGF and Ang1 in serum, the protein expressions of VEGF and Ang1, Nrf2, and HO-1 in the wound tissue in the madecassoside group, VSD group, and madecassoside+VSD group were obviously increased (P<0.05), and the effect of combined application of hydroxyasiaticoside and VSD was stronger than that of single application, The change of each index in ML385 group was opposite to that in hydroxyasiaticoside + VSD group, and ML385 could reverse the effect of hydroxyasiaticoside and VSD combined application on the change of each index in model rats. Conclusion The combination of VSD and madecassoside can synergistically up-regulate the expression of Nrf2/HO-1 signaling pathway protein, thereby promoting the repair and healing of chronic wounds and angiogenesis.
Key words: vacuum sealing drainage; madecassoside; Nuclear factor erythroid-2 related factor 2; chronic wounds; healing; angiogenesis
慢性创面是慢性难愈合创面的简称,作为外科常见疾病,治疗难度大、周期长且花费高,给患者造成巨大的负担和痛苦[1-2]。创面愈合涉及感染、炎症、细胞运动、氧化应激和血管生成等生物学现象,通过减弱炎症和氧化应激、增强血管新生可促使创面进入促愈合的微环境,加快其修复愈合[3-4]。核因子E2相关因子2(Nuclear factor erythroid-2 related factor 2,Nrf2)是重要的抗氧化因子,可增强HO-1表达,减少ROS的产生,抑制炎症和氧化应激,促进血管生成,加快糖尿病伤口愈合[5-6],过表达Nrf2能促进骨髓间充质干细胞存活和血管生成,加速全层切除伤口的动物模型创面收缩及修复愈合[7],因而激活Nrf2/HO-1信号是促进慢性创面修复愈合和血管生成的有潜力的治疗手段。VSD是一种广泛应用于各种急慢性复杂伤口处理的技术,有助于伤口早期的血管化,促进伤口创面愈合[8-9];羟基积雪草苷是积雪草中含有的一种三萜皂苷成分,具有广泛的抗炎、抗溃疡、抗氧化活性,能修复皮肤损伤及瘢痕、促进纤维细胞再生、加速伤口愈合[10],还可通过激活Nrf2/HO-1信号减轻过氧化氢诱导的视网膜色素上皮细胞凋亡[11],但VSD联合羟基积雪草苷是否可通过上调Nrf2/HO-1信号通路促进慢性创面修复愈合和血管生成,目前尚未有明确研究,本文通过构建慢性创面大鼠模型,对此问题进行探究。
1 材料和方法
1.1 实验动物:SPF级SD大鼠,雄性,购自华中科技大学动物实验中心,生产许可证号SCXK(鄂)2021-0009,体质量200~230 g,饲养及实验操作严格遵照《中华人民共和国实验动物管理条例》的要求进行。
1.2 主要试剂和仪器:羟基积雪草苷(纯度:HPLC≥98%,货号IM0480)、大鼠血管内皮细胞生长因子(Vascular endothelial growth factor,VEGF)酶联免疫吸附反应(Enzyme linked immunosorbent assay,ELISA)试剂盒(货号SEKR-0032)、促血管生成素1(Angiopoietin 1,Ang1)ELISA试剂盒(货号SEKR-0055)、通用SP免疫组织化学试剂盒(货号SP0041)、ROS检测试剂盒(货号CA1410)、大鼠环氧化酶-2(Cyclooxygenase 2,COX-2)ELISA试剂盒(货号SEKR-0075)购自北京索莱宝生物科技有限公司;丙二醛(Malondialdehyde,MDA)检测试剂盒(货号ab118970)、大鼠白细胞介素-6(Interleukin-6,IL-6)ELISA试剂盒(货号ab234570)、兔源抗大鼠Ang1一抗(货号ab183701)、兔源抗大鼠CD34一抗(货号ab81289)、HRP偶联山羊抗兔二抗(货号ab6721)、兔源抗大鼠HO-1一抗(货号ab68477)购自Abcam公司;兔源抗大鼠Nrf2一抗(货号AF7623)、兔源抗大鼠VEGF一抗(货号AF8325)、RIPA裂解液(货号P0013K)、兔源抗大鼠β-actin一抗(貨号AF5003)购自上海碧云天生物技术有限公司等。激光多普勒血液灌流成像仪—型号LISCA,购自Perimed公司(瑞典);旋转石蜡切片机—型号CUT 4050,购自Leica公司(德国);实验室光学显微镜—型号Panthera TEC POL,购自Motic公司(加拿大);全波长酶标仪—型号Uquant,购自biotek公司(美国);垂直电泳槽、电泳仪电源、转膜槽—型号Tetra Systerm、PowerPac Basic 1645050、Power PacBasic,购自Bio-Rad公司(美国)等。
1.3 方法
1.3.1 实验分组
1.3.1.1 预实验构建大鼠慢性创面模型及分组处理:参照文献[12]构建大鼠慢性创面模型,将25只SD大鼠随机分为模型对照组、羟基积雪草苷低剂量组、羟基积雪草苷中剂量组、羟基积雪草苷高剂量组、羟基积雪草苷高剂量+ML385(Nrf2抑制剂)组,每组5只。于大鼠腹腔内注入3 ml/kg的3%戊巴比妥钠溶液,麻醉后脱去大鼠背部毛发,消毒备皮,于脊柱两侧各做一个直径1.5 cm的圆形标记,然后沿标记于无菌条件下创建深达筋膜层的全层皮肤缺损创面,接着立即肌肉注射80 mg/kg的醋酸氢化可的松注射液1次,致使形成慢性难愈合创面。造模后24 h开始给药,羟基积雪草苷低剂量组、羟基积雪草苷中剂量组、羟基积雪草苷高剂量组大鼠分别腹腔注射25、50、100 mg/kg的羟基积雪草苷(2.5、5、10 mg/ml的羟基积雪草苷溶液各10 ml/kg)[13];羟基积雪草苷高剂量+ML385组大鼠腹腔注射100 mg/kg的羟基积雪草苷和30 mg/kg的ML385(10 mg/ml的羟基积雪草苷与3 mg/ml的ML385混合溶液10 ml/kg)[14];模型对照组大鼠腹腔注射10 ml/kg的生理盐水,各组大鼠给药的同时以无菌纱布覆盖创面(隔1天换1次纱布),每天给药1次,共给药7 d,然后继续饲养大鼠直至创面愈合,观察记录各组大鼠创面愈合时间。
1.3.1.2 构建大鼠慢性创面模型及分组处理:取70只SD大鼠随机分为对照组、模型组、羟基积雪草苷组、VSD组、羟基积雪草苷+VSD组、ML385组、羟基积雪草苷+VSD+ML385组,每组10只,除对照组外其余各组大鼠参照上述方法构建慢性创面模型,对照组大鼠只脱毛备皮后做圆形标记,不做其他处理,造模后24 h开始分组处理。羟基积雪草苷组大鼠腹腔注射100 mg/kg的羟基积雪草苷(10 mg/ml的羟基积雪草苷溶液10 ml/kg)。VSD组大鼠以VSD治疗,修剪VSD护创材料为创面大小覆盖创面,在护创材料下置入一个直径2 mm的输液器管作引流管,以透明贴膜完全密封护创材料及创面,然后将引流管连接到负压引流装置,以125 mm Hg的负压持续吸引(8 h/d)[15],同时腹腔注射10 ml/kg的生理盐水;羟基积雪草苷+VSD组大鼠腹腔注射100 mg/kg的羟基积雪草苷,同时进行VSD治疗;ML385组大鼠腹腔注射30 mg/kg的ML385(3 mg/ml的ML385溶液10 ml/kg);羟基积雪草苷+VSD+ML385组大鼠腹腔注射100 mg/kg的羟基积雪草苷和30 mg/kg的ML385(10 mg/ml的羟基积雪草苷与3 mg/ml的ML385混合溶液10 ml/kg),同时进行VSD治疗;对照组和模型组大鼠腹腔注射10 ml/kg的生理盐水,另外不进行VSD治疗的大鼠给药的同时以无菌纱布覆盖创面(隔1天换1次纱布),每组大鼠均每天给药处理1次,共给药处理7 d。
1.3.2 检测大鼠创面愈合率及微循环血流灌注值(Microcirculation perfusion value,MPD):7组大鼠处理前对创面进行拍照,然后于7 d处理结束后24 h观察创面愈合情况并再次拍照,采用Motic 6.0数码医学图像系统分析图像,定量各组大鼠创面面积后计算创面愈合率=(1-未愈创面面积/处理前创面面积)×100%。创面MPD运用激光多普勒血液灌流成像仪进行测定,打开仪器,设置参数为轮廓50像素、扫描宽度64像素、视距12 cm、显示频率5 Hz、扫描速度100 ms/Line,每只大鼠各扫描3次取均值。
1.3.3 免疫组织检测大鼠创面组织微血管密度(Microvessel density,MVD)及标本采集:腹腔内注射3 ml/kg的3%戊巴比妥钠溶液麻醉各组大鼠,采集各组大鼠尾静脉血液,3 000 r/min离心10 min,获得血清于-80℃保存备用;断头处死大鼠,各处理组大鼠剥下背部创面皮肤组织,对照组大鼠取圆形标记处的皮肤,剪下创面皮肤组织各0.8 g于液氮中保存备用;剩余创面皮肤组织清洗干净,固定后做常规脱水、透明处理,置于热石蜡中包埋,然后将石蜡组织块固定在旋转切片机中切片,获得厚约4 µm的切片,每只大鼠选出无损伤的3张切片做常规脱蜡处理,水化后浸没入0.3% H2O2处理,漂洗后孵育5%山羊血清进行封闭,孵育兔源抗大鼠CD34一抗(稀释200倍),以通用SP免疫组织化学试剂盒做免疫组化:孵育二抗(稀释200倍)、DAB显色,以实验室光学显微镜观察染色情况并采集图像,通过Motic 6.0数码医学图像系统分析定量任意视野切片面积及血管数,CD34阳性表达细胞或细胞簇呈现棕色,并将一个CD34阳性表达细胞或细胞簇设定为1个微血管计数单位,即可算出MVD,MVD=微血管计数/切片面积。
1.3.4 检测大鼠血清VEGF、Ang1及创面组织ROS、MDA、COX-2、IL-6水平:取出1.3.3中保存在-80℃的血清缓慢解冻后,采用ELISA法测量其中VEGF、Ang1水平,具体步骤参照各自试剂盒说明書中指导进行;取出1.2.3中保存在液氮中的创面皮肤组织,加入适量RIPA裂解液研磨匀浆,提取出总蛋白,运用BCA法测出其浓度,然后每组各取出0.4 ml创面组织蛋白样品液,测量其中ROS、MDA、COX-2、IL-6水平,具体步骤参照各自试剂盒说明书中指导进行,剩余创面组织蛋白样品液保存在-80℃备用。
1.3.5 免疫印迹检测大鼠创面组织VEGF、Ang1与Nrf2/HO-1通路蛋白表达:取1.3.4中保存在-80℃的创面组织蛋白样品液缓慢冻融,每组上样20 µg变性后总蛋白,做SDS-PAGE电泳,通过湿转将分散在SDS-PAGE胶中的蛋白移至硝酸纤维素膜,将其浸没入脱脂牛奶中,封闭其上总蛋白非特异抗原位点,参照分子量大小将VEGF、Nrf2、Ang1、HO-1、β-actin蛋白裁下,孵育相应兔源抗大鼠一抗、HRP偶联山羊抗兔二抗,化学发光试剂处理显色后拍照,以Image-Pro plus软件分析图像,定量各组蛋白条带灰度值后,量化其相对表达。
1.4 统计学分析:本文实验数据运用GraphPad Prism 8.0软件做统计分析,并使用均数±标准差(x¯±s)描述,多组间差异比较进行单因素方差分析,组间两两比较行SNK-q检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 预实验羟基积雪草苷对慢性创面大鼠创面愈合时间的影响:与模型对照组相比,羟基积雪草苷低、中、高剂量组大鼠创面愈合时间降低(P<0.05),且呈剂量依赖性(P<0.05);与羟基积雪草苷高剂量组相比,羟基积雪草苷高剂量+ML385组大鼠创面愈合时间升高(P<0.05)。见表1。
2.2 各组慢性创面大鼠创面愈合率、MPD及MVD的检测结果:与对照组相比,模型组大鼠创面MPD、MVD降低(P<0.05);与模型组相比,羟基积雪草苷组、VSD组、羟基积雪草苷+VSD组大鼠创面愈合率、MPD、MVD升高(P<0.05),ML385组大鼠创面愈合率、MPD、MVD降低(P<0.05);与羟基积雪草苷组、VSD组相比,羟基积雪草苷+VSD组大鼠创面愈合率、MPD、MVD均升高(P<0.05);与羟基积雪草苷+VSD组相比,羟基积雪草苷+VSD+ML385组大鼠创面愈合率、MPD、MVD降低(P<0.05)。见图1、表2。
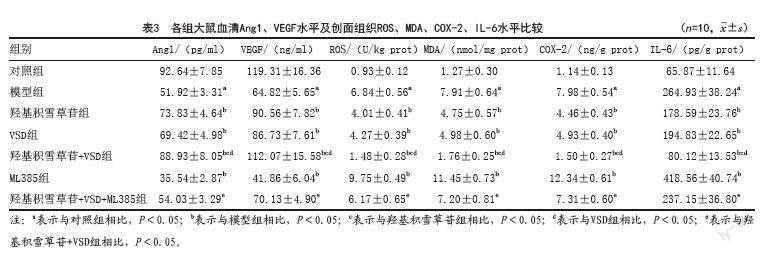
2.3 各组慢性创面大鼠血清Ang1、VEGF水平及创面组织ROS、MDA、COX-2、IL-6水平的检测结果:与对照组相比,模型组大鼠血清Ang1、VEGF水平明显降低(P<0.05),创面组织ROS、MDA、COX-2、IL-6水平明显升高(P<0.05)。与模型组相比,羟基积雪草苷组、VSD组、羟基积雪草苷+VSD组大鼠血清Ang1、VEGF水平升高(P<0.05),创面组织ROS、MDA、COX-2、IL-6水平降低(P<0.05);ML385组大鼠血清Ang1、VEGF水平降低(P<0.05),创面组织ROS、MDA、COX-2、IL-6水平升高(P<0.05)。与羟基积雪草苷组、VSD组相比,羟基积雪草苷+VSD组大鼠血清Ang1、VEGF水平升高(P<0.05),创面组织ROS、MDA、COX-2、IL-6水平降低(P<0.05)。与羟基积雪草苷+VSD组相比,羟基积雪草苷+VSD+ML385组大鼠血清Ang1、VEGF水平降低(P<0.05),创面组织ROS、MDA、COX-2、IL-6水平升高(P<0.05)。见表3。
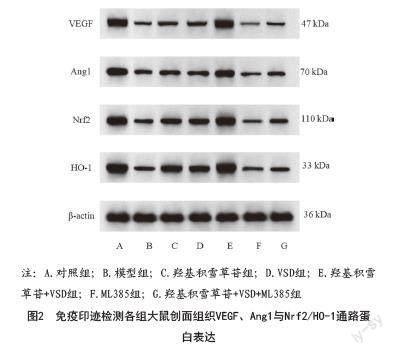
2.4 各组大鼠创面组织VEGF、Ang1与Nrf2/HO-1通路蛋白表达的检测结果:与对照组相比,模型组大鼠创面组织VEGF、Ang1、Nrf2、HO-1蛋白表达明显降低(P<0.05);与模型组相比,羟基积雪草苷组、VSD组、羟基积雪草苷+VSD组大鼠创面组织VEGF、Ang1、Nrf2、HO-1蛋白表达升高(P<0.05),ML385组大鼠创面组织VEGF、Ang1、Nrf2、HO-1蛋白表达降低(P<0.05);与羟基积雪草苷组、VSD组相比,羟基积雪草苷+VSD组大鼠创面组织VEGF、Ang1、Nrf2、HO-1蛋白表达升高(P<0.05);与羟基积雪草苷+VSD组相比,羟基积雪草苷+VSD+ML385组大鼠创面组织VEGF、Ang1、Nrf2、HO-1蛋白表达降低(P<0.05)。见图2、表4。
3 讨论
慢性创面可造成疼痛,不仅严重降低患者生活质量,还会带来很大经济负担,长期难以愈合,会有癌变风险,根据目前的医疗水平,还未找到慢性创面的特效治疗药物,因此探寻新型的治疗策略具有积极临床意义[1-2]。VSD是处理各种急慢性复杂伤口的一种技术,使用聚乙烯醇覆盖伤口,在其上覆一层聚氨酯,两者之间插入连接负压吸引装置的引流管,并以医用贴膜封闭,具有良好的促创面修复愈合的效果[8-9,16],可促进创面组织肉芽组织再生和再上皮化,提高Ⅰ型和Ⅲ型胶原蛋白表达,提升创面的抗拉伸强度,加快创面的修复愈合[15]。羟基积雪草苷是提取自积雪草的积雪草总苷中的一种,可消炎抗菌、抑氧化,具有修复皮肤损伤、溃疡及瘢痕的功能,研究显示,含有羟基积雪草苷的积雪苷霜软膏可治疗女性外阴硬化萎缩性苔藓,减轻皮肤损伤,复方积雪草凝胶贴剂可促进瘢痕愈合[17-18],但VSD联合羟基积雪草苷是否可协调促进慢性创面修复愈合和血管生成,目前尚不清楚。本研究结果显示,以不同剂量羟基积雪草苷处理慢性创面模型大鼠,可降低其创面愈合时间,且呈剂量依赖性,表明羟基积雪草苷可呈剂量依赖性地加速慢性创面愈合。VSD治疗或羟基积雪草苷处理慢性创面模型大鼠,均可升高大鼠创面愈合率、MPD及MVD、血清VEGF及Ang1、创面组织VEGF及Ang1蛋白表达,降低创面组织ROS、MDA、COX-2、IL-6水平,两者联合对上述指标的作用更强,表明VSD治疗和羟基积雪草苷均可减少ROS和炎症因子,降低脂质过氧化水平,减轻炎症和氧化应激,增强促血管生成因子表达及血管生成,改善创面血流微循环,加快创面修复愈合,两者联合具有协同作用,可增强各自的促慢性创面修复愈合和血管生成的作用。
Nrf2/HO-1是调控组织细胞ROS产生和脂质过氧化的主要信号,上调该信号蛋白表达可显著降低ROS水平,增加内皮祖细胞数量,减轻其功能损伤,阻止炎症与脂质过氧化损伤,增強创面血管化及上皮化,促进糖尿病伤口愈合[6,19-20],因而推测激活Nrf2/HO-1信号可能是VSD联合羟基积雪草苷促进机制。本研究结果显示,以Nrf2抑制剂处理慢性创面模型大鼠,可降低大鼠创面愈合率、MPD及MVD、血清VEGF及Ang1、创面组织VEGF及Ang1、Nrf2、HO-1蛋白表达,升高创面组织ROS、MDA、COX-2、IL-6水平,且VSD治疗或羟基积雪草苷处理慢性创面模型大鼠,均可升高大鼠创面组织Nrf2、HO-1蛋白表达,两者联合对Nrf2与HO-1蛋白表达的上调作用更强,表明抑制Nrf2信号可加重炎症和脂质过氧化,抑制慢性创面修复愈合和血管生成,Nrf2/HO-1信号参与介导VSD联合羟基积雪草苷促进慢性创面修复愈合和血管生成的过程。VSD治疗同时以羟基积雪草苷和ML385联合处理慢性创面模型大鼠,相比VSD治疗同时以羟基积雪草苷处理,可降低大鼠创面愈合率、MPD及MVD、血清VEGF及Ang1、创面组织VEGF及Ang1、Nrf2、HO-1蛋白表达,升高创面组织ROS、MDA、COX-2、IL-6水平,表明ML385可减轻VSD联合羟基积雪草苷的抗炎和抗脂质过氧化作用,减弱其对慢性创面大鼠创面血管生成的促进及微血管血液循环的改善作用,最终逆转VSD联合羟基积雪草苷治疗的促慢性创面创面修复愈合作用,揭示VSD联合羟基积雪草苷协同促进慢性创面修复愈合和血管生成是通过激活Nrf2信号实现的。
综上所述,VSD治疗和羟基积雪草苷均可上调Nrf2/HO-1通路蛋白表达,进而抑制炎症,减少ROS产生,阻止脂质过氧化损伤,增强血管生成,改善创面微血管血液循环,促使创面修复愈合,两者联合可起到协同作用,激活Nrf2/HO-1信号可能是其作用机制之一,本研究为慢性创面创面的修复愈合提供了新型治疗手段,对于缩短慢性创面患者创面愈合时间做出了一定贡献,但关于其作用机制的研究还不够详细全面,存在一定不足,后续会进一步探究VSD联合羟基积雪草苷调控Nrf2下游更具体清晰的分子机制。
[参考文献]
[1]Růžička J,Dejmek J,Bolek L,et al.Hyperbaric oxygen influences chronic wound healing-a cellular level review[J].Physiol Res,2021,70(S3):S261-S273.
[2]Martínez García R M, Fuentes Chacón R M, Lorenzo Mora A M,et al.La nutrición en la prevención y curación de heridas crónicas. Importancia en la mejora del pie diabético [Nutrition in the prevention and healing of chronic wounds. Importance in improving the diabetic foot][J].Nutr Hosp,2021,38(Spec No2):60-63.
[3]Verdolino D V,Thomason H A,Fotticchia A,et al.Wound dressings:curbing inflammation in chronic wound healing[J].Emerg Top Life Sci,2021,5(4):523-537.
[4]Berger A G,Chou J J,Hammond P T.Approaches to modulate the chronic wound environment using localized nucleic acid delivery[J].Adv Wound Care (New Rochelle),2021,10(9):503-528.
[5]Xu Z,Liu Y,Ma R,et al.Thermosensitive hydrogel incorporating prussian blue nanoparticles promotes diabetic wound healing via Ros scavenging and mitochondrial function restoration[J].ACS Appl Mater Interfaces,2022,14(12):14059-14071.
[6]Lin S,Zhang Q,Li S,et al.Antioxidative and angiogenesis-promoting effects of tetrahedral framework nucleic acids in diabetic wound healing with activation of the Akt/Nrf2/Ho-1 pathway[J]. ACS Appl Mater Interfaces,2020,12(10):11397-11408.
[7]Sabzevari R,Mohammadi Roushandeh A,Alijani-Ghazyani Z,et al.SA/G hydrogel containing NRF2-engineered HEK-293-derived CM improves wound healing efficacy of WJ-MSCs in a rat model of excision injury[J].J Tissue Viability,2021,30(4):527-536.
[8]Qiu L,Wang F,Xu Q,et al.Negative pressure wound therapy promotes healing and reduced pain in patients with acute suppurative mastitis[J].BMC Womens Health,2022,22(1):243-249.
[9]Du W,He L,Wang L,et al.Experimental vascular protective shield combined with vacuum sealing drainage prevents pressure on exposed vessels and accelerates wound repair[J].Ann Palliat Med,2020,9(5):3059-3069.
[10]Lueangarun S,Srituravanit A,Tempark T.Efficacy and safety of moisturizer containing 5% panthenol,madecassoside,and copper-zinc-manganese versus 0.02% triamcinolone acetonide cream in decreasing adverse reaction and downtime after ablative fractional carbon dioxide laser resurfacing: A split-face,double-blinded,randomized, controlled trial[J].J Cosmet Dermatol,2019,18(6):1751-1757.
[11]Zhou J,Chen F,Yan A,et al.Madecassoside protects retinal pigment epithelial cells against hydrogen peroxide-induced oxidative stress and apoptosis through the activation of Nrf2/HO-1 pathway[J].Biosci Rep,2020,40(10):BSR20194347-BSR20194355.
[12]黄许森,兰海生,李明尚,等.湿润暴露疗法/湿润烧伤膏对大鼠慢性难愈合创面中RELM-α表达的影响[J].现代中西医结合杂志,2021,30(1):7-12.
[13]贾颜锋,陈伟.羟基积雪草苷对大鼠创伤性颅脑损伤后神经功能障碍的改善作用及机制研究[J].创伤外科杂志,2021,23(7):546-550.
[14]Shan W,Liao X,Tang Y,et al.Dexmedetomidine alleviates inflammation in neuropathic pain by suppressing NLRP3 via Nrf2 activation[J].Exp Ther Med,2021,22(4):1046-1054.
[15]趙鑫,石新,陈贝,等.负压封闭引流技术对大鼠急性创面愈合过程中Ⅰ/Ⅲ型胶原比例变化的影响[J].中国组织工程研究,2020,24(32):5122-5127.
[16]Wei S,Wang W,Li L,et al.Recombinant human epidermal growth factor combined with vacuum sealing drainage for wound healing in Bama pigs[J].Mil Med Res,2021,8(1):18-31.
[17]金艺,赵春华,滕序,等.积雪苷霜结合卤米松乳膏对女性外阴硬化萎缩性苔藓疗效,皮损面积及瘙痒评分的影响[J].中国妇幼保健,2020,35(10):1800-1802.
[18]陈阳,玄光善.复方积雪草凝胶贴剂体外透皮及在体瘢痕实验[J].中国药师,2019,22(8):1527-1531.
[19]Chen L Y,Cheng H L,Kuan Y H,et al.Therapeutic potential of luteolin on impaired wound healing in streptozotocin-induced rats[J].Biomedicines,2021,9(7):761-773.
[20]Fan J,Liu H,Wang J,et al.Procyanidin B2 improves endothelial progenitor cell function and promotes wound healing in diabetic mice via activating Nrf2[J].J Cell Mol Med,2021,25(2):652-665.
[收稿日期]2022-07-21
本文引用格式:李凡,曾黎,刘朝东,等.VSD联合羟基积雪草苷促进慢性创面愈合和血管生成的机制研究[J].中国美容医学,2023,32(9):48-53.
