南瓜中β-胡萝卜素提取工艺优化及稳定性研究
2023-10-10韩浩李晓娟王珣冷春旭赵伟赵曦李柱刚
韩浩,李晓娟,王珣,冷春旭,赵伟,赵曦,李柱刚
(1.黑龙江大学生命科学学院 农业微生物技术教育部工程研究中心,黑龙江省寒区植物基因与生物发酵重点实验室,哈尔滨 150080;2.黑龙江省农业科学院生物技术研究所,黑龙江省南瓜育种与深加工工程技术研究中心,黑龙江省作物与家畜分子育种重点实验室,哈尔滨 150028;3.黑龙江省农业科学院耕作栽培研究所,哈尔滨 150028)
南瓜是葫芦科南瓜属一年生蔓性草本植物,其中含有多种活性物质,如氨基酸、蛋白质、维生素等,有较高的营养价值[1],现代药理学研究表明,南瓜对减肥[2]、烫伤治疗[3]、前列腺增生[4]等有一定的效果。
β-胡萝卜素属于脂溶性色素,无毒无害,是自然界中普遍存在的天然色素,β-胡萝卜素是维生素A的重要前体物质,对哺乳动物非常重要,发挥着巨大作用[5],如抗氧化、抗炎、调节免疫系统、抗肿瘤等[6-7],并可作为食品添加剂、营养强化剂,在食品或动物饲料中应用,有研究表明β-胡萝卜素作为饲料可提高喂养动物的抵抗力、繁殖能力、生产力以及幼崽成活率等[8]。
β-胡萝卜素的提取方法很多,如超声辅助提取法、离子液体提取法以及微乳法等[9-11]。超声辅助提取法具有操作简单、投资费用低、提取率高、环境污染小等优点。前人主要以新鲜南瓜果肉为原料提取β-胡萝卜素[12-16],或以提取过南瓜多糖的滤渣为原料。本文以南瓜粉为研究对象,将超声辅助提取法应用于β-胡萝卜素的提取,并进一步考察其稳定性,从而为南瓜β-胡萝卜素的应用提供理论参考。
1 材料与方法
1.1 材料与仪器
南瓜粉:牡丹江康维食品有限责任公司;β-胡萝卜素(标准品):北京博奥拓达科技有限公司;无水乙醇(分析纯):天津市天力化学试剂有限公司;石油醚(分析纯):天津市富宇精细化工有限公司。
YH-A10002型电子天平 惠州市英衡电子科技有限公司;KQ-600V型超声波清洗器 昆山市超声仪器有限公司;SHZ-Ⅲ型循环水式真空汞、B-220型恒温水浴锅、RE52CS型旋转蒸发仪 上海亚荣生化仪器厂。
1.2 试验方法
1.2.1 南瓜中β-胡萝卜素提取工艺
采用关正萍等[17]的方法并略作修改,提取工艺:南瓜粉→加乙醇混匀→超声辅助提取南瓜β-胡萝卜素→过滤→滤液即为β-胡萝卜素提取液。
1.2.2 单因素试验设计
1.2.2.1 料液比对β-胡萝卜素提取率的影响
称取南瓜粉4 g,固定超声温度25 ℃、超声时间30 min,设置不同料液比梯度1∶4、1∶8、1∶12、1∶16、1∶20 (g/mL)进行提取,然后检测提取液的吸光度,计算β-胡萝卜素浓度,参照1.2.4中公式(1)计算提取率。
1.2.2.2 超声温度对β-胡萝卜素提取率的影响
称取南瓜粉4 g,固定料液比1∶8 (g/mL)、超声时间30 min,设置不同超声温度梯度30,40,50,60,70 ℃进行提取,然后检测提取液的吸光度,计算β-胡萝卜素浓度,参照公式(1)计算提取率。
1.2.2.3 超声时间对β-胡萝卜素提取率的影响
称取南瓜粉4 g,固定料液比1∶8 (g/mL)、超声温度25 ℃,设置不同超声时间梯度20,40,60,80,100 min进行提取,然后检测提取液的吸光度,计算β-胡萝卜素浓度,参照公式(1)计算提取率。
1.2.3 正交试验设计
设计L9(33)正交试验表,以超声时间(A)、超声温度(B)、料液比(C)为主要因素,并且每个因素设置3个水平进行研究,以提取率为指标进行分析,正交试验因素水平见表1。

表1 正交试验因素水平
1.2.4β-胡萝卜素含量的测定
参考郁兴娜[18]的方法绘制β-胡萝卜素标准曲线,并进行简单修改,首先称取20 mgβ-胡萝卜素标准品,用无水乙醇定容至25 mL,配制成标准溶液,再将标准溶液稀释至浓度为0.8,0.4,0.2,0.1,0.05 mg/mL,然后将5份标准溶液于444 nm处测定吸光值,绘制成标准曲线,y轴为吸光值,x轴为β-胡萝卜素浓度。
参考向珊珊等[19]的方法检测南瓜中β-胡萝卜素的含量,并进行简单修改。
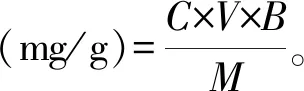
(1)
式中:M表示南瓜粉的质量,g;C表示提取液中β-胡萝卜素浓度,mg/mL;V表示提取液的体积,mL;B表示提取液稀释倍数。
1.2.5β-胡萝卜素的纯化
在β-胡萝卜素粗提取液中含有一些醇溶蛋白,为得到更高浓度的提取液,采用皂化反应将其去除。采用吕爽[20]的方法,并进行简单修改,配制15%的KOH溶液,按体积比2∶1加入β-胡萝卜素粗提取液中,混匀,放置12 h后过滤,按体积比1∶1加入石油醚进行萃取,其中水相去除,有机相用蒸馏水反复冲洗,直至中性,再用旋转蒸发仪浓缩至干,最后配制成0.05%的β-胡萝卜素醇溶液备用。
1.2.6β-胡萝卜素稳定性试验
1.2.6.1 光照对β-胡萝卜素保留率的影响
参考申海进等[21]的方法,并进行简单修改。配制0.05%南瓜β-胡萝卜素醇溶液,分别置于光照和黑暗处,每隔1 d(24 h)检测南瓜β-胡萝卜素醇溶液的吸光度(A),并根据公式(2)计算保留率。
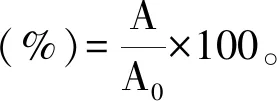
(2)
式中:A表示所测样品的吸光度;A0表示对照品的吸光度。
1.2.6.2 温度对β-胡萝卜素保留率的影响
参考孙静亚等[22]的方法。配制0.05%南瓜β-胡萝卜素醇溶液,在黑暗处分别置于4,20,50,75,100 ℃条件下,每隔1 h检测南瓜β-胡萝卜素醇溶液的吸光度(A),并计算保留率。
1.2.6.3 pH对β-胡萝卜素保留率的影响
参考杨晓玲等[23]的方法。配制0.05%南瓜β-胡萝卜素醇溶液,用1 mol/L NaOH溶液和1 mol/L HCl溶液调pH至4,6,8,10,每隔1 h检测南瓜β-胡萝卜素醇溶液的吸光度(A),并计算保留率。
1.2.6.4 金属离子对β-胡萝卜素保留率的影响
参考杨德孟[24]的方法。配制0.05%南瓜β-胡萝卜素醇溶液和0.1 mol/L NaCl、KCl、MgCl2、CaCl2、FeSO4、ZnCl2、FeCl3、AlCl3溶液,取离子溶液10 mL,加入β-胡萝卜素醇溶液5 mL,对照组加入蒸馏水10 mL、β-胡萝卜素醇溶液5 mL,置于-4 ℃下保存,24 h后测定吸光度(A),计算保留率并观察现象。
1.3 数据处理
使用Excel软件分析试验数据,应用SPSSAU进行极差和方差分析,应用OriginPro 2021绘图。
2 结果与分析
2.1 β-胡萝卜素标准曲线
β-胡萝卜素标准曲线见图1,方程为y=1.696x+0.027,R2=0.998 8,其中y为吸光度(A),x为β-胡萝卜素浓度(mg/mL),拟合度较好。
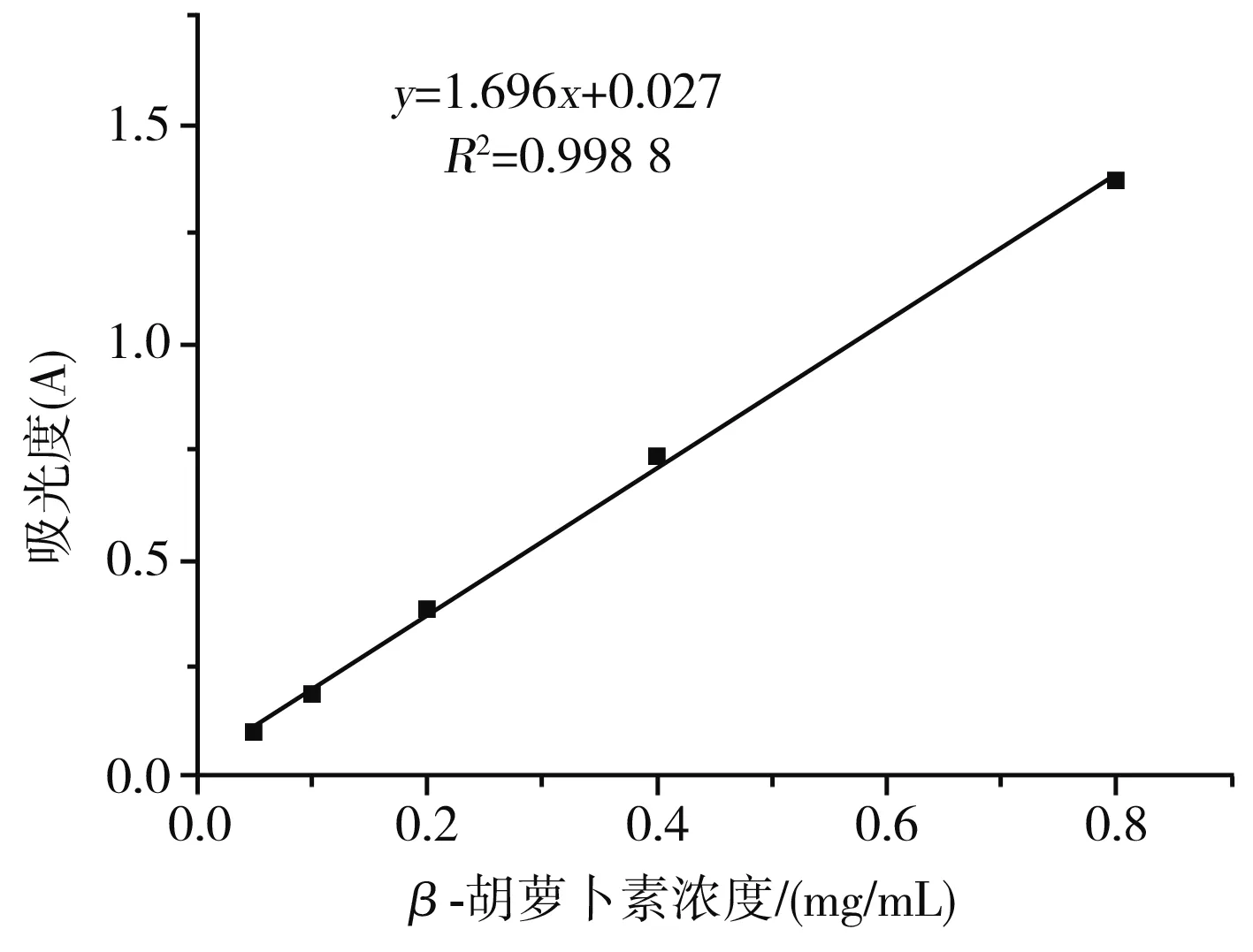
图1 β-胡萝卜素标准曲线
2.2 单因素试验结果
2.2.1 料液比对β-胡萝卜素提取率的影响
料液比对β-胡萝卜素提取率的影响见图2。
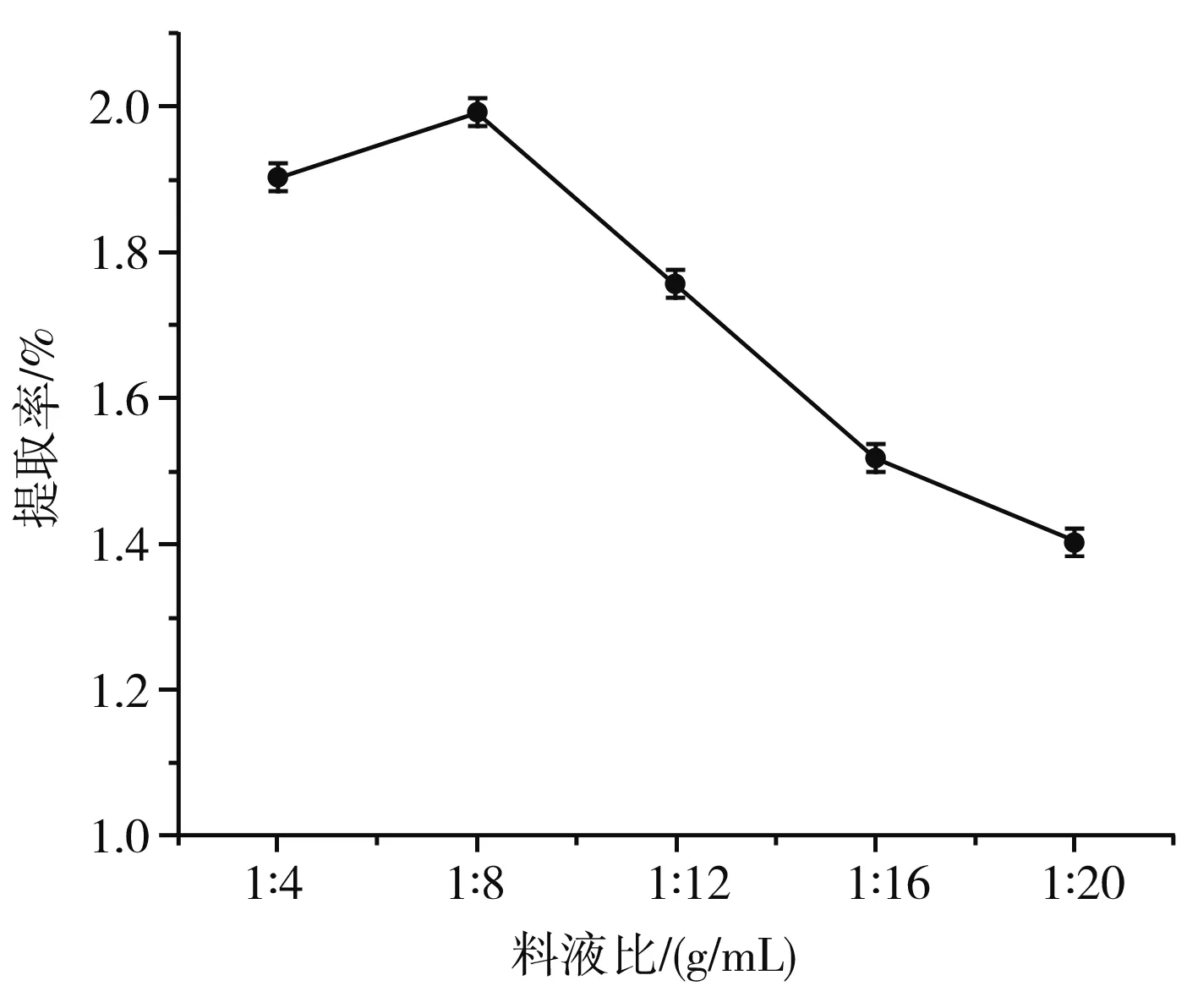
图2 料液比对β-胡萝卜素提取率的影响
由图2可知,图线呈现山峰状态,料液比在1∶8 (g/mL)时为最高点,提取率为1.99%,最高点之前提取率随料液比的增加略有上升,随后提取率下降,推测是由于料液比超过1∶8 (g/mL)时,溶液中会出现许多脂溶性物质与乙醇作用,从而抑制了β-胡萝卜素与之结合,影响了提取率[19],因此选择最优料液比为1∶8 (g/mL)。
2.2.2 超声温度对β-胡萝卜素提取率的影响
超声温度对β-胡萝卜素提取率的影响见图3。
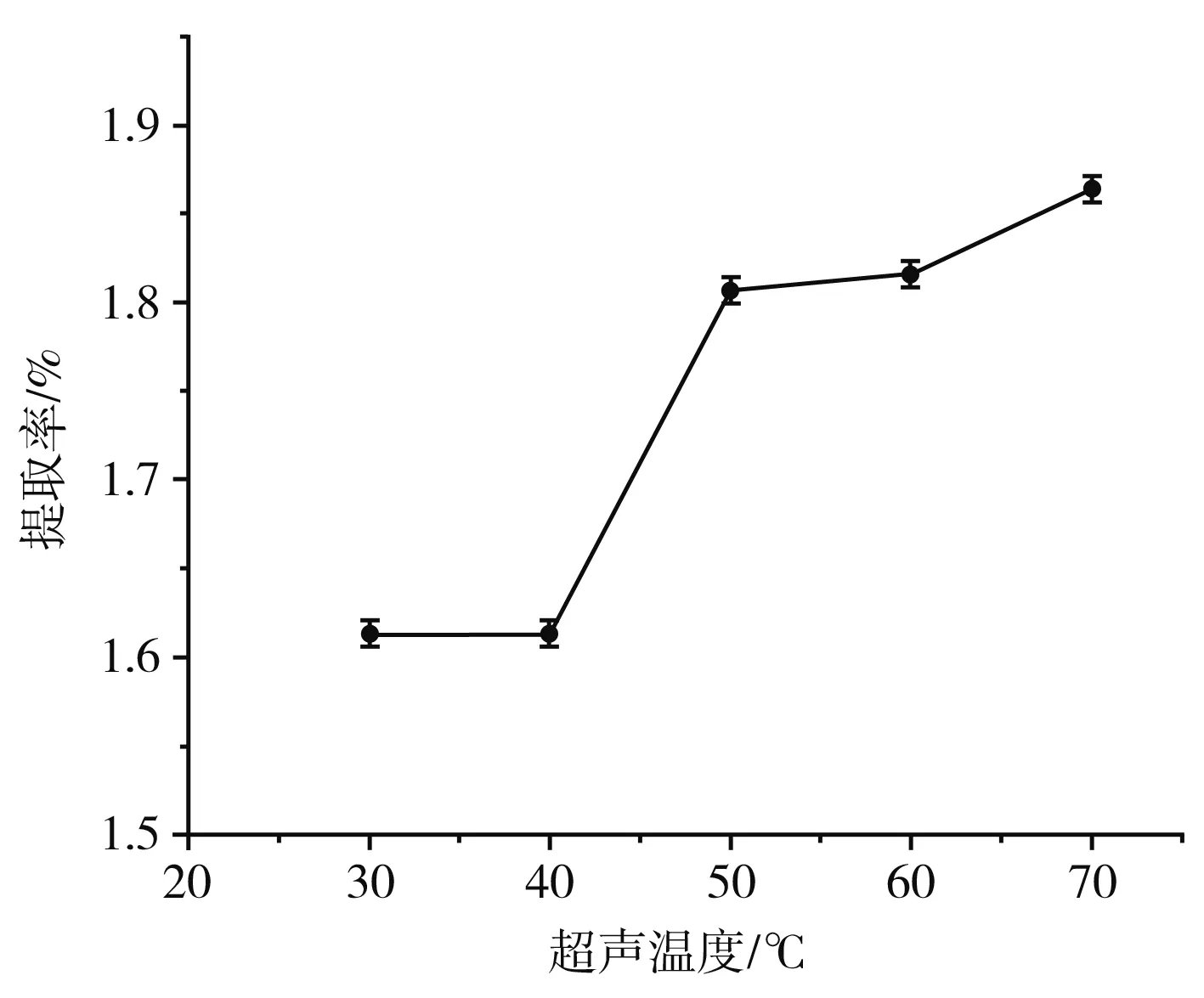
图3 超声温度对β-胡萝卜素提取率的影响
由图3可知,超声温度在30~40 ℃之间时,提取率几乎不增长,在40~50 ℃之间快速增长,50 ℃之后增长缓慢。在一定范围内,温度升高可使提取率增加,而超过50 ℃增长放缓,可能是由于高温对β-胡萝卜素产生了降解作用[25],因此选择最优超声温度为50 ℃。
2.2.3 超声时间对β-胡萝卜素提取率的影响
超声时间对β-胡萝卜素提取率的影响见图4。
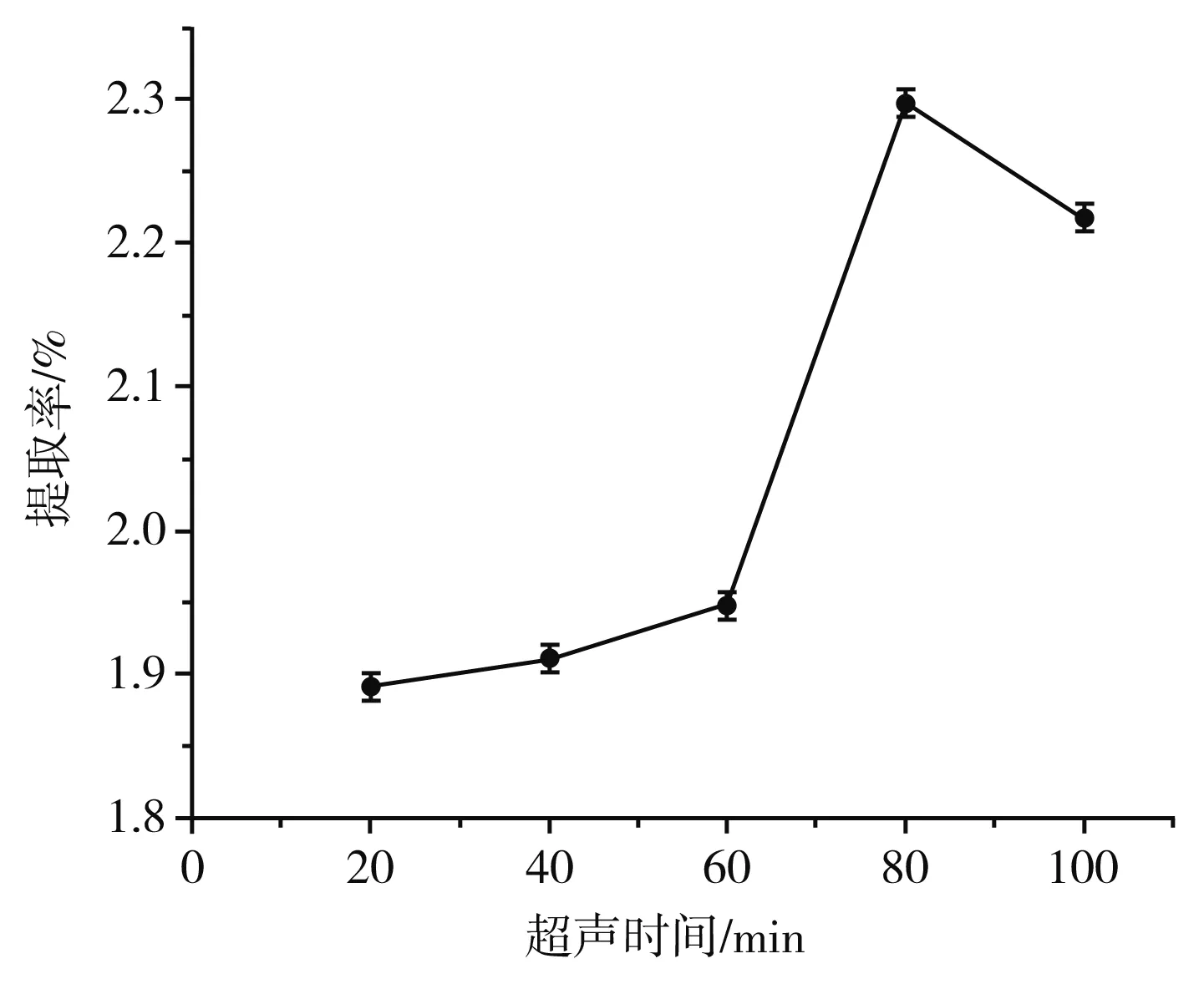
图4 超声时间对β-胡萝卜素提取率的影响
由图4可知,超声时间在20~80 min时,提取率先缓慢增长再迅速增长,在80 min时达到最大,当超过80 min时,提取率逐渐降低,推测可能是超声时间太长会诱导部分β-胡萝卜素发生降解作用[17],因此选择最优超声时间为80 min。
2.3 正交试验结果
由表2可知,RA>RB>RC;由表3可知,FA>FB>FC;二者结果一致,因此在超声辅助乙醇提取南瓜β-胡萝卜素的过程中,β-胡萝卜素提取的影响因素主次顺序为超声时间(A)>超声温度(B)>料液比(C)。超声辅助乙醇提取南瓜β-胡萝卜素的最佳条件为A2B2C2,即最佳工艺为超声时间80 min、超声温度50 ℃、料液比1∶8 (g/mL)。
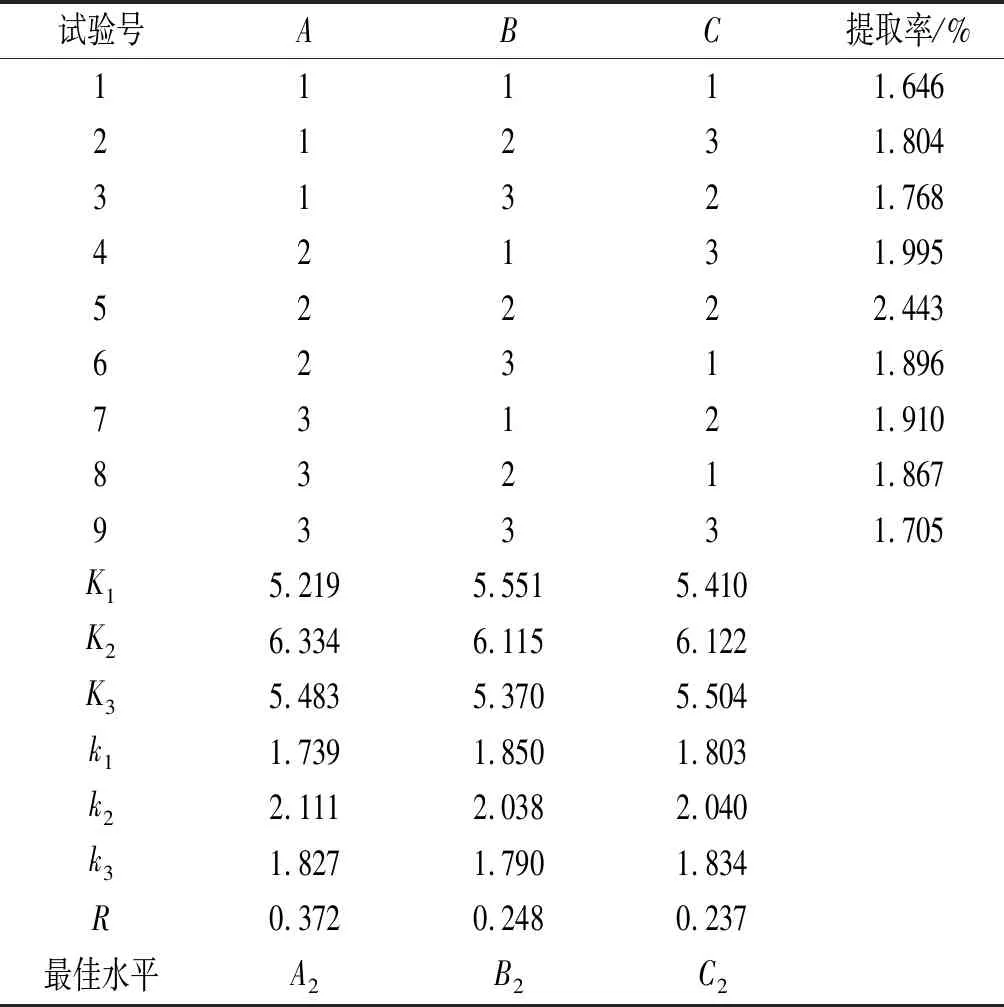
表2 L9(33)正交试验设计及结果
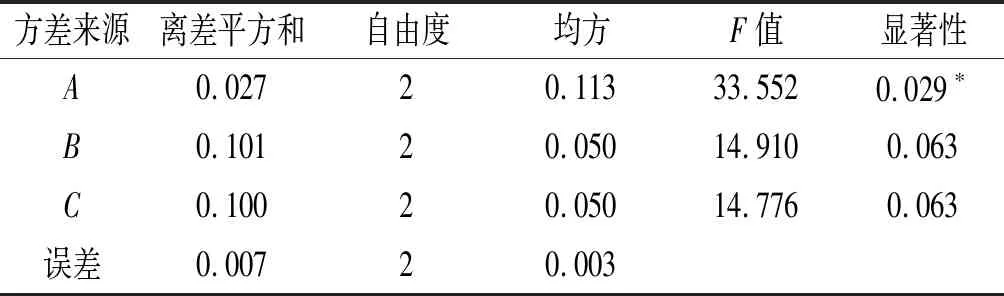
表3 正交试验方差分析结果
2.4 验证试验
用正交试验中的最佳参数A2B2C2进行5组验证试验,通过计算得到β-胡萝卜素提取量为(23.811±0.589) mg/g,和正交表中试验结果接近,证明该试验设计结果正确。张德华等[26]采用浸提法提取南瓜中色素,提取量为16.547 mg/g。徐小军等[27]以鲜南瓜果肉为原料,提取量为0.839 mg/g(鲜质量),提取率的差异可能是提取原料、材料预处理方法以及提取工艺等不同导致。
2.5 β-胡萝卜素稳定性试验
2.5.1 光照对β-胡萝卜素保留率的影响
光照和黑暗对其稳定性都有一定的影响,光照对β-胡萝卜素保留率的影响见图5。
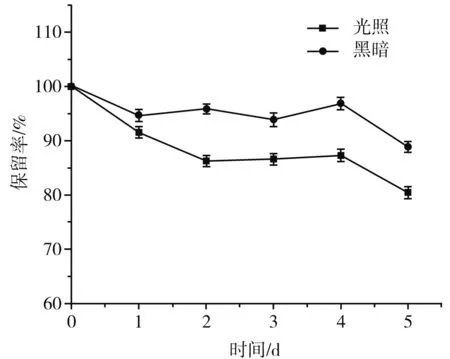
图5 光照对β-胡萝卜素保留率的影响
由图5可知,光照对保留率的影响较显著,黑暗对其影响较小,在第5天黑暗处样品保留率下降至88.84%,而光照处样品保留率下至80.47%,相差8.37%。由此可知光照会加速β-胡萝卜素的降解,黑暗更利于保存β-胡萝卜素,但也会有所降解[28]。
2.5.2 温度对β-胡萝卜素保留率的影响
由图6可知,在第1 h,4 ℃样品保留率下降缓慢,温度越高,样品保留率下降越明显,随着时间的延长,在4,25,50,75 ℃下β-胡萝卜素的保留率基本接近,但100 ℃下β-胡萝卜素降解非常明显,100 ℃对其稳定性的影响较大,在第6 h保留率降到44.45%,因此说明β-胡萝卜素有一定的耐热性,但温度不能太高[25]。
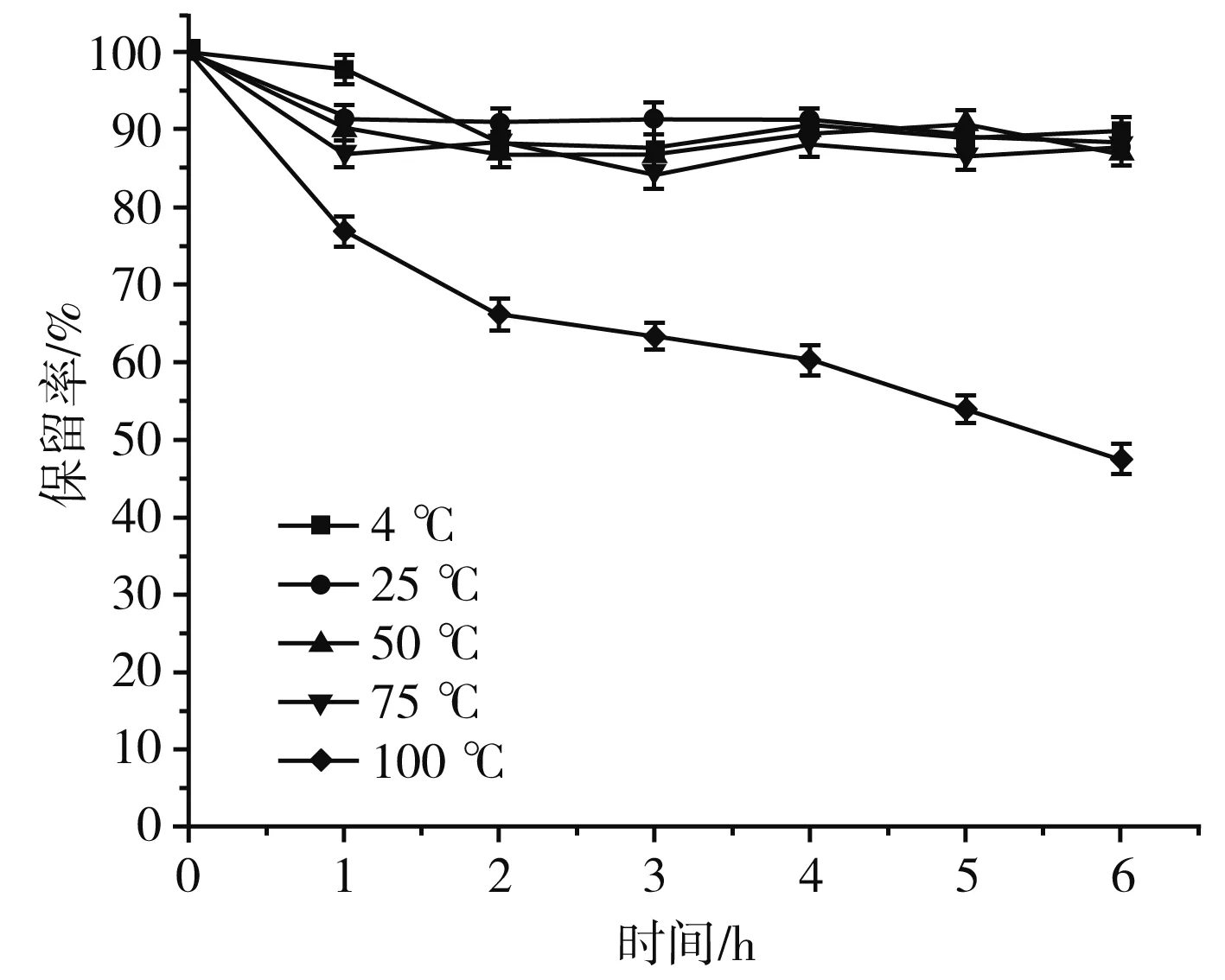
图6 温度对β-胡萝卜素保留率的影响
2.5.3 pH对β-胡萝卜素保留率的影响
由图7可知,在酸性(pH 4)和碱性(pH 8,10)条件下,保留率都有所降低。酸性(pH 4)和碱性(pH 8,10)中样品的保留率都小于pH 6下的保留率,原因可能是在酸性和碱性条件下,部分β-胡萝卜素被析出或降解。因此,β-胡萝卜素更适合在中性条件下保存[19]。
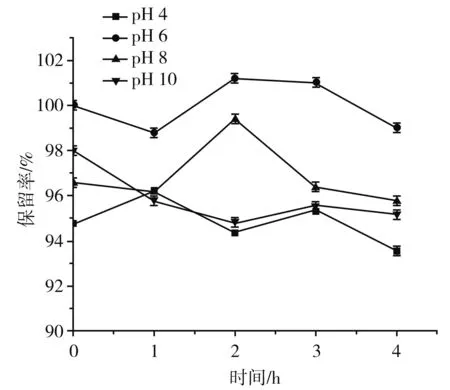
图7 pH对β-胡萝卜素保留率的影响
2.5.4 金属离子对β-胡萝卜素保留率的影响
所测金属离子均对其稳定性产生了一定程度的影响,结果见表4。
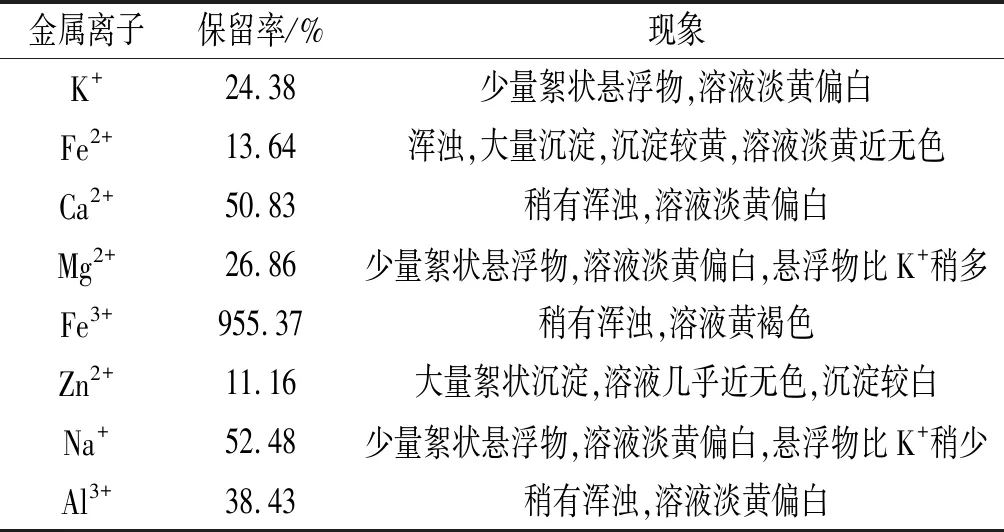
表4 金属离子对β-胡萝卜素保留率的影响
由表4可知,所测金属离子中Ca2+和Na+的影响相对较小,放置24 h后保留率在50%左右,Fe2+和Zn2+的影响较大,放置24 h后保留率在10%左右,原因可能是形成大量沉淀,β-胡萝卜素富集在沉淀中,使得溶液中β-胡萝卜素含量降低。但是Fe3+的加入使得β-胡萝卜素的保留率明显上升,放置24 h后保留率达到了955.37%,原因可能是Fe3+本身带有更深的黄色,加入后使得吸光度上升[15]。
3 结论
超声辅助乙醇提取南瓜中β-胡萝卜素的最佳工艺为超声时间80 min、超声温度50 ℃、料液比1∶8 (g/mL),在此参数下,β-胡萝卜素提取量为(23.811±0.589) mg/g。
在稳定性试验中,光照、温度、酸碱性、金属离子对南瓜中β-胡萝卜素均有一定的影响,其中光照、温度和金属离子对其影响较大,保存时宜放置于避光、低温处,并注意保存器皿的选择。不同的pH值会对南瓜中β-胡萝卜素的稳定性带来影响,酸性和碱性都会使之降解,中性条件对稳定性无明显影响。所测金属离子中,Zn2+和Fe3+对南瓜β-胡萝卜素的影响最强烈。本研究可为南瓜色素在调味品中的应用提供理论参考。
