L-苏氨酸醛缩酶:C—C键手性合成的绿色催化剂
2023-10-10郑文隆杨立荣吴坚平
郑文隆,徐 刚,杨立荣,,吴坚平,
(1.浙江大学杭州国际科创中心生物与分子智造研究院,浙江 杭州 311200;2.浙江大学化学工程与生物工程学院,浙江 杭州 310058)
利用生物催化技术制备手性化学品具有重要意义,经过多年努力,我国学者已经取得了很多重要成果。如,欧阳平凯院士等主持的国家重点研究发展计划(973计划)“生物催化和生物转化中关键问题的基础研究”等项目开发了一系列利用生物法制备高值手性化学品的技术路线(d-泛酸、d-泛醇和苯基-1,2-乙二醇等)[1-5]。近年来,利用L-苏氨酸醛缩酶(L-threonine aldolase,LTA,EC 4.1.2.X)催化合成β-羟基-α-氨基酸成为研究热点之一[6]。LTA是一种磷酸吡哆醛(PLP)依赖酶,能够可逆催化甘氨酸和多种醛(芳香醛和脂肪醛)生成β-羟基-α-氨基酸[6](图1(a))。该过程一步反应生成2个手性中心,在不对称合成方面应用潜力巨大[7]。β-羟基-α-氨基酸是一类重要的手性砌块,在医药、农业和食品等领域应用广泛[8],可用于合成多种药物,如新冠口服药阿兹夫定、艾滋病用药达芦那韦、帕金森症特效药屈昔多巴、兽用广谱抗生素氟苯尼考等[9](图1(b))。
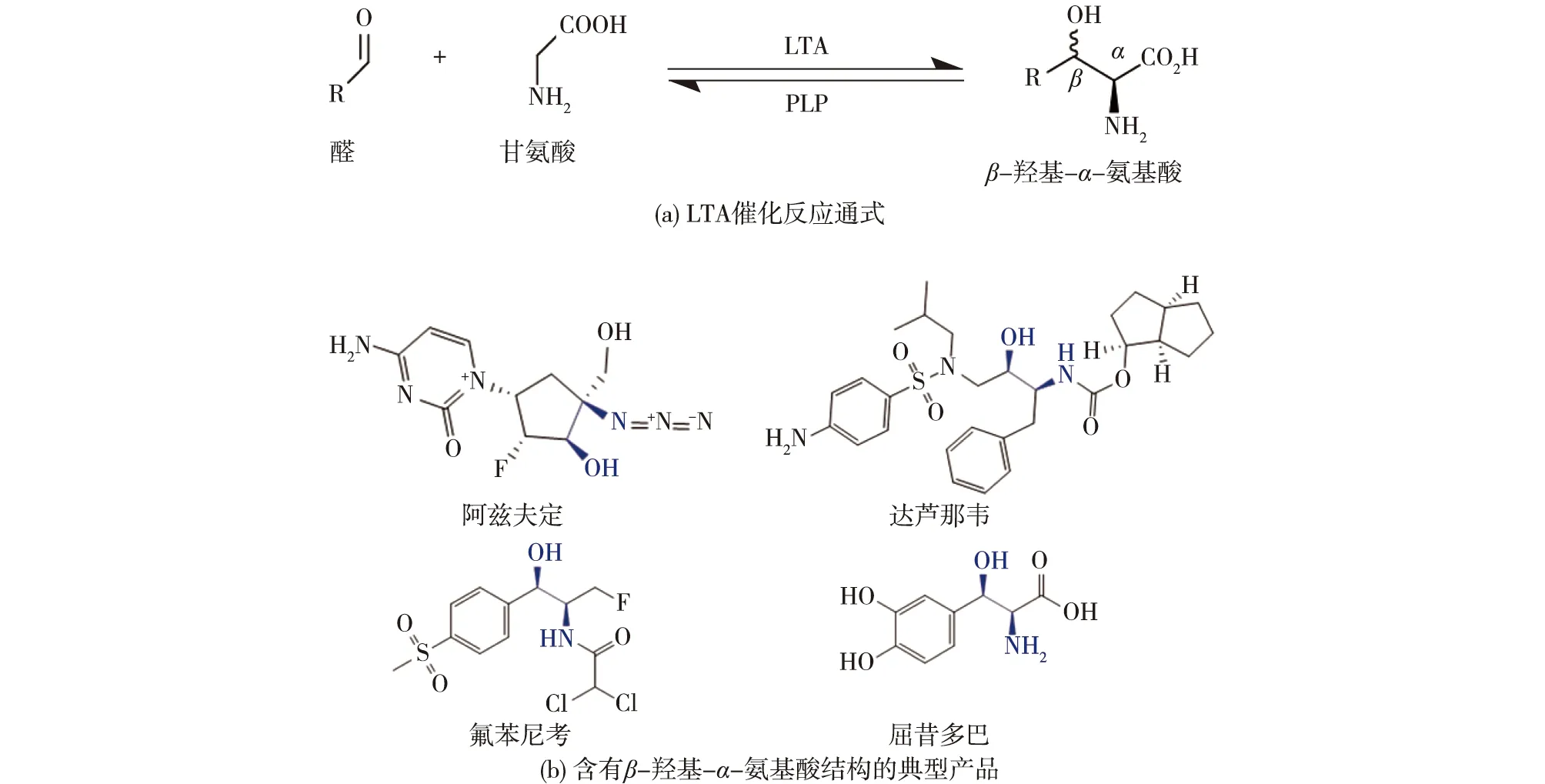
图1 β-羟基-α-氨基酸的制备及其在医药领域的应用Fig.1 Preparation of β-hydroxy-α-amino acid and its application in pharmaceutical field
化学法合成β-羟基-α-氨基酸存在过程复杂、条件苛刻、环境污染大及产物光学纯度低等缺点,不符合绿色可持续发展理念[10]。然而,生物催化过程高效绿色,利用生物法制备手性化学品具有反应条件温和、产物立体选择性高和环境污染小等优点[11-12]。基于此,本文综述了LTA新酶挖掘、催化机制解析、分子改造和手性砌块合成等方面的研究进展,以期为LTA的深入研究和应用提供思路和借鉴,促进结构多样、功能丰富的β-羟基-α-氨基酸生物合成体系的构建。
1 LTA的来源及分类
LTA来源十分广泛,普遍存在于微生物、动物和植物中。该酶参与生物体内甘氨酸和苏氨酸代谢,可裂解苏氨酸生成甘氨酸,是生物体内产生甘氨酸的重要途径,其中微生物来源的LTA研究最为广泛。如,Escherichia coli(EcLTA)[13]、Aeromonas jandaei(AjLTA)[14]、Thermotoga maritima(TmLTA)[15]、Pseudomonas putida(PpLTA)[16]、Bacillus nealsonii(BnLTA)[17]、Leishmania major(LmLTA)[9]、Actinocorallia herbida(AhLTA)[18]、Streptomycessp.(SsLTA)[19]、Saccharomyces cerevisiae(ScLTA)[20]等来源的LTA(表1)。不同来源的LTA基因序列同源性差异较大,如TmLTA和BnLTA的序列同源性仅有10.95%(图2)。
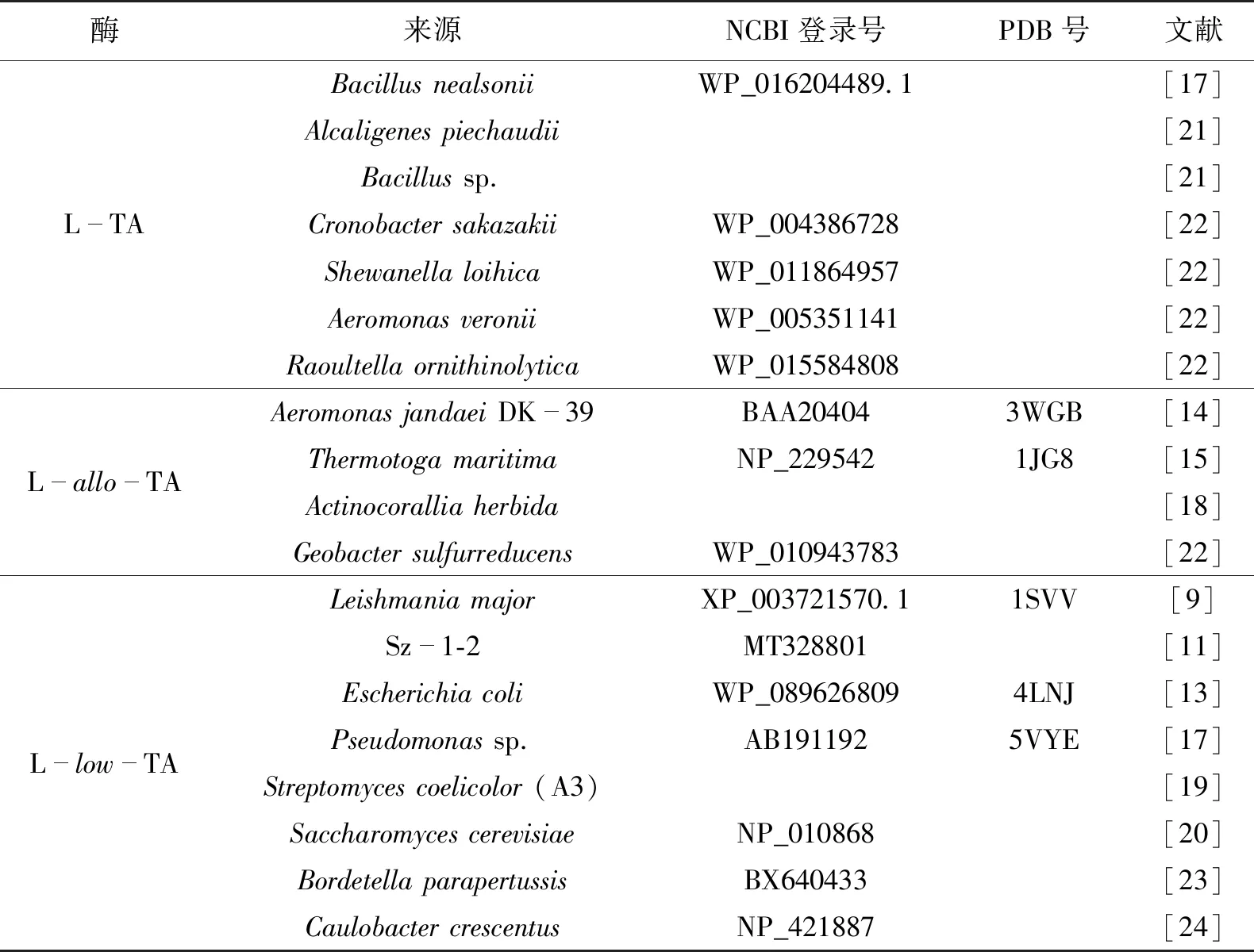
表1 部分文献报道的LTA及其分类

红色表示一致序列;蓝绿色表示保守序列;白色表示不保守序列图2 不同来源LTA多序列比对Fig.2 Multiple sequence alignment of LTAs from different microorganisms
研究表明,LTA对β羟基-α-氨基酸的Cα具有严格的立体选择性(对映体过量值(e.e.值)>99%),而对其Cβ的立体选择性不高[21]。根据对L型苏氨酸Cβ的选择性,LTA进一步被分为L-TA(EC 4.1.2.5)、L-allo-TA(EC 4.1.2.49)和L-low-TA(EC 4.1.2.48)[25]。如:L-TA对L-syn-苏氨酸选择性高,包括PpLTA、BnLTA等;L-allo-TA对L-anti-苏氨酸选择性高,包括AjLTA、TmLTA等;而L-low-TA的构型偏好性不明显,包括EcLTA和ScLTA等[22]。以上分类仅基于LTA对L型苏氨酸的非对映体选择性[26]。同一种酶对不同的醛基底物也会产生不同的构型偏好性,如PaLTA催化合成芳香类β羟基-α-氨基酸时普遍展现出L-syn构型产物偏好性[6]。
2 LTA的结构特点
目前,已有多个不同来源的LTA晶体结构被解析,包括Neptunomonas marina(NmLTA,PDB:7YVR)[8]、Escherichia coli(EcLTA,PDB:4LNJ)[13]、Thermotoga maritima(TmLTA,PDB:1LW4)[15]、Aeromonas jandaei(AjLTA,PDB:3WGB)[14,27]和Pseudomonas putida(PpLTA,PDB:5VYE)[17,28]、Leishmania major(LmLTA,PDB:1SVV)[9]等。尽管它们的氨基酸序列存在较大差异,但空间结构类似,序列比对显示不同结构之间的均方根偏差(RMSD)<0.25 nm,表明它们的空间结构差异较小。LTA为同源四聚体,由4个相同的亚基聚合而成,每个单亚基由大小两个结构域组成(图3)。在范德华力、疏水相互作用和氢键等作用下,4个亚基的大结构域相互聚集,而4个小结构域分布在外侧。每个亚基具有一个活性中心,位于大小两个结构域的交界处,该结构特点导致LTA活性中心的空间较大,由此使得LTA底物谱十分广泛[17,26]。LTA活性中心的结构复杂,每个活性中心由相邻3个亚基的氨基酸残基组成。如,EcLTA的D亚基活性中心由A、C和D这3个亚基的相应氨基酸组成[13]。

图3 不同来源LTAs三维结构比对及EcLTA的D亚基空间结构特写Fig.3 Structure alignments of various LTAs and the view of subunit D of EcLTA
3 LTA的催化机制
Di Salvo等[13]以EcLTA为对象初步解析了LTA的催化机制:与其他PLP依赖酶类似,EcLTA催化反应前PLP与酶活性中心的赖氨酸残基形成内醛亚胺复合体(PLP-酶)。反应过程中,甘氨酸(Gly)进入活性中心取代赖氨酸,与PLP生成外醛亚胺复合体(PLP-Gly)。甘氨酸的Cα与PLP吡啶环垂直的碳氢键能够与辅酶形成共轭结构,易于断裂去质子化形成Cα碳负离子。当底物醛接近Cα时,Cα碳负离子的电子攻击醛的羰基碳原子,形成烷氧负离子。最后,经过质子传递,烷氧负离子获得氢原子形成β羟基(图4(a))。EcLTA中His83和His126能够与Cβ的羟基形成氢键,这两个残基在LTA家族中高度保守(图2)。由此他们推断,His83和His126在羟基形成过程中起到质子传递作用,于是构建了一系列突变体进行验证,结果发现:His126系列突变体的酶活保持不变或者提高,说明His126不参与催化反应的质子传递;His83系列突变体都丧失了催化活性,然而在加入过量PLP后,突变体却能表现出微弱活性,由此认为His83也没有参与质子传递,可能是活性中心的水分子参与质子传递,His83仅仅起到固定水分子的作用。

图4 LTA催化机制Fig.4 Catalytic mechanism of LTA
2022年,Rocha等[29]利用量子力学(QM/MM)法在原子水平上进一步解析了LTA的催化机制(图4(b)),该反应可以概括为3个步骤:EA2去质子化、C—C键断裂和甘氨酸释放;EA1在活性中心的位置非常重要,决定反应是否发生;反应的限速步骤是C—C键断裂,需要69.9 kJ/mol能量,相比其他步骤更加困难;Lys224、PLP的磷酸基团和水分子起着重要的质子/电子传递作用,进一步证实水分子参与反应质子传递,而非His83。
4 LTA催化特性及存在的问题
利用LTA制备手性β-羟基-α-氨基酸具有反应条件温和、产物对映体选择性严格、醛基底物范围广以及原子经济性高等优点,应用潜力巨大。但野生酶的应用存在一些瓶颈,如非对映体选择性低、氨基底物谱窄和反应转化率不高等问题[12,21]。在LTA催化合成β-羟基-α-氨基酸过程中,对其Cα具有严格的立体选择性,而对Cβ碳原子的立体选择性不高,得到的往往是L-syn和L-anti构型混合物。Franz等[26]、Fesko等[23]、Steinreiber等[30]和Liu等[31]研究发现,该酶对乙醛等天然底物具有较高的非对映体选择性(>90%),而对大部分脂肪醛和芳香醛等非天然底物的非对映体选择性较低(<65%)。由于醛缩反应是可逆反应,受热力学平衡影响,体系中2种非对映体的浓度不断接近,产物的非对映体过量值(d.e.值)不断降低。有学者尝试通过动力学控制得到高光学纯β-羟基-α-氨基酸,然而这种策略是以牺牲转化率为代价的,造成底物转化率不高、催化效率降低[26]。
为了提高LTA的非对映体选择性,有学者在反应体系中添加有机溶剂,通过改变酶的催化环境来影响活性中心的微环境。Chen等[32]通过在反应体系中添加体积分数10%~20%的乙腈、丙酮、二甲基甲酰胺(DMF)和二甲基亚砜(DMSO)等溶剂,LTA的非对映体选择性提升了20%~30%。Cech等[33]发现,LTA的非对映体选择性与有机溶剂种类有关,当反应体系中加入甲苯时得到的产物是L-anti-苯丝氨酸,而加入甲基四氢呋喃时得到的是L-syn-苯丝氨酸。
酶的活性和稳定性也是其工业化应用的重要因素,野生LTA对非天然底物的活性较低,且稳定性差。同时,非对映体选择性与活性和稳定性之间存在trade-off现象,当非对映体选择性提升时,往往伴随着活性、稳定性下降。Zheng等[17]利用分子改造技术将BnLTA的非对映体选择性从65.4%提高至93.1%,而比酶活却从2.9 U/mg降至1.2 U/mg。近年来,利用分子改造提高LTA非对映体选择性取得了巨大进展,详细内容将在下节进行介绍。
LTA催化的醛缩反应有两个底物,分别是醛基底物和氨基底物(图1(a))。理论上,不同的醛基底物和氨基底物组合能够产生结构丰富、功能各异的β-羟基-α-氨基酸。LTA醛基底物混杂性非常高,能够识别多种脂肪醛、芳香醛等作为底物[26]。相反,野生LTA氨基底物混杂性却很低,多数LTA只能接受甘氨酸为氨基底物,对其他的非天然氨基底物识别能力差。目前只有4个LTA能够以D-丙氨酸或D-丝氨酸等作为氨基底物合成β-羟基-α-氨基酸,但活性普遍较低[22,27,34-35]。国内外多个团队利用LTA制备β-羟基-α-氨基酸的研究也都以甘氨酸为氨基底物。如,日本Toyama Prefectural大学Yamada团队利用LTA催化甘氨酸和苯甲醛制备苯丝氨酸[28,36]。中科院天津工业生物技术研究所朱敦明教授团队[32,37]、福州大学林娟教授团队[18]、浙江大学吴坚平教授团队[9,38]和上海交通大学冯雁教授团队[8]等利用甘氨酸和对甲砜基苯甲醛合成对甲砜基苯丝氨酸。江南大学倪晔教授团队[10]利用甘氨酸和呋喃醛合成手性呋喃丝氨酸。可见,LTA氨基底物混杂性低的缺陷极大限制了产物β-羟基-α-氨基酸的多样性。
由于LTA催化的醛缩反应为可逆反应,热力学平衡导致反应转化率不高。因此在反应时,一般采取甘氨酸过量的办法提高转化率,当甘氨酸和底物醛的摩尔比为10∶1时,转化率超过60%[17]。此外,转化率也受醛基底物种类和助溶剂的影响,溶解度高的醛基底物转化率高,适当添加助溶剂能够增加醛基底物浓度,进一步提高反应转化率。Zheng等[17,39]通过添加25% DMF作为助溶剂,对甲砜基苯甲醛转化率超过70%。Wang等[18]使用30%乙腈反应体系,底物转化率超过90%。Cai等[40]使用40%乙醇反应体系,对硝基苯甲醛转化率超过90%,但大量使用有机溶剂不符合绿色生物催化的要求。
5 LTA的分子改造
野生型LTA制备β-羟基-α-氨基酸存在非对映体选择性低、活性和稳定性差、氨基底物谱窄以及转化率不高等问题,不能满足工业化应用需求。利用蛋白质工程手段探究LTA结构和功能关系并对其进行分子改造是提高该酶催化鲁棒性的有效方法。最近,通过定向进化、理性和半理性设计提高LTA非对映体选择性、活性和稳定性取得了巨大进展。然而,利用分子改造扩展氨基底物谱、提高转化率的研究相对较少。
5.1 高通量筛选方法
定向进化和半理性设计是LTA工程化改造的主要手段,该过程会产生大量的突变体。开发高通量筛选方法从大量突变体中快速获得阳性突变是提高该酶进化效率的关键。目前,针对LTA活性、稳定性和选择性等方面开发了多种高通量筛选方法。LTA活性改造常用生长偶联法进行高通量筛选。如,构建甘氨酸营养缺陷型菌株,利用LTA裂解β-羟基-α-氨基酸产甘氨酸的特性,可以快速筛选出酶活提高的突变体。Giger等[24]和Bulut等[41]利用该方法分别对E.coliMG1655和P.putida进行底盘细胞改造构建甘氨酸营养缺陷型宿主,用于高活性LTA的筛选。Lee等[42]利用乙醛的细胞毒性构建生长依赖型系统筛选活性提高的LTA突变体。因为LTA能够催化乙醛和甘氨酸生成苏氨酸,高活性突变株会快速消耗乙醛,降低培养基毒性,正常生长繁殖。该方法既能筛选突变体的活性,还可以应用于有机溶剂耐受性、热稳定性等功能突变体的筛选。Chen等[32]耦联L-TA和L-threo-苯丝氨酸脱水酶(L-threo-PSDH)构建了活性和立体选择性分步可视化筛选方法(图5(a))。L-threo-苯丝氨酸脱水酶能够催化L-threo-苯丝氨酸生成相应的酮酸,但不能识别L-erythro-苯丝氨酸,因此在反应过程中检测醛基底物消耗量和酮酸的生成量,可间接计算突变体的活性和非对映体选择性。该方法依赖L-threo-苯丝氨酸脱水酶的活性和选择性,对不同醛基底物适配性需要进一步优化。Zheng等[39]和Li等[43]开发了基于醛缩反应逆反应的高通量筛选方法,用于筛选LTA突变体的活性和非对映体选择性(图5(b))。该方法利用2,4-二硝基苯肼(DNPH)显色法检测裂解反应生成的醛,通过分别检测同一个突变体对不同构型β-羟基-α-氨基酸的催化效率,然后计算突变体的活性和选择性。但需要注意的是,只有LTA催化合成反应和裂解反应的活性呈正相关时,该方法才能够使用。Zheng等[39]利用该方法获得了非对映体选择性大于99%的突变体,Li等[41]利用该方法筛选到的突变体的非对映体选择性是野生型的5.1倍。

图5 LTA高通量筛选方法Fig.5 High throughput screening method for LTA
5.2 非对映体选择性改造
非对映体选择性低是阻碍LTA广泛应用的主要因素。近年来,多个研究团队致力于研究和解决这一问题。利用蛋白质工程手段对LTA活性中心的底物结合位点、活性口袋和底物通道进行改造提高LTA的非对映体选择性取得显著进展。Fesko等[27]利用生物信息学技术将AjLTA与多种来源的PLP依赖型酶进行比对分析后发现,家族特异性位点(family-specific positions,FSP)能够通过控制PLP在活性中心的位置来影响酶的底物特异性,因此家族特异性位点可以作为探究LTA非对映体选择性的重点。Chen等[32]对来源于Pseudomonassp的LTA进行同源建模,并对底物结合位点进行突变,结果发现:突变体D93F/E147D、D93H/E147D和D93N/E147D能够实现非对映体选择性的提高甚至反转,其中D93和E147两个位点不同程度影响了2个非对映体的β-羟基与催化氨基酸(组氨酸)的距离,从而导致选择性改变,为LTA的非对映体选择性改造提供了新的思路。Wang等[44]对AhLTA的底物结合口袋进行改造获得了突变体N16A/E98S/Y314R,使非对映体选择性从23%提高至81%。Li等[43]利用易错PCR对PpLTA随机突变,从4 000多个突变体中获得了A9V/Y13K/Y312R,该突变体的非对映体选择性是野生酶的5.1倍,达到86%;分子动力学模拟表明,与野生型相比,该突变体中存在额外的氢键、盐桥、疏水相互作用和π-阳离子相互作用,底物结合口袋得到重塑。Zha等[11]从黑熊肠道微生物宏基因组中分离出LTA(Sz-1-2)并进行了同源建模,在模型结构的指导下对酶的活性中心进行虚拟筛选获得了突变体R318L/H128N,该突变体的非对映体选择性从31.2%提高至93.7%。Zheng等[39]在LTA改造过程中提出了影响非对映体选择性的路径假说:认为醛从不同的路径进入活性中心导致不同构型β-羟基-α-氨基酸的形成(图6);并提出阻碍anti式产物路径,强化syn式路径的改造策略,获得了非对映体选择性>99%的突变体RS1。基于该假说,他们利用空间位阻、静电作用、π-π相互作用对LmLTA的底物进出通道微环境进行调节,获得的突变体WFH非对映体选择性从26.8%提高至96.3%[9]。随后,Xu等[1]应用Prelog规则解释了LTA非对映体选择性的形成机制(图6(b)):当Cα负离子的电子攻击底物醛re-face时,形成anti式产物;相反,当Cα负离子的电子攻击底物醛的si-face,形成syn式产物。Prelog规则对指导催化碳-碳键不对称合成酶的立体选择性改造具有普适性,如转醛酶、转酮醇酶等。在路径假说和Prelog规则的共同指导下,结合突变景观分析和CAST/ISM突变策略对CpLTA进行改造,获得的突变体H305L/Y8H/V143R对L-syn-MTPS的非对映体选择性从37.2%提高至99.4%,突变体H305Y/Y8I/W307E对L-anti-MTPS的非对映体选择性反转至97.2%。He等[8]使用同样的策略对Neptunomonas marine来源的NmLTA进行改造,突变体N18S/Q39R/Y319L的非对映体选择性>99%。
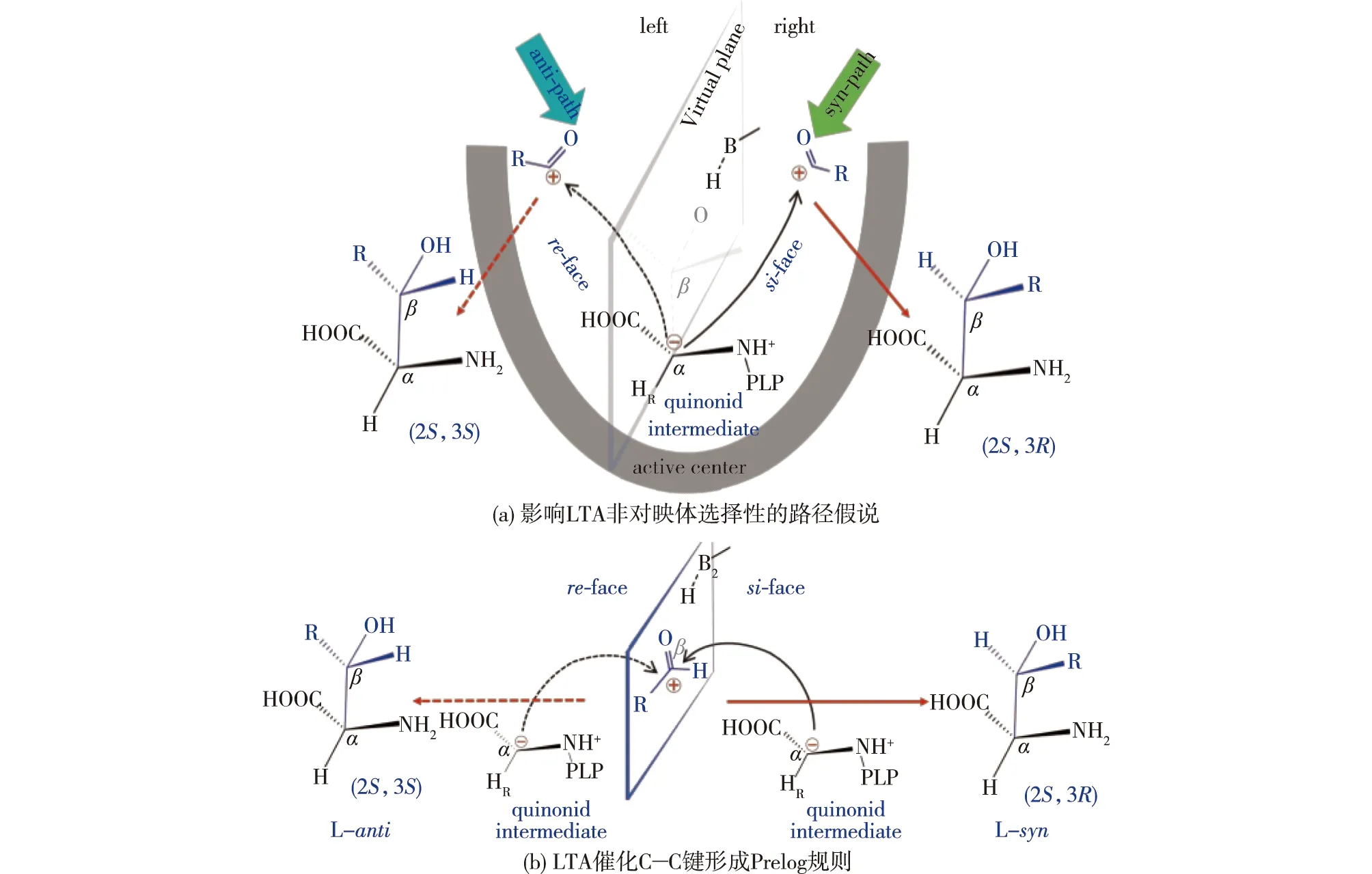
图6 LTA中的Prelog规则和路径假说[1,39]Fig.6 Prelog rule and path hypothesis in LTA[1,39]
5.3 稳定性和活性改造
酶的稳定性和活性是生产应用的重要指标,提高LTA的稳定性和活性有助于降低生产成本,减少三废排放,进一步增强该酶的工业应用潜力。Baik等[19]对S.coelicolor来源的LTA热稳定性进行改造,结果发现:H177Y、A169T、D104N和F18I这4个突变体在60 ℃处理20 min后残余酶活大幅提升,分别为85.7%、67.6%、62.1%和58.6%,是野生酶(10.6%)的5~8倍。Wieteska等[15]通过向TmLTA亚基间引入盐桥或二硫键提高其稳定性,结果发现:突变体P56C在80 ℃时的热稳定性提高了15%,且酶活不受影响;在改造过程中还获得了活性提高的突变体W86E。Cai等[40]对PpLTA不稳定的loop区域进行改造,获得的18点突变体EM-ALDO031在40%乙醇中的稳定性是野生酶的30倍。Fang等[45]以BnLTA为研究对象探究了该酶非对映体选择性和活性trade-off的问题,结果发现:对其活性中心微环境改造,获得的突变体RS1-VR(T92V/E123R)比酶活达到18.65 U/mg,是原始酶的2倍,同时保持了较高的非对映体选择性(94.21%)。He等[8]在改造NmLTA非对映体选择性过程中获得的突变体N18S/Q39R/Y319L,不仅其非对映体选择性得到提高,同时酶活也从64.8 U/mg提高至95.7 U/mg,为目前报道的最高酶活。
6 LTA在手性合成中的应用
利用LTA制备手性β-羟基-α-氨基酸原子经济性高,应用前景广。生物法制备氟苯尼考前体L-syn-对甲砜基苯丝氨酸是当前的研究热点。Zheng等[17]通过分子改造提高了BnLTA的非对映体选择性,首次实现生物法制备L-syn-对甲砜基苯丝氨酸且d.e.值>99%,当反应体系中添加了25% DMF后,100 mmol/L底物的转化率超过70%。Wang等[18]使用AhLTA突变体,在30%乙腈体系中进行反应,底物浓度为300 mmol/L,转化率超过90%,产物d.e.值达到93.7%;随后使用该产物制备L-syn-对甲砜基苯丝氨酸乙酯,产物纯度超过99%。He等[8]在10% DMF反应体系中催化100 mmol/L底物制备L-syn-对甲砜基苯丝氨酸,时空产率达到9.0 g/(L·h),工业应用潜力巨大。
L-syn-3,4-二羟基苯丝氨酸(药用名屈昔多巴),是一种治疗帕金森综合征的特效药。LTA可以一步催化3,4-二羟基苯甲醛和甘氨酸制备L-syn-3,4-二羟基苯丝氨酸,应用潜力巨大。Zha等[11]利用全细胞催化制备l-syn-3,4-二羟基苯丝氨酸,其产物d.e.值达到95.4%,时空产率为1.6 g/(L·h)。相比于LTA制备l-syn-对甲砜基苯丝氨酸,该反应有进一步提升的空间。
L-syn-对硝基苯丝氨酸是氯霉素的中间体,余进海等[46]利用重组表达LTA的大肠杆菌全细胞催化100 mmol/L对硝基苯甲醛和甘氨酸制备L-syn-对硝基苯丝氨酸,实现43%的转化率。Cai等[40]使用PpLTA突变体在40%乙醇体系中反应,底物质量浓度为150 g/L(约815 mmol/L),转化率超过90%,但产物d.e.值仅为85%。Gong等[10]利用磁性材料(Fe3O4@MCM-41/SO2-4)制备固定化酶催化糠醛和甘氨酸缩合制备β-(2-呋喃)丝氨酸。该方法不仅能够对生物质降解液进行预处理降低糠醛生物毒性,还实现了高价值非天然氨基酸制备。
Chai等[47]将LTA应用于DNA文库编码技术(DNA encoded library technology,DEL),利用LTA底物谱广的催化特性增加DNA的多样性。
Ligibel等[48]利用Vanrija humicolaAKU4586来源的LTA催化了一系列芳香类、氮杂环类以及不同取代基团的醛基底物制备多种β-羟基-α-氨基酸,其转化率为0.7%~95%,大大丰富了LTA的应用场景。Fesko等[22]通过扩展氨基底物,利用D-丙氨酸、D-丝氨酸等代替甘氨酸与醛进行缩合制备tertiary-α-氨基酸,尽管转化率较低,但扩大了LTA在手性化学品制备中的应用潜力。
此外,LTA还可以用于其他药物中间体制备,如新冠口服药阿兹夫定、艾滋病用药达芦那韦等。由于这些药物结构复杂,双手性C—C键合成难度大,使用LTA进行手性砌块制备有望提高该类药物的生产效率。
7 总结与展望
LTA来源多样、底物谱广,利用LTA制备手性β-羟基-α-氨基酸反应条件温和、原子经济性高、环境污染小,应用前景广阔。目前,LTA非对映体选择性机制得到初步解析,路径假说和Prelog规则能够有效指导LTA非对映体选择性改造。因为影响LTA非对映体选择性的因素较多,如有机溶剂、底物种类等,所以需要进一步探索LTA非对映体选择性机制,并不断完善该酶非对映体选择性改造策略。醛缩反应为可逆反应,热力学平衡导致该反应转化率较低,虽添加过量甘氨酸推动反应平衡能提高转化率,但导致生产成本增加、经济效益降低。
尽管在反应体系中添加DMF、乙醇和乙腈等有机溶剂能一定程度提高转化率,但大量使用有机溶剂不符合绿色生物发展理念。可见,提高醛缩反应转化率是当前LTA工业应用面临的一个新挑战。此外,虽然LTA醛基底物谱广,但是氨基底物谱窄,仅能接受甘氨酸、丙氨酸等小型氨基酸,这极大限制了β-羟基-α-氨基酸的结构多样性。因此,解析LTA氨基底物识别机制,扩展LTA氨基底物谱范围能够进一步丰富该酶的应用场景提高其工业应用潜力。
基于计算机软件和硬件性能不断提升,生物信息学、计算生物学和人工智能等学科飞速发展,为LTA的分子改造提供了巨大便利。利用分子动力学模拟、QM/MM等传统方法指导LTA的理性改造是非常有效的手段,但是依然面临设计效率低、准确性差等难题。今后,进一步利用人工智能指导LTA功能改造,可望大幅度提高LTA的改造效率,有助于解决非对映体选择性低、转化率低和氨基底物谱窄等问题,实现结构丰富、功能多样β-羟基-α-氨基酸的绿色生物制造。
谨以本文纪念欧阳院士多年来在我国生物催化领域所做出的重要贡献。
