棘孢木霉对向日葵幼苗抗氧化酶活性及菌核病防效的影响
2023-10-10马光恕陈玉蓉赵振涵李润哲
马光恕,姜 博,廉 华,陈玉蓉,赵振涵,李 梅,李润哲,张 渟
(1.黑龙江八一农垦大学园艺园林学院,黑龙江 大庆 163319;2.中国农业科学院植物保护研究所,北京 100081)
向日葵(HelianthusannuusL.)是一种草本植物,属菊科(Asteraceae)向日葵属(Helianthus),其原产美国,在明代中期引入国内,是世界四大油料作物之一[1-2]。2019年,全国向日葵种植面积达85.00万hm2,总产能为242.00万t,单产为2 847.06 kg·hm-2[3],主要分布在中国西北、华北、东北的轻盐碱类地区及半干旱地区[4]。
向日葵菌核病是一种世界性普遍发生的土传病害,又称烂盘病、白腐病,其病原菌为病原真菌核盘菌(Sclerotiniasclerotiorum(Lib.)de Bary),核盘菌的寄主范围十分广泛,危害极严重[5]。随着国内种植向日葵面积的不断增加,菌核病对向日葵生产的危害也日益加剧。在中国东北、内蒙古等产区,因菌核病造成向日葵地块平均发病率达到40%~60%,最高可达到90%以上[6],严重影响着向日葵产量和品质。
目前,对向日葵菌核病的防治主要采用农业防治、选育抗病品种、化学防治和生物防治等措施,但是农业防治和筛选抗病品种周期长,耗时耗力[7];化学防治虽然效果显著,但常伴随病菌抗药性增强和农药残留、食品安全和环境污染等问题[8]。利用生物防治是当前非常提倡的一项措施[9],木霉(Trichodermaspp.)是目前研究和应用最为广泛的生防真菌类型之一。国内已有报导对核盘菌有效的生防菌菌类包括盾壳霉(Coniothyriumminitans)、蠕形青霉(Penicilliumvermiculatum)、葚孢霉(Sporidesmiumsclerotivorum)、绿色木霉(Trichodermaviride)、链孢粘帚霉(Gliocladiumcatenulatum)、红蛋巢菌(Nidulacandida)等类型[10]。欧洲已有两种盾壳霉商品制剂成功应用于生产实际[11]。食菌核葚孢霉(Sporidesmiumsclerotivorum)是土壤中一种专门寄生于多种核盘菌菌核上的重寄生菌,作为一种有潜力的菌核病生防菌,对各类作物菌核病的防治具有重要意义[12];红蛋巢菌是中国农业大学首次筛选出的对核盘菌有较强拮抗作用的生防菌,对油菜菌核病表现出较好的防治效果[13]。曹翠玲等[14]的研究表明,康氏木霉对向日葵菌核病具有一定的拮抗性。胡俊等[15]通过对向日葵菌核病重病地土样中拮抗细菌的分离培养,已初步确认对于向日葵菌核病有较好抑制效果的拮抗菌是AO3和DE,二者均为芽孢杆菌属。本研究拟采用前期平板对峙试验筛选出的对向日葵菌核病防治效果达91.46%的棘孢木霉Trichodermaasperellum581菌株,系统研究其不同施用浓度对向日葵幼苗生长、抗氧化酶活性及对向日葵菌核病防治效果的影响,为木霉菌剂未来研发和推广提供技术支持。
1 材料与方法
1.1 供试材料
(1)供试向日葵品种。丰葵杂1号,由中国农业科学院植物保护研究所廊坊试验基地提供。
(2)供试培养基。马铃薯葡萄糖琼脂固体培养基(PDA):马铃薯200 g,葡萄糖20 g,琼脂粉20 g,蒸馏水1 000 ml,pH值7.0~7.2,121℃高压蒸汽灭菌30 min,冷却后备用。
马铃薯葡萄糖液体培养基(PD):马铃薯200 g,葡萄糖20 g,蒸馏水1 000 ml,121℃高压蒸汽灭菌30 min,冷却后备用。
(3)供试菌株。棘孢木霉Trichodermaasperellum581,由中国农业科学院植物保护研究所木霉菌研究组提供。
向日葵菌核病病原菌:核盘菌(Sclerotiniasclerotiorum(Lib.)de Bary),由中国农业科学院植物保护研究所土传病害生物防治研究组提供。
(4)供试土壤。将营养土和蛭石按照4∶1均匀混合。营养土壤基本理化性质为:全氮0.84%,碱解氮137. 79 mg·kg-1,全磷130. 29 mg·kg-1,速效钾198.63 mg·kg-1,有机质5.63%,pH值7. 31。
1.2 木霉发酵液和病原菌孢子悬浮液的制备
(1)木霉发酵液的制备。将木霉菌在PDA培养基上于28℃黑暗条件培养3 d,从菌落边缘取直径5 mm的菌饼5块,接种在含有100 mL马铃薯葡萄糖液体培养基(PD)的 250 mL三角瓶中,在摇床(250 rpm)上于28℃黑暗条件下振荡培养7 d,制成木霉发酵液。用血球记数板测定孢子数,并将木霉发酵液的孢子数调整至1.2×108个·mL-1备用。
(2)核盘菌菌丝悬浮液的制备。将向日葵病原菌在PDA培养基上于28℃黑暗条件下培养3 d,从菌落边缘取直径5 mm的菌饼5块,接种在含有100 mL PD的250 mL三角瓶中,28℃、250 r·min-1振荡培养3 d,用双层纱布滤出菌丝团,将菌丝搅碎,用无菌水调整为1.2×107CFU·mL-1的菌丝悬浮液,备用。
1.3 木霉菌对向日葵抗氧化酶活性影响和菌核病防治试验
1.3.1 试验方法 2021年5—8月,在中国农业科学院植物保护研究所温室内开展相关试验研究。试验采用盆栽方式,将营养土和蛭石按照4∶1均匀混合,装入塑料材质的育苗盆(11 cm×11.5 cm×11.5 cm)中,每盆土重300 g。向日葵种子催芽后,每盆播种2粒,出苗后每盆保留1棵,置于阳光充足的地方,每隔1 d每盆浇无菌水100 mL。待植株长出4片真叶即播种后20 d,利用向日葵菌核病病原菌菌丝悬浮液灌根,每盆20 mL。木霉菌施用方式选择前期试验筛选出的最佳模式,即播种前5 d利用100mL·盆-1木霉菌悬浮液拌土+接种菌核病菌前2 d利用100 mL·盆-1木霉菌悬浮液灌根,两次均按照下面设置浓度(T1~T4)处理。
试验共设6个处理,木霉孢子悬浮液浓度按照单位体积孢子数设置为4个水平,分别为T1:1×103个·mL-1、T2:1×104个·mL-1、T3:1×105个·mL-1、T4:1×106个·mL-1;CK1:单独利用向日葵菌核病菌灌根且不施用木霉悬浮液;CK2:单独利用无菌水灌根且不施用向日葵菌核病菌和木霉悬浮液。每个处理设60盆,随机区组设计,4次重复。
1.3.2 测定指标与方法 接种后15 d即播种后35 d取其植株,每个处理选取20株(每个重复5株),用于测定向日葵幼苗形态指标和物质积累量指标,计算根冠比;同时期取其植株,每个处理选取40株(每个重复10株),用于测定向日葵抗氧化酶活性和抗病性指标。
(1)形态指标测定。株高:植株的茎基部到生长点之间的距离,用直尺测定;茎粗:植株子叶节下1 cm处粗度,用游标卡尺测定。
(2)物质积累量指标测定。利用清水反复冲洗植株,再用吸水纸吸干,按照地上部与地下部分开后测其鲜质量;然后将鲜样在105℃杀青15 min后,在70℃烘至恒重,用电子天平(TB-4002 型,湖北孝感亚光医用电子技术有限公司)分别测定地上部与地下部干质量。按照下面公式计算根冠比和壮苗指数:
根冠比=地下部鲜质量/地上部鲜质量
壮苗指数=(茎粗/株高+地下部干质量/地上部干质量)×全株干质量
(3)抗氧化酶活性测定。在接种后15 d即播种后35 d,以幼苗自上至下的3~5片叶为目标源,采样时间在9∶00左右,每个处理采取4个样,每个样含有3~6 片叶。样品采好后迅速用锡箔纸包住并贴好标签放入液氮中速冻30 min,然后放入超低温冰箱中-80℃保存。以后每隔5 d取样1次,共取样5次。
抗氧化酶活性利用酶标分析仪(Rayto RT-6100)测定分析,采用植物过氧化物酶(POD)ELISA检测试剂盒测定POD活性,以每分钟每克鲜质量样品在470 nm下吸光度变化值表示酶活性大小;采用植物过氧化氢酶(CAT)ELISA检测试剂盒测定CAT 活性,以每分钟每克鲜质量样品在240 nm下吸光度变化值表示酶活性大小;采用植物超氧化物歧化酶(SOD)ELISA检测试剂盒测定SOD活性,以每分钟样品的反应体系对NBT(氮蓝四唑)光化还原的抑制为50% 时为1个酶活性单位;采用植物苯丙氨酸解氨酶(PAL)ELISA检测试剂盒测定PAL活性,以每分钟每克鲜质量样品在290 nm下吸光度变化值表示酶活性大小;采用植物抗坏血酸过氧化物酶(APX)ELISA检测试剂盒测定APX活性,以每分钟每克鲜质量样品在290 nm下吸光度变化值表示酶活性大小;采用植物多酚氧化酶(PPO)ELISA检测试剂盒测定PPO活性,以每分钟每克鲜质量样品在420 nm下吸光度变化值表示酶活性大小。酶活性均以U·g-1·min-1表示。每个处理重复4次。
(4)抗病性指标调查,包括植株发病率、病情指数、防治效果。接种病原菌后第6 d开始调查发病情况,以后每隔1 d调查1次,连续调查5次。
向日葵菌核病分级标准参照陈娴等[16]方法,分为5级:0 级表示无病;1 级表示病斑面积占全叶10% 以下;2 级表示病斑面积占全叶10%~30%;3级表示病斑面积占全叶31%~50%;4 级表示病斑面积占全叶51% 以上。病情指数参照宗兆锋和康振生[17]的计算方法。植株发病率为接种后15 d各处理发病株数占调查总株数的百分比。
病情指数= [∑(病级株数×代表级数)÷(植株总数×最高代表级值)]×100
防治效果(%) = (对照病情指数-处理病情指数)÷对照病情指数×100
1.4 数据统计与分析
利用Microsoft Excel 2010软件进行图表制作,试验数据取4次重复的平均值和标准差,利用DPS 7.05(Data processing system)进行差异显著性分析。
2 结果与分析
2.1 木霉菌对向日葵幼苗形态建成和物质积累的影响
向日葵播种后35 d,T.asperellum581不同施用浓度对幼苗形态和物质积累指标影响如表1所示:T3即木霉菌悬浮液施用浓度为1×105个·mL-1的株高和茎粗最高,分别为19.60 cm和0.91 cm;T3株高显著高于CK1(单独利用向日葵菌核病菌灌根且不施用木霉悬浮液)、CK2(单独利用无菌水灌根且不施用向日葵菌核病菌和木霉悬浮液)、T1(木霉菌悬浮液施用浓度为1×103个·mL-1)、T2(木霉菌悬浮液施用浓度为1×104个·mL-1)、T4(木霉菌悬浮液施用浓度为1×106个·mL-1),分别高64.71%、42.03%、18.79%、7.10%、13.95%;T2株高显著高于CK1、CK2、T1、T4,分别高53.78%、32.61%、10.91%、6.40%;T4与T1株高之间的差异不显著但二者均显著高于CK1和CK2,分别高44.54%、24.64%和38.66%、19.57%;CK2株高显著高于CK1(15.97%)。T3与T2、T2与T4之间茎粗差异均不显著,T2、T3、T4均显著高于T1,分别高31.25%、42.19%、17.19%;T1显著高于CK1和CK2,分别高106.45%和39.13%;CK2茎粗显著高于CK1(48.39%);CK1的茎粗最低,为0.31 cm。
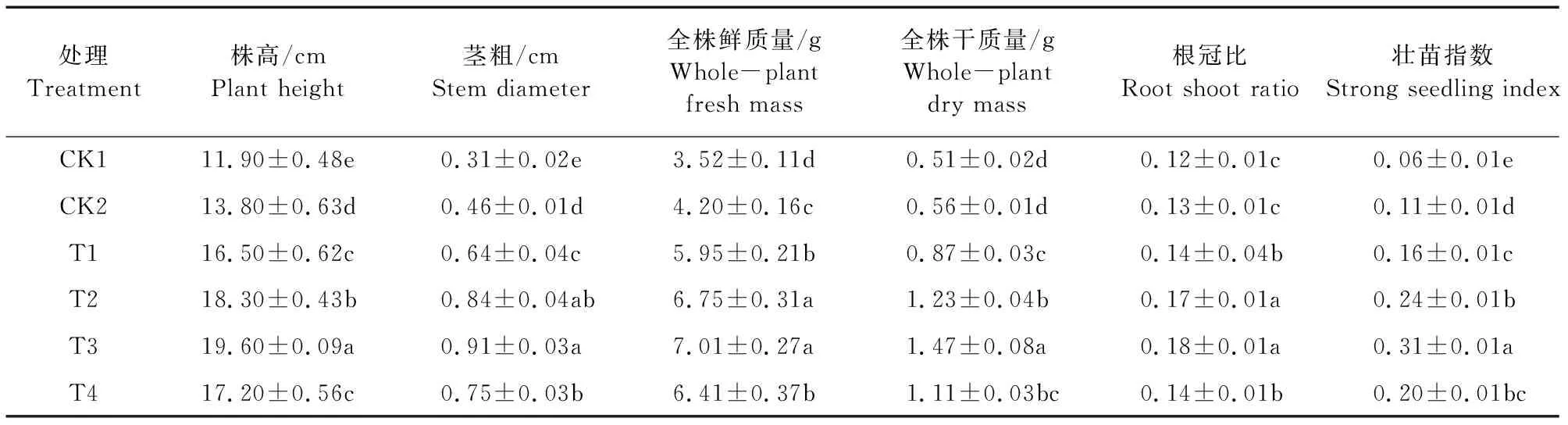
表1 T. asperellum 581对向日葵幼苗形态和物质积累指标的影响Table 1 Effects of T. asperellum 581 on morphological formation and matter accumulation indexes of sunflower seedlings
同时,T3全株鲜质量和全株干质量均最高,分别为7.01 g和1.47 g;T3与T2、T4与T1之间的全株鲜质量差异均不显著,但T1、T2、T3、T4的全株鲜质量均显著高于CK1和CK2,分别高69.03%、91.76%、99.15%、82.10%和41.67%、60.71%、66.90%、52.62%;CK2全株鲜质量显著高于CK1(19.32%)。T3全株干质量显著高于CK1、CK2、T1、T2与T4,分别高188.24%、162.50%、68.97%、19.51%、32.43%;T2与T4、T4与T1、CK2与CK1之间差异均不显著;CK1全株干质量最低,为0.51 g。
同时,T3根冠比和壮苗指数均最高,分别为0.18和0.31;T3与T2、T4与T1之间的根冠比差异均不显著,但T1、T2、T3、T4的根冠比均显著高于CK1和CK2,分别高16.67%、41.67%、50.00%、16.67%和7.69%、30.77%、38.46%、7.69%;CK2与CK1之间差异不显著。T3壮苗指数显著高于CK1、CK2、T1、T2与T4,分别高416.67%、181.82%、93.75%、29.17%和55.00%;T2与T4、T4与T1之间差异均不显著;CK2显著高于CK1(83.33%);CK1壮苗指数最低,为0.06。
以上结果说明木霉不同施用浓度对向日葵幼苗株高、茎粗、全株鲜质量、全株干质量、根冠比和壮苗指数的作用效果有差异性表现,T3处理对向日葵幼苗形态建成和物质积累促进效果最强,为提高向日葵幼苗抗逆性提供了基础保证。
2.2 木霉菌对向日葵幼苗叶片抗氧化酶活性的影响
2.2.1 木霉菌对向日葵幼苗叶片过氧化物酶(POD)和过氧化氢酶(CAT)活性的影响T.asperellum581不同施用浓度对向日葵幼苗叶片过氧化物酶(POD)活性的影响如图1A所示:在接种后15~35 d,不同处理的向日葵幼苗叶片中的POD活性变化有明显规律性,即随时间的推移POD活性先上升后下降,且在接种后25 d达到最大值。在接种后15 d,T3的POD活性最高,为11 238.12 U·g-1·min-1;T3与T2、T4与T1之间POD活性差异不显著;T1、T2、T3、T4均显著高于CK1、CK2,分别高25.72%、40.24%、47.66%、29.88%和10.85%、23.65%、30.20%、14.52%;CK2显著高于CK1(13.41%);CK1的POD活性最低,为7 610.85 U·g-1·min-1。在接种后20 d,T3显著高于CK1、CK2、T1、T2和T4,分别高43.21%、27.70%、18.30%、11.70%和13.54%;T2与T4之间差异不显著,但二者均显著高于CK1、CK2、T1,分别高28.21%、14.33%、5.91%和26.13%、12.47%、4.19%;T1显著高于CK1和CK2,分别高21.06%和7.95%;CK2显著高于CK1(12.14%);CK1的POD活性最低,为8 795.72 U·g-1·min-1。在接种后25 d,各处理POD活性均达到最大值,其中T3的POD活性最高,为14 254.98 U·g-1·min-1;T3与T2、T4与T1之间POD活性差异不显著;T1、T2、T3、T4均显著高于CK1、CK2,分别高22.19%、37.87%、41.88%、25.16%和7.95%、14.33%、27.70%、12.47%;CK2显著高于CK1(12.14%),CK1的POD活性最低,为10 047.19 U·g-1·min-1。在接种后30 d,T3显著高于CK1、CK2、T1、T2和T4,分别高69.14%、39.22%、22.78%、7.07%、10.70%;T2与T4之间差异不显著但二者均显著高于CK1、CK2、T1,分别高57.97%、30.03%、14.67%和52.80%、25.77%、10.91%;T1显著高于CK1和CK2,分别高37.76%和13.39%;CK2显著高于CK1(21.49%);CK1的POD活性最低,为7 871.89 U·g-1·min-1。在接种后35 d,T3的POD活性最高,为11 738.10 U·g-1·min-1;T3与T2、T4与T1之间POD活性差异不显著;T1、T2、T3、T4均显著高于CK1、CK2,分别高52.12%、60.73%、64.35%、54.41%和19.33%、26.09%、28.93%、21.13%;CK2显著高于CK1(27.48%);CK1的POD活性最低,为7 142.02 U·g-1·min-1。
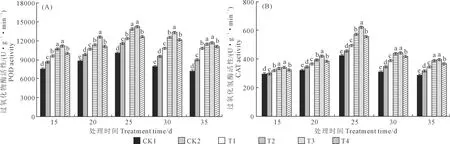
注:图中正负误差线表示标准差大小。不同小写字母表示在同一处理时间下各处理之间差异显著(P<0.05)。下同。Note:Values in the chart are standard error. Different lowercase letters in the same treatment time indicate that the differences reach a significant level (P<0.05)among different treatments. The same below.图1 T. asperellum 581对向日葵幼苗叶片过氧化物酶和过氧化氢酶活性的影响Fig.1 Effects of T. asperellum 581 on peroxidase activity and catalase activity of sunflower seedlings leaves
T.asperellum581不同施用浓度对向日葵幼苗叶片过氧化氢酶(CAT)活性的影响如图1B所示:在接种后15~35 d,不同处理的向日葵幼苗,其叶片中的过氧化氢酶活性变化有明显的规律性,即随时间的推移CAT活性先上升后下降,且在接种后25 d达到最大值。在接种后15 d,T3的CAT活性最高,为339.05 U·g-1·min-1;T3与T2、T4与T1之间CAT活性差异不显著;T1、T2、T3、T4均显著高于CK1、CK2,分别高7.52%、13.08%、15.15%、9.25%和3.94%、9.32%、11.32%、5.62%;CK2显著高于CK1(3.44%);CK1的CAT活性最低,为294.43 U·g-1·min-1。在接种后20 d,T3的CAT活性最高,为424.40 U·g-1·min-1;T3显著高于CK1、CK2、T1、T2和T4,分别高31.13%、22.37%、15.15%、7.01%、10.14%;T2与T4之间差异不显著但二者均显著高于CK1、CK2、T1,分别高22.54%、14.36%、7.61%和19.06%、11.11%、4.55%;T1显著高于CK1和CK2,分别高13.88%和6.27%;CK2显著高于CK1(7.15%);CK1的CAT活性最低,为323.66 U·g-1·min-1。在接种后25 d,各处理的CAT活性均达到最高值,其中T3的CAT活性最高,为620.64 U·g-1·min-1;T3显著高于CK1、CK2、T1、T2和T4,分别高46.74%、36.28%、25.40%、8.96%、12.06%;T2与T4之间差异不显著但二者均显著高于CK1、CK2、T1,分别高34.67%、25.08%、15.09%和30.94%、21.62%、11.90%;T1显著高于CK1和CK2,分别高17.02%和8.68%;CK2显著高于CK1(7.67%);CK1的CAT活性最低,为422.96 U·g-1·min-1。在接种后30 d,T3的CAT活性最高,为446.11 U·g-1·min-1;T3与T2之间差异不显著但二者均显著高于CK1、CK2、T1和T4,分别高43.57%、29.02%、14.94%、7.21%和40.71%、26.45%、12.65%、5.08%;T4显著高于CK1、CK2和T1,高33.91%、20.33%和7.20%;T1显著高于CK1、CK2,分别高24.91%和12.25%;CK2显著高于CK1(11.28%);CK1的CAT活性最低,为310.73 U·g-1·min-1。在接种后35 d,T3的CAT活性最高,为395.53 U·g-1·min-1;T3与T2之间差异不显著但二者均显著高于CK1、CK2、T1和T4,分别高35.62%、24.51%、15.14%、7.38%和32.92%、22.04%、12.86%、5.25%;T4显著高于CK1、CK2和T1,分别高26.30%、15.95%和7.23%;T1显著高于CK1、CK2,高17.78%和8.14%;CK2显著高于CK1(8.92%);CK1的CAT活性最低,为291.65 U·g-1·min-1。
2.2.2 木霉菌对向日葵幼苗叶片超氧化物歧化酶(SOD)和苯丙氨酸解氨酶(PAL)活性的影响T.asperellum581不同施用浓度对向日葵幼苗叶片超氧化物歧化酶(SOD)活性的影响如图2A所示:在接种后15~35 d,不同处理的向日葵幼苗叶片中SOD活性变化有明显规律性,即随时间的推移呈现先上升后下降的变化趋势,且在接种后25 d均达到最大值。在接种后15 d,T3的SOD活性最高,为1 613.51 U·g-1·min-1;T3与T2之间差异不显著且二者均显著高于CK1、CK2、T1和T4,分别高48.46%、39.26%、25.21%、10.11%和43.49%、34.59%、21.01%、6.42%;T4显著高于CK1、CK2和T1,分别高34.83%、26.47%和13.71%;T1显著高于CK1和CK2,分别高18.57%和11.22%;CK2显著高于CK1(6.61%);CK1的SOD活性最低,为1 086.81 U·g-1·min-1。在接种后20 d,T3的SOD活性最高,为1 888.29 U·g-1·min-1;T3与T2之间差异不显著且二者均显著高于CK1、CK2、T1和T4,分别高62.90%、53.44%、39.43%、19.01%和52.17%、43.34%、30.24%、11.18%;T4显著高于CK1、CK2和T1,分别高36.88%、28.93%、17.15%;T1显著高于CK1和CK2,分别高16.84%和10.05%;CK2显著高于CK1(6.61%);CK1的SOD活性最低,为1 159.16 U·g-1·min-1。在接种后25 d,T3的SOD活性最高,为2 189.21 U·g-1·min-1;T3显著高于CK1、CK2、T1、T2和T4,分别高62.79%、51.88%、41.79%、13.08%、34.43%;T2显著高于CK1、CK2、T1和T4,分别高43.96%、34.32%、25.40%、18.88%;T4与T1之间差异不显著但二者均显著高于CK1、CK2,分别高21.10%、12.98%和14.81%、7.11%;CK2显著高于CK1(7.18%)。在接种后30 d,T3的SOD活性最高,为1 847.55 U·g-1·min-1;T3与T2、T4与T1之间差异均不显著,T1、T2、T3、T4均显著高于CK1和CK2,分别高24.63%、52.82%、63.41%、29.97%和13.10%、38.69%、48.29%、17.95%;CK2显著高于CK1(10.19%);CK1的SOD活性最低,为1130.63 U·g-1·min-1。在接种后35 d,T3的SOD活性最高,为1 680.68 U·g-1·min-1;T3与T2、T4与T1之间差异均不显著,T1、T2、T3、T4均显著高于CK1和CK2,分别高25.78%、47.93%、59.14%、31.30%和9.86%、29.22%、39.00%、14.69%;CK2显著高于CK1(14.49%);CK1的SOD活性最低,为1056.10 U·g-1·min-1。
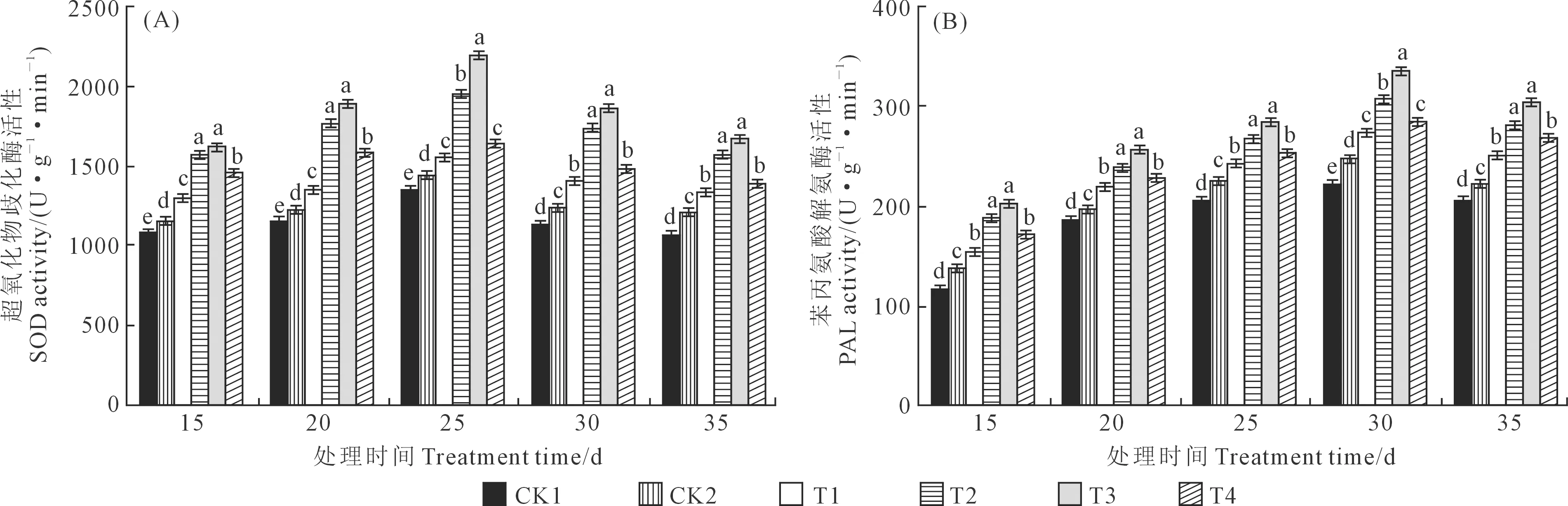
图2 T. asperellum 581对向日葵幼苗叶片超氧化物歧化酶和苯丙氨酸解氨酶活性的影响Fig.2 Effects of T. asperellum 581 on superoxide dismutase and phenylalnine ammonialyase activity of sunflower seedlings leaves
T.asperellum581不同施用浓度对向日葵幼苗叶片苯丙氨酸解氨酶(PAL)活性的影响如图2B所示:在接种后15~35 d,不同处理的向日葵幼苗叶片中PAL活性变化有明显规律性,即随时间的推移呈现先上升后下降的变化趋势,且在接种后30 d均达到最大值。在接种后15 d,T3的PAL活性最高,为200.62 U·g-1·min-1;T3与T2、T4与T1之间差异均不显著,T1、T2、T3、T4均显著高于CK1和CK2,分别高30.61%、58.95%、70.51%、44.20%和13.75%、38.44%、48.51%、25.60%;CK2显著高于CK1(14.81%);CK1的PAL活性最低,为117.66 U·g-1·min-1。在接种后20 d,T3的PAL活性最高,为256.48 U·g-1·min-1;T3与T2、T4与T1之间差异均不显著,T1、T2、T3、T4均显著高于CK1和CK2,分别高19.15%、30.17%、39.33%、23.50%和11.81%、22.14%、30.74%、15.89%;CK2显著高于CK1(6.57%);CK1的PAL活性最低,为184.08 U·g-1·min-1。在接种后25 d,T3的PAL活性最高,为282.89 U·g-1·min-1;T3与T2、T4与T1之间差异均不显著,T1、T2、T3、T4均显著高于CK1和CK2,分别高16.70%、29.41%、37.60%、22.54%和6.79%、18.42%、25.91%、12.13%;CK2显著高于CK1(9.28%);CK1的PAL活性最低,为205.59 U·g-1·min-1。在接种后30 d,T3的PAL活性最高,为335.82 U·g-1·min-1;T3显著高于CK1、CK2、T1、T2和T4,分别高52.57%、35.50%、23.88%、9.56%、17.79%;T2显著高于CK1、CK2、T1和T4,分别高39.26%、23.68%、13.07%、7.52%;T4与T1之间差异不显著但二者均显著高于CK1、CK2,分别高29.52%、15.03%和23.16%、9.38%;CK2显著高于CK1(12.60%);CK1的PAL活性最低,为220.11 U·g-1·min-1。在接种后35 d,T3的PAL活性最高,为304.65 U·g-1·min-1;T3与T2、T4与T1之间差异均不显著,T1、T2、T3、T4均显著高于CK1和CK2,分别高22.79%、37.71%、50.02%、31.65%和12.01%、25.62%、36.85%、20.09%;CK2显著高于CK1(9.62%);CK1的PAL活性最低,为203.07 U·g-1·min-1。
2.2.3 木霉菌对向日葵幼苗叶片抗坏血酸过氧化物酶(APX)和多酚氧化酶(PPO)活性的影响T.asperellum581不同施用浓度对向日葵幼苗叶片抗坏血酸过氧化物酶(APX)活性的影响如图3A所示:在接种后15~35 d,不同处理的向日葵幼苗叶片中的APX活性变化有明显规律性,即随时间的推移呈现缓慢上升的变化趋势。在接种后15 d,T3的APX活性最高,为1 519.04 U·g-1·min-1;T3与T2之间差异不显著且二者均显著高于CK1、CK2、T1和T4,分别高69.56%、39.84%、24.35%、13.64%和66.28%、37.14%、21.94%、11.44%;T4显著高于CK1、CK2和T1,分别高49.20%、23.05%和9.42%;T1显著高于CK1和CK2,分别高36.36%和12.46%;CK2显著高于CK1(21.25%);CK1的APX活性最低,为895.89 U·g-1·min-1。在接种后20 d,T3的APX活性最高,为1 652.38 U·g-1·min-1;T3与T2、T4与T1之间差异均不显著,T1、T2、T3、T4均显著高于CK1和CK2,分别高26.42%、42.99%、49.54%、28.00%和13.99%、28.93%、34.84%、15.41%;CK2显著高于CK1(10.91%);CK1的APX活性最低,为1 104.96 U·g-1·min-1。在接种后25 d,T3的APX活性最高,为1 706.94 U·g-1·min-1;T3与T2之间差异不显著且二者均显著高于CK1、CK2、T1和T4,分别高35.32%、27.80%、19.50%、9.56%和33.87%、26.43%、18.22%、8.39%;T4显著高于CK1、CK2和T1,分别高23.51%、16.65%、9.07%;T1显著高于CK1和CK2,分别高13.23%和6.95%;CK2显著高于CK1(5.88%);CK1的APX活性最低,为1261.43 U·g-1·min-1。在接种后30 d,T3的APX活性最高,为2 084.93 U·g-1·min-1;T3与T2之间差异不显著且二者均显著高于CK1、CK2、T1和T4,分别高55.62%、33.55%、23.18%、13.99%和47.91%、26.93%、17.07%、8.34%;T4显著高于CK1、CK2和T1,分别高36.52%、17.16%和8.06%;T1显著高于CK1和CK2,分别高26.34%和8.42%;CK2显著高于CK1(16.52%);CK1的APX活性最低,为1 339.75 U·g-1·min-1。在接种后35 d,T3的APX活性最高,为2 233.73 U·g-1·min-1;T3与T2之间差异不显著且二者均显著高于CK1、CK2、T1和T4,分别高43.39%、36.27%、29.22%、18.29%和34.19%、27.52%、20.93%、10.70%;T4显著高于CK1、CK2和T1,分别高21.22%、15.20%和9.24%;T1显著高于CK1和CK2,分别高10.97%和5.46%;CK2显著高于CK1(5.23%);CK1的APX活性最低,为1 557.78 U·g-1·min-1。

图3 T. asperellum 581对向日葵幼苗叶片抗坏血酸过氧化物酶和多酚氧化酶活性的影响Fig.3 Effects of T. asperellum 581 on ascorbate peroxidase and polyphenol oxidase activity of sunflower seedlings leaves
T.asperellum581不同施用浓度对向日葵幼苗叶片多酚氧化酶(PPO)活性的影响如图3B所示:在接种后15~35 d,不同处理的向日葵幼苗叶片中的PPO活性变化有明显的规律性,即随时间的推移呈现缓慢上升的变化趋势。在接种后15 d,T3的PPO活性最高,为10 031.62 U·g-1·min-1;T3显著高于CK1、CK2、T1、T2和T4,分别高35.06%、18.05%、11.89%、5.34%、5.83%;T2与T4之间差异不显著但二者均显著高于CK1、CK2和T1,分别高28.21%、12.07%、6.22%和27.61%、11.54%、5.72%;T1显著高于CK1和CK2,分别高20.70%和5.50%;CK2显著高于CK1(14.41%);CK1的PPO活性最低,为7 427.72 U·g-1·min-1。在接种后20 d,T3的PPO活性最高,为11 096.54 U·g-1·min-1;T3与T2、T4与T1之间差异均不显著,T1、T2、T3、T4均显著高于CK1和CK2,分别高23.42%、37.50%、40.27%、27.85%和9.32%、21.78%、24.24%、13.24%;CK2显著高于CK1(12.90%);CK1的PPO活性最低,为7 910.85 U·g-1·min-1。在接种后25 d,T3的PPO活性最高,为11 254.98 U·g-1·min-1;T3与T2、T4与T1之间差异均不显著,T1、T2、T3、T4均显著高于CK1和CK2,分别高18.16%、31.21%、34.84%、26.25%和6.32%、18.06%、21.32%、13.59%;CK2显著高于CK1(11.14%);CK1的PPO活性最低,为8 347.19 U·g-1·min-1。在接种后30 d,T3的PPO活性最高,为12 114.72 U·g-1·min-1;T3与T2、T4与T1之间差异均不显著,T1、T2、T3、T4均显著高于CK1和CK2,分别高22.11%、28.08%、30.66%、25.62%和4.40%、9.51%、11.71%、7.40%;CK2显著高于CK1(16.96%);CK1的PPO活性最低,为9 271.89 U·g-1·min-1。在接种后35 d,T3的PPO活性最高,为13 738.13 U·g-1·min-1;T3显著高于CK1、CK2、T1、T2和T4,分别高41.16%、37.32%、19.67%、10.08%和13.18%;T2与T4之间差异不显著但二者均显著高于CK1、CK2和T1,分别高28.23%、24.74%、8.71%和24.73%、21.33%、5.74%;T1显著高于CK1和CK2,分别高17.96%和14.75%;CK2显著高于CK1(2.80%);CK1的PPO活性最低,为9 732.02 U·g-1·min-1。
说明T.asperellum581不同施用浓度对向日葵幼苗叶片POD、CAT、SOD、PAL、APX和PPO活性的影响有明显差别,其中T3处理通过提高向日葵幼苗叶片中POD、CAT、SOD、PAL、APX和PPO酶活性,增强了向日葵植株的抗逆系统的功能和生理活性,提高了向日葵幼苗对菌核病的防治效果。
2.3 木霉菌对向日葵菌核病盆栽防治效果的影响
在向日葵播种后35 d,调查各处理菌核病的发病率,发病率以CK1最高,为97.58%;以T3处理发病率最低,为1.89%;T1、T2、T3、T4和CK2发病率分别为10.21%、8.76%、8.34%和26.12%。根据公式计算病情指数和防治效果,结果如图4所示。病情指数与发病率的规律一致,均以CK1最高,为57.50;T3病情指数最低,为0.71。木霉菌对菌核病的防治效果以T3最高,为98.77%;T3显著高于T1、T2、T3和CK2,分别高5.50%、2.97%、3.90%和41.98%;T2、T4之间差异不显著但二者均显著高于T1和CK2,分别高2.45%、37.86%和1.54%、36.65%;CK1的防治效果最低,为0。说明木霉不同施用浓度对向日葵菌核病的防治效果有一定影响,生产上选择木霉适宜浓度施用对提高菌核病防效具有一定的积极作用。
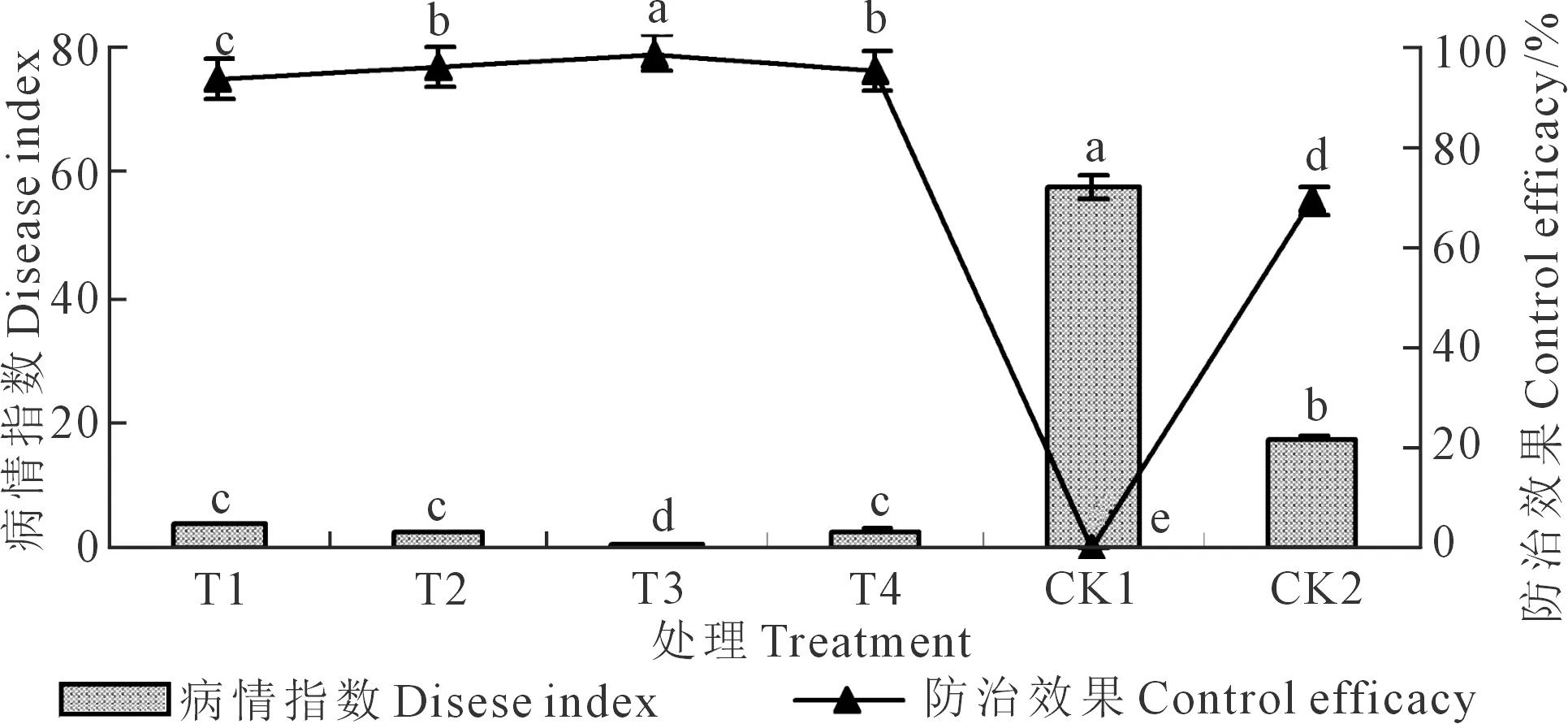
图4 T. asperellum 581对向日葵菌核病防效的影响Fig.4 Effects of T. asperellum 581 against Sclerotinia sclerotiorun of sunflower
3 讨 论
木霉(Trichodemaspp.)是一种广谱拮抗菌,能抑制许多种病原菌,具有很强的生防特性,目前在许多植物病害生物防治中被应用。王子晴等[18]通过挥发性与非挥发性物质抑菌的方法对分离自健康北细辛植株根际土壤的木霉菌株进行筛选,结果发现,筛选得到的木霉,其非挥发性物质对北细辛菌核病菌的抑制率均达到75%以上。康彦平等[19]通过圆盘滤膜法测定了拟康宁木霉(Trichodermakoningiopsis)非挥发性代谢产物对核盘菌的抑制作用,结果发现,核盘菌培养3 d后,对照组中的菌丝已扩展到整个培养皿;培养5 d后,菌核已经形成,但未见菌丝生长,且抑制率达到100%;培养后12 d,菌丝生长非常缓慢,菌落致密,不能在培养基上扩展,甚至不产菌核,说明木霉及其代谢物均对核盘菌有较好的抑制效果。袁辉[20]研究发现,木霉对小麦纹枯病具有显著的生防效果,防治效果达89%。本试验中T.asperellum581在平板对峙试验中向日葵菌核病防治效果达91.46%,4种施用浓度的盆栽防效均达到93%以上。这是由于木霉菌可以通过竞争营养和空间、溶菌、产生抗生和次生代谢物来抑制病原菌[21],还可以促进植物的生长[22]、诱导植物系统抗性提高,促进植物防御系统的建立,提高植物的抗逆性。我们在前期研究中做过检测,即在木霉菌施入土壤后,检测土壤中该木霉菌含量,用菌落形成单位表示,在施入菌剂后连续测定1 a,明确木霉菌可以在土壤中定殖。通过萌发率测定发现,有超过95%的孢子萌发受到抑制,在4—6个月时,土壤中木霉菌检出量与初始含量相当,在12个月时仍有该木霉菌检出,说明该木霉菌在土壤中已经定殖。
木霉菌可从土壤中获取众多养分,通过增加不溶性化合物的溶解性和微量营养素的可利用性,有效促进植物生长、干物质积累及产量[23]。株高、茎粗均可作为农作物生长水平的重要指标,通过影响株型、抗倒伏性能等,影响作物产量[24]。Zhao等[25]研究发现,TrichodermaafroharzianumTM2-4培养滤液经100倍稀释处理后,番茄下胚轴长度、根长和活力指数分别提高了28.7%、19.4%、62.1%,具有产生生物活性物质和促进番茄种子萌发的作用;Yani等[26]研究发现,利用木霉(Trichodermaspp.)处理的大蒜株高、根长和块茎质量分别增加0.8%、9%~23%、21%~51%,通过生物治剂可以提高大蒜产量。本试验中T.asperellum581的4种不同处理浓度下,向日葵幼苗株高、茎粗、全株鲜质量、全株干质量、根冠比和壮苗指数均显著高于CK1,提高幅度分别为38.66%~64.71%、106.45%~193.55%、69.03%~99.15%、70.59%~188.24%、16.67%~50.00%、166.67%~416.67%,与文献报道结果相似。因为木霉菌可以产生植物生长调节物质,提高植物对土壤中矿物质的吸收,直接促进植物生长发育,同时木霉提高了植物对土壤养分的利用率,间接促进植物生长发育[27]。
生防菌株对病原菌的生长有一定的拮抗作用,主要是通过干扰菌丝的正常生理代谢途径来抑制多种重要酶的活性,从而抑制病原菌的生长。许多生防菌株均能诱导寄主增强防御保护酶的活性或抑制病原菌保护酶的活性。植物抗性主要通过防卸酶系统的应答体现出来,防卸酶系统包括过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、苯丙氨酸解氨酶(PAL)、抗坏血酸过氧化物酶(APX)等,它们是生物体内抗氧化系统的组成部分,能有效地防止组织细胞受到氧化损伤,并能抑制组织细胞发生膜脂过氧化[28]。在本研究中,POD、CAT、SOD、PAL、APX、PPO等6种抗氧化酶对木霉菌作用均比较敏感,并呈现上升的趋势。与CK1相比,T.asperellum581在4种施用浓度下均显著增加了POD、CAT、SOD、PAL、APX、PPO等6种保护酶的活性,其中以T3处理增幅最大,分别增加了64.35%、35.62%、59.14%、50.02%、43.39%、41.16%。宿畅等[29]研究发现,拟康氏木霉T.pseudokoningii886处理黄瓜幼苗叶片后,对比只接种黄瓜枯萎病病原菌的处理,SOD、POD、CAT、PPO活性分别增加了46.82%、34.93%、18.75%、11.63%;梁艳琼等[30]利用生防菌TB2处理甘蔗叶片后发现,先喷施生防菌后接种病原菌、先接种赤腐病菌后喷施生防菌、先喷施生防菌后接种病原菌、病原菌处理、生防菌处理等处理后,与植物防御抗病相关的PPO、POD、SOD、PAL、CAT防御酶活性均比对照组高,表明TB2和赤腐病菌均能诱导甘蔗叶片中的防御酶活性增强。本试验的研究结果与文献报道结果基本一致。这是因为当植物受病原菌侵染后,木霉等生防微生物能够诱导植物抗病相关防御酶发生变化,提高植物体的抗病防御功能,而不同的保护酶活性与防御反应之间存在着密切的联系[31]。
4 结 论
棘孢木霉T.asperellum581不同施用浓度通过提高向日葵幼苗抗氧化酶活性促进了幼苗形态建成和物质积累,增强了向日葵对菌核病的抗性。以T3即木霉菌悬浮液施用浓度为1×105个·mL-1处理应用效果最好,在向日葵播种后35 d,向日葵叶片中的POD、CAT、SOD、PAL、APX和PPO活性分别比CK1提高64.35%、35.62%、59.14%、50.02%、43.39%、41.16%,向日葵幼苗株高、茎粗、全株鲜质量、全株干质量、根冠比和壮苗指数分别比CK1提高64.71%、193.55%、99.15%、188.24%、50.00%、416.67%,对向日葵菌核病的防效达到98.77%。
