马铃薯根系分泌物及氨基酸对萎缩芽孢杆菌QHZ3趋化成膜的影响
2023-10-10庞娅楠邱慧珍成志远陈兰兰董爱菊张春红王友玲
庞娅楠,邱慧珍,成志远,陈兰兰,董爱菊,张春红,王友玲
(1.甘肃农业大学资源与环境学院/甘肃省干旱生境作物学重点实验室,甘肃 兰州 730070;2.甘肃省畜禽废弃物资源化利用工程研究中心,甘肃 兰州 730070)
马铃薯作为继水稻、玉米、小麦后的第四大粮食作物,在保障我国粮食安全、调整种植业结构和农业生产转型升级等方面发挥着重要作用[1-2]。甘肃省因其独特的土壤和气候特点成为我国重要的马铃薯种薯和商品薯生产基地,种植面积和产量均居全国前列[3-4]。然而,随着马铃薯种植面积的扩大,其轮作倒茬难以实现,连作障碍日益严重,加剧了土传病害的发生,特别是由立枯丝核菌(Rhizoctoniasolani)侵染引起的马铃薯黑痣病严重制约着我国马铃薯产业的可持续发展[5-8]。
马铃薯黑痣病可通过化学防治、农业防治和生物防治等方法进行防治[9]。生物防治时施用添加植物根际促生菌(Plant growth-promoting rhizobacteria,PGPR)的生物有机肥具有显著的防病、促生和增产效果,且其环保、安全、无毒,不会引起病原菌产生抗药性[10-12],能有效防控香蕉枯萎病[13]、黄瓜枯萎病[14]、西瓜枯萎病[15]、小麦根腐病[16]和棉花黄萎病[17]等土传病害。PGPR是一类能在植物根际存活和定殖的有益微生物,具有促进植物生长及防控土传病害的作用[18]。可作为生防菌的PGPR包括真菌、放线菌、弱毒或无致病力微生物菌株及细菌等[19],尤其是细菌中的芽孢杆菌,因其具有分布范围广、环境适应性强、易培养且抗逆性强等特点,其作为生防因子防治植物病害已成为热点[20]。
萎缩芽孢杆菌QHZ3是本实验室分离出的一株兼具促生及生防特性的根际促生菌[21-22],施用由其制成的生物有机肥可观察到菌株能在马铃薯根际定殖且可显著降低马铃薯黑痣病的发生[3,8,20],定殖主要包括促生菌向根际的趋化和在根际聚集形成生物膜两个步骤[18,23],其信号物质可能是根系分泌物中的一些氨基酸、小分子糖、小分子有机酸、酚酸或次级代谢产物等[24-26],本实验室前期研究发现酚酸和有机酸可介导其有效定殖[27]。有研究表明,氨基酸类物质能使促生菌在植株根系趋化成膜[26,28]。因此,本研究采用土培试验,结合气质联用鉴定马铃薯3个关键生育时期(苗期、现蕾期及盛花期)的根系分泌物,并比较马铃薯不同生育时期根系分泌物及氨基酸对菌株QHZ3趋化成膜的影响,进一步揭示菌株QHZ3的定殖机制。
1 材料与方法
1.1 材料
供试品种:马铃薯‘大西洋’原原种,购于定西市农业科学研究院。
供试菌株:萎缩芽孢杆菌(Bacillusatrophaeus)QHZ3由本实验室分离、鉴定和保存。
供试土壤:取自甘肃农业大学校内试验地,使用前进行2次高压灭菌处理,用干净的布袋(以高压锅的铁筐为模具制作)装满土壤后置于铁筐中,扎紧布袋,在121℃的条件下灭菌30 min,每筐装土20 kg,每次2筐,取出后晾2 h,继续于同等条件下进行二次灭菌,最后置于阴凉处自然晾干。正式播种前用紫外照射以杀死空气中的杂菌。土壤基本理化性质为:有机质18.50 g·kg-1,全氮1.18 g·kg-1,碱解氮132.4 mg·kg-1,速效磷90.75 mg·kg-1,速效钾27.20 mg·kg-1,pH 8.26。
供试培养基及试剂:LB液体培养基、LB固体培养基、LB半固体培养基、生理盐水、趋化缓冲液,参考陈兰兰等[2]的方法配制。
氨基酸标准品:脯氨酸,甘氨酸,天冬氨酸,苯丙氨酸,酪氨酸,购于上海源叶生物科技有限公司。
1.2 方法
1.2.1 原原种的播前处理 用0.1%的次氯酸钠溶液对马铃薯原原种浸种消毒10 min后用无菌水冲洗,自然风干后避光平铺于含脱脂棉的盘子里,置于通风处催芽,温度以25℃为宜。待种子露白后,把顶芽以外的芽子掰掉,只留1个顶芽播种,每盆6株,重复15盆,盆钵内径22 cm,深度17 cm,每盆装土6 kg,播种深度3 cm,于2021年6月14日播种。
播种前先将每盆土壤用水浇透,隔夜播种。前期每2 d浇1次水,后期按照网室的温度和土壤的干湿情况而定,每次浇水量及浇水时间相同。
1.2.2 根系分泌物的收集 参照张文明等[29-30]的收集方法:采用破坏性采样,于马铃薯苗期(播种后35 d)、现蕾期(播种后55 d)和盛花期(播种后75 d)分别选取生长良好的植株3盆,每盆采样5株,将15株植株混合后放入盛有500 mL色谱纯甲醇溶液的烧杯中反复淋洗根系,得到根系分泌物的甲醇溶液,4 000 r·min-1离心5 min, 35℃下旋转蒸发仪浓缩至100 mL,取50 mL蒸干后加50 mL蒸馏水,真空冷冻干燥得到根系分泌物干粉,于-80℃备用。
1.2.3 根系分泌物的衍生化 取5mL根系分泌物的甲醇溶液,用氮吹仪(35℃)吹干后进行硅烷衍生化。硅烷化过程具体操作如下[29-30]:加入0.5 mL Regisil试剂(99%N,O-双三甲基硅烷基三氟乙酰胺+1%三甲基-氯硅烷)和1.16 mL嘧啶,在 70℃水浴中加热30 min,冷却后取样品0.1 ml,用乙酸乙酯稀释至2 mL,进行GC-MS分析。
1.2.4 根系分泌物的鉴定 气相色谱型号:安捷伦7890;质谱型号:安捷伦5975C;色谱柱型号:HP-5;检测器型号:FID。进样量:1 μL;进样口温度:140℃;分流比:30∶1;加热器温度:280℃;电子能量:70 eV;离子源温度:230℃;传输线温度:300℃;质量扫描范围:40~550 m·z-1。色谱条件:40℃保持5 min,10℃·min-1升温至250℃,5℃·min-1升温至280℃保持5 min。检测完成后应用标准谱库NIST05a进行物质的鉴定。
1.2.5 根系分泌物及其氨基酸对菌株QHZ3的趋化作用定性分析 定性分析参照Park等[31]的方法:按1%的体积比将过夜活化的菌株QHZ3种子液接种至LB液体培养基中,37℃、170 r·min-1、90 min培养至OD600=0.4。将直径为6 mm的无菌滤纸片置于含有根系分泌物(60 μg·mL-1)和氨基酸(30 μmol·L-1)的半固体培养基中。取10 μL菌悬液滴加到滤纸片上,每个处理重复3次, 37℃培养12 h后用十字交叉法测量趋化圈直径,测量3次求平均值。
1.2.6 根系分泌物及其氨基酸对菌株QHZ3的趋化作用定量分析 定量分析参考Ling等[24]的方法:按1.2.5小节的方法培养QHZ3至OD600=1.0,4℃、5 000 r·min-1离心5 min后重悬于等体积的趋化缓冲液中,将吸取了100 μL根系分泌物(60、120、240 μg·mL-1)和氨基酸 (10、25、50、75、100 μmol·L-1)的1 mL无菌注射器针头插入吸取了100 μL菌悬液的枪头细口端,针头朝上,置于超净工作台中2 h后,对注射器中的溶液进行稀释涂布,稀释倍数为103,涂布体积为100 μL,37℃培养24 h后,计算移动的细菌数及趋化性指数,每个处理3次重复。
每毫升待测组分中的细菌数=C÷V×M
式中,C代表平均菌落数,V代表涂布体积(mL),M代表稀释倍数。
趋化性指数(RCI)=处理菌落数÷对照菌落数
当RCI≥2时代表处理的趋化作用与对照相比差异显著。
1.2.7 菌株QHZ3生物膜的形成过程 生物膜的形成过程参考曹启航等[32]的方法:按1.2.5小节的方法培养QHZ3至OD600=0.2,稀释100倍后吸取12 mL加入放有无菌载玻片的无菌培养皿中,置于37℃培养6、12、24、36、48、72 h后,取出载玻片用无菌生理盐水冲洗3次,甲醇固定30 min后,用无菌生理盐水冲洗3次,再用0.1%结晶紫染色30 min后,用无菌生理盐水冲洗4次,室温晾干后置于光学显微镜下观察、拍照。
1.2.8 根系分泌物及其氨基酸对菌株QHZ3生物膜形成的影响 将根系分泌物和氨基酸加入到1.2.7稀释后的菌悬液中,涡旋混匀后分装至96孔细胞培养板中,每孔200 μL,每个处理8个重复,37℃培养24 h后将培养基吸出,用250 μL无菌生理盐水冲洗3次以清除尚未形成的生物膜,室温干燥后,加入200 μL 0.1%结晶紫溶液染色30 min,然后用200 μL无菌生理盐水冲洗4次以去除未结合的结晶紫,室温干燥后,加入200 μL 95%乙醇溶液脱色后稀释40倍,用酶标仪测定光吸收值(OD562)。
1.3 数据统计与分析
试验数据采用Excel 2010进行试验数据统计分析,Origin 2019制图,SPSS 24进行方差分析和差异显著性检验,显著性水平为P<0.05。
2 结果与分析
2.1 马铃薯不同生育时期根系分泌物的鉴定
马铃薯苗期、现蕾期及盛花期根系分泌物总离子质谱图分别见图1、图2及图3,通过计算机检索系统对总离子质谱图进行搜索得到马铃薯不同生育时期根系分泌物的主要组分(表1)。
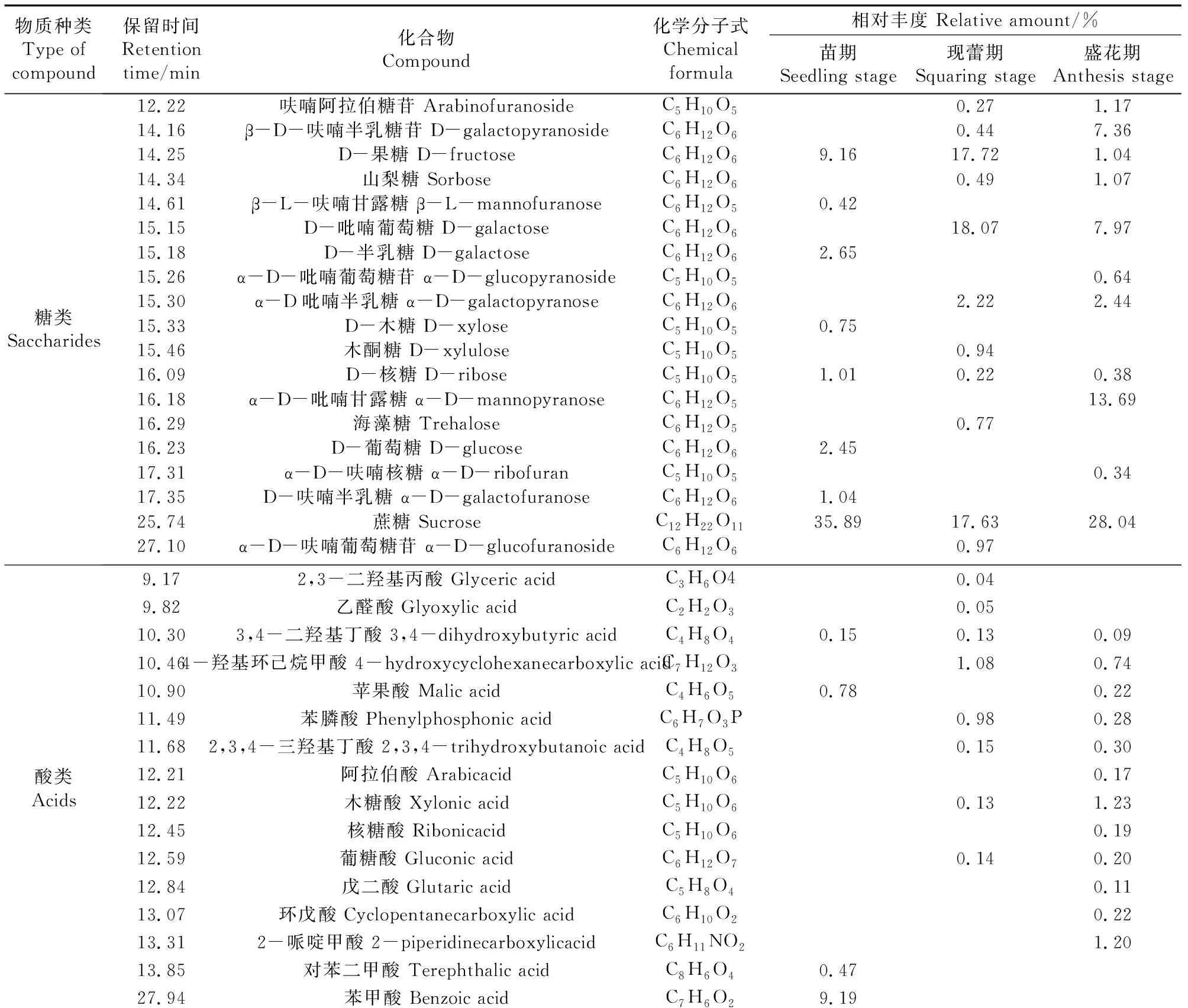
表1 马铃薯不同生育时期根系分泌物的GC-MS分析结果Table 1 GC-MS analysis results of potato root exudates at different growth stages
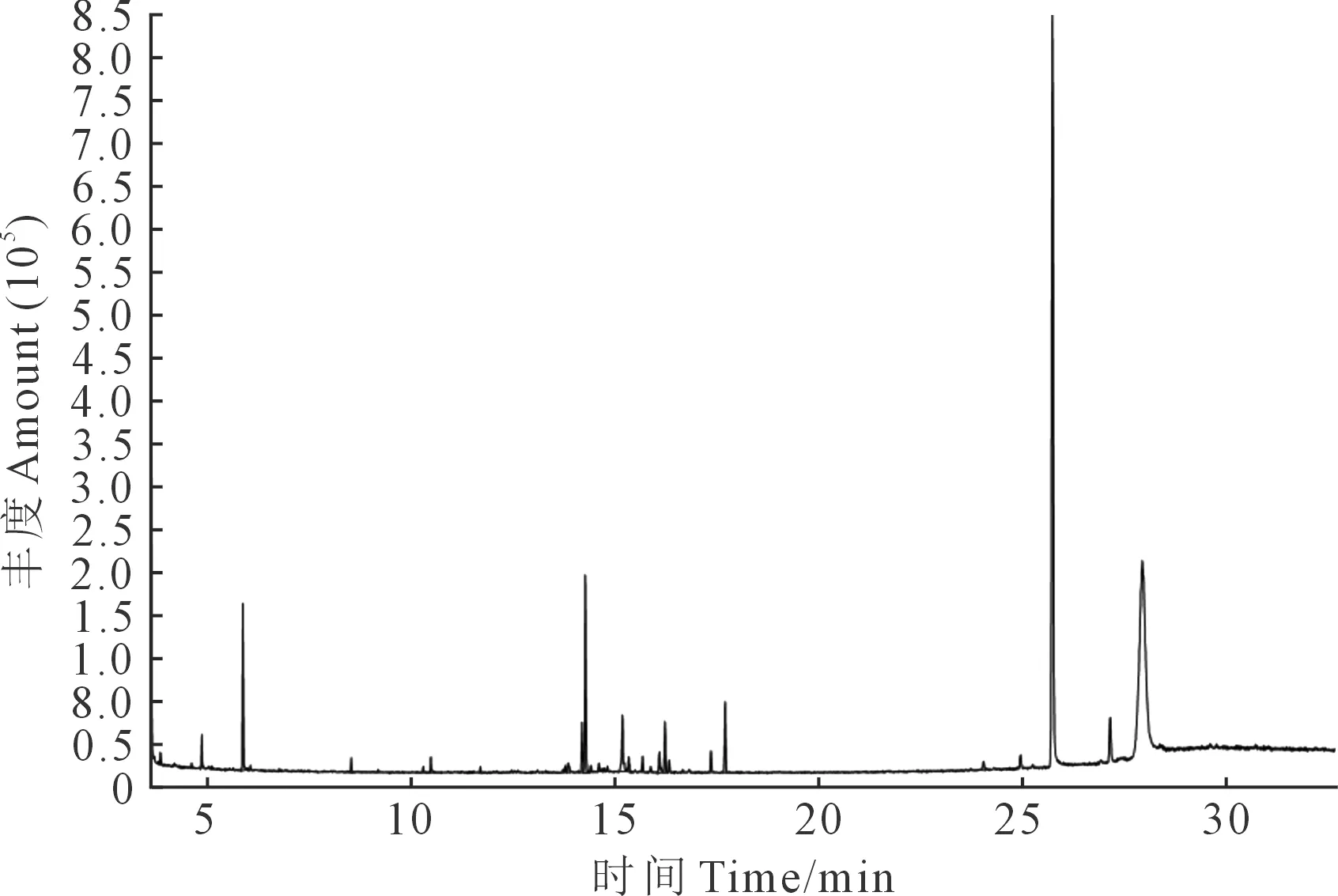
图1 马铃薯苗期根系分泌物总离子质谱图Fig.1 Total ion mass chromatogram of potato root exudates at seedling stage
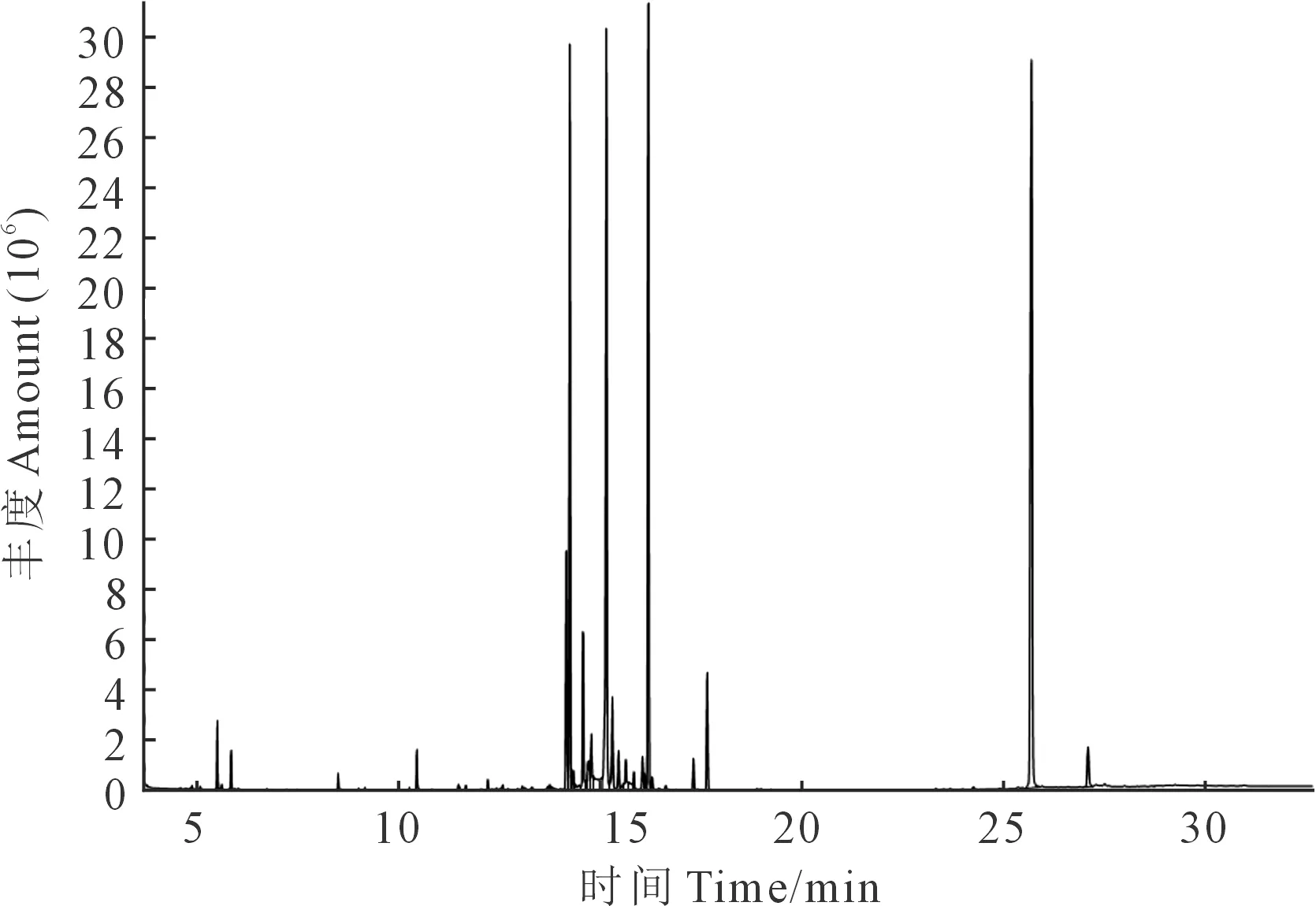
图2 马铃薯现蕾期根系分泌物总离子质谱图Fig.2 Total ion mass chromatogram of potato root exudates at squaring stage
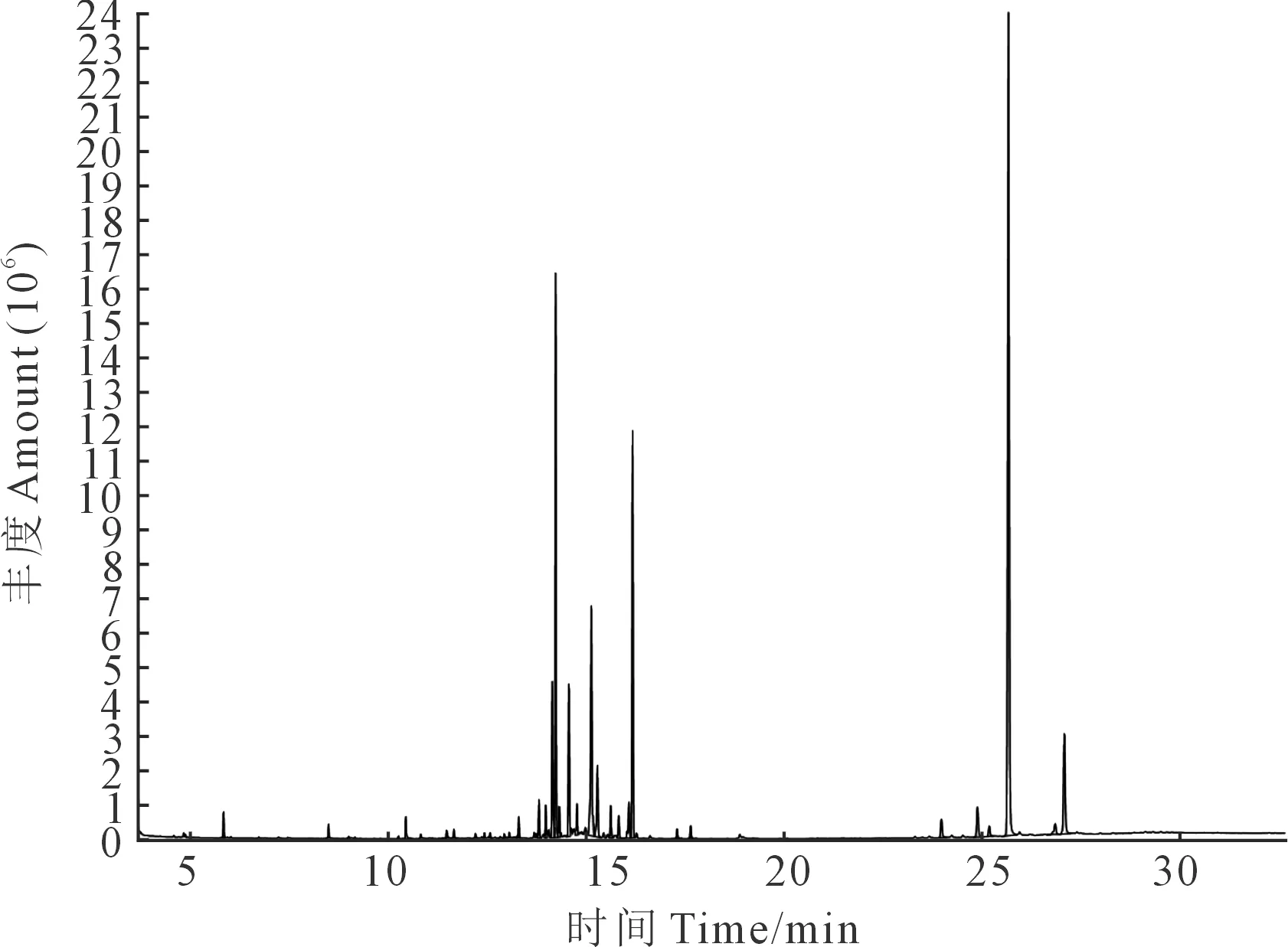
图3 马铃薯盛花期根系分泌物总离子质谱图Fig.3 Total ion mass chromatogram of potato root exudates at anthesis stage
由表1可知,马铃薯的3个生育时期根系分泌物中所检测出的物质可分为8个大类,即糖类、有机酸类、醇类、胺类、氨基酸类、酯类、酰胺类和脂肪酸类,但各个大类的物质数量及其相对含量在不同生育期之间有较大差异,苗期、现蕾期和盛花期根系分泌物中分别含有24种、31种和31种主要物质,3个生育时期均检测出的物质共7种,分别是D-果糖、D-核糖、蔗糖、3,4-二羟基丁酸、甘油、甘露醇和肌醇,苗期和现蕾期的根系分泌物中有8种相同物质,相对含量分别占苗期和现蕾期根系分泌物总量的51.30%和39.81%;现蕾期与盛花期的根系分泌物中有18种相同物质,分别占现蕾期和盛花期根系分泌物总量的67.43%和55.58%;苗期与盛花期的根系分泌物中有10种相同物质,分别占苗期和盛花期根系分泌物总量的57.21%和33.46%。这些差异说明,在马铃薯的生长发育过程中,根系分泌物中的有些物质一直存在且不断地累积,有些物质则发生转化或降解,同时还有新物质陆续产生。
鉴定得到氨基酸类物质主要有5种,分别是脯氨酸、甘氨酸、天冬氨酸、苯丙氨酸和酪氨酸,苗期、现蕾期和盛花期根系分泌物中分别有2种、3种和2种,相对含量分别占相应时期根系分泌物总量的0.35%、0.42%和0.96%。虽然氨基酸类物质种类及所占比例较少,但王玉双等[33]、冯海超[34]、Yao等[35]、沈怡斐等[26]、Liu等[28]的研究发现其能影响促生菌趋化成膜,因此针对氨基酸组分进行研究。
2.2 根系分泌物及氨基酸对菌株QHZ3趋化性的影响
2.2.1 不同生育时期根系分泌物对菌株QHZ3趋化作用的定性分析 测定不同生育时期根系分泌物对菌株QHZ3的趋化性,结果如图4所示。与对照组相比,苗期、现蕾期和盛花期根系分泌物均对菌株QHZ3有显著趋化性,其趋化圈直径分别是4.33、4.93 cm和5.43 cm,分别相当于对照(3.48 cm)的1.24、1.42倍和1.56倍,以现蕾期和盛花期的趋化作用最为显著,说明随着生育进程的推进,马铃薯生物量变大的同时对菌株QHZ3产生趋化作用的物质也随之增加。
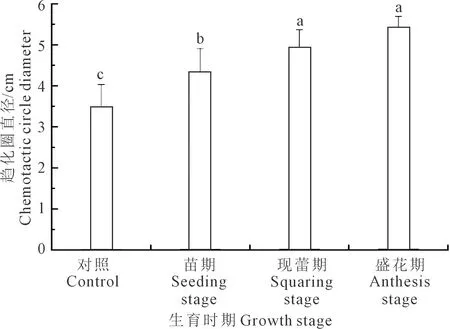
注:不同字母表示处理间差异显著(P<0.05),下同。Note: Different letters indicate significant differences among treatments (P<0.05), the same below.图4 不同生育时期根系分泌物对QHZ3趋化性的影响Fig.4 Effects of root exudates at different growth stages on chemotaxis of QHZ3
2.2.2 氨基酸对菌株QHZ3趋化作用的定性分析 由图5可知,与对照相比,除脯氨酸外,其他氨基酸对菌株QHZ3趋化性均有显著影响,其中影响最大的是甘氨酸,趋化圈直径为6.40 cm,是对照(3.48 cm)的1.84倍;其次是天冬氨酸(5.70 cm)、苯丙氨酸(5.35 cm)和酪氨酸(5.07 cm),分别是对照的1.64、1.54倍和1.45倍。

图5 氨基酸对菌株QHZ3趋化性的影响Fig.5 Effects of amino acids on chemotaxis of QHZ3
2.2.3 不同浓度根系分泌物对菌株QHZ3趋化作用的定量分析 不同浓度根系分泌物对菌株QHZ3的趋化作用如图6所示:根系分泌物对菌株QHZ3均有正趋化作用,且随着根系分泌物浓度的增加,对QHZ3的趋化作用越强,其中240 μg·mL-1的现蕾期和盛花期根系分泌物趋化性指数最大,毛细管中细菌数量均达到对照组的2.8倍。
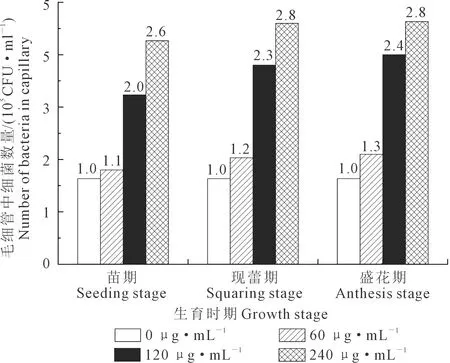
注:数字代表趋化性指数,下同。Note: Figures represent chemotaxis index, the same below.图6 不同浓度根系分泌物对QHZ3的趋化作用Fig.6 Chemotactic of root exudates on QHZ3 with different concentrations
2.2.4 氨基酸对菌株QHZ3趋化作用的定量分析 氨基酸对菌株QHZ3的趋化作用如图7所示:各浓度氨基酸对菌株QHZ3均有趋化性作用,但趋化程度不同,趋化性指数(RCI)大于2的氨基酸为甘氨酸(10~50 μmol·L-1)、天冬氨酸(50~75 μmol·L-1)和苯丙氨酸(25~50 μmol·L-1),即在该浓度下的氨基酸对菌株QHZ3有显著的正趋化作用,其中以25 μmol·L-1的甘氨酸趋化性指数最大,毛细管中细菌数量达到5.13×105CFU·mL-1,是对照组(1.53×105CFU·mL-1)的3.3倍,而脯氨酸和酪氨酸所有浓度下的趋化性指数均小于2,说明脯氨酸和酪氨酸对菌株QHZ3没有显著趋化作用。
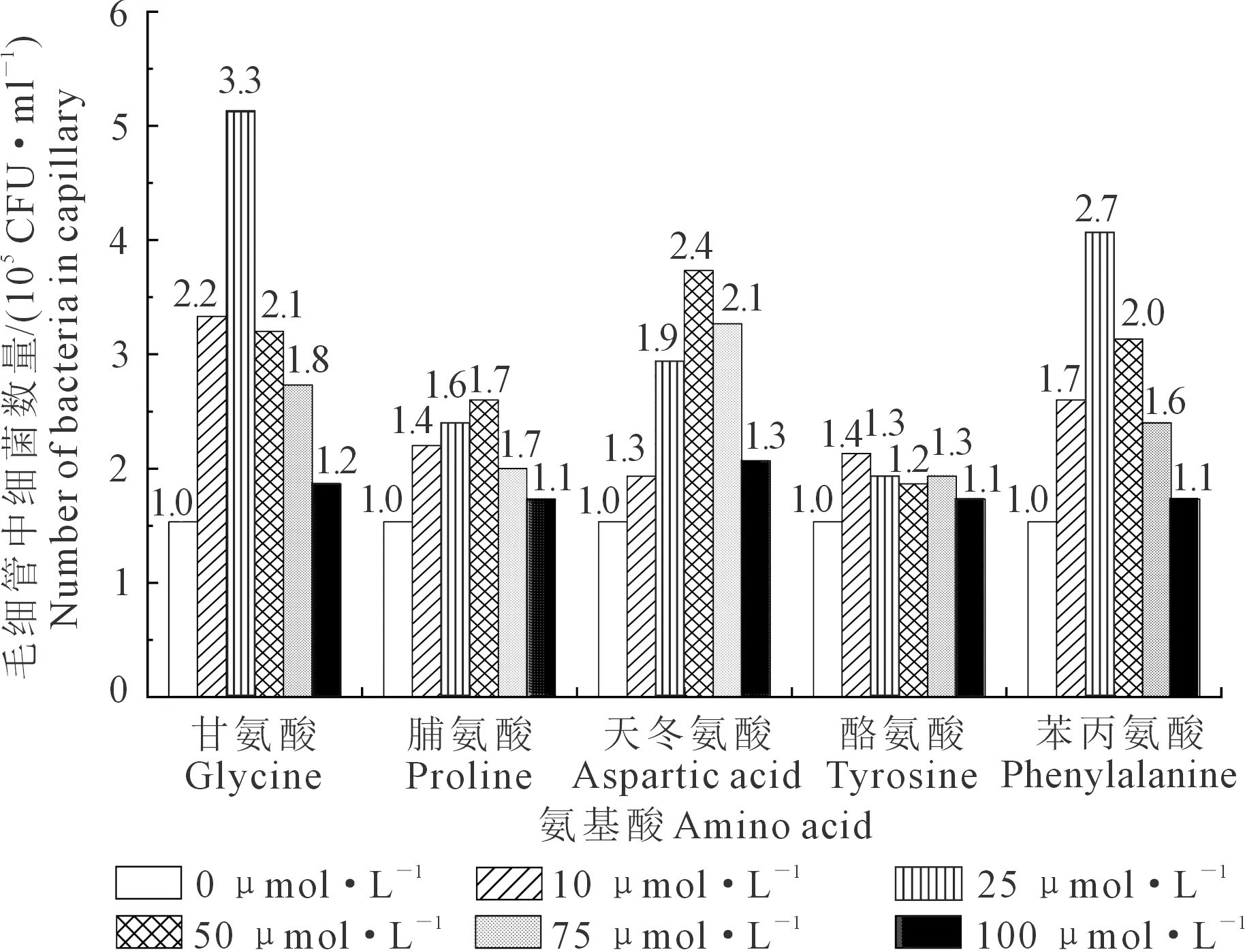
图7 不同浓度氨基酸对QHZ3的趋化作用(定量)Fig.7 Chemotaxis of QHZ3 by amino acids with different concentrations (Quantitative)
从图7也可以看出,随着各氨基酸浓度升高,除酪氨酸的RCI变化呈下降趋势外,其他氨基酸的RCI变化均呈先上升后下降的趋势。
2.3 马铃薯不同生育时期根系分泌物及氨基酸组分对菌株QHZ3生物膜形成的影响
2.3.1 菌株QHZ3生物膜的形成过程 QHZ3生物膜的形成过程如图8所示。整体来看,菌株QHZ3生物膜随着培养时间的增加呈现增加趋势。培养6 h后,有少量细菌粘附在载玻片上,空白区域占整个视野的80%左右;培养12 h后,粘附在载破片上的细菌数量明显增多,且形成微菌落,空白区域占整个视野的50%左右;培养24 h后,微菌落聚集形成菌落,呈片状结构,空白区域明显减少;培养36 h后,菌落铺满整个视野且具有一定厚度;培养48 h后,菌落间相互叠加,形成团状结构;培养72 h后,团状结构聚集变厚,形成致密的生物膜。
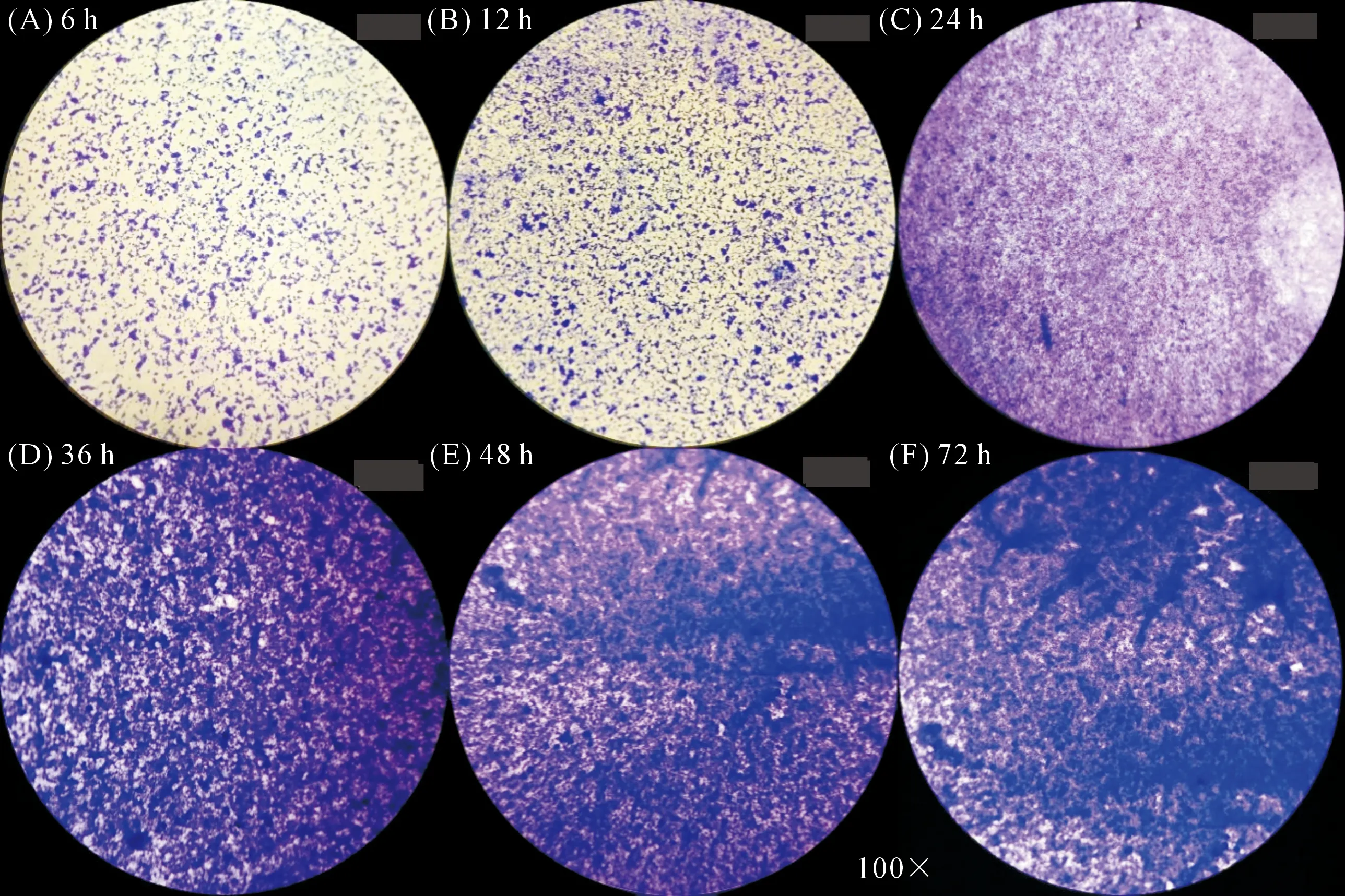
图8 不同培养时间菌株QHZ3生物膜的形成能力Fig.8 Biofilm formation capacity of strain QHZ3 at different culture time
2.3.2 不同浓度根系分泌物对菌株QHZ3生物膜形成的影响 不同浓度根系分泌物对菌株QHZ3生物膜形成的影响结果如图9所示。马铃薯根系分泌物可明显促进菌株QHZ3生物膜形成,与未添加根系分泌物相比,苗期各浓度与对照组间差异不显著;现蕾期和盛花期,根系分泌物浓度为120 μg·mL-1和240 μg·mL-1时可显著促进菌株QHZ3生物膜的形成。

图9 不同浓度根系分泌物对各生育期QHZ3生物膜形成的影响Fig.9 Effects of different concentrations of root exudates on QHZ3 biofilm formation at different growth stage
2.3.3 不同浓度氨基酸对菌株QHZ3生物膜形成的影响 如图10所示,各浓度的氨基酸对菌株QHZ3生物膜形成的影响各不相同。其中甘氨酸(25~100 μmol·L-1)、脯氨酸(75~100 μmol·L-1)和苯丙氨酸(25~100 μmol·L-1)可以显著促进菌株QHZ3生物膜的形成,而酪氨酸和天冬氨酸则对QHZ3的生物膜形成影响不显著。
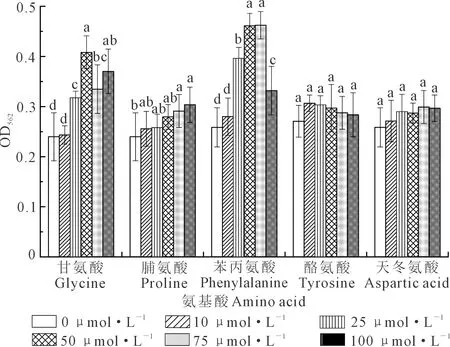
图10 不同浓度氨基酸对QHZ3生物膜形成的影响Fig.10 Effects of different concentrations of amino acids on QHZ3 biofilm formation
从图10可知,随着各氨基酸浓度的升高,甘氨酸和苯丙氨酸对菌株QHZ3生物膜形成的影响效果呈先上升后下降的趋势,脯氨酸和天冬氨酸呈上升趋势,而酪氨酸呈现下降趋势。
3 讨 论
根系分泌物能够联系植物与根际土壤微生物且可以为根际微生物提供生存和繁衍所需的营养和能源物质,并可作为信号物质吸引特异微生物从而促进根际有益微生物的定殖[36]。已有研究表明,根系分泌物中可作为信号物质来介导根系与微生物间的互作关系[26]。陈兰兰[27]通过研究发现,酚酸和有机酸能促进萎缩芽孢杆菌QHZ3定殖。赵大君等[37]研究发现凤眼莲根系分泌物中的氨基酸可以诱导肠杆菌属F2的趋化性。本研究通过气质联用从不同生育时期马铃薯的根系分泌物中鉴定出的物质主要有糖类、有机酸类、醇类、胺类、氨基酸类、酯类、酰胺类和脂肪酸类等,其中包括5种氨基酸,分别是甘氨酸、脯氨酸、苯丙氨酸、天冬氨酸、酪氨酸。
半固体平板法的趋化圈大小和深浅可以反映趋化物对菌株的趋化能力。本研究发现除脯氨酸外,其他4种氨基酸均能使QHZ3形成明显的趋化圈,同时也发现,3个生育时期根系分泌物对QHZ3有显著正趋化作用。胡小加等[38]研究发现天冬氨酸对枯草芽孢杆菌Tu-100具有显著正趋化作用,沈怡斐等[26]研究发现多黏类芽孢杆菌SQR-21对甘氨酸、天冬氨酸和苯丙氨酸具有强烈的正趋化作用,本试验结果与其一致。
类毛细管试验发现趋化物对细菌的作用往往存在一个最适浓度范围,高于或低于该浓度都表现出相对较弱的正趋化作用[26]。本试验发现除脯氨酸和酪氨酸外,其他3种氨基酸(甘氨酸、苯丙氨酸和天冬氨酸)均对菌株QHZ3具有明显趋化性,且当其处于中浓度(25~75 μmol·L-1)时,菌株QHZ3趋化能力均强于低、高浓度,同时,根系分泌物(120 μg·mL-1和240 μg·mL-1)也对菌株QHZ3具有明显趋化性,这与Mesibov等[39]研究大肠杆菌对氨基酸的趋化性时得到的结果相同,说明菌株对某些氨基酸的趋化依赖于浓度梯度,浓度过大或过小都可能对菌株的趋化作用产生抑制。
生防细菌在植物根际的定殖能力与其生防效果相关,并且生防细菌根际定殖能力与其生物膜形成相关[40]。本试验观察得到不同生育时期根系分泌物及氨基酸对菌株QHZ3的生物膜形成的影响不同,研究发现根系分泌物和氨基酸均可促进菌株QHZ3 生物膜形成,尤其是现蕾期和盛花期(120 μg·mL-1和240 μg·mL-1)根系分泌物、甘氨酸(25~100 μmol·L-1)、脯氨酸(75~100 μmol·L-1)和苯丙氨酸(25~100μmol·L-1)可显著促进菌株QHZ3生物膜的形成。Goh等[41]发现添加适宜浓度的L-脯氨酸和赖氨酸能够显著提高大肠杆菌BL21菌株的生物膜形成能力。赵卫松等[42]发现L-脯氨酸可显著促进枯草芽胞杆菌NCD-2菌株生物膜形成。Price[43]研究发现,加入脯氨酸能显著提高气单胞菌属细菌的生物膜形成。从以上研究结果可知,菌株生物膜形成能力可能与外源添加剂种类和浓度及菌株的种类有关,浓度过大或过小时,可能会抑制生物膜的形成。
4 结 论
1)从不同生育时期马铃薯的根系分泌物中鉴定出的物质有8类,即糖类、有机酸类、醇类、胺类、氨基酸类、酯类、酰胺类和脂肪酸类等,其中氨基酸类物质有5种,分别是甘氨酸、脯氨酸、苯丙氨酸、天冬氨酸、酪氨酸。
2)马铃薯不同生育时期根系分泌物对菌株QHZ3的趋化成膜均有显著影响,尤其添加现蕾期及盛花期根系分泌物作用显著,且促生效果随着根系分泌物浓度增大而明显加强。
3)5种氨基酸对菌株QHZ3趋化成膜的作用程度不同,其中天冬氨酸和酪氨酸对菌株QHZ3具有显著正趋化作用,脯氨酸能显著影响菌株QHZ3生物膜的形成,而甘氨酸和苯丙氨酸则能显著影响菌株QHZ3的趋化成膜。
