7个平欧杂交榛子品种的生理解剖特性及其抗寒性研究
2023-10-10刘在国赵梦炯陈炜青
刘在国,赵 通,2,马 超,赵梦炯,陈炜青, 2
(1. 甘肃省林业科学研究院,甘肃 兰州 730020;2. 甘肃省木本油料工程研究中心,甘肃 兰州 730020)
榛子(CorylusheterophllaFisch.)为桦木科(Betulaceae)榛属(corlus)落叶灌木或小乔木,是世界著名的四大坚果之一,在中亚及欧洲许多地方进行了栽培利用,通过不断地选育,培育了许多优良品种,同时还进行大量的无性繁殖,在世界各地传播,其栽培范围已超过了它们的自然分布区[1-2]。榛子坚果的种仁营养丰富,含有蛋白质、脂肪、碳水化合物以及多种维生素和矿物质等,对人体有益的不饱合脂肪酸含量极高,也是重要的木本油料作物[3]。西北地区气候寒冷,榛子树种单一,品种严重匮乏,各地对榛树的研究和发展均高度重视,所以引进抗寒品种(系)并对其进行抗寒筛选显得尤为重要。
我国榛子资源丰富,本土品种多为平榛(CorylusheterophyllaFisch.)、毛榛(CorylusmandshuricaMaxim.)。自1999年开始,辽宁省经济林研究所利用我国的平榛(CorylusheterophyllaFisch.)与引进的欧洲榛(CorylusavellanaL.)种间远缘杂交,成功育成了平欧杂交榛(CorylusheterophyllaFisch.×CorylusavellanaL.)[4],作为我国重要的经济林树种之一,由于其丰产性较强,近年来在我国西北大部分地区广泛栽植,但因其冻害的频繁发生,低温成为限制其生长的主要环境影响因子之一,严重制约榛子产业的发展[5]。因此,探究适宜平欧杂交榛的生长环境,选育适宜的栽植品种十分必要。
前人对植物受低温胁迫响应的分子和生理研究主要集中在低温驯化和低温耐寒方面[6]。如刘彬昕等[4]通过测定榛树枝条的含水率和电导率探讨了7个品种 (系) 榛树的抗寒性与电导率的关系;梁锁兴等[7]对榛子10个品种(系)1年生枝条进行低温处理,通过枝条电解质渗出率分析品种(系)间的抗寒性差异。研究也表明,植物在低温胁迫下抗氧化系统被激活,激素代谢被改变,渗透调节物质被积累以抵抗胁迫[8]。一些报道通过测定致死温度、可溶性碳水化合物、脯氨酸(Pro)含量、抗氧化酶、蛋白质含量和叶片结构来研究植物的抗逆性[9]。低温胁迫严重会导致细胞膜系统的破坏,当植物在极端低温下,它们通常会经历氧化应激。一般来说,它们对环境胁迫的响应与活性氧(ROS)的积累有关,如过氧化氢、单线态氧[10]。由于植物多样性的复杂性,不同品种通过调节低温胁迫下不同的生命活动机制来增强其抗寒性。因此,与单一指标相比,使用多指标来评价不同植物品种的抗寒性更为确切。叶片解剖结构一定程度可以反映植物的耐寒能力[11]。雷翠云等[12]、王娜等[13]、王泽华等[14]以植株的叶片厚度、表皮厚度、栅栏组织厚度、海绵组织厚度等叶片解剖结构为研究对象,探索不同品种植株的抗寒性,所得结果与供试植株在自然界的实际生长状况相符合。此外,光合作用是研究植物生长环境和生长相关性的重要途径[15]。绿色植物可将光照产生的太阳能通过一系列的反应转化为其可利用的化学能储存在体内。植物的净光合效率既与品种差异、叶片厚度、叶片成熟度等自身生理特性密切相关,同时又受光照强度、大气温度等外界因素的影响,光合作用可以从侧面来反映树体的生长发育状况,通过研究其光合作用对植物抵御低温胁迫、提高越冬率具有重要意义[16]。
近年,甘肃省榛子引种栽培主要分布在陇南山地、陇东黄土高原和中部黄土丘陵地区。但由于品种未经驯化,适应性差,部分栽培点植株存在严重抽梢、春季重新萌发的现象,严重影响了榛子产业化、规模化发展。植株是否能安全越冬是平欧杂交榛子在本地区能够引种成功的关键[17]。甘肃省引进杂交榛子品种时间短,大多品种正在试验研究阶段,抗寒性研究主要集中在田间栽培试验观察或通过单一指标判断,多指标评价不同榛子品种抗寒水平的研究鲜见报道。因此,本研究以引进的7个榛子品种为试验材料,通过前期光合作用的强弱比较,结合叶片解剖结构,分析与抗寒性相关生理生化指标的变化规律,综合评价7个榛子品种在甘肃栽培地抗寒性的强弱,以期为抗寒性品种选育和栽培推广提供理论依据。
1 材料与方法
1.1 试验区概况
试验于2021年7—11月在黄土高原与青藏高原、中原农区与西部牧区的过渡地带(103°21′E、35°60′N)进行,平均海拔2 000 m,属温带半干旱气候,年平均气温6.3℃,极端最高温32.5℃,年平均降水量530 mm,年平均蒸发量为1 700 mm,全年无霜期137 d。年平均日照时数2 572 h,光热资源丰富。果园地势平坦,水源充足,灌溉条件优良。土壤以黄土为主,土、肥、水管理一致。供试品种引自辽宁省经济林研究所育成的1年生大果榛子压条繁育苗木,于2020年4月9日栽植在甘肃省临夏市南龙镇邓家村,地径大于1 cm,高60~70 cm,根系完整。品种分别为辽榛3号、辽榛4号、辽榛7号、辽榛8号、辽榛9号、达维和玉坠(表1)。栽植密度为2 m×2 m,定植前穴施农家肥1 kg,整个生长期对植株进行统一常规浇水及除草等田间管理。
表1 不同平欧杂交榛子品种来源信息Table 1 Information on the origin of different hybrid hazelnut varieties
1.2 试验材料及处理
分别于2021年9月和11月,在邓家村采集露地栽培长势良好、无病虫害的成熟的功能性叶片和休眠期枝条作为试验材料。其中叶片用自来水冲洗干净,避开叶脉将其剪成5 mm×7 mm的组织块并立即用福尔马林-酒精-醋酸固定液(FAA)固定,带回实验室保存于4℃冰箱备用。用自来水将采集好的枝条冲洗干净,并用滤纸吸干表面水分,每个品种分为6个处理,分别装于自封袋中封好。将封好的枝条放入低温培养箱(型号LRH-250CB,上海一恒)进行低温处理,温度分别设置为4、-10、-15、-20、-25、-30℃,以4℃处理为对照(CK)。待达到所需温度后计时,12 h后再升温,达到0℃后取出,在4℃下放置2 h解冻。每个品种3次重复。
1.3 试验指标测定
1.3.1 光合指标测定 选定6棵长势良好、无明显病虫害的植株,每棵树选6片叶子,分别于2021年7月1日、8月1日、9月1日,连续3个月测定其光合。测定仪为Li-6400光合仪(LI-COR公司,美国),采用开放式气路,光合有效辐射为400~600 μmol·m-2·s-1),设定叶室内空气流量为500 mL·min-1,叶室内CO2体积分数为(385±10) μL·L-1。于晴天上午9∶00—11∶00,选取向阳面同一节位的功能叶片测定净光合速率(Pn)、蒸腾速率(Tr)、胞间CO2(Ci)、气孔导度(Gs)。试验设置3次重复。
1.3.2 电导率测定 将处理后的枝条分别用蒸馏水和双蒸水冲洗数次,擦干,避开芽眼剪成均匀的小段,快速称取3份,每份0.2 g,重复3次。分别置于试管中,用10 mL去离子水浸泡提取,震荡提取1 h,用DDS-11A型电导率仪测定电导率C1,后沸水浴提取20 min,再次测定浸提液电导率,测得C2,未加枝条的去离子水则即为C0,按公式计算电导率:相对电导率=(C1-C0)/(C2-C0)×100%。
1.3.3 其他生理指标的测定 酶液制备时,取经冷冻处理后的枝条,用刀片刮下皮,剪碎并混匀进行测定。可溶性糖及淀粉含量采用蒽酮比色法测定[18];脯氨酸(Pro)含量采用酸性茚三酮法测定[19];超氧化物歧化酶(SOD)及丙二醛(MDA)测定参考Redillas等[20]的方法。
1.3.4 显微结构观察及指标测定 每个品种各选取6片叶片,以叶片最宽处和主叶脉之间的交点为中心点,取长1.0 cm、宽0.7 cm的组织为切片制作材料,FAA液固定后完成脱水、透明、包埋等制片过程,番红-固绿双重染色,中性树胶封片,将封好的切片放入烘箱(37℃)中烘干。将制作好的石蜡切片置于显微镜下,每片叶片观察6个视野。采用光学显微镜(Olympus,BX51,Japan)搭配目镜测微尺观察并测量栅栏组织、海绵组织、叶片厚度、上表皮、下表皮,并计算叶片组织结构紧密度(CTR)、叶片组织结构疏松度(SR)和叶片栅海比。其中,CTR=栅栏组织厚度/叶片厚度;SR=海绵组织厚度/叶片厚度;栅海比=栅栏组织厚度/海绵组织厚度。每种处理观察6个切片,每个切片测定6组数据,取平均值。
1.4 数据处理
采用Excel 2013及Origin 2018进行数据的处理及作图,SPSS 22.0软件进行方差分析,并将相关指标进行主成分分析。
2 结果与分析
2.1 不同榛子品种光合特性的变化
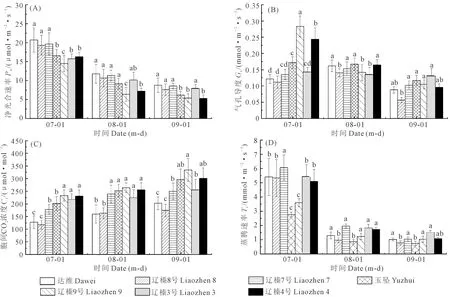
2.1.1 净光合速率(Pn) 如图1A所示,不同品种的净光合速率随时间的变化呈逐渐下降趋势,7月各品种的Pn显著高于其他时期,分别为20.73(达维)、19.30(辽榛8号)、19.67(辽榛7号)、16.53(玉坠)、14.50(辽榛9号)、15.70(辽榛3号)和16.30 μmol·m-2·s-1(辽榛4号),且7月品种达维的Pn最高,显著高于玉坠、辽榛9号、3号和4号。8月,品种辽榛9号的Pn值显著低于其他品种,为6.38 μmol·m-2·s-1。9月光照强度降低,各品种的Pn也出现最低值,与7月相比,分别降低57.81%(达维)、61.57%(辽榛8号)、56.27%(辽榛7号)、62.49%(玉坠)、62.75%(辽榛9号)、49.04%(辽榛3号)、67.42%(辽榛4号)。说明随光照强度的减弱,各品种的Pn逐渐下降,但同一时期各品种之间却无明显的变化规律。
注:不同小写字母表示相同时间不同品种之间差异显著(P<0.05)。Note: The different lowercase letters indicate significant differences among varieties (P<0.05) at the same time.图1 不同榛子品种净光合速率、气孔导度、胞间CO2浓度、蒸腾速率的变化Fig.1 Changes of Pn, Gs, Ci, and Tr in leaves of different hazelnut varieties
2.1.2 气孔导度(Gs) 由图1B可知,不同榛子品种的Gs随时间变化呈逐渐下降趋势,9月光强减弱,气温下降,各品种的Gs出现最低值,与7月相比,分别降低27.27%(达维)、52.89%(辽榛8号)、24.44%(辽榛7号)、31.97%(玉坠)、62.89%(辽榛9号)、8.39%(辽榛3号)、60.65%(辽榛4号),且辽榛8号的下降幅度最小。但7月辽榛9号的Gs显著高于其他品种,为0.283 mmol·m-2·s-1,而辽榛8号的Gs在7月和9月出现最低值,分别为0.112 mmol·m-2·s-1(7月)和0.057 mmol·m-2·s-1(9月),8月辽榛3号的Gs显著低于其他品种,仅为0.133 mmol·m-2·s-1。说明随着时间的变化,光强减弱,气温下降,不同榛子品种的Gs也出现一定幅度的下降。
2.1.3 胞间CO2浓度(Ci) 由图1C可知,不同榛子品种的Ci随时间变化呈逐渐上升趋势,且不同时期各品种的Ci具有显著性差异。同一时期,品种辽榛9号的Ci高于其他品种。9月气温下降,光强减弱,各品种达到峰值,分别为202.67 μmol·mol-1(达维),174.33 μmol·mol-1(辽榛8号),250.33 μmol·mol-1(辽榛7号),296.67(玉坠),334.33 μmol·mol-1(辽榛9号),252.67 μmol·mol-1(辽榛3号),301 μmol·mol-1(辽榛4号),与7月相比,分别上升59.05%、48.71%、41.24%、47.26%、47.23%、17.75%、30.31%,且品种辽榛3号的上升幅度最小。Ci越高说明同化效率越低,可见用于光合作用的CO2原料较少,其Pn值也相对较低。
2.1.4 蒸腾速率(Tr) 由图1D可知,各品种的Tr随时间变化呈显著下降趋势,且具有显著性差异,同一时期品种玉坠的Tr显著低于其他品种,分别为2.77(7月)、0.86 mmol·m-2·s-1(8月)和0.74 mmol·m-2·s-1(9月)。7月各品种的Tr最高,显著高于8月和9月。9月随着气温降低,光强减弱,各品种的Tr降至最低值,与7月相比,分别降低81.11%(达维)、84.81%(辽榛8号)、82.83%(辽榛7号)、72.20%(玉坠)、68.89%(辽榛9号)、72.03%(辽榛3号)、79.84%(辽榛4号)。说明随着光强减弱,各品种的Tr也出现一定幅度的下降。
2.2 低温胁迫下不同榛子品种的可溶性糖和淀粉含量变化
由图2A可知,辽榛8号和辽榛4号的可溶性糖含量随温度的降低呈逐渐升高趋势,-30℃时升至最高,分别为74.01 μg·g-1和65.33 μg·g-1,但其他品种的可溶性糖含量随温度的降低呈先升后降趋势,-25℃时出现最高值,在4℃(CK)和-10℃,各品种的可溶性糖变化幅度相对较小,且一致性较强,-10℃至-25℃之间显著升高,且不同温度处理下(-20℃除外),辽榛8号的可溶性糖含量高于其他品种。

注:不同小写字母表示相同温度下不同品种之间差异显著(P<0.05),下同。Note: The different lowercase letters indicate significant differences between varieties at the same temperature (P<0.05), the same below.图2 不同榛子品种的可溶性糖和淀粉含量变化Fig.2 Changes in soluble sugar and starch contents of different hazelnut varieties
由图2B可知,不同温度处理下各品种的淀粉含量具有显著性差异,在4℃(CK)和-10℃,品种辽榛7号的淀粉含量显著高于其他品种,但随着温度的降低(-15~-30℃),达维的淀粉含量显著高于其他品种,-30℃时,辽榛9号的淀粉含量显著低于其他品种,为19.86 μg·g-1,各品种的淀粉含量在-25℃时降至最低,分别为29.86(达维)、28.98(辽榛8号)、19.63(辽榛7号)、24.56(玉坠)、18.56(辽榛9号)、14.44(辽榛3号)、19.68(辽榛4号) μg·g-1,与4℃(CK)相比,分别降低18.56%、9.37%、48.72%、16.23%、43.75%、12.51%、20.83%,说明随着处理温度的降低,各品种的淀粉含量也出现一定程度的下降,但辽榛7号的下降幅度更大。
2.3 低温胁迫下不同榛子品种的电导率和丙二醛(MDA)含量变化
如图3A可知,不同品种的相对电导率随低温处理呈逐渐上升趋势,在4~-15℃之间,各品种的相对电导率变化幅度相对较小,且一致性较强,说明在此温度区间,细胞膜受害程度不明显,但随着温度的降低,-30℃时升至最高值,显著高于4℃(CK),且-30℃时品种辽榛3号的电导率含量上升幅度显著高于其他品种,为75.88。而玉坠和达维的相对电导率上升幅度最低,分别为48.65和61.20。说明在此温度条件下,品种辽榛3号的细胞膜破坏程度最大。

图3 不同榛子品种的相对电导率和丙二醛(MDA)含量变化Fig.3 Changes in relative conductivity and malondialdehyde content of different hazelnut varieties
由图3B可知,辽榛3号和辽榛4号的MDA含量随低温处理呈先升后降趋势,-25℃升至最高值,分别为2.75 μg·g-1和2.96 μg·g-1。其他品种的MDA含量随低温处理呈逐渐升高趋势,且具有显著性差异。在4℃(CK)和-10℃,各品种的MDA含量变化幅度相对较小,之后显著上升,-30℃时出现最高值,显著高于4℃(CK),分别为4.56(达维)、4.51(辽榛8号)、3.86(辽榛7号)、2.96(玉坠)、2.58(辽榛9号) μg·g-1。同一温度处理下,品种达维和辽榛8号的MDA含量显著高于其他品种。且不同低温处理下,辽榛9号的MDA含量显著低于其他品种,说明在同一温度处理下,达维和辽榛8号的受伤害程度更小,而辽榛9号更不耐低温胁迫。
2.4 低温胁迫下不同榛子品种的脯氨酸(Pro)含量和超氧化物歧化酶(SOD)活性变化
由图4A可知,不同品种的Pro含量随低温处理呈逐渐升高趋势,且不同品种之间具有显著性差异,-30℃时各品种均出现最高值,与4℃(CK)相比,分别升高225%(达维)、216%(辽榛8号)、346%(辽榛7号)、371%(玉坠)、222%(辽榛9号)、182%(辽榛3号)、205%(辽榛4号),且品种玉坠的上升幅度最大。-10~-15℃时,辽榛8号的Pro含量显著高于其他品种,分别为38.96 μg·g-1(-10℃)和44.65 μg·g-1(-15℃),随着温度的降低,-20~-30℃时,达维的Pro含量显著高于其他品种,而品种辽榛3号的Pro含量最低,说明在-20~-30℃之间,辽榛3号的叶片受低温伤害程度比较高。
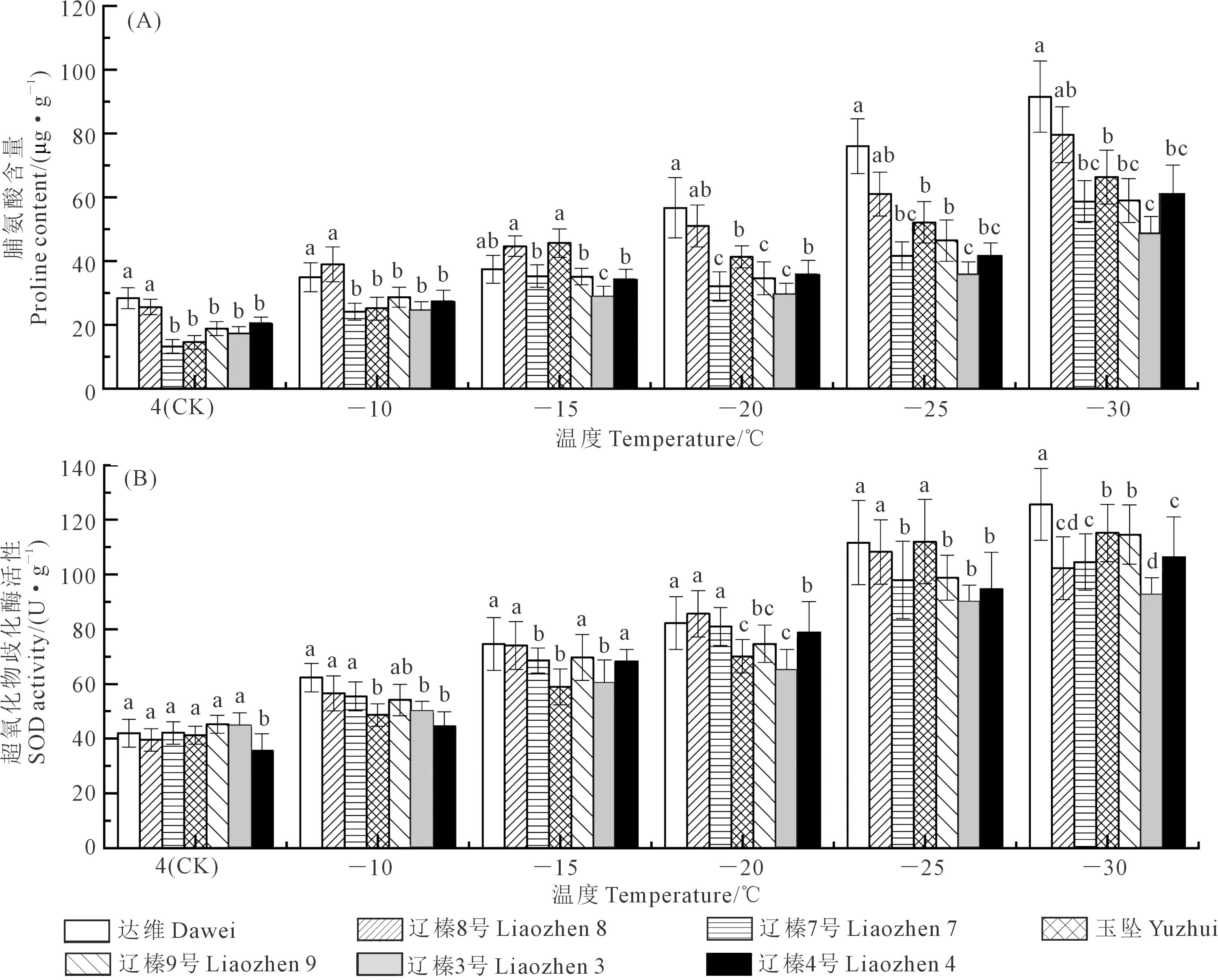
图4 不同榛子品种的脯氨酸(Pro)含量和超氧化物歧化酶(SOD)活性变化Fig.4 Changes in proline (Pro) and superoxide dismutase (SOD) contents of different hazelnut varieties
由图4B可知,不同品种的SOD活性随低温处理呈逐渐升高趋势,且具有显著性差异。-30℃时各品种出现最高值,分别为125.65(达维)、102.32(辽榛8号)、104.63(辽榛7号)、115.26(玉坠)、114.63(辽榛9号)、92.02(辽榛3号)、106.36(辽榛4号) U·g-1。在-25~-30℃,各品种的SOD 活性变化幅度相对较小,且一致性较强。不同温度处理下,达维的SOD含量高于其他品种,说明随着低温胁迫的加剧,达维的叶片受伤害程度可能小于其他品种。
2.5 不同品种榛子叶片组织结构指标分析
不同榛子品种的栅栏组织、海绵组织以及上、下表皮表现出一定的差异性(图5,表2)。达维、辽榛7号和辽榛9号的栅栏组织较厚,均在50 μm以上,且达维的栅栏组织厚度显著高于其他品种,其余各品种均在40~50 μm之间。达维和辽榛7号的海绵组织厚度显著高于其他品种,其中达维最厚,达到83.6μm。各榛子品种的叶片厚度均达到120 μm以上,达维(168.6 μm)及辽榛7号(157.2 μm)的叶片厚度最大,显著高于其他品种。达维和辽榛7号的上、下表皮厚度均在10 μm以上,辽榛3号的上、下表皮厚度在7个品种中最小,分别为13.8 μm和7.5 μm。达维和辽榛9号的叶片紧密度、栅海比显著高于其他品种,辽榛4号和辽榛3号的表现为最低。而达维和辽榛7号的叶片疏松度显著高于其他品种。

注:图5A~E分别为品种达维、辽榛8号、辽榛7号、玉坠、辽榛9号、辽榛3号、辽榛4号。ue:上表皮;le:下表皮;pp:栅栏组织;sp:海绵组织Note:In this figure, A~E are respectively Dawei, Liaozhen 8, Liaozhen 7, Yuzhui, Liaozhen 9, Liaozhen 3, Liaozhen 4. ue, le, pp and sp represent upper epidermis, lower epidermis, palisade parenchyma and spongy parenchyma respectively.图5 不同榛子品种叶片的显微结构Fig.5 Microstructure of hazelnut leaves of different varieties
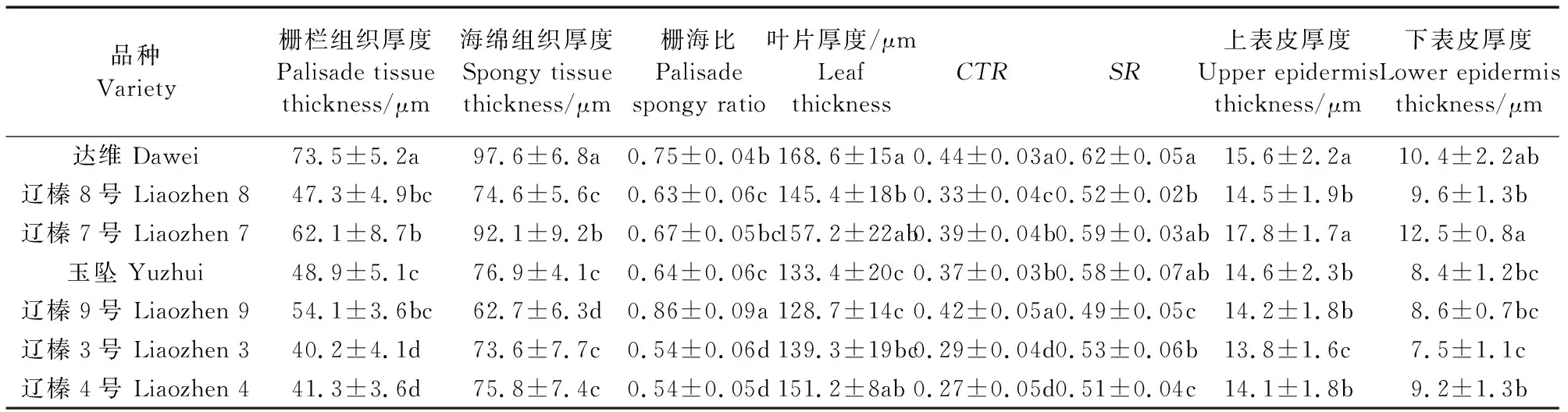
表2 榛子叶片的组织结构Table 2 Tissue structure indexes of hazelnut leaves
2.6 主成分分析
主成分分析可以把互相关联的指标转换成独立的综合指标从而降低误差。对不同品种的18个指标进行主成分分析,提取特征值大于1的4个主成分,其累计贡献率达到了93.8%,说明已经把7个榛子品种与抗寒性有关的93.8%的数据都反映出来,能够较好地代表数据反映的信息(表3)。对17个与抗寒有关的指标进行主成分分析(表4),在这4个主成分中各指标的载荷值差异较大,而载荷值越大,说明其对主成分的贡献越大,代表性越强。光合速率、淀粉含量、叶片厚度、 海绵组织厚度、MDA含量等5个指标在主成分1中载荷值的绝对值最高,说明主成分1反映的数据主要是这5个指标。主成分2中上表皮厚度、栅栏组织、电导率、可溶性糖等4 个指标载荷值的绝对值最高,表明主成分2主要映射这4个指标的特征。将上述4个主成分的得分值代入综合评价函数,利用相关公式(F=PC1×51.321%+PC2×21.889%+PC3×13.933%+PC4×6.657%),计算得出每个品种的综合得分,并依据综合得分对其进行排序(表5)发现,7个榛子品种中,达维的综合得分最高(91.131),辽榛7号和玉坠次之,辽榛3号得分最低。据此可知,达维、辽榛7号和玉坠品种的抗寒性优于其他品种。
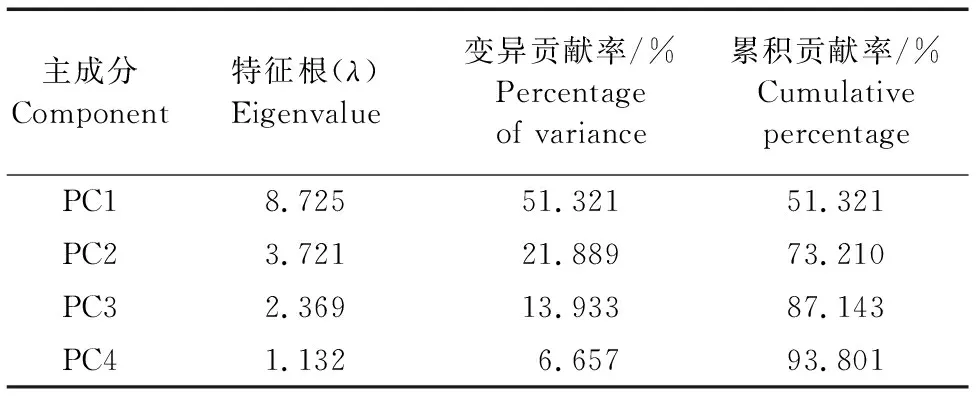
表3 主成分列表及方差贡献率 Table 3 List of principle components, percentage of variance, cumulative percentage
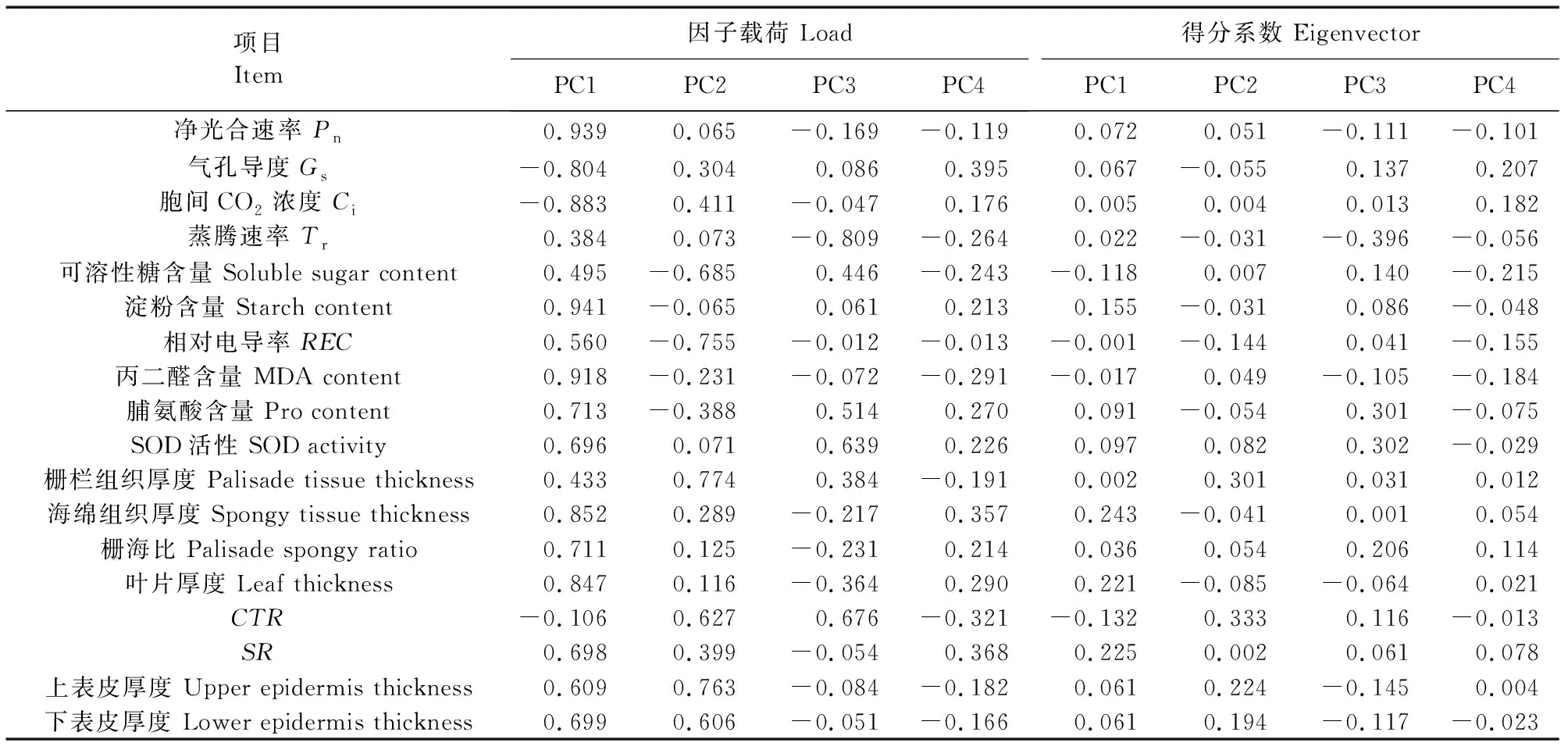
表4 因子负荷矩阵和得分系数矩阵Table 4 Component matrix and score coefficient matrix

表5 不同榛子品种的综合得分及排名Table 5 Comprehensive scores and ranking of different hazelnut varieties
3 讨论与结论
在植物的生命周期中,冷胁迫是植物面临的最严重的非生物胁迫之一,叶片作为植物进行光合、呼吸作用的重要场所,对外界环境极为敏感。观察植物叶片的解剖结构、分析各组织之间的关系是研究植物对低温环境适应性能力的重要途径之一[21]。孟诗原等[22]在研究卫矛属植物的抗寒能力时发现,叶片的表皮组织越厚,对叶片内部组织的保护作用也越好,更可能降低低温环境对叶片的伤害。本研究通过石蜡切片对7个榛子品种的叶片组织结构进行观察,发现各榛子品种的叶片厚度均达到120 μm以上,达维及辽榛7号的叶片厚度最大,显著高于其他品种,且植株的抗寒性也高于其他品种;同时,7个品种中辽榛3号的叶片紧密度及栅栏组织显著低于其他品种,其抗寒性也最低(图5,表1),这与前人的研究结果相一致。如,郭雁君等[23]对砂糖橘叶片的研究发现,抗寒性强的品种植株叶片的紧密度、栅海比等综合指标都较高。郭学民等[24]对桃叶片的研究发现,影响抗寒性的主要叶片解剖结构指标是叶片厚度、栅栏组织厚度和海绵组织厚度,这3项指标的差异在一定程度上可以反映不同桃品种抗寒性的变化。由于在正常的生命活动中,植株叶片表皮细胞能有效保护内部组织,防止水分过分蒸发而引起对植株的伤害,从而提高了植株的抗寒性能[25]。
光合作用是影响植物生长的关键因素,同时光合作用的变化是植物生产过程中物质积累、生理代谢以及能量转化的基本单元[21,26]。研究表明,光合能力越高,植物的物质积累越多,越能够有效提高植株的抗寒能力,促进植株在低温下生长[15]。而胞间CO2浓度则反映了叶肉细胞对CO2的需求关系,当叶肉细胞对CO2的需求增加时,细胞间隙的CO2浓度下降,当叶肉细胞对CO2的需求减少,细胞间隙的CO2浓度便升高[27]。本研究中,不同时期达维、辽榛7号叶片净光合速率显著高于其他品种,但是胞间CO2浓度却低于其他品种,说明光合速率高的品种短时间内积累更多的干物质,且更能抵御低温胁迫。其次当植物体的蒸腾速率过大时,就会导致植物体内的水分在短时间内大量蒸发,不利于植物合理地利用水分。本研究中,不同时期辽榛3号、辽榛4号的叶片蒸腾速率显著高于其他品种,根据主成分综合评价,达维、辽榛7号的抗寒性显著高于其他品种,而辽榛3号和辽榛4号的抗寒性最小。所以蒸腾速率大的品种在短时间内产生的干物质相对较少,更不利于植物抵御低温胁迫,这与前人在水稻中的研究结果一致[28]。
相对电导率常被用来表示植物在低温伤害下细胞膜的受损程度,反映了细胞内电解质的外渗程度,是评价低温胁迫对植物伤害程度的重要指标之一。过度低温胁迫下,植株的细胞膜会遭到破坏,造成部分电解质渗漏[29]。宋尚伟等[30]发现,石榴受冻害程度越重,细胞膜受伤害程度越重,细胞膜外渗物质越多,其电导率就越大,抗寒性越弱。本研究中,不同榛子品种的相对电导率随低温胁迫呈一定幅度的上升趋势,在4~-15℃之间,各品种的电导率变化幅度相对较小,且一致性较强,说明在此温度区间,细胞膜受害程度不明显,但随着温度的降低,-25~-30℃时升至最高值,辽榛3号和辽榛4号的相对电导率显著高于其他品种,且升高幅度最大。而玉坠和达维的相对电导率最低。说明在此温度条件下,品种辽榛3号和辽榛4号的细胞膜破坏程度最大,其抗寒性也相对较弱。这与前人在紫花苜蓿中的研究结果相一致[31]。
细胞膜是植物维持胞内环境相对稳定,保证各种生化反应有序进行的重要细胞结构,但同时也对低温胁迫最为敏感。低温胁迫下,植物组织中会产生对细胞膜有害的活性氧自由基(ROS),使细胞膜发生膜脂过氧化反应而产生MDA,阻碍细胞膜正常的生理功能,因此可以用MDA含量来衡量植物的抗寒性[31-32]。张敏欢等[33]在核桃的研究中发现,当植物遭遇逆境胁迫时,ROS代谢的动态平衡遭到破坏形成MDA,致使其含量增加。本研究中,随着低温胁迫,各品种的MDA含量都出现了一定幅度的升高,且同一温度处理下,品种达维和辽榛8号的MDA含量显著高于其他品种,说明其抗寒性也高,而辽榛3号和辽榛4号的MDA含量在-25℃时出现最高值,-30℃时开始下降,这可能是因为此低温胁迫下植物细胞膜已受到活性氧的毒害,有膜脂过氧化现象发生,细胞膜功能受损,导致膜渗透性发生改变,细胞通透性加大,胞内电解质外渗现象严重,对植物造成了不可逆转的损伤。这与前人在油菜中的研究结果相一致[34]。
低温胁迫会造成细胞液的外渗,导致细胞内、外渗透平衡失调,植物会通过积累各类渗透调节物质来减少甚至消除因低温胁迫而造成的损伤。可溶性糖、游离脯氨酸是降低植物质膜受冻害程度的重要渗透调节物质,通过提高植物细胞质液浓度,增大细胞保水力,保护植物因脱水而受伤害,维护植物正常的生理生化过程[35]。本研究中,随着低温胁迫程度的加重,其含量均持续上升,但两个指标的增加幅度和增长速度明显不同,说明7个品种对低温胁迫造成植株伤害均有一定的防御能力。他们在低温胁迫下,可以通过合成更多的渗透调节物质来提高细胞液浓度,维持细胞内外渗透压平衡,应对低温造成的伤害,但是不同品种之间存在差异,这与武艳等[36]在茶树中的研究结果相似。同时植物体内还存在着SOD等抗氧化酶系统以清除活性氧,降低逆境损伤,维持细胞膜正常的生理功能。随着胁迫程度的加重,活性氧的积累量超出保护酶系统的清除能力,SOD能够将有毒的活性氧自由基还原成氧和水,其活性的高低直接关系到植株抗氧化能力的强弱[35,37]。本研究中,7个品种的SOD含量随低温胁迫均呈逐渐上升趋势,说明低温胁迫导致细胞内活性氧数量增加,植株通过抗氧化酶参与相关反应来消除有害物质。
综上所述,低温胁迫下,7个榛子品种的生理指标都发生了明显的变化,其应对低温胁迫的作用机理主要为:一是通过渗透调节物质的合成来提高细胞内渗透势,二是抗氧化酶对活性氧自由基的清除。在进行植物的抗寒性评价时,不同生理指标的表现情况在低温胁迫下变化不尽一致,植物抗寒反应机制相对复杂,单用某一个指标来判定榛子的耐寒性过于片面,因此通过多指标来建立不同榛子品种抗寒水平,使其更具有科学性。本研究选择18个较常见的抗寒性评价指标,既有相对独立性,又存在一定的相关性。主成分分析是目前最常用的综合评价方法,主成分携带信息量与其贡献量呈正相关。通过主成分分析对7个品系的抗寒性进行综合评价,达维的综合得分(91.131)最高,辽榛7号和玉坠次之,辽榛3号得分最低。据此可知,达维、辽榛7号和玉坠品种的抗寒性优于其他品种,可作为甘肃高寒地区示范推广的耐寒参考品种。
