结核通路基因与肺鳞状细胞癌预后及免疫微环境的相关性研究
2023-10-10蒋逆立刘曾晶胡艳玲
蒋逆立,张 蝶,刘曾晶,胡艳玲,,
1. 广西医科大学生命科学研究院(南宁 530022)
2. 广西医科大学再生医学与医用生物资源开发应用省部共建协同创新中心(南宁 530021)
3. 广西医科大学信息与管理学院(南宁 530022)
癌症是全球严重的公共卫生问题,其中肺癌导致的死亡人数最多,约25%癌症患者死亡归因于肺癌,其中82%由吸烟导致[1-2]。两项随机对照试验研究显示低剂量CT 筛查能显著降低肺癌患者的死亡率[3-4]。结核病(tuberculosis, TB)是全球成年人传染病的主要死因,每年患病人数达1 000 多万[5]。呼吸道感染期间细胞炎症和损伤与癌症相关,研究显示,结核病感染与癌症风险之间存在显著的正相关,根据肺癌组织学分层分析,肺结核病史与腺癌和鳞状细胞癌之间存在显著相关性[6];具有结核分枝杆菌感染史的患者进展为癌症的可能性更高[7-8]。 结核病恶化为肺癌的原因可能是肺部炎症和纤维化导致的基因突变或损伤,进而增加了肺癌患病风险[9]。既往研究证实了肺结核患者外周血细胞中的基因表达差异,已鉴定的表达谱也显示免疫系统的慢性激活,同时干扰素(interferon, IFN)信号传导明显激活,通过Janus 酪氨酸蛋白激酶/信号转导及转录激活因子(Janus kinase-sinal transducer and activator of transcription, JAK-STAT)信号通路途径的促炎信号传导,以及具有下游反应元件Fcγ 受体(Fc gamma receptors, FcγR)高表达[10-12]。在结核患者中,再刺激诱导的细胞死亡(restimulation-induced cell death, RICD)和T 细胞活化受自然杀伤、T 和B 细胞抗原/淋巴细胞活化分子相关蛋白信号转导途径(natural killer, T and B cell antigen/signaling lymphocyte activation molecule-associated protein,NTB-A/SAP)的调节[13]。然而,目前尚缺乏结核相关基因与肺鳞状细胞癌(lung squamous cell carcinoma, LUSC)预后及免疫浸润关系方面的研究。本研究旨在基于生物信息学探讨结核通路基因表达差异与LUSC 预后及肿瘤免疫微环境的相关性。
1 资料与方法
1.1 数据获取与处理
基于京都基因与基因组百科全书数据库(Kyoto Encyclopedia of Genes and Genomes,KEGG)(www.kegg.jp/kegg/pathway.html)[14], 获取结核病感染相关通路(map05152)的138 个基因,包括C3、JNK和TNF等基因。LUSC 患者的临床数据和基因表达数据来自癌症基因组图谱数据库(The Cancer Genome Atlas, TCGA)(www.cancer.gov/ccg/research/genome-sequencing/tcga)[15]。总样本为502 例LUSC 患者,剔除年龄、性别、生存状态、临床分期等信息缺失的样本后,最终纳入374 例,对患者的表达矩阵数据进行归一化处理,得到原始表达数据(fragments per kilobase million, FPKM)[16]。
1.2 构建COX比例风险回归模型与森林图分析
通过单因素COX 分析得到结核通路基因中与LUSC 预后(即生存状态)相关的关键基因,再将单因素分析差异有显著意义的变量纳入多因素COX 分析,筛选与LUSC 预后相关的基因,消除基因间的潜在协同效应和偏倚误差,得到风险评分、风险分组(风险评分高于均值的患者纳入高风险组,低于均值则纳入低风险组)及风险比(hazard ratio, HR),构建独立预后模型。通过森林图分析该预后模型的风险评分、年龄、性别和肿瘤分期与LUSC 预后的相关性,评估预后模型的风险评分是否受其它临床变量(性别、年龄、临床分期等)的影响,并绘制临床相关性热图。使用的R 软件包有survival、tidyverse、glmnet 和survminer。
1.3 构建ROC曲线和列线图
通过风险评分、年龄、性别、肿瘤分期分别构建受试者工作特征(receiver operating characteristic, ROC)曲线,并评估风险评分对LSCC 患者预后(2 年、3 年和5 年生存率)的预测敏感性和特异性。基于多因素COX 回归分析结果,采用列线图(Nomogram)展示各变量与LUSC 预后之间的关系。使用的R 软件包有survival、survminer、timeROC、tidyverse、regplot和myplot。
1.4 肿瘤微环境和单样本免疫浸润
通过CIBERSORT 方法计算不同风险组结核通路基因的LUSC 样本免疫细胞浸润,利用线性支持向量回归的原理对免疫细胞亚型的表达矩阵进行去卷积,估计免疫细胞的丰度,使用的R 软 件 包 为ggplot2、mmunedeconv、tidyverse、dplyr 和reshape2。通过不同风险分组肿瘤样本中结核通路基因的表达评估LUSC 肿瘤微环境的组成,并进行单样本免疫浸润分析,分析每种免疫细胞富集差异,使用的R 软件包有genefilter、SVA、GSVA、stringr、ggpubr、ggsignif、pheatmap、ggplot2 和myplot。
2 结果
2.1 一般情况
本研究纳入374 例LUSC 患者,患者的性别、年龄、临床分期、生存状态和风险分组等临床信息见表1。

表1 374例LUSC患者的临床信息Table 1. Clinical information of 374 LUSC patients
2.2 COX比例风险回归模型与森林图独立预后分析
单因素COX 回归分析筛选得到预后相关基因TGFB2、CASP9、FADD、CEBPB和PLK3,多因素COX 分析结果显示FADD、PLK3基因与LUSC预后显著相关(P<0.05),并在高风险组中均为高表达,见表2。
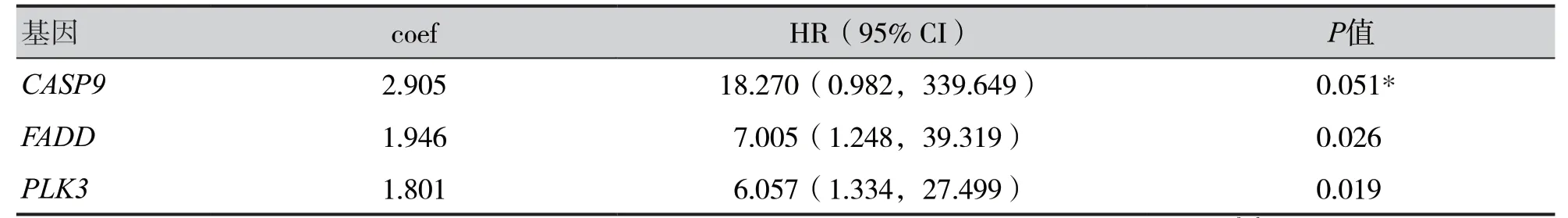
表2 LUSC患者预后相关基因的多因素COX分析Table 2. Multivariate COX analysis of prognostic related genes in LUSC patients
森林图结果显示,风险评分和年龄具有独立预测LUSC 患者预后的能力(P<0.05),进一步对风险分组和相关临床信息进行相关性热图分析,结果见图1。
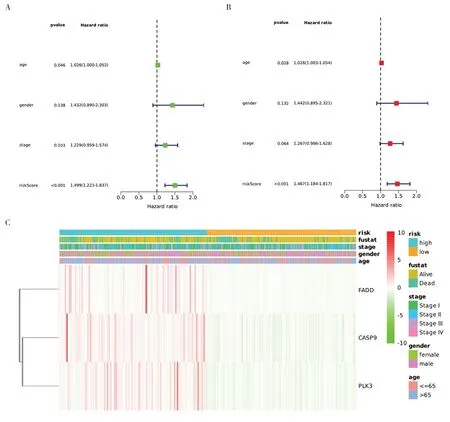
图1 LUSC患者预后的森林图分析及关键基因热图Figure 1. Forest map analysis and key gene heatmap analysis of the prognosis of LUSC patients
2.3 ROC曲线和列线图分析
本研究构建不同临床特征的ROC 曲线,探索风险评分、年龄、性别和临床分期对LUSC 患者总生存率的预测准确率,结果显示风险评分预测模型的曲线下面积(area under the curve, AUC)为0.637,高于其他临床因素的预测准确率,并验证了该预测模型对LUSC 患者2 年、3 年及5 年生存率的AUC 值。根据列线图结果可知,LSCC 患者的预后与风险得分的相关性最高,其次是性别、临床分期和年龄,见图2。

图2 LUSC患者预后的ROC曲线和列线图Figure 2. The ROC curve and nomogram of the prognosis of LUSC patients
2.4 肿瘤微环境分析
如图3 所示,通过分析不同风险评分组的肿瘤微环境,计算免疫细胞在各样本中的富集得分,其中差异有统计学意义的免疫细胞有CD56bright natural killer、central memory CD4 T、effector memeory CD4 T、gamma delta T、myeloid-derived suppressor cell(MDSC)、memory B、natural killer、natural killer T。高风险组内高富集的免疫细胞为CD56bright natural killer、MDSC、memory B,高风险组内低富集的免疫细胞为central memory CD4 T、effector memeory CD4 T、gamma delta T、natural killer、natural killer T。

图3 肿瘤免疫微环境和免疫细胞的富集得分Figure 3. Tumor immune microenvironment and enrichment score of immune cells
3 讨论
本研究通过COX 回归分析结核通路基因在LUSC 中的表达情况,筛选出与LUSC 预后相关的基因,分别为CASP9、FADD、PLK3基因。一项荟萃分析显示,Caspase 9(CASP9)单核苷酸多态性(single nucleotide olymorphisms, SNPs)与癌症易感性相关[18];CASP9基因在非小细胞肺癌(non small cell lung cancer, NSCLC)中低表达[19],而在高风险组中相对高表达。FAS 相关死亡结构域(fas-associating protein with a novel death domain, FADD)的表达和活性受到复杂网络的调节,如DNA 甲基化、非编码RNA 和翻译后修饰,其失调已被证实与多种类型癌症的发病机制密切相关,FADD 已被证实参与并调节大多数信号体复合体,已成为先天免疫、炎症和癌症进展的新参与者[20-21]。Polo 样激酶(Polo-like kinase,PLK)基因家族是细胞分裂过程中的重要调节因子,其成员的异常遗传和表观遗传学改变在不同的癌症中起着不同作用,肺癌亚型中PLK 1/4(Polo-like kinase 1/4)基因过表达但PLK 2/3(Polo-like kinase 2/3)欠表达[22],PLK3在高风险组中相对高表达,敲除PLK3可以减弱磷酸化及致癌性[23]。森林图显示CASP9、FADD、PLK3三个基因构建的风险评分预后模型与年龄可以独立预测LUSC 预后情况,同时ROC 曲线也显示风险评分预测模型的AUC 值高于年龄、性别和临床分期,说明该模型的敏感性最好,预测2 年和3年生存率的敏感性和特异性较好。既往研究基于TCGA 和GEO 数据库构建LUSC 早期患者的ROC曲线,AUC 值也仅为0.67 和0.679[24]。在临床应用中,临床医师可以依靠列线图,将LUSC 患者的相关信息带入列线图,来估计患者1 年、2 年及3 年生存率。国内学者发现吸烟会导致重要基因的甲基化水平发生变化,从而影响LUSC 患者预后[25]。本研究侧重结核相关基因表达对LUSC患者预后的影响,并进一步探索肿瘤免疫微环境的变化。
自然杀伤细胞(natural killer cell, NK)被认为是一种相对原始的“杀手”,它们不仅被视为先天免疫的真正参与者,还被视为塑造和影响适应性免疫反应的重要细胞[26]。CD56 bright natural killer 细胞可通过分泌细胞因子起到免疫调节的作用,研究显示肿瘤内和循环NK 细胞数量的增加与抗西妥昔单抗和抗cd20 单抗治疗的良好效果相关[27-28]。而通过结核通路基因显示出CD56bright natural killer 细胞在LUSC 高风险组中高富集,这可能提示其对放化疗具有敏感性。骨髓来源抑制性细胞(myeloid-derived suppressor cells, MDSCs)参与癌症相关的炎症反应,是肿瘤免疫微环境中的重要细胞,MDSCs 促进Tregs 的形成,MDSCs 患者死于癌症的风险几乎翻了一番[29-30]。B 细胞分别分化为浆细胞或记忆B 细胞来发挥效应或记忆功能,一些研究表明继发性流感会触发记忆B 细胞快速迁移和重新定位[31-33],本研究也显示其在LUSC 高风险组高富集。CD4+T 淋巴细胞是适应性免疫的关键因子,可以指导和增强B 细胞和CD8+T 细胞对各种病原体的反应功能[34]。记忆T 细胞通常被分为中央记忆细胞(central memory CD4 T cell, TCM)和效应记忆细胞(effector memeory CD4 T cell, TEM),前者在血液中循环,后者可以从血液迁移到非淋巴组织[35]。研究表明TCM 是唯一与口腔鳞状细胞癌预后相关的独立免疫细胞,同时也与头颈部鳞状细胞癌的炎性肿瘤微环境和预后改善相关[36-37];在免疫反应过程中T 细胞接受抗原刺激后,经过增殖,分化形成TEM,与靶细胞接触后释放的穿孔素导致靶细胞表面形成小孔,从而介导杀伤作用[38]。同时,效应T 细胞还能释放出免疫活性物质(淋巴因子),如白细胞介素、干扰素等。γ-δT 细胞(gamma delta T cell)是一类非常规的T 淋巴细胞,在宿主防御、免疫监视和免疫系统内稳态中发挥着不可或缺的作用,对于促进淋巴和髓系的炎症反应和免疫反应也尤为重要[39-40]。自然杀伤T 细胞(natural killer T cell, NKT)和NK 细胞都是先天细胞毒性淋巴样细胞,产生炎症因子、细胞因子和趋化因子,它们对肿瘤和微生物免疫应答的作用已被证实[41],在肿瘤细胞的肿瘤微环境中发挥着重要作用,然而在LUSC 高风险分组中低表达,说明其对肿瘤细胞的免疫应答不足,这可能是导致预后不良的重要因素。
虽然本研究发现了结核通路相关基因与LUSC 预后的关系,并通过对LUSC 患者预后进行风险分组,探索了高风险组有富集差异的免疫细胞,但局限于采用生信分析,其结果有待在人群中进一步验证。未来有望进一步深入研究,寻找结核和LUSC 新的治疗靶点,为结核进展为LUSC 患者提供更科学合理的治疗方法。
