复杂运动情境下AMPK的多位点修饰及其活性调节
——基于蛋白质结构生物学的解析
2023-10-10王静艺邹勇漆正堂
王静艺,邹勇,漆正堂*
(1.华东师范大学 “青少年健康评价与运动干预”教育部重点实验室,上海 200241;2.华东师范大学 体育与健康学院,上海 200241)
腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)属于丝/苏氨酸蛋白激酶,几乎存在于哺乳动物所有组织中,其活性受一磷酸腺苷(adenosine monophosphate,AMP)、三磷酸腺苷(adenosine triphosphate,ATP)、AMP/ATP、AMPK激酶、蛋白磷酸酶、活性氧等多重因素调节。AMPK一旦被激活,可磷酸化100多种蛋白质,以促进ATP生成的分解代谢,抑制ATP消耗的合成代谢,从而维持能量稳态(Townsend et al.,2023)。AMPK通过磷酸化下游底物参与细胞生长、衰老与凋亡、细胞自噬、线粒体生物合成等几乎所有的生命活动。磷酸化是蛋白质活性的一种调节方式,而这种调节大多是以AMPK激活为前提的。AMPK的蛋白结构包含多个磷酸化位点,以及泛素化、SUMO化、乙酰化、甲基化和氧化位点,这些位点的修饰大部分是可逆和可组合的,使AMPK能以多种形态灵活应对复杂的生理情境(Ovens et al.,2021)。
AMPK是细胞感受能量应激状态并将其“翻译”成细胞信号的重要激酶,其底物的广泛性及其活性的可调节性,让AMPK一直是运动与代谢研究的焦点。在能量应激状态下,急性运动导致AMPK迅速激活,动员细胞产生ATP满足运动需要。长期训练会提高安静状态下AMPK的活性,让机体处于代谢活跃状态,但也导致机体对运动的应激反应减弱,表现为AMPK瞬时激活不明显。关于AMPK与运动的研究已持续数十年,并达成共识:AMPK是能量代谢的核心调控因子,运动激活AMPK改善细胞内稳态,产生健康效应(Spaulding et al.,2022)。然而这依旧是笼统而宏观的概念。AMPK在复杂运动情境中的应答形态是怎样的?在细胞和动物实验中很难捕捉AMPK蛋白复合物的实时变化和多位点结构修饰,因此对这一问题很难回答。综合结构生物学的方法和新的研究证据,本综述进一步解析运动情境对AMPK的多位点修饰过程,以及AMPK不同活性形态对运动能力和健康维持的不同意义。
1 AMPK的识别基序及其底物选择性
1973年研究发现,大鼠肝脏中有一个组分具有激酶活性,可以磷酸化并抑制乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)和3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl coenzyme A reductase,HMGCR)这两个脂质合成关键酶的活性(Beg et al.,1973; Carlson et al.,1973)。进一步研究发现,该组分能被AMP激活,因此,在1988年被确定为AMPK而非蛋白激酶A(Sim et al.,1988)。随后的研究发现,AMPK的AMP结合域和催化域位于一个63 kDa的多肽上,磷酸化底物的共识别序列包含丝氨酸残基、N端(即-1处)一个疏水残基,在-2、-3或-4处至少有一个精氨酸残基(Carling et al.,1989a,1989b)。哺乳动物AMPK与酵母Snf1蛋白激酶的催化结构域具有结构和功能同源性,识别底物所需的基序为M/V/L/I-(R/K/H,X,X)-X-S/T-X-X-X-M/V/L/I,其中M、V、L、I为可以相互替代的疏水残基,R、K、H为可以相互替代的碱性残基,X为任意残基,逗号表示括号中残基的顺序不重要。S/T表示Ser、Thr磷酸化位点(Mitchelhill et al.,1994)。这种基序决定了AMPK对底物选择性并不高,许多蛋白质一级结构都包含这种基序(表1)。同时,也决定了AMPK在生物进化中的保守性和物种间的相似性。

表1 AMPK常见底物蛋白的磷酸化位点及其基序Table 1 Phosphorylation Sites and Motifs of Common Substrate Proteins of AMPK
AMPK激活通过靶向固醇调节元件结合蛋白-1C(sterol regulatory element binding protein-1c,SREBP-1c)、碳水化合物反应元件结合蛋白(carbohydrate response element binding protein,ChREBP)、哺乳动物雷帕霉素靶点(mammalian target of rapamycin,mTOR)和ACC1/2的不同磷酸化位点抑制脂肪和蛋白质合成。AMPK还通过磷酸化组蛋白去乙酰化酶(histone deacetylase 5,HDAC5)、过氧化物酶体增殖物激活受体γ共激活因子-1α (peroxisome proliferator-activated receptor-γ coactivator-1α,PGC-1α)和UNC-51样激酶(unc-51-like kinase,ULK)增强葡萄糖摄取、线粒体代谢和细胞自噬等(Ke et al.,2018)。总之,AMPK通过底物蛋白的磷酸化,促进营养物的摄取和分解,并抑制合成代谢。很多蛋白在氨基酸序列上保留了AMPK的识别位点(磷酸化位点,即表1中的红色小写字母),AMPK激活对细胞或机体代谢具有整体调控能力(图1)。这也是AMPK作为能量代谢核心调控因子的前提。
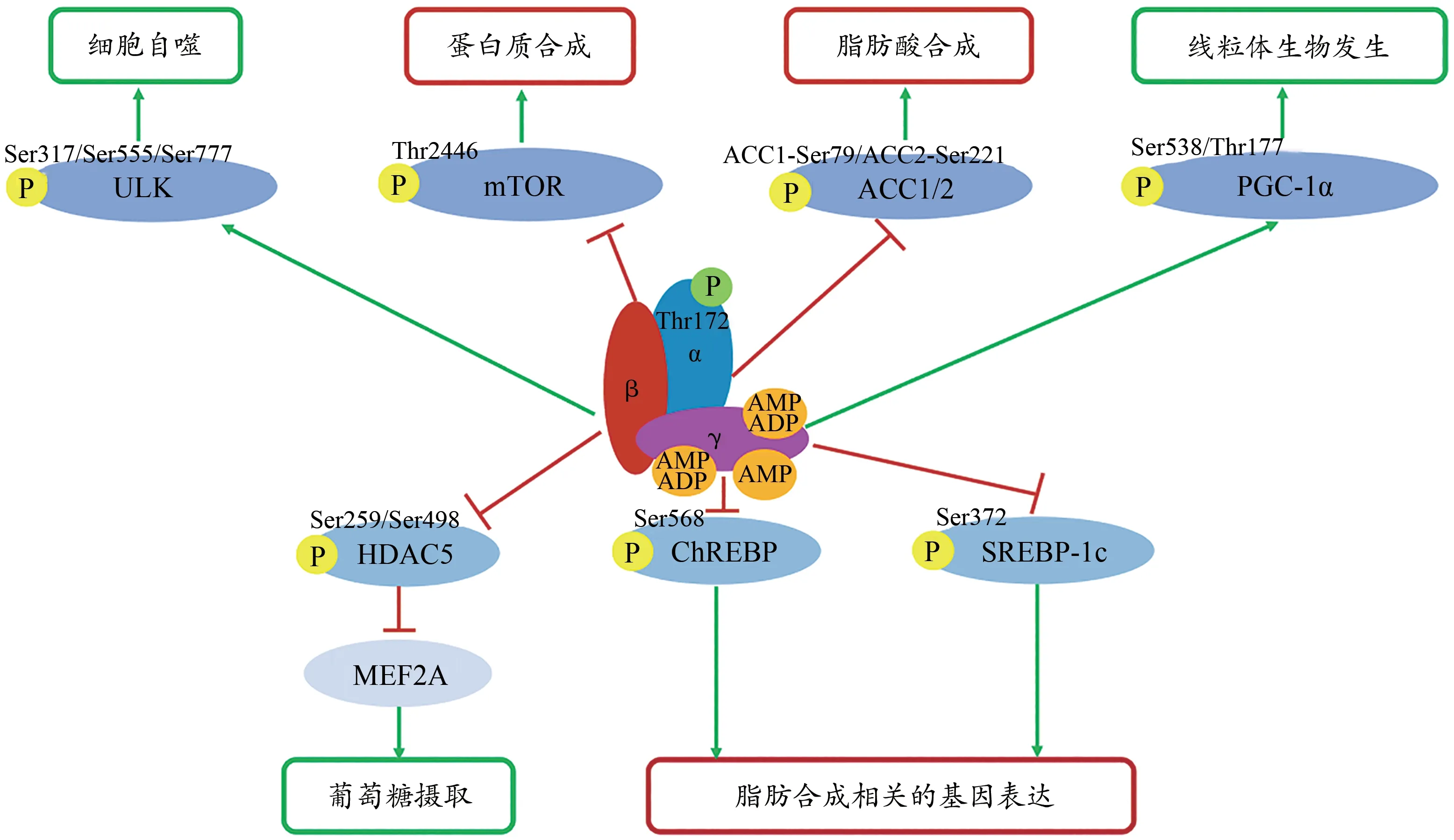
图1 AMPK激活对细胞或机体代谢的整体调控路径Figure 1.A Holistic Pathway that AMPK Activation Regulates Cellular or Body Metabolism
2 AMPK亚基的结构生物学解析
AMPK是由一个催化亚基α(α1和α2两种亚型)、两个调节亚基β(β1和β2两种亚型)和γ(γ1、γ2和γ3三种亚型)组成的异源三聚体(Cheung et al.,2000)(图2)。每个亚基的所有亚型都能以1∶1∶1的比例结合,从而产生12种可能的AMPK复合物,分布在细胞的特定隔间中,如细胞核、细胞质、线粒体、溶酶体或内质网等。不同组织中AMPK复合物的组成存在差异,在啮齿类动物的肝脏中,α1和α2的表达水平相似,β1和γ1是主要的调节亚基,意味着啮齿类动物肝脏主要表达α1β1γ1和α2β1γ1两种复合物,而在骨骼肌中,α2、β2和γ3是主要亚基,因此含有α2β2γ3的异源三聚体占主导地位(Steinberg et al.,2019)。研究发现,在骨骼肌(主要在白肌,糖酵解Ⅱ型纤维)中表达的α2β2γ3复合物优先被短时间高强度运动激活(Birk et al.,2006),可能是急性运动激活AMPK的表现;而不局限于骨骼肌表达的α1β2γ1和α2β2γl复合物则更多是在红肌、氧化型I型骨骼肌纤维中被长时间的耐力运动激活(Kjobsted et al.,2018),这可能是长期训练导致AMPK活性提高的主要表现。这表明AMPK复合物具有组合多变的激活形式,以备不同的运动情境选择性激活。

图2 AMPK复合物的蛋白结构域及其能量-信号转换域(引自蛋白质结构数据库)Figure 2.The Protein Domain and Its Energy Signal Conversion Domain of AMPK Complex
α亚基是激酶活性亚基,主要由N端的激酶结构域(kinase domain,KD)、自抑制结构域(autoinhibitory domain,AID)、α连接体(α-linker)和C端结构域(C-terminal domain,CTD)组成。AID会抑制KD的激酶活性。在KD的C端α螺旋上存在Thr172位点(α1与α2相应的位点不同,为方便描述,以下统一为α-Thr172),可被肝激酶B1(liver kinase B1,LKB1)、钙/钙调蛋白依赖性蛋白激酶激酶2(calcium/calmodulin dependent protein kinase kinase 2,CAMKK2)等上游激酶磷酸化,以解除AID对KD的抑制作用,进而激活AMPK (Chen et al.,2009)。α-linker包含两个调节性亚基相互作用基序(α-regulatory subunit interacting motif,α-RIM),即α-RIM1和α-RIM2,可与γ亚基相互作用。在人体实验中,AMPK α2的激活是运动强度依赖性的,而AMPK α1不易被激活(Fujii et al.,2000;Wojtaszewski et al.,2000),提示含α2的AMPK复合物,而不是α1,参与骨骼肌对运动的代谢反应。然而后来研究发现,含α1的AMPK复合物也参与运动的代谢反应(Kjobsted et al.,2018),结果不一致的原因可能是运动情境不同。因此,骨骼肌AMPK备有多种激活形态应对运动刺激,进而介导不同的代谢反应,这导致不同运动情境在分子水平不具有可比性。
β亚基包括N端肉豆蔻酰化位点和糖原结合域(carbohydrate-binding module,CBM)。α-Thr172磷酸化在AMP、ADP与γ亚基的胱硫醚-β-合成酶(cystathionine-β-synthase,CBS)结构域的1和3位点结合时增强,前提是N端第2位甘氨酸位点是肉豆蔻酰化的。一旦α-Thr172磷酸化,AMP的直接激活和对不被去磷酸化的保护都不需要β亚基的肉豆蔻酰化(Oakhill et al.,2010,2011)。糖原通过与CBM结合以抑制AMPK活性。在α亚基KD和β亚基CBM之间存在一个独特的口袋结构域,是变构药物和代谢物(allosteric drug and metabolite,ADaM)位点,是AMPK与小分子激活剂(如A769662、长链脂酰辅酶A、991、水杨酸、PF-739、MT63-78、GSK621、MK-8722、SC4等)结合的主要位点(Trefts et al.,2021)。β-Ser108磷酸化诱导β亚基形成α-螺旋,与KD的C-螺旋相互作用,导致KD向稳固的活性构象转变,防止α-Thr172去磷酸化,并增加底物亲和力。β亚基还有几个调节性磷酸化位点,与AMPK核定位(Ser24、Ser25)和催化活性(Ser182)有关(Calabrese et al.,2014)。因此,β亚基的变构与磷酸化修饰让AMPK的活性形态更加复杂。
γ亚基具有可变的N端和4个保守的CBS结构域,其中γ2、γ3的N端比γ1更长。N端的差异调节γ亚基对化合物991的激活反应,也能调节AMPK对其他激活剂的特异性反应(Willows et al.,2017)。使得AMPK对不同激活剂可能有不同的激活程度,这在动物研究中难以准确定量。AMPK通过CBS1、CBS3与AMP/ADP/ATP的竞争性结合,感知细胞能量状态。CBS4以非交换方式结合AMP,CBS2缺乏关键的天冬氨酸残基,不能结合AMP(Xiao et al.,2011)。由于AMP结合在γ亚基,而激酶结构域位于α亚基,因此当切换到激活状态时,必须进行亚基间通信。晶体结构显示,这种构象开关由α亚基AID、α-linker与γ亚基上的可交换AMP结合位点相互作用而实现,为AMP变构调节和α-Thr172磷酸化提供信号转导机制(Hardie et al.,2016)。运动时ATP水解生成AMP,γ亚基将能量代谢与AMPK激活及下游信号偶联,AMP作为ATP水解的直接产物还兼任重要信号分子角色。
3 AMPK的激活机制及其蛋白结构分析
AMPK的核心功能是对多种底物蛋白进行磷酸化修饰。AMPK从非活性状态过渡到能够磷酸化底物的催化活性状态,这一过程涉及多种激活机制,包括变构调节、磷酸化调节、去磷酸化调节和氧化还原调节等。
3.1 变构调节
变构激活是AMPK最迅速的激活方式。AMP可直接激活AMPK(Oakhill et al.,2011)。在机体处于应激或能量代谢紧张的情况下(如运动),AMP/ATP和ADP/ATP比率增加,AMP与γ亚基CBS3位点结合,α-RIM1和α-RIM2的一些氨基酸分别与CBS2和CBS3形成稳固的相互作用。一方面使得α-linker和AID在催化模块(包含α-KD和β-CBM)和核苷酸结合模块(包含α、β亚基的C端结构域和γ亚基)之间形成柔性铰链,保护α-Thr172不被去磷酸化;另一方面,导致α-linker将AID从KD的抑制性相互作用中拉开,从而导致AMPK的变构激活(Hardie,2018)。当ADP结合CBS3时,也会保护α-Thr172不被去磷酸化,因此,在某些情况下ADP可能也是AMPK激活信号。相反,当ATP与CBS3位点结合时,α-linker与γ亚基解离,使AID旋转回到KD后面的抑制位置,引起催化模块和核苷酸结合模块的分离,这导致蛋白磷酸酶可以靠近α-Thr172,并解除AMP、ADP对α-Thr172不被去磷酸化的保护作用(Ross et al.,2016)。总之,AMP、ATP对CBS3位点的争夺并非单纯的蛋白质变构调节,而是直接牵连α-Thr172磷酸化。
以前有研究认为,AICAR作为AMP模拟剂能够激活AMPK,并产生运动激活AMPK的类似效应(Fan et al.,2017)。但从结构生物学分析,外源性AMPK激活剂一般结合ADaM位点,与AMP的结合位点完全不同,很难体现运动的“类似效应”。如A-769662、水杨酸、MT47-100只对β1亚基的AMPK特异性激活,MK-8722、MSG011能激活所有12种可能的AMPK复合物。这些变构激活剂诱导的强大AMPK信号并没有伴随α-Thr172磷酸化或AMP/ATP比值的变化。因此,运动激活AMPK很难被激动剂模拟。鉴于大多数ADaM位点激活剂以类似的方式对接AMPK,很可能在结合位置的近端和远端,ADaM口袋周围的结构变化,有助于调节AMPK异构体的特异性和效力。这并非完全是结构生物学的预测。来自实验室的数据也表明,在MSG011及其类似物MSG012、MK-8722、PF-739的激活作用下,AMPK活性是连续递增的,并在某个特定的浓度区间呈现指数级递增(Ovens et al.,2022)。该研究提示,AMPK在变构调节水平并非简单的“开”和“关”,AMPK活性调节是一种连续态。在体内环境下,很难对AMP浓度与AMPK活性进行连续监测,所以这种连续性只能在体外实验中被观测到。
然而,值得注意的是AMPK过度激活可能会导致疾病预后不良,如亨廷顿舞蹈病就是一种AMPK过度激活有关的神经退行性疾病(Hua et al.,2022)。目前可用的AMPK小分子抑制剂非常有限。其中,应用最广泛的化合物C是一种ATP竞争性抑制剂,与高度保守的活性位点结合,其选择性较差。SBI-0206965作为一种直接的AMPK抑制剂,抑制效力是化合物C的40倍,激酶选择性更高,但是没有降低α-Thr172磷酸化水平,其与AMPK α2激酶结构域结合的晶体结构表明,该药物占据了部分ADaM位点(Dite et al.,2018)。这些研究表明,α-Thr172磷酸化作为AMPK的活性标记是不妥当的,AMPK具有不依赖α-Thr172磷酸化的变构激活方式,并且其活性调节范围可能更广。在体内尤其在不同运动情境中,是否有运动产生的代谢物结合ADaM位点,目前并不清楚。但根据结构生物学判断,一旦有类似代谢物出现,AMPK的活性调节可能是一种连续态,并且不依赖α-Thr172磷酸化。这可以解释为什么急性运动能够迅速激活AMPK。
3.2 磷酸化调节
磷酸化对酶活性的影响取决于被磷酸化的残基。α-Thr172磷酸化被认为是AMPK的关键调节位点,并且α1、α2亚基都包含这个位点,但AMPK上游激酶一直到2003年才被发现。LKB1在与小鼠蛋白25(mouse protein 25,MO25)和Ste20相关衔接蛋白(ste20-related adaptor protein,STRAD)结合后,通过磷酸化α-Thr172激活AMPK(Hawley et al.,2003),是肝脏和骨骼肌AMPK的主要上游激酶(Townsend et al.,2023)。在能量供应紧张时,LKB1-Lys178的SUMO1修饰(指SUMO1蛋白与Lys共价结合)促进LKB1对α-Thr172的磷酸化。LKB1的K178R突变使得AMPK信号和线粒体功能缺陷,最终导致能量剥夺、细胞死亡(Ritho et al.,2015)。此外,葡萄糖饥饿时溶酶体AMPK可被激活,这是因为葡萄糖水平下降引起果糖-1,6-二磷酸(fructose-1,6-bisphosphate,FBP)下降,醛缩酶和囊泡型腺苷三磷酸酶(vacuolar-type adenosine triphosphatase,v-ATPase)之间的相互作用发生了改变;LKB1将AMPK结合配体Axis抑制蛋白(Axis inhibition protein,AXIN)募集到溶酶体,在溶酶体胞内囊泡表面形成复合物,以不依赖AMP的方式激活AMPK。并且,醛缩酶感应FBP浓度激活AMPK,比AMP/ATP激活通路阈值更低,灵敏度更高。如果细胞ATP供应持续紧张,还会启动AMP依赖的AMPK激活途径(Zhang et al.,2017)。这些研究表明,LKB1作为上游激酶磷酸化α-Thr172以应对能量应激,并且AMPK激活不是简单的“开”和“关”状态,而是根据能量紧张状态的多层次、连续性激活,至少包括AMP依赖型和非依赖型。
AMPK还有不依赖LKB1的α-Thr172磷酸化方式。CaMKK2也是AMPK上游激酶,能被胞内钙离子激活,从而磷酸化α-Thr172(Hawley et al.,2005),并在神经组织中占主导地位。AMPK以钙离子和CaMKK2依赖的方式在细胞核中被特异性激活(Vara-Ciruelos et al.,2018)。转化生长因子-β激活激酶1(transforming growth factor-β-activated kinase 1,TAK1)在溶酶体受损时,也能够磷酸化α-Thr172(Jia et al.,2020)。此外,混合连接激酶3(mixed lineage kinase 3,MLK3)和牛痘相关激酶1(vaccinia related kinase 1,VRK1)也可以磷酸化α-Thr172,但该实验结果是通过重组α亚基,而不是通过完整的AMPK异源三聚体观测到的(Luo et al.,2015;Park et al.,2020)。这种α-Thr172磷酸化不代表AMPK激活,只能显示α-Thr172连接了一个磷酸基团。因此,MLK3和VRK1是否作为AMPK上游激酶需要进一步验证。
除了α-Thr172,还存在其他磷酸化位点调控AMPK活性。α1-Ser175/α2-Ser173、α1-Ser347/α2-Ser345、α1-Ser485/α2-Ser491可分别被蛋白激酶A(protein kinase A,PKA)(Djouder et al.,2010)、周期蛋白依赖激酶4(cyclin-dependent kinase 4,CDK4)(Lopez-Mejia et al.,2017)、蛋白激酶B(protein kinase B,PKB)(Valentine et al.,2014)磷酸化,进而抑制AMPK活性。而α2-Ser377、β1/2-Ser108、γ1-Thr284可分别被mTORC1(Needham et al.,2022)、AMPK(Mitchelhill et al.,1997)、DNA依赖性蛋白激酶(DNA-dependent protein kinase,DNA-PK)(Puustinen et al.,2020)磷酸化,从而增强AMPK活性。其中,β1/2-Ser108可被AMPK自磷酸化,这表明AMPK复合物之间存在交互激活,以正反馈或链式反应方式迅速增强AMPK的活性,这对急性运动而言意义重大。但在以往的研究中没有足够关注。此外,体外研究还发现了α1-Ser178/α2-Ser176(Hornbeck et al.,2015)、β1-Ser101(Woods et al.,2003)、γ1-Ser261/Thr263(Dite et al.,2017;Loffler et al.,2011)这些磷酸化位点,其作用还不清楚。总之,AMPK磷酸化修饰的位点很多,对应的上游激酶和刺激因子也不尽相同,导致AMPK的活性调节十分复杂。AMPK活性调节的复杂性使得AMPK有充足的应答状态应对复杂的体外环境,这对于维持机体稳态十分重要。
3.3 去磷酸化调节
蛋白磷酸酶(protein phosphatase,PP)是一类以蛋白质为底物使其去磷酸化的酶,与蛋白激酶的磷酸化作用刚好相反,二者共同调节和维持蛋白的磷酸化水平。已知的蛋白磷酸酶种类比蛋白激酶少,对底物选择性也较低。AMPK的α-Thr172磷酸化可通过蛋白磷酸酶PP1、PP2A、PP2C、Ppm1E或PHLPP2脱磷酸而失活(Martin et al.,2010;Park et al.,2013; Yan et al.,2021)。这些蛋白磷酸酶并不仅仅靶向α-Thr172,许多其他磷酸化位点都是它们的作用对象。此外,在缺氧条件下,一种靶向脯氨酸-谷氨酸-丝氨酸-苏氨酸基序的蛋白酪氨酸磷酸酶(protein tyrosine phosphatase with proline-glutamine- serine-threonine-rich motifs,PTP-PEST),通过α-Tyr436去磷酸化可以诱导α-RIM的构象变化,解除AID的抑制作用。这能促进上游激酶磷酸化α-Thr172以激活AMPK,从而使内皮细胞自噬和血管生成增加(Chandel et al.,2021)。
3.4 氧化还原调节
活性氧(reactive oxygen species,ROS),特别是过氧化氢(hydrogen peroxide,H2O2),能够可逆地氧化靶蛋白的半胱氨酸残基(Cys)。氧化修饰可以控制许多酶和转录因子的生物活性,以及它们的细胞定位或与蛋白之间的相互作用(Lennicke et al.,2021)。AMPK也是ROS的靶蛋白之一,而且对氧化应激高度敏感(Garcia et al.,2017)。ROS可以诱导AMP/ATP的增加间接激活AMPK,也可以通过直接的氧化修饰来调节AMPK活性(Choi et al.,2001)。在HEK293细胞和肺细胞中,H2O2可诱导α1-Cys299/Cys304的氧化和巯基SH-谷胱甘肽化,从而激活AMPK(Zmijewski et al.,2010)。但在心肌细胞中,H2O2诱导α2-Cys130/Cys174的氧化和分子间二硫键形成,造成AMPK聚集,阻止上游激酶对其磷酸化激活。可见,H2O2诱导Cys的氧化位点不同,对AMPK活性的调控也不同,这可以解释以往许多研究中的矛盾(包括运动情境),因为这些研究中没有对Cys的氧化位点作深入分析。ROS对AMPK的调节取决于细胞的抗氧化能力,能量应激诱导AMPK的Cys氧化和失活可被抗氧化酶硫氧还蛋白-1(thioredoxin-1,TRX1)的表达所逆转(Shao et al.,2014)。
急性运动诱导ROS产生而引发氧化应激,与AMPK的激活几乎是同步的(Trewin et al.,2018)。除了AMP和α-Thr172磷酸化,Cys氧化可能也是AMPK迅速激活的原因之一。长期训练适应增强内源性抗氧化防御系统,导致AMPK的α-Cys不再容易受到H2O2的氧化(Bouviere et al.,2021; Steinbacher et al.,2015)。这可以解释为什么长期训练后AMPK对急性运动不再敏感。还有研究发现,适度运动产生的ROS促进肝脏AMPK谷胱甘肽化(氧化)的激活。然而,过度运动使线粒体功能受损,增加氧化损伤,抑制AMPK的活性和表达。该研究提出,AMPK的激活结合氧化损伤的指标,可以作为运动干预时氧化还原状态变化的“前哨”标志物,用于判别适度和过度运动(Wu et al.,2022)。从结构生物学角度分析,适度和过度运动的差别还可能体现在Cys氧化位点不同,及其对AMPK各亚基结构域的影响。这些都有待进一步研究。
总之,AMPK的激活态并非特指AMPK在某一位点修饰后的蛋白结构,而是多个位点修饰的组合状态。AMPK的活性调节总是与细胞能量应激状态对应的。变构调节发挥迅速的代谢响应,Thr172位点与其他位点的磷酸化与去磷酸化调节、α-Cys的氧化还原调节等则维持AMPK处于适宜活性水平。变构调节也会影响AMPK的磷酸化,这与AMPK的调节亚基与变构剂的物理结合状态有关。此外,AMPK的泛素化、SUMO化、乙酰化、甲基化等修饰也相继被发现,与变构调节可能叠加形成更加复杂和更有柔性的AMPK复合物,这是难以用简单的激活态或失活态进行描述的。
4 AMPK的运动“钝化”现象
运动与AMPK的研究已经积累很多。近来的观点认为,运动诱导的各种组织和器官的适应可以促进健康和预防疾病,AMPK的激活在其中发挥关键作用。这些组织包括骨骼肌、心脏、肝脏、脂肪、大脑等。运动和AMPK激活剂可以促进分解代谢和细胞适应,从而改善能量内稳态(Spaulding et al.,2022)。然而,这一解释在理论上依旧是抽象的,只是用新的实验依据复述了以往的观点——AMPK是核心代谢调节因子(Hardie,2004; Jorgensen et al.,2006),并且有倾向性强调AMPK激活的重要性。纵观AMPK的研究,根据运动情境不同,AMPK的活性调控存在以下3种结果:
1)急性运动激活AMPK。一次中等强度运动可以使肌肉能量失衡,游离AMP、AMP/ATP比值、AMPKα1、α2和上游激酶活性、ACC磷酸化、葡萄糖摄取均显著增加;高强度运动时除AMPKα1和上游激酶活性不再增加外,其余进一步增加。运动期间AMP的增加对AMPK起变构作用,使上游激酶更容易磷酸化Thr172。AMPK活性依赖于运动强度,与α1相比,α2对运动的反应更强烈(Chen et al.,2003)。此外,未经训练的骨骼肌AMPKα2活性、α2-Thr172和ACC-Ser222磷酸化在一次中等强度耐力运动后即刻显著增加,在运动后3 h、24 h都恢复到基础水平,而相应蛋白的表达并没有改变。表明一次急性耐力运动会引起AMPK信号的短暂增加,但不足以诱导AMPK信号或蛋白表达的持续增加(Lee-Young et al.,2008)。很多类似研究都发现同样的结果。总之,急性运动引起的能量应激状态,都会以AMP为激活剂变构激活AMPK,并且增加α-Thr172的磷酸化。AMPK的这种激活态属于瞬时性爆发,其活性增加幅度较大。
2)长期训练提升安静状态AMPK活性。12周中等强度训练显著增加安静时骨骼肌、脂肪和肝脏AMPKα-Thr172和ACC Ser79的磷酸化、AMPKα1和α2的表达水平(Mortensen et al.,2013; Takekoshi et al.,2006)。在这里,ACC Ser79的磷酸化比α-Thr172的磷酸化更能体现AMPK的激活,因为ACC Ser79是AMPK发挥激酶活性的重要位点。55周中等强度训练激活AMPK/PGC-1α信号通路,该研究把蛋白印迹实验的p-AMPK Thr172/ AMPK比值定义为AMPK激活(Liang et al.,2021)。类似研究很多,α-Thr172磷酸化经常被作为AMPK激活的生物标记,但生物组织都是在安静状态取材,细胞内AMP浓度低、ATP充足,AMPK的激活态可能不是因AMP变构激活,而是上游激酶和磷酸酶、氧化还原、SUMO化等多位点修饰的结果。
3)长期训练导致AMPK瞬时性激活减弱。与久坐者相比,耐力训练者骨骼肌在一次20 min 80% V˙O2max运动后即刻AMPKα-Thr172 和ACC-Ser221磷酸化降低,同时AMP/ATP、乳酸和肌酸水平较低,肌糖原和磷酸肌酸水平较高,表明长期训练使骨骼肌ATP生成的能力提高,更好地维持了能荷状态(Nielsen et al.,2003)。未经训练者骨骼肌在一次2 h 65% V˙O2max运动后即刻游离AMP、AMP/ATP、AMPKα1和α2活性、ACC-Ser221磷酸化均大幅度增加,经过10天短期训练后再次进行相同运动,急性反应明显减弱,并且运动后即刻这些指标数值均低于训练前(Mcconell et al.,2005)。在12周长期训练后进行一次1 h 65% V˙O2max的运动,运动后即刻骨骼肌游离AMP、AMP/ATP、AMPKα1/2、β2、γ1/γ3和ACC2蛋白水平、α-Thr172磷酸化水平、α1/α2β2γ1和总AMPK活性与安静时相比均无明显变化(Mortensen et al.,2013)。这些研究表明,长期运动训练后工作肌肉保持能量稳态的能力增强,显著减弱了急性运动对AMPK的影响。
因此,AMPK的不同激活形态可能来自不同的运动情境以及取材时间。AMPK对运动的响应表现出明显的钝化现象。急性运动通过AMP引起的变构激活,因训练适应会减弱。整合运动生理学的观点认为,运动是对全身内稳态的挑战,引起大量细胞、组织和器官的广泛扰动。为了应对挑战,多种反应协调发生,以削弱由运动引起的肌肉能量和氧气需求增加所产生的内稳态威胁(Hawley et al.,2014)。既然AMPK能感受细胞能量状态,那么出现运动“钝化”现象,也符合这一观点。运动适应导致AMPK下游蛋白磷酸化响应下降,减少运动引起的系统紊乱,反映机体抗干扰能力提升。
5 AMPK多位点修饰与复杂生理环境
从AMPK的结构生物学以及激酶活性的调节来看,AMPK的激活不是简单的有或无、开或关。AMP与γ亚基的结合、变构剂与ADaM位点的结合、多位点的磷酸化和去磷酸化、α-Cys的氧化等修饰及其相互作用,让AMPK呈现多种蛋白构象。这些构象对一些公认的AMPK激活标记物提出了挑战。在以往研究中,多用Thr172的磷酸化作为AMPK的激活标记,抗体也是围绕Thr172的磷酸化进行设计,这与AMPK活性调控的多位点是不相符的。也有研究把ACC Ser79磷酸化作为AMPK的激活标记,这与AMPK底物广泛、选择性低也不相符。由于AMPK不同亚型具有不同的定位和下游靶标,甚至不同的上游激酶,因此使用亚型特异性抗体和其他测定工具捕获AMPK活性显得尤为关键。不同类型的AMPK激活态与特定生理环境、病理状态是相适应的,表现为不同位点的磷酸化,并非AMPK一激活,所有位点同步磷酸化(Heidorn-Czarna et al.,2021;Jiang et al.,2021;Matzinger et al.,2020)。由于研究方法的限制,以往只能检测少数几个位点的修饰,并将其作为AMPK激酶活性的标记。磷酸化蛋白组学可以更好展示,AMPK的激活是多位点修饰组合的结果(Sun et al.,2021)。表2以AMPKα亚基为例作了部分归纳。

表2 AMPKα亚基的多位点修饰与生理环境的对应关系Table 2 Correspondence between Multi-site Modification of AMPK α Subunit and Physiological Environment
可以看出,在不同的运动情境或药物处理下,AMPK具有复杂的激活形式。进一步表明,AMPK是细胞应答所有环境刺激的通用调控因子,并非以往许多研究定义的运动因子或运动敏感基因。运动情境只是环境刺激的一种特例。急性运动、长期训练、长期训练后的急性运动代表了以往研究中最常见的3种运动情境,尽管都可以观察到AMPK激活,甚至都以Thr172磷酸化为表现形式,但后续的生理效应可能完全不同。近来一项研究对人体耐力、冲刺和抗阻运动下的骨骼肌进行磷酸化蛋白组学分析,确定了5 486个运动调节的磷酸化位点,在这3种运动方式中只有77个位点被共同磷酸化,其中包含AMPKα2-Ser377、Ser491两个位点,表明这两个位点可能是不同运动的共同分子响应。对不同类型运动的磷酸化分析发现,在耐力运动3 h后,只有一个细丝蛋白B(filamin b,FLNB)的Ser2454磷酸化位点有差异,这表明磷酸化蛋白组已经完全恢复到运动前基础水平。这与冲刺和抗阻运动形成鲜明对比,短跑和抗阻运动3 h后,分别还有2 904和687个磷酸化位点有差异,这些位点分别对应848和84个蛋白的修饰(Blazev et al.,2022)。由此可知,运动激活AMPK只是起点事件,不同运动方式之间磷酸化蛋白组学差异极大。后续的复杂场景远没有被解释,或者被简单解释了(如AMPK促进脂肪氧化、葡萄糖摄取、线粒体代谢等)。
6 总结
综合近几十年的研究发现,运动与AMPK的研究已经陷入解释困境。急性运动激活AMPK,长期训练AMPK激活则会出现“钝化”现象,其复杂性与个体对运动强度的反应性有关。对健康而言,AMPK的基础活性提高,有助于维持能量平衡和细胞内稳态,应对体力活动不足以及能量摄入过剩的现实。运动激活AMPK产生多器官的健康效应,这一解释都基于这一前提。对运动能力而言,AMPK应激活性提高,有助于细胞分解能源物质合成ATP,但破坏了能量平衡和细胞内稳态。过度的AMPK激活将导致细胞死亡、生理系统崩溃。因此,AMPK的运动“钝化”现象被认为是机体的自我保护。这是对AMPK的另一种解释范式。也就是说,无论在研究中观测到AMPK激活还是失活,都可以参照AMPK激活的健康效应和AMPK“钝化”的保护效应进行解释。如果不对AMPK进行深入的蛋白结构剖析,后续研究只能在这种解释中盘绕。
基于AMPK的结构生物学分析,有两点值得运动科学研究时借鉴:1)AMPK对蛋白底物的选择性很低,具有结构上的保守性。这决定AMPK一旦激活,将是对细胞乃至整个机体的系统性调控。AMPK激活的健康效应和AMPK“钝化”的保护效应,这两种解释范式都是片面的,因为没有证据辨别Thr172磷酸化在运动中是有益的,比如在亨廷顿舞蹈病中就是有害的。2)AMPK的多位点修饰决定了其蛋白复合物的结构复杂性和蛋白质表面的柔性。这表明AMPK作为蛋白激酶的功能和活性,不是简单地进行“开”和“关”,而是可以多层次连续性调节。磷酸化蛋白组学有助于更深入描述AMPK激活后细胞内蛋白的磷酸化状态,但对AMPK不同活性状态的深度刻画必须依赖结构生物学解析。对AMPK的结构生物学解析可以深入理解AMPK激酶调控及其下游信号的复杂性,进一步揭示复杂生理环境下(包括运动情境)AMPK多位点修饰对健康和运动能力的不同意义。突破运动与AMPK研究的解释困境,更需要结构生物学方法去深入解析AMPK的多位点修饰,探讨AMPK在运动情境中可能存在的多种活性形态或中间状态。
