地表水-地下水混合比例对沉积物活化分子氧降解三氯乙烯的影响
2023-10-09刘佳彧刘依然
刘佳彧,余 浩,刘依然,张 鹏*
(1.中国地质大学(武汉)生物地质与环境地质国家重点实验室,湖北 武汉 430078;2.中国地质科学院矿产综合利用研究所,四川 成都 610041;3.中国地质大学(武汉)
环境学院,湖北 武汉 430078)
氯代烃,如三氯乙烯(trichloroethylene,TCE)等,作为干洗剂、金属清洗剂和化工原料等被广泛地用于工业领域。由于氯代烃使用后处理不当以及地下储罐泄漏等原因,造成氯代烃进入地下水环境,使其成为地下水中最常见的有机污染物之一[1-4]。氯代烃对人体具有“三致”效应,严重威胁着人民群众身体健康。因此,弄清楚地下水中氯代烃迁移转化的规律与机制具有非常重要的意义。
潜流带是连接地表水与地下水的纽带,也是氯代烃跨介质传播的重要界面[2]。受地表水-地下水交互作用的影响,潜流带呈现出独特的生物地球化学特征,使其成为氯代烃自然衰减的天然过滤器[2,5-6]。传统的观点认为潜流带中氯代烃的去除机制主要是微生物好氧氧化、微生物厌氧还原以及还原性组分非生物还原3种途径[2,5,7-9]。然而,近年来研究发现地下环境中还原性组分[主要为二价铁(Fe(Ⅱ))和还原性有机质]在厌氧-好氧动态变化条件下,可以活化分子氧(O2)产生具有强氧化性的羟自由基(HO·),从而氧化降解污染物(如氯代烃)[10-15]。进一步,Schaefer等[16]于2018年报道沉积物曝氧氧化产生的HO·氧化降解TCE的速率比非生物还原脱氯高2~3个数量级。由于潜流带中存在大量的还原性组分,并且其氧化还原条件呈厌氧-好氧动态变化,因此潜流带具备产生HO·的可能性。此外,Zhang等[17]通过野外调查证实潜流带分布着一定浓度的双氧水(H2O2),其中H2O2是HO·产生的前驱体[18]。基于上述分析,推测潜流带可能存在HO·氧化降解氯代烃的途径。然而,目前尚未见潜流带中HO·氧化降解氯代烃规律与机制的相关研究报道。
地表水-地下水交互作用是影响潜流带O2补给的关键过程[6],由于两种水体中O2浓度差异显著,因此地表水-地下水交互频率与强度(即地表水-地下水混合比例)控制着潜流带O2的分布[19-21]。由于O2浓度是HO·产生的限制性因素,因此可以推测地表水-地下水混合比例将直接影响潜流带中HO·产生的规律。此外,地表水与地下水在化学组分上存在着明显的差异[6],两种水体的交互过程会显著地改变潜流带含水层中阴阳离子和有机质的含量,从而影响污染物的去除效率[22-24]。为此,本研究拟以TCE作为代表性氯代烃,探究不同地表水-地下水混合比例(0∶10~10∶0)对沉积物曝氧氧化过程中HO·产生与TCE去除的影响规律,研究结果将可为潜流带中氯代烃自然衰减过程提供新认识。
1 材料与方法
1.1 试验材料
苯甲酸钠(BA,99.5%)、对羟基苯甲酸(p-HBA,99%)、乳酸钠、Ca(HCO3)2、KNO3、FeSO4等均购自国药集团;TCE(99.6%)购自J&K百灵威科学公司,TCE饱和溶液通过在超纯水中加入过量的TCE试剂制得。超纯水(18.2 MΩ·cm)由Heal Force NW超纯水机制得。
沉积物样品采用手持土壤取样钻机(SD-1,澳大利亚)于湖北省汉江沙洋-潜江段河岸带(112°40′34″E,30°35′10″N)采集。由于该场地地下水水位在3~4 m范围内,因此本研究选取了地下深度为7~8 m的沉积物芯样品(常年处于饱和带环境)作为代表性沉积物。沉积物的质地为黏壤土,沉积物中总铁和总有机碳含量分别为20.1 mg/g(以6 mol/L HCl提取)和1.5 mg/g,含水率为30%。沉积物样品取出后在现场用保鲜膜紧紧包裹,真空密封,于24 h内转运到实验室,保存于-20 ℃冰柜中。将冰冻沉积物置于真空冻干机干燥处理,再采用40目尼龙筛筛分去除植物残体和石子等粗颗粒,最后置于厌氧手套箱(96% N2和4% H2,COY,美国)中保存。
地表水和地下水水化学组分参考本地野外调查数据配制[25]。其中,配制模拟地下水时,首先将超纯水采用高纯N2吹脱2 h,并在厌氧手套箱中搅拌12 h后,然后依次加入0.05 mmol/L KCl、0.008 mmol/L 乳酸钠、0.3 mmol/L NaCl、0.12 mmol/L MgSO4、0.7 mmol/L Mg(HCO3)2、1.75 mmol/L Ca(HCO3)2、0.14mmol/L FeSO4。配制模拟地表水时,直接向超纯水中依次加入0.04 mmol/L 乳酸钠、0.15 mmol/L MgCl2、0.13 mmol/L MgSO4、0.15 mmol/L Mg(HCO3)2、0.75 mmol/L Ca(HCO3)2、0.06 mmol/L KNO3。
1.2 试验方法
考虑到潜流交互作用发生于饱和带[6],因此所有试验体系均为饱水体系,无顶空存在。此外,为了避免光照,所有反应器均采用锡纸包裹。为了探究地表水-地下水混合比例对TCE去除的影响,本研究采用牺牲模式进行试验,将地表水-地下水的混合比例分别设置为0∶10、1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1、10∶0,具体试验方法如下:首先,在厌氧手套箱内将1.8 g沉积物与不同体积的地下水在体积为20 mL的厌氧瓶中进行混合,并采用丁基胶塞和铝盖进行密封;然后,将反应器移出厌氧手套箱后,利用注射器迅速抽出对应于地表水体积的顶空气体,加入75 μL TCE储备液(1.07 mg/mL),并向反应器中注入地表水,使反应器中初始TCE浓度为7.6 μmol/L;最后,将反应器置于恒温摇床(25 ℃,220 r/min)振荡24 h,取样测试TCE和溶解氧(DO)的浓度。为了探究地表水-地下水混合比例对HO·产生的影响,将20 mmol/L BA代替7.6 μmol/L TCE加入到上述试验体系中,反应24 h后,采样分析p-HBA以及不同形态Fe(Ⅱ)的浓度。为了探究不同地表水-地下水交互条件下TCE的降解过程以及HO·产生和Fe(Ⅱ)氧化的动力学规律,本研究选择地表水与地下水的混合比例0∶9、5∶5和10∶ 0为代表性条件,在体积为121 mL厌氧瓶中进行试验。试验开始前,在厌氧手套箱内称取干重11 g的潜流带沉积物与不同体积的地下水混合,随后与上述牺牲模式试验一样,在厌氧手套箱外添加对应体积的地表水和TCE。所有试验均至少平行进行两次,结果以均值±方差的形式呈现。
1.3 分析方法
TCE浓度的测定:从厌氧瓶中抽取1 mL沉积物悬浊液置于哈希管中,经2 mL正己烷萃取后,采用气相色谱仪(Shimadzu 2014 C,日本)测定溶液中TCE浓度,测试柱温保持在55 ℃,进样口和检测器的温度分别设置为230 ℃和280 ℃[11]。
HO·浓度的测定:从厌氧瓶中抽取1 mL沉积物悬浊液,经0.22 μm滤膜过滤后,取0.5 mL滤液立即与0.5 mL甲醇混合,通过高效液相色谱仪(Shimadzu,16C HPLC)测定溶液中p-HBA浓度,色谱柱为Inter Sustain C18柱(4.6 × 250 mm),流动相比例为0.1%三氟乙酸∶乙腈=65∶35,检测器波长为255 nm。p-HBA浓度与累积HO·浓度之间的换算系数为5.87[18]。HO·浓度的检出限为0.59 μmol/L。
Fe(Ⅱ)浓度的测定:为了测定沉积物中不同形态Fe(Ⅱ)的浓度,取1 mL沉积物悬浊液以8 000 r/min转速离心3 min后,倒掉上清液,依次加入10 mL 1 mmol/L CaCl2(pH =7.0,4 h)、10 mL 1 mmol /L NaH2PO4(pH =5.0,18 h)、10 mL 6 mmol/L HCl(12 h)以分别提取离子交换态Fe(Ⅱ)、表面吸附态Fe(Ⅱ)、矿物结构态Fe(Ⅱ)[26]。溶液中Fe(Ⅱ)浓度采用邻菲罗啉比色法测定[27]。
DO浓度测定:在厌氧瓶内壁靠近瓶底约为1/4瓶身的高度用卡夫特705硅橡胶粘贴氧气贴片,利用非侵入式便携光纤氧分析仪(Fibox 4,Pre-Sens GmbH)测定体系中水相的DO浓度。
2 结果与讨论
2.1 不同地表水-地下水混合比例对沉积物活化O2产生HO· 降解TCE的影响
表1 不同地表水-地下水混合比例条件下溶液中DO、Cl-和HC的浓度以及HO· 累积浓度、TCE降解量和HO· 利用效率
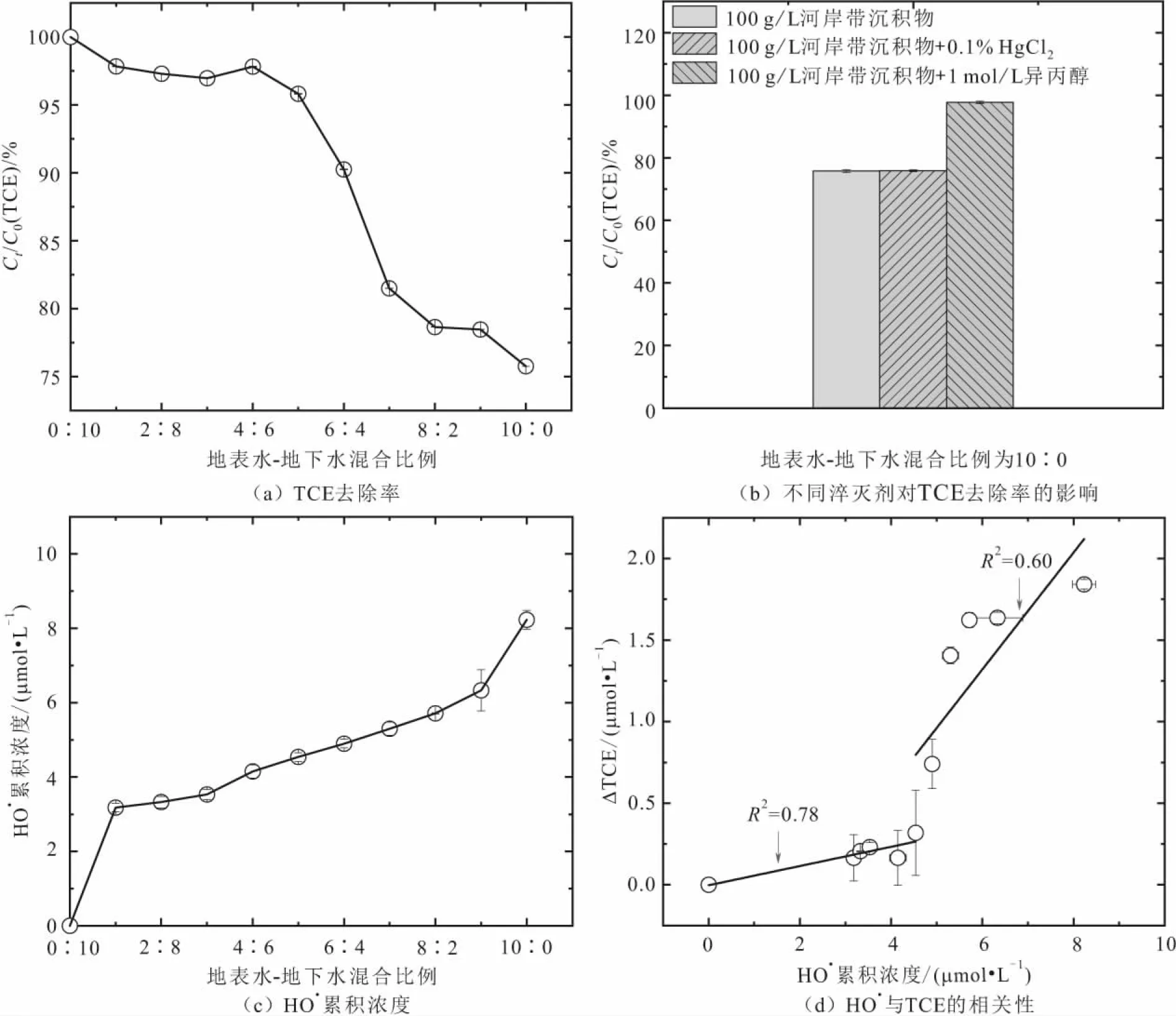
注:ΔTCE为TCE降解量,下同。图1 地表水-地下水混合比例对沉积物活化O2产生HO· 降解TCE的影响Fig.1 Effect of surface water-groundwater mixture ratios on TCE degradation by HO·produced from sediment-activated O2
由图1和表1可知∶
1) 在含7.6 μmol/L TCE的100 g/L沉积物悬浊液体系中,当地表水与地下水的混合比例为0∶10时,24 h内TCE的去除率小于1%;当地表水-地下水的混合比例增加至1∶9时,TCE的去除率增加至2.2%;然而当地表水-地下水的混合比例继续增加至4∶6,TCE的去除率没有明显变化;当地表水-地下水的混合比例从4∶6增加至10∶0时,TCE的去除率从3%提升至22.5%[图1(a)]。上述结果说明地表水与地下水的混合比例对TCE的去除起到了控制性作用。此外,由于所有体系中沉积物投加量相同,因此沉积物对TCE的吸附作用也相同。当地表水-地下水的混合比例为0∶10时,TCE的去除率小于1%,该结果表明沉积物对TCE的吸附作用可以忽略不计。
2) 为了区分微生物途径和非生物途径对TCE去除的相对贡献,本研究将0.1% HgCl2加入到地表水-地下水混合比例为10∶0的体系中,以屏蔽微生物途径的作用[28]。结果显示,HgCl2的加入对TCE的去除没有影响[图1(b)],因此TCE的降解主要归因于非生物途径的作用。如表1所示,随着地表水-地下水混合比例的增加,体系水相中DO浓度呈线性增加,然而O2无法直接氧化TCE,只有被进一步活化为活性氧(如HO·)才可以发挥氧化效应。为了探究HO·对TCE的降解作用,本研究选择1 mol/L异丙醇作为HO·的淬灭剂,加入到上述地表水-地下水混合比例为10∶0的体系中。结果显示,加入异丙醇后,TCE的降解被显著抑制[图1(b)],由此可知HO·是TCE去除的主要氧化剂。
3) 为了进一步评估HO·对TCE降解的影响,本研究测试了反应24 h后的累积HO·浓度。结果显示,随着地表水-地下水的混合比例从1∶9增加至10∶0,24 h内累积HO·浓度线性地从3.2 μmol/L增加至8.2 μmol/L[图1(c)]。
4) 相关性分析表明,HO·累积浓度与TCE去除量之间呈线性关系[图1(d)],支撑了HO·氧化去除TCE的推论。
上述试验结果表明:受沉积物活化O2产生HO·可以有效地降解TCE,并且TCE的降解程度受到地表水-地下水混合比例的强烈影响。
2.2 地表水-地下水混合比例对沉积物中Fe(Ⅱ)氧化的影响
前人的研究表明固相Fe(Ⅱ)[6 mol/L HCl可提取态Fe(Ⅱ),即离子交换态Fe(Ⅱ)、表面吸附态Fe(Ⅱ)和矿物结构态Fe(Ⅱ)的总和]和还原态有机质均可以贡献HO·的产生[14-15,18],这两种活性组分的相对贡献与有机碳/Fe(Ⅱ)摩尔比有关。当有机碳/Fe(Ⅱ)摩尔比小于39时,固相Fe(Ⅱ)主要贡献HO·的产生;当有机碳/Fe(Ⅱ)摩尔比大于39时,还原性有机质主要贡献HO·的产生[25]。本研究中固相Fe(Ⅱ)和固相有机质含量分别为6.6 mg/g和1.5 mg/g,因此有机碳/Fe(Ⅱ)摩尔比为1.1,远小于39,故固相Fe(Ⅱ)是HO·产生的主要电子供体。地下水-地表水混合比例对沉积物中不同形态Fe(Ⅱ)氧化的影响以及Fe(Ⅱ)氧化量与DO浓度和HO·累积浓度之间的关系,见图2。
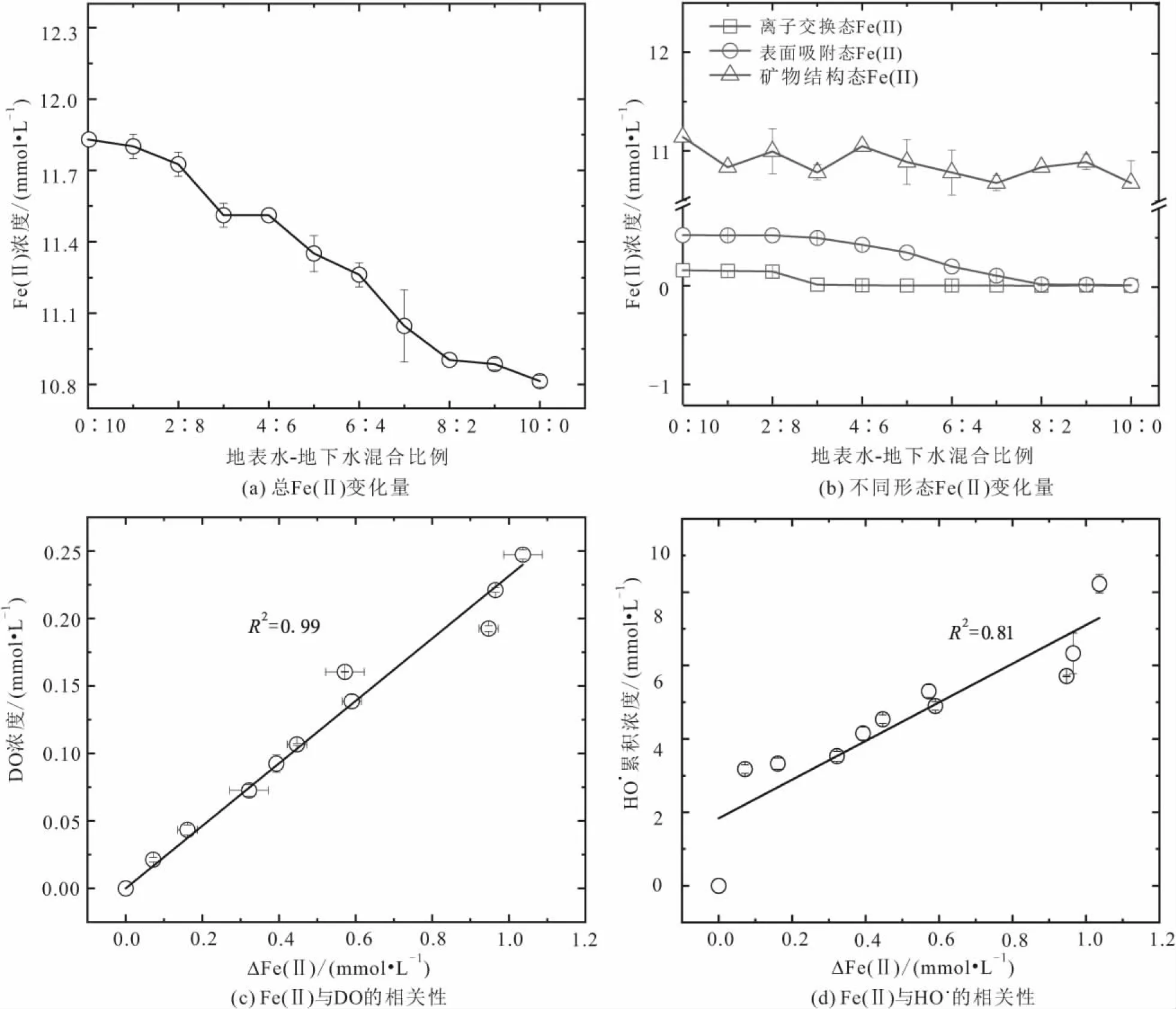
注:ΔFe(Ⅱ)为总Fe(Ⅱ)变化量。图2 地表水-地下水混合比例对沉积物中不同形态Fe(Ⅱ)氧化的影响以及Fe(Ⅱ)氧化量与DO浓度和HO· 累积 浓度之间的关系Fig.2 Effect of surface water-groundwater ratios on the oxidation of different Fe(Ⅱ) species and the relationship between Fe(Ⅱ) oxidation amount and DO (or HO·concentration)
由图2可知:
1) 随着地表水-地下水混合比例的增加,本研究体系中Fe(Ⅱ)氧化量不断增加[图2(a)]。
2) 相关性分析表明,不同地表水-地下水混合比例条件下,Fe(Ⅱ)氧化量与初始DO浓度(或者DO减少量)之间呈正相关,两者之间直线斜率为4.3[R2=0.99,图2(c)]。根据Haber-Weiss机制[26-27],Fe(Ⅱ)与O2反应之间的化学剂量比为4∶1,与本研究所测量的数值4.3很接近,说明本研究体系中Fe(Ⅱ)是O2的主要还原剂。
3) Fe(Ⅱ)氧化量与累积HO·浓度之间也呈正相关[R2=0.81,图2(d)],进一步证实本研究体系中Fe(Ⅱ)是HO·产生的主要电子供体。
由于沉积物中Fe(Ⅱ)种类繁多,不同形态Fe(Ⅱ)的反应活性差异显著[18],因此,本研究采用连续化学提取法测定了不同地表水-地下水混合比例条件下不同形态Fe(Ⅱ)的变化规律[图2(b)]。
结果表明:当地表水-地下水的混合比例由0∶10增加至2∶8,反应24 h内沉积物中离子交换态Fe(Ⅱ)含量从0.16 mmol/L降低至0.14 mmol/L,表面吸附态Fe(Ⅱ)含量几乎没有变化,而矿物结构态Fe(Ⅱ)含量从11.1 mmol/L稍微降低至11.0 mmol/L;当地表水-地下水的混合比例从2∶8增加至5∶5时,反应24 h内沉积物中离子交换态Fe(Ⅱ)含量从0.14 mmol/L降低至0 mmol/L,表面吸附态Fe(Ⅱ)含量从0.51 mmol/L降低至0.34 mmol/L,而矿物结构态Fe(Ⅱ)含量从11.0 mmol/L稍微降低至10.9 mmol/L;当地表水-地下水混合比例从5∶5增加至10∶0时,反应24 h内沉积物中离子交换态Fe(Ⅱ)含量一直为0 mmol/L,表面吸附态Fe(Ⅱ)含量从0.34 mmol/L降低至0 mmol/L,而矿物结构态Fe(Ⅱ)含量从10.9 mmol/L稍微降低至10.7 mmol/L。上述结果表明,沉积物中不同形态Fe(Ⅱ)的反应活性符合如下规律:离子交换态Fe(Ⅱ)>表面吸附态Fe(Ⅱ)>矿物结构态Fe(Ⅱ)。由于地表水-地下水混合比例发生变化时,本研究体系中O2浓度也随之发生变化,因此沉积物中不同形态Fe(Ⅱ)会按照一定次序发生氧化,整体规律表现为:当地表水-地下水混合比例较低时(<2∶8)主要是离子交换态Fe(Ⅱ)发生氧化;当地表水-地下水混合比例居中时(2∶8~5∶5)主要是离子交换态Fe(Ⅱ)和表面吸附态Fe(Ⅱ)发生氧化;当地表水-地下水混合比例较高时(5∶5~10∶0)主要是表面吸附态Fe(Ⅱ)和矿物结构态Fe(Ⅱ)发生氧化。
2.3 地表水-地下水混合比例对HO· 降解TCE的影响机制
为了深入探究地表水-地下水混合比例对沉积物活化O2降解TCE的影响机制,本研究选择地表水-地下水的混合比例分别为1∶9、5∶5和10∶0三种条件进行动力学分析。由于Fe(Ⅱ)是HO·产生的电子供体,因此本文将考察不同地表水-地下水混合比例条件下沉积物在有氧氧化过程中不同形态Fe(Ⅱ)含量随反应时间的变化规律,并论述HO·产生机制以及TCE降解过程,见图3和图4。
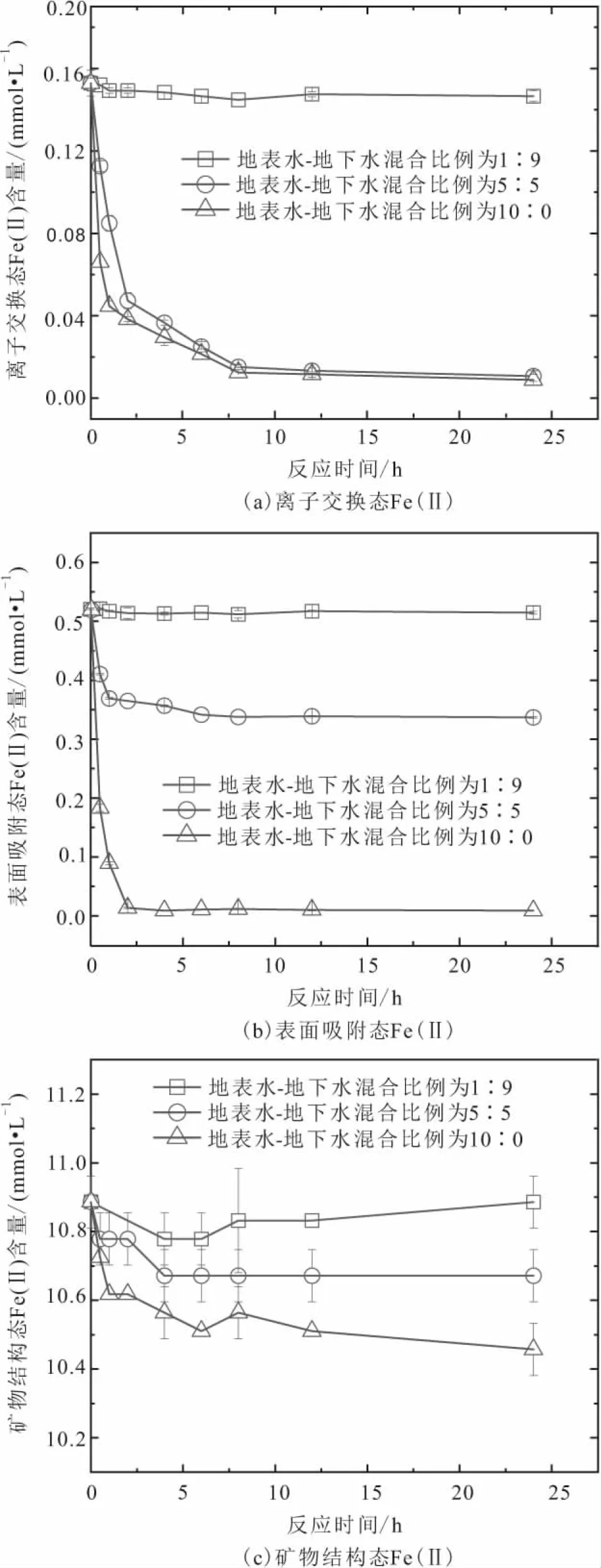
图3 不同地表水-地下水混合比例条件下沉积物在有氧氧 化过程中不同形态Fe(Ⅱ)浓度随反应时间的变化规律Fig.3 Variations of different Fe(Ⅱ) species concentrations versus reaction time during oxygenation of sediments under the conditions of different surface water- groundwater mixture ratios
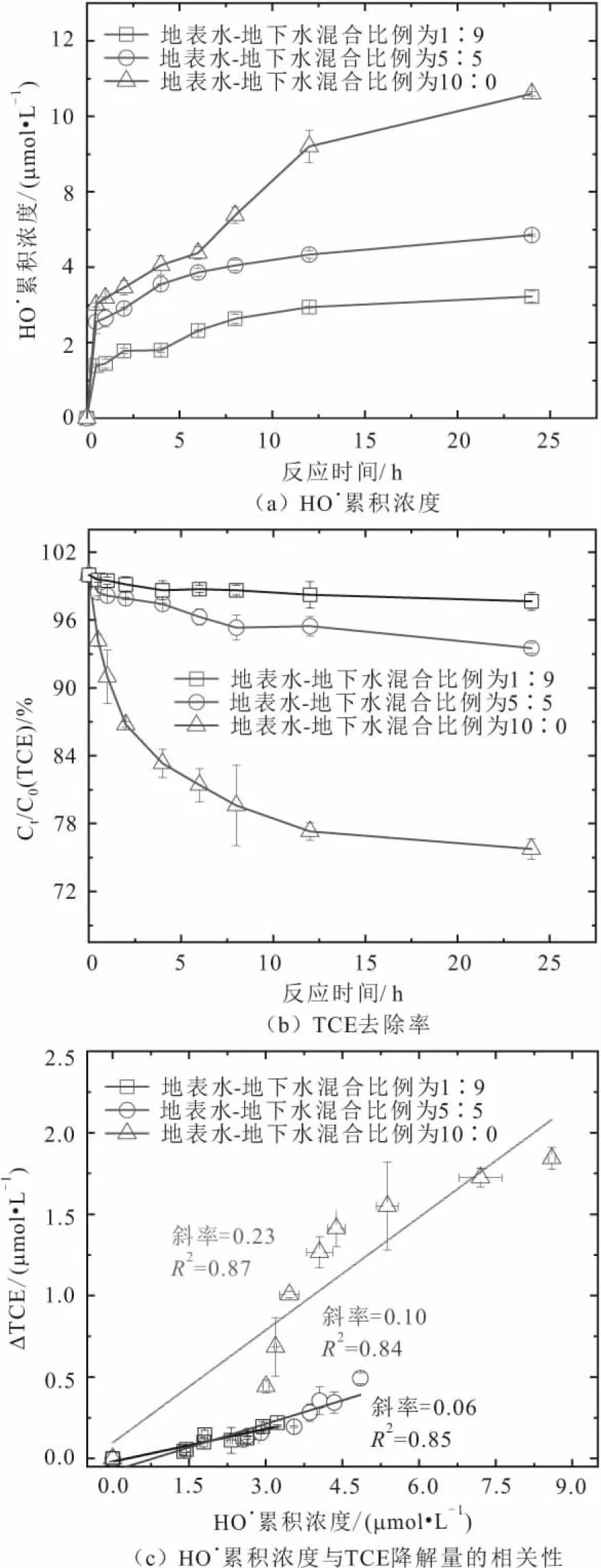
图4 不同地表水-地下水混合比例条件下沉积物在有氧 氧化过程中HO· 累积浓度和TCE浓度随反应时 间的变化规律及其相关性Fig.4 Variations of HO·concentration and TCE concen- tration versus reaction time during oxygenation of sediments under the conditions of different surface water-groundwater mixture ratios
由图3可以看出:
1) 当地表水-地下水的混合比例较低时(1∶9),沉积物中离子交换态Fe(Ⅱ)含量在8 h内迅速降低,从0.16 mmol/L降低至0.14 mmol/L,随后持平;整个反应过程中沉积物中表面吸附态Fe(Ⅱ)含量变化不显著;而沉积物中矿物结构态Fe(Ⅱ)含量稍微降低。
2) 当地表水-地下水的混合比例居中时(5∶5),沉积物中离子交换态Fe(Ⅱ)含量在8 h内氧化完全,表面吸附态Fe(Ⅱ)含量在2 h内从0.52 mmol/L降低至0.36 mmol/L,随后在6 h内缓慢降低至0.34 mmol/L,最后持平;沉积物中矿物结构态Fe(Ⅱ)含量在6 h内从10.9 mmol/L降低至10.7 mmol/L,随后持平。
3) 当地表水-地下水的混合比例较高时(10∶0),沉积物中离子交换态Fe(Ⅱ)含量在8 h内氧化完全;而表面吸附态Fe(Ⅱ)含量则在2 h内氧化完全;矿物结构态Fe(Ⅱ)含量在整个反应过程持续降低。
上述结果表明:沉积物中不同形态Fe(Ⅱ)氧化速率与地表水-地下水的混合比例有关,当这两种水体混合比例较低时,沉积物中离子交换态Fe(Ⅱ)氧化速率高于表面吸附态Fe(Ⅱ),而当这两种水体混合比例居中或者较高时,则表现为离子交换态Fe(Ⅱ)氧化速率小于表面吸附态Fe(Ⅱ);无论两种水体混合比例大小如何,沉积物中矿物结构态Fe(Ⅱ)均会发生氧化,但是氧化速率较低。
离子交换态Fe(Ⅱ)配位结构与溶解态Fe(Ⅱ)类似[18],因此可以假定沉积物中离子交换态Fe(Ⅱ)和O2反应的速率也与溶解态Fe(Ⅱ)相同。表面吸附态Fe(Ⅱ)可以理解为溶解态Fe(Ⅱ)被沉积物中固相基质(如二氧化硅、氧化铝、铁氧化物等)吸附络合而形成,由于固相基质上配体原子可以增加Fe(Ⅱ)电子云密度,从而提高其反应活性,因此理论上沉积物中表面吸附态Fe(Ⅱ)与O2反应的速率要高于溶解态Fe(Ⅱ),也就是沉积物中表面吸附态Fe(Ⅱ)的氧化速率将高于离子交换态Fe(Ⅱ)。实际上,当地表水-地下水混合比例居中或者较高时,沉积物中表面吸附态Fe(Ⅱ)的快速氧化也刚好与理论预测一致。对于地表水-地下水混合比例较低时,沉积物中离子交换态Fe(Ⅱ)氧化速率高于表面吸附态Fe(Ⅱ)这一表观矛盾可以解释为矿物结构态Fe(Ⅱ)向表面Fe(III)矿物传递电子,从而削弱了表面吸附态Fe(Ⅱ)的氧化量。Liao等[29]研究表明当还原性含铁黏土矿物仅遭受小剂量氧化剂氧化时,表面吸附态Fe(Ⅱ)会被优先氧化,随后固相内部Fe(Ⅱ)的电子会转移至表面,从而再生表面吸附态Fe(Ⅱ)。由于含铁硅酸盐矿物是沉积物中重要的铁组分,因此推测沉积物遭受氧化时也可能存在类似的还原性含铁黏土矿物的电子转移过程。
由图4可以看出:
1) 无论在哪种地表水-地下水混合比例条件下,沉积物在有氧氧化过程中HO·累积浓度都呈现先快速增加、后缓慢增加的趋势[图4(a)]。在反应初期,沉积物中HO·累积浓度迅速增加可能与离子交换态Fe(Ⅱ)和表面吸附态Fe(Ⅱ)快速氧化有关;而反应后期其缓慢增加可能与矿物结构态Fe(Ⅱ)缓慢地将电子转移至沉积物表面以及矿物结构态Fe(Ⅱ)自身活化O2的速率较慢有关。

3) 为了量化沉积物中HO·累积浓度与TCE降解量之间的关系,本研究对两者之间进行了相关性分析,其中直线斜率代表了HO·的利用效率。地表水-地下水的混合比例为1∶9,5∶5和10∶0条件下,沉积物中HO·利用效率分别达到6%、10%和23%[图4(c)]。
3 结 论
1) 地表水-地下水交互过程中沉积物活化分子氧(O2)产生HO·可以贡献TCE的去除,但是TCE的去除效率受到两种水体混合比例的强烈控制。当两种水体的混合比例小于4∶6时,沉积物中HO·氧化途径的作用可以忽略,只有当地表水-地下水混合比例大于4∶6时,沉积物中HO·氧化途径才可以有效地降解TCE,并且TCE的降解效率随着地表水-地下水混合比例的增加而增加。此外,随着地表水-地下水混合比例的增加,沉积物中HO·利用效率也随着增加。

