分枝杆菌对硝基苯甲酸实验及其鉴别分枝杆菌的分子机制研究进展
2023-10-09李月夏辉李马超王瑞白
李月 夏辉 李马超 王瑞白
结核病是一种主要由结核分枝杆菌(Mycobacteriumtuberculosis,MTB)感染引起的传染性疾病,目前在全球范围内仍是一个重大的健康威胁。2021年约有1060万例新发患者和160万例死亡患者。新增患者例数和死亡例数相比2020年的1000万和150万均有所增加[1-2]。分枝杆菌的传统分类中,除结核分枝杆菌复合群和麻风分枝杆菌外,其余的分枝杆菌统称为非结核分枝杆菌(non-tuberculous mycobacteria,NTM)。近几十年来,由于对NTM认知度的提高、合并HIV感染发病率的上升,以及实验室检测技术和诊断方法的显著改进,NTM感染在世界范围内的发病率不断上升,也已经成为一个重要的公共卫生问题[3]。由于NTM感染在临床表现、细菌学、病理学等方面与结核病相似,但NTM和MTB对抗结核药物的敏感性差异显著,因此,临床治疗方案和管理不尽相同。尽早、准确地进行MTB和NTM的鉴别诊断可有效治疗疾病,降低疾病负担。
1964年,Tsukamura和Tsukamora研发了对硝基苯甲酸(4-nitrobenzoic acid, PNB)和噻吩-2-羧酸联氨(thiophene-2-carboxylic acid hydrazine,TCH)选择性培养基用于分枝杆菌的鉴别[4-5],依据培养结果可将分枝杆菌分为牛型MTB、人型MTB和NTM三类[6]。在两种培养基上的生长情况分别为:牛型MTB PNB(阴性)/TCH(阴性)、人型MTB PNB(阴性)/TCH(阳性)和NTM PNB(阳性)/TCH(阳性)。作为一种操作简单、成本低廉和技术可靠的检测方法,PNB/TCH实验被临床广泛应用于分枝杆菌的鉴别,尤其是在广大发展中国家或缺乏分子生物学菌种鉴定能力的实验室中。在我国,PNB/TCH实验被纳入《全国结核病细菌学检验规程》(1984版)[7]、《结核病诊断细菌学检验规程》(1995版)[8]及《结核病实验室检验规程》(2015版)[9],规定用于结核病的病原学检测。实际应用中,牛型MTB仅对吡嗪酰胺天然耐药,对其他药物的敏感性与人型MTB相同,且总体牛型MTB占比非常少见[10],故多数情况下仅使用PNB实验鉴定MTB和NTM。
一、PNB实验方法的研究进展
传统PNB实验使用2~3周的新鲜分枝杆菌培养物进行试验。0.01 ml 10-1mg/ml浓度的菌液均匀接种至中性改良罗氏斜面培养基和含PNB(500 μg/ml)的改良罗氏斜面培养基各1支,即10-3mg/管,37 ℃培养。每周观察1次结果,同时记录两种培养基上菌落的生长情况直至孵育4周。实验时设置堪萨斯分枝杆菌(Mycobacteriumkansasii)为阳性对照菌株,MTB标准菌株H37Rv为阴性对照菌株[9]。PNB生长阳性判断为NTM,阴性判断为MTB。PNB实验的主要局限性在于这是一个基于培养的实验方法,加上从样本中进行菌株分离的培养时间,至少需要6~8周,非常耗时。为了缩短PNB实验的检测时间、提高检测的敏感度,研究人员相继对PNB实验方法进行了改进。
(一)液体法
液体法包括PNB-Mycobacteria Growth Indicator Tube(MGIT)法和微量肉汤培养法两种方法。PNB-MGIT法是在BACTEC MGIT 960培养管中添加500 μg/ml的PNB进行鉴别培养。该方法利用BACTEC MGIT 960培养管底部植入的氧依赖性荧光淬灭感受器,提高敏感度的同时,将报告时间缩短至7~10 d[11],但高度依赖于专用大型仪器BACTEC MGIT 960/320全自动分枝杆菌培养及药敏检测系统。
微量肉汤培养法是在96孔板中添加100 μl含PNB的Middlebrook 7H9(10% oleic acid-albumin-dextrose-catalase(OADC))液体培养基,PNB的鉴别浓度降为200 μg/ml;然后每个检测孔再加入100 μl 10-3mg/ml的待测菌液,同时设无PNB的生长对照孔,培养7~10 d判读结果[12]。该方法无需昂贵的专用设备,成本较低,适于基层实验室进行大样本量检测。
(二)固体法
PNB-7H10法是在配制Middlebrook 7H10(10% OADC)固体琼脂培养基时添加终浓度为500 μg/ml 的PNB。将1麦氏浊度的菌液1∶100稀释后取10 μl接种PNB-7H10平板,根据生长情况判读结果。报告时间在3~28 d,93%的MTB菌株培养后14 d可以报告结果。PNB-7H10法与PNB-MGIT的检测结果完全一致,但每个样本的检测成本可以从PNB-MGIT的3.5美元下降至PNB-7H10的0.7美元。7H10固体培养基不使用罗氏培养基中的无抗生素蛋基,不含蛋白水解污染物,培养基呈半透明,更容易观察菌落生长及污染的情况。同时,7H10培养基已被美国临床实验室标准协会(the US Clinical Laboratory Standards Institute,CLSI)推荐用于药物敏感性试验,在全球大多数实验室中得到广泛使用[13]。
使用PNB的改良直接硝酸还原酶实验(Modified direct nitrate reductase assay using PNB,NRAp)[14-15]则利用分枝杆菌将硝酸盐还原为亚硝酸盐的能力[16]。在含1000 μg/ml KNO3的罗氏培养基上生长的分枝杆菌,可以将Griess试剂转变为粉色。NRA和使用刃天青(resazurin)、Alarmblue等染料一样,都是利用颜色的变化使生长结果更易判读,以提高实验的敏感度,缩短判读时间。NRA方法2011年被世界卫生组织推荐用于耐多药结核病患者的快速药敏检测。在KNO3罗氏培养基添加500 μg/ml的PNB,并采用NRA法检测即NRAp实验。与其他PNB实验不同的是,该方法可以直接检测涂片阳性的痰液样本。
(三)代谢产物检测法
代谢产物检测法是使用分光光度计或液相色谱-质谱联用仪(liquid chromatograph-mass spectrometer,LC-MS)直接对PNB的还原代谢物对氨基苯甲酸(p-aminobenzoic acid,PABA)进行浓度测定,无需培养。实验时是将待测菌株的新鲜培养物制成20 mg/ml的菌液,每毫升菌液加入5 μl 5% PNB,37 ℃孵育过夜。0.2 μm滤膜过滤后的菌液可直接进行LC-MS检测,PABA的质荷比瞬态为138→77.1,鉴定的cut-off 值为0.7[17]。滤液也可经三氯乙酸、亚硝酸钠和氨基磺酸氨依次处理,N-(1-萘基)乙二胺二盐酸盐显色,在分光光度计上读取540 nm的吸光度值。以PABA 浓度 0 μg/ml 定为 cut-of值,>0 μg/ml 判定为NTM,≤0 μg/ml 判定为 MTB。代谢产物法所需最低分枝杆菌菌量为1 mg,在细菌培养阳性后最短可以在8 h进行MTB 及NTM鉴定[18]。两种检测方法中LC-MS更灵敏,检测过程仅需5 min,但对仪器条件和实验技术要求更高。
与传统的PNB方法相比,改进后的方法显著缩短了结果报告的时间(表1)。但在使用PNB实验进行分枝杆菌鉴定时还需要注意:(1)分枝杆菌对PNB的敏感性不是绝对的。约2%的MTB菌株可以在PNB培养基上生长,而NTM中也有部分菌种,或部分菌种中的少量菌株不能耐受500 μg/ml的PNB。PNB实验的错判率约为10%~20%[11, 19-22];(2)PNB实验不适用于混合感染,NTM在PNB上的生长,会掩盖混合感染样本中MTB的检出。
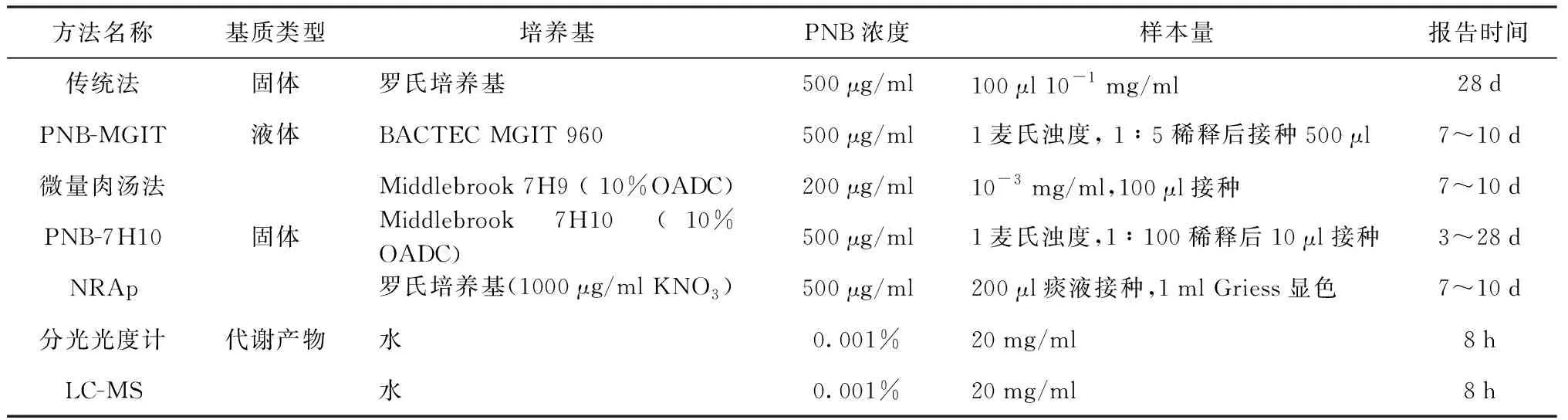
表1 传统及改良PNB实验主要参数比较
二、分枝杆菌PNB代谢及其催化酶的研究进展
PNB实验的生化原理较为清晰,即PNB在硝基还原酶(nitroreductase,NR)的作用下,硝基还原为氨基,转变为PABA(图1)。PNB对于细菌是有毒性的,而PABA不仅无毒,而且是叶酸合成的中间产物,而叶酸对于细菌的存活是至关重要的。PNB鉴别MTB和NTM两类菌株的机制可能是MTB中不存在参与此代谢的NR酶或酶活性低,PNB无法被转化而抑制MTB的生长;而NTM中天然存在的NR能够转化PNB,使其自身生长代谢不被抑制。因此,PNB的鉴别机制研究主要在于参与反应的NR的鉴定及其在基因组上的定位。PNB的同分异构体邻硝基苯甲酸(2-nitrobenzoic acid)与间硝基苯甲酸(3-nitrobenzoic acid)不能区分MTB与NTM,提示涉及的NR酶具有构象特异性。

图1 对硝基苯甲酸代谢的生化反应
细菌的NR属于硝基黄素单核苷酸还原酶[nitro flavin mononucleotide (FMN) reductase]超家族,利用非共价结合的FMN作为辅助因子,烟酰胺腺嘌呤二核苷酸磷酸[nicotinamide adenine dinucleotide phosphate,NAD(P)H]作为电子供体进行强制性的双电子转移,催化硝基化合物的还原。
该酶家族的成员包括NAD(P)H:FMN氧化还原酶、氧不敏感硝基还原酶、黄素还原酶P、二氢蝶啶还原酶、NADH氧化酶和NADH脱氢酶等。NR编码基因在细菌基因组中是广泛存在的,在真核生物中也有发现。NR普遍存在的原因可能是硝基芳香族化合物通常是有毒和致突变的。许多微生物中都建立了降解和解毒这些化合物的酶代谢途径。分枝杆菌不同种的基因组上携带有不同数量、种类的NR编码基因,如脓肿拟分枝杆菌CF00207-00450基因组(NZ_CP089589.1)中就包含34个预测的NR家族蛋白。但迄今为止,分枝杆菌中以PNB为底物,确证能够转化PNB的NR包括仅有脂酰胺脱氢酶(lipoamide dehydrogenase,Lpd)和硝基还原酶/二氢蝶啶还原酶(nitroreductase/dihydropteridine reductase,NfnB)两种。
(一)Lpd
由于硝基很容易接受电子,许多具有不同生理作用的酶也可以还原芳香硝基,尽管还原硝基不是这些酶的主要作用[23-25]。Lpd就是其中很典型的一种。Lpd是多酶α-酮酸脱氢酶复合物的一种成分,包括α-酮戊二酸和丙酮酸脱氢酶。多酶的作用是催化α-酮戊二酸转化为琥珀酰辅酶A,丙酮酸转化为乙酰辅酶A,随后用于脂肪酸生物合成或转化为柠檬酸盐进入三羧酸循环中进行氧化。Lpd还能够进行替代氧化剂的单电子或双电子非生理性还原,其中就包括连接三羧酸循环和脂肪酸生物合成的糖酵解反应。脂肪酸代谢途径对分枝杆菌是尤为重要的,合成的长支链脂质分枝菌酸整合入细胞壁,为菌体提供抗亲水性溶质和药物的非渗透性屏障,也使分枝杆菌的致病菌株如MTB、麻风分枝杆菌和鸟分枝杆菌可以在巨噬细胞的吞噬溶酶体中存活[26]。
Lpd是一种多催化功能活性酶[27],来自猪心、分枝杆菌和克氏锥虫的Lpd是仅有的三种具有NR活性的脂酰胺脱氢酶[28],其中猪心来源的Lpd是最早确定具有NR活性的[23]。Lpd是分枝杆菌中最早确定具有NR活性的酶[29]。1994年,Rafii等[29]从属于NTM的范巴伦分枝菌酸杆形菌(Mycolicibacteriumvanbaalenii)环境株Pyr-1的胞内蛋白中分离到一种NR活性酶,可以在体外将PNB转化为PABA。检测结果显示,其是对氧不敏感的胞内酶,可由硝基化合物1-硝基芘诱导表达,酶活性是菌量依赖性的,可以被还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)增强,被对氯苯甲酸、邻碘异苯甲酸、甲萘醌、双香豆素和抗霉素A抑制。1997年,Marcinkeviciene和Blanchard[26]从耻垢分枝杆菌(Mycobacteriumsmegmatis)Mc2155菌体蛋白中分纯了一个相对分子质量49 000的蛋白,Edman氨基末端测序显示为Lpd。但在该项研究中,Lpd的硝基还原酶活性是用硝基呋喃衍生物硝基呋喃酮(nitrofurazone)进行测定的。2001年Rafii等[28]完成了Pyr-1菌株中NR酶的纯化及氨基酸测序,结果显示,N端20个氨基酸残基中18个与耻垢分枝杆菌Lpd蛋白相同(90%同源性),确定也为Lpd蛋白。2005年,Rajashankar等[30]报道了MTB的Lpd蛋白(Rv0462基因编码)的晶体结构及功能,结果显示,MTB的Lpd是二聚体,和其他生物的Lpd具有相似的结构形式,Arg-93、His-98、Lys-103和His-386 是其保守的活性位点,但酶活性分析中仅检测了脂酰胺脱氢酶、丙酮酸脱氢酶和二硫代硝基苯还原酶活性,没有进行硝基还原酶活性检测。
(二)Nrd/NfnB
大肠杆菌中的NfnB是原核生物中硝基还原酶的原型物。这种酶通过将硝基还原为氨基,激活抗肿瘤药物中含硝基前药,从而被用于抗癌化学疗法的研究[31]。2010年,Manina等[32]进行了耻垢分枝杆菌中NfnB的结构、生物特性及其在苯并噻嗪酮(benzothiazinone,BTZ)耐药中的作用研究。BTZ是靶向分枝杆菌癸烯基磷酸-β-D-核糖2′-差向异构酶(decaprenylphosphoryl-β-d-ribose 2′-epimerase,DprE1)亚单位的新型抗结核药物,其硝基基团是抗分枝杆菌活性所必需的。耻垢分枝杆菌中的NfnB催化其硝基完全还原为氨基,失活而产生分枝杆菌对该药物的耐药性。在MTB和耻垢分枝杆菌中过表达NfnB,都可以导致对BTZ043的耐药,但需要在有氧条件下,说明NfnB是氧依赖型。而MTB中预测的NR酶的过表达,包括acg、Rv0306、moeY、fbiB、Rv3131、Rv3127、Rv3368c、Rv3547、Rv1558、Rv1261c、Rv3178和lpdC,都不能影响BTZ043对分枝杆菌最低抑菌浓度(minimal inhibitory concentrations,MIC)[32]。
2013年,丁朋举[33]利用大肠杆菌对耐PNB的脓肿分枝杆菌ATCC19977中注释为NR的基因(YP_001703395)进行了体外表达及酶活性测定。蛋白纯化复性后测定酶活性证实产物确实能够还原PNB而发生显色反应,酶的活力单位是0.21,比活性为32.2 U/mg。YP_001703395和WP_005111198的序列100%相同,而后者的注释为“PnbA_NfnB-like,nitroreductase similar toMycobacteriumsmegmatisNfnB;cd02136”,正是耻垢分枝杆菌中的NfnB基因。MTB基因组中不存在NfnB的直系同源物(http://tuberculist.epfl.ch/),因此,可能是两类分枝杆菌对PNB、BTZ等化合物敏感性不同的原因。
三、现有研究的局限性
关于分枝杆菌PNB耐药机制的研究较少。虽然除Lpd和NfnB外,分枝杆菌中已经确定具有NR活性的蛋白及其编码基因还包括:Rv3547,一种硝基咪唑并噁嗪特异性硝基还原酶,对重要的双环硝基咪唑类抗结核新药PA-824(pretomanid)前药的激活至关重要[28, 32, 34-37];Rv2466c,MTB氧化应激反应中的一种放线硫醇依赖型硝基还原酶(mycothiol-dependent nitroreductase,MSH),其过表达会增加MTB野生型和耐药突变株对噻吩嘧啶衍生物类新型抗分枝杆菌药物TP053的敏感性,表明TP053是由Rv2466c激活的前药[38];Acg/Rv2032,一种罕见的FMN结合蛋白,是MTB的必需毒力因子[39],acg的缺失无论是静止和激活的巨噬细胞还是急性和持续性小鼠感染模型中毒力和生长力都会减弱,不能作为NR酶还原活化前药,但有可能还原降解呋喃妥因和硝基呋喃类药物[40];Rv3131和acg同样属于受控于DosR调控子的48个基因[41],是一个含FMN结合结构域的硝基还原酶蛋白,可诱导TLR2介导促炎细胞因子分泌,有助于MTB的肉芽肿形成并影响先天免疫应答[42],但在以上这些蛋白或基因的研究中没有进行PNB的代谢能力测定。而已有的Lpd和NfnB研究中,多是在大肠杆菌中进行克隆、表达、蛋白纯化后测定的NR酶活性。现有文献表明,以PNB为底物的体外活性测定是NR活性测定的常用方法,但体外检测并不能说明目标蛋白在分枝杆菌内的实际表达情况;同时,已有研究均缺乏MTB和NTM间的差异性对比及基因替代等确证性实验,因此,难以确定其在PNB区分两类分枝杆菌中的作用。
综上所述,分枝杆菌中确定的PNB转化NR酶,以及两类分枝杆菌对PNB敏感性差异产生的原因迄今并未阐明。因为内在共同代谢酶NR的关联,PNB实验可能与分枝杆菌的滞留性、低氧环境应激和抗结核药物的耐药性等重要生物学功能存在相关性。例如,耻垢分枝杆菌中过表达MTB-LpdC蛋白可延长其在巨噬细胞内的存活能力[43]。NfnB的过度表达是一种新的苯并噻嗪酮类药物耐药机制,可能在同样靶向DprE1的二硝基苯甲酰胺类化合物药物耐药性形成中起作用[32]。而且分枝杆菌不同菌种间存在的硝基化合物的代谢差异,决定了BTZ043、TP053及PA-824等抗结核新药应用于不同分枝杆菌菌种的潜力[32, 44],这与PNB区分两类分枝杆菌的原理是相同的。因此,对PNB的相关代谢机制存在重要的意义,需要进一步阐明。
利益冲突所有作者均声明不存在利益冲突
作者贡献李月:查阅文献、汇总资料、撰写文章初稿;夏辉和李马超:对文章的知识性内容作批评性审阅;王瑞白:指导研究、对文章的知识性内容作批评性审阅、获取研究经费
