毒害艾美耳球虫和产气荚膜梭菌双重PCR检测方法的建立
2023-10-09王佳丽宋军科赵光辉
陈 曦,王 一,王佳丽,杨 新,宋军科,赵光辉
(西北农林科技大学动物医学院,杨凌 712100)
毒害艾美耳球虫(Eimerianecatrix)属于孢子虫纲、艾美耳科、艾美耳属,是引起鸡球虫病的主要致病病原之一,可造成鸡的营养吸收障碍、饲料转化率降低、血痢等症状,感染严重的雏鸡甚至会出现大批死亡[1-4]。产气荚膜梭菌(Clostridiumperfringens)是一种革兰阳性厌氧菌,在自然界广泛分布,可引起鸡的坏死性肠炎[5],表现采食量下降,产蛋量减少,严重时鸡只消瘦、排黑色稀便并伴有恶臭味,有时会出现血痢[6],多见于2~6周龄的肉鸡,发病率和病死率较高,病死率最高可达50%[7-8],经治疗后的雏鸡会出现发育迟缓、生产性能下降等,严重危害全球畜牧业的发展[9]。
纳米PCR(nanoparticle-assisted PCR,nano-PCR)是纳米技术结合分子生物学的一种新型PCR方法,通过向体系中加入纳米颗粒,使PCR具有更好的灵敏性、特异性和反应速率[10]。纳米粒子良好的导热性使纳米PCR 检测在扩增过程中更快地达到目标温度,同PCR 相比减少了反应在非目标温度下的时间,可以有效减少非特异性扩增,增加反应的灵敏度。有研究表明,加入纳米粒子的PCR的灵敏度提高了5倍~10倍,实时荧光PCR的灵敏度提高104倍[11-12]。同时,纳米粒子有同单链结合蛋白(single strand binding protein,SSB)相似的作用,可有效降低引物和模板的错配从而提高特异性[13]。此外,纳米粒子还可通过在反应体系中吸附DNA聚合酶、Mg2+、寡核苷酸引物或DNA模板,使PCR反应物聚集,提高反应效率[14]。由于纳米PCR优良的性能,近年来已经应用于犬巴贝斯虫(Babesiacanis)、犬肝簇虫(Hepatozooncanis)和食脑性阿米巴原虫(Acanthamoebaspp.、Balamuthiamandrillaris、Naegleriafowleri)等病原的检测[15-16]。
临床上,鸡球虫和产气荚膜梭菌常混合感染。为了实现同时对两种病原的快速检测,本研究初步建立了检测毒害艾美耳球虫和产气荚膜梭菌的双重PCR及双重纳米PCR检测方法,以期为临床鸡毒害艾美耳球虫病和坏死性肠炎的诊断提供技术支持。
1 材料与方法
1.1 病原及质粒
毒害艾美耳球虫、产气荚膜梭菌、柔嫩艾美耳球虫、贝氏隐孢子虫、蓝氏贾第虫、毕氏肠微孢子虫、芽囊原虫、禽毛滴虫、沙门菌、金黄色葡萄球菌和大肠埃希氏菌等病原的基因组DNA样品由西北农林科技大学动物寄生虫学实验室提取、鉴定并保存。
pMD19-T-ITS2和pMD19-T-cpa质粒均由西北农林科技大学动物寄生虫学实验室构建、保存。
1.2 主要试剂
E.Z.N.A. Stool DNA Kit购自美国Omega Bio-tek公司;纳米PCR试剂盒购自上海户实医药科技有限公司;ExTaqDNA聚合酶、10×ExTaqBuffer(Mg2+free)、MgCl2、dNTP、6×Loading buffer、DL2000 DNA Marker、pMD19-T Vector、大肠埃希菌感受态细胞JM109均购自中国宝生物工程(大连)有限公司;DNA纯化回收试剂盒、质粒小提中量试剂盒购自天根生化科技(北京)有限公司。
1.3 引物设计与合成
参考GenBank数据库收录的毒害艾美耳球虫ITS-2基因序列(GenBank登录号:AM922243、AM922242、AM922241、JN022588、JN022587)应用软件DNAMAN 7.0设计一对引物EnITS2 F/R。产气荚膜梭菌的特异性引物cpa398 F/R参考前人文献[17]。引物均由生工生物技术(上海)有限公司合成(表1)。

表1 毒害艾美耳球虫和产气荚膜梭菌双重PCR和双重纳米PCR扩增引物Table 1 Primers for duplex PCR and duplex nano-PCR to detect E. necatrix and C. perfringens
1.4 毒害艾美耳球虫和产气荚膜梭菌双重PCR检测方法的建立
双重PCR预设定反应体系:10×ExTaqBuffer(Mg2+free)1.25 μL、dNTP(2.5 mmol·L-1)1 μL、MgCl2(25 mmol·L-1) 1 μL、EnITS2 F/R(10 μmol·L-1)各0.5 μL、cpa398 F/R(10 μmol·L-1)各0.5 μL、ExTaqDNA聚合酶(5 U·μL-1)0.07 μL、模板DNA 1 μL,ddH2O补至12 μL;反应条件:94 ℃ 5 min;94 ℃ 45 s、54 ℃ 30 s、72 ℃ 1 min,35个循环;72 ℃ 10 min。
退火温度、引物浓度和MgCl2浓度优化:在相同条件下,进行不同退火温度(50、52、53、55、57、59、60、62 ℃)的优化;引物用量2~16 pmol进行优化,间隔2 pmol;MgCl2的使用体积为0.2~2.0 μL进行优化,间隔0.2 μL。
1.5 毒害艾美耳球虫和产气荚膜梭菌双重纳米PCR检测方法的建立及优化
双重纳米PCR预设定反应体系:2×Nano-QPCR Buffer 6 μL、EnITS2 F/R各1 μL、cpa398 F/R各1 μL、Taqenzyme mix 0.2 μL、模板DNA 1 μL,ddH2O补至12 μL;反应条件同“1.4”方法。
双重纳米PCR反应体系及条件优化:退火温度梯度设置同双重PCR,引物用量梯度设置同“1.4”方法。
1.6 特异性试验
分别用优化后的双重PCR和双重纳米PCR对毒害艾美耳球虫、产气荚膜梭菌、蓝氏贾第虫、芽囊原虫、毕氏肠微孢子虫、禽毛滴虫、贝氏隐孢子虫、柔嫩艾美耳球虫、沙门菌、金黄色葡萄球菌、大肠埃希菌的DNA样品,以及毒害艾美耳球虫和产气荚膜梭菌混合DNA样品进行扩增,检验所建立检测方法的特异性。
1.7 敏感性试验
重组质粒pMD19-T-ITS2和pMD19-T-cpa经10倍倍比稀释得到不同浓度梯度的质粒模板,分别用优化后的双重PCR和纳米PCR进行扩增,检测最低质粒检出量。
1.8 临床粪便样品检测
本研究的粪便样品采集自规模化鸡场鸡的新鲜粪便,已用病原学(饱和盐水漂浮法和形态学)方法明确了毒害艾美耳球虫和产气荚膜梭菌的感染情况;E.Z.N.A. Stool DNA Kit提取这些粪便的基因组DNA,用所建立的双重PCR和双重纳米PCR对这些样品进行检测,分析其临床适用性。
2 结 果
2.1 毒害艾美耳球虫和产气荚膜梭菌双重PCR检测方法的建立
优化后的双重PCR反应体系为10×ExTaqBuffer(Mg2+free)1.25 μL、dNTP(2.5 mmol·L-1)1 μL、MgCl2(25 mmol·L-1)1.2 μL、EnITS2 F/R(10 μmol·L-1)各0.4 μL、cpa398 F/R(10 μmol·L-1)各0.4 μL、ExTaqDNA聚合酶(5 U·μL-1)0.07 μL、模板DNA 1 μL,ddH2O补至12 μL;反应条件:94 ℃ 5 min;94 ℃ 45 s、55 ℃ 30 s、72 ℃ 1 min,35个循环;72 ℃ 10 min。
在优化后的体系和条件下对毒害艾美耳球虫和产气荚膜梭菌的混合DNA样品进行双重PCR扩增,在约150 bp左右出现了毒害艾美耳球虫的目的条带,在约400 bp左右出现了产气荚膜梭菌的目的条带,扩增产物胶回收纯化后送公司测序,经序列比对证实约150 bp的条带为毒害艾美耳球虫ITS-2基因的目的片段,约400 bp的条带为产气荚膜梭菌 α毒素基因的目的片段。
2.2 双重PCR特异性试验
双重PCR分别扩增出E.necatrix和C.perfringens大小约为150和400 bp的目的条带,其他寄生原虫和细菌均无目的条带扩增(图1)。
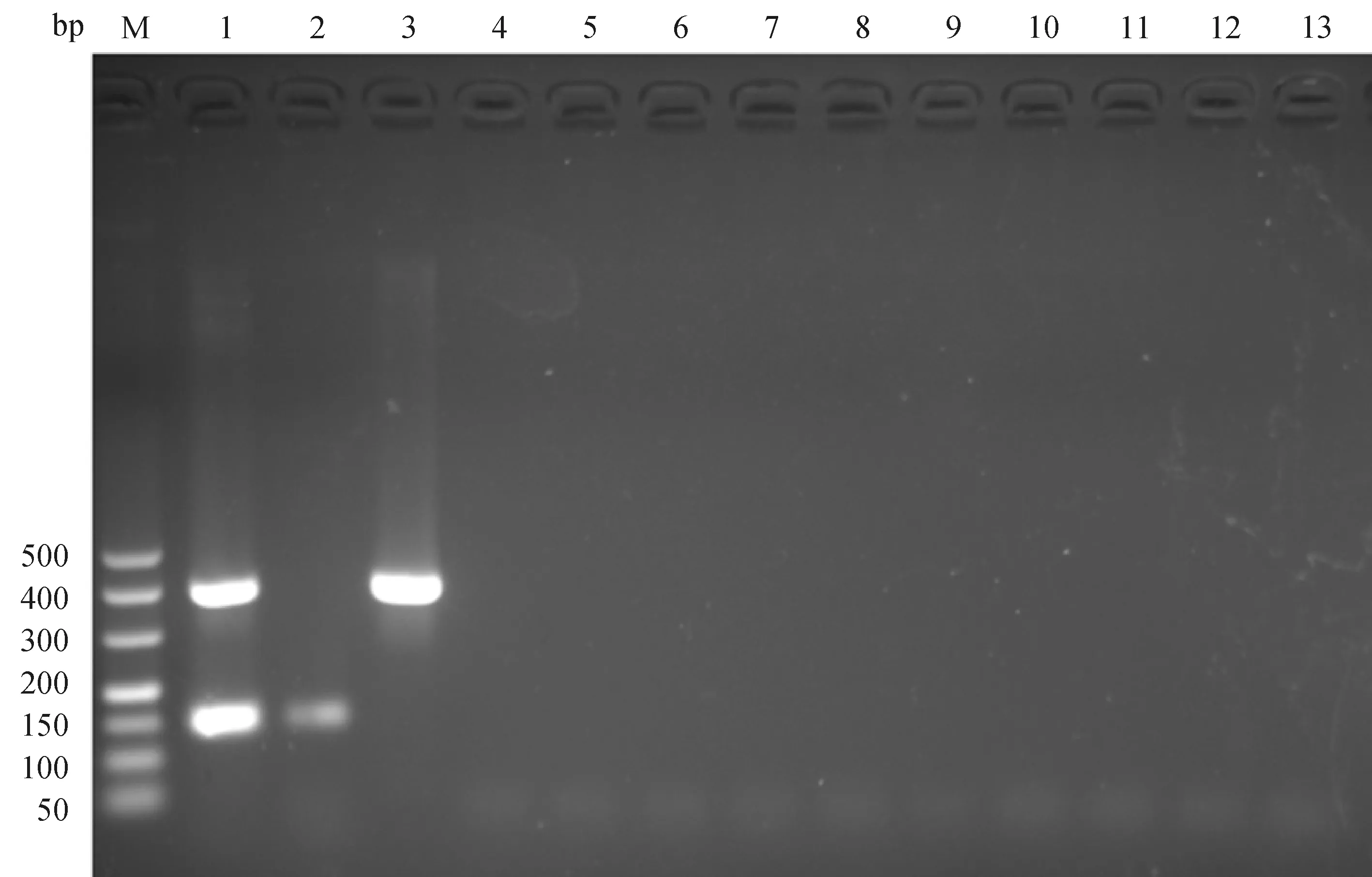
M. DNA相对分子质量标准 GL500;1. 毒害艾美耳球虫+产气荚膜梭菌;2. 毒害艾美耳球虫;3. 产气荚膜梭菌;4. 蓝氏贾第虫;5. 芽囊原虫;6. 毕氏肠微孢子虫;7. 禽毛滴虫;8. 贝氏隐孢子虫;9. 柔嫩艾美耳球虫;10. 沙门菌;11. 金黄色葡萄球菌;12. 大肠埃希菌;13. 阴性对照M. GL500 DNA marker; 1. E. necatrix+C. perfringens; 2. E. necatrix; 3. C. perfringens; 4. G. lamblia; 5. Blastocystis sp.; 6. E. bieneusi; 7. T. gallinae; 8. C. baileyi; 9. E. tenella; 10. Salmonella spp.; 11. Staphylococcus aureus; 12. Escherichia coli; 13. Negative control图1 毒害艾美耳球虫和产气荚膜梭菌双重PCR特异性试验Fig.1 Specificity test of the duplex PCR for E. necatrix and C. perfringens
2.3 双重PCR敏感性试验
所保存的质粒pMD19-T-ITS2和pMD19-T-cpa浓度分别为1.81×1011和1.05×1011copies·μL-1。将重组质粒pMD19-T-ITS2和pMD19-T-cpa 10倍倍比稀释至浓度分别为1.81和1.05 copies·μL-1,对质粒浓度梯度进行双重PCR扩增,最低检出质粒量为pMD19-T-ITS2 181 copies和pMD19-T-cpa 1 050 copies。
2.4 毒害艾美耳球虫和产气荚膜梭菌体系双重纳米PCR检测方法的建立
优化后的双重纳米PCR反应体系为2×Nano-qPCR Buffer 6 μL、EnITS2 F/R各0.6 μL、cpa398 F/R各0.6 μL、Taqenzyme mix 0.2 μL、模板DNA 1 μL、ddH2O补至12 μL;反应条件:94 ℃ 5 min;94 ℃ 45 s、55 ℃ 30 s、72 ℃ 1 min,35个循环;72 ℃ 10 min。
利用优化后的反应条件对毒害艾美耳球虫和产气荚膜梭菌的混合DNA样品进行双重纳米PCR扩增,分别在约150和400 bp左右出现了毒害艾美耳球虫和产气荚膜梭菌的目的条带。扩增产物胶回收纯化后送测序,经序列比对证实约150 bp左右的条带为毒害艾美耳球虫ITS-2基因的目的片段,而约400 bp左右的条带为产气荚膜梭菌α毒素基因的目的片段。
2.5 双重纳米PCR特异性试验
双重纳米PCR分别扩增出毒害艾美耳球虫和产气荚膜梭菌大小约为150和400 bp的目的条带,其它病原均未出现扩增条带(图2)。

M. DNA相对分子质量标准 GL500;1. 毒害艾美耳球虫+产气荚膜梭菌;2. 毒害艾美耳球虫;3. 产气荚膜梭菌;4. 蓝氏贾第虫;5. 芽囊原虫;6. 毕氏肠微孢子虫;7. 禽毛滴虫;8. 贝氏隐孢子虫;9. 柔嫩艾美耳球虫;10. 沙门菌;11. 金黄色葡萄球菌;12. 大肠埃希菌;13. 阴性对照M. GL500 DNA marker; 1. E. necatrix+C. perfringens; 2. E. necatrix; 3. C. perfringens; 4. G. lamblia; 5. Blastocystis sp.; 6. E. bieneusi; 7. T. gallinae; 8. C. baileyi; 9. E. tenella; 10. Salmonella spp.; 11. Staphylococcus aureus; 12. E. coli; 13. Negative control图2 毒害艾美耳球虫和产气荚膜梭菌双重纳米PCR特异性试验Fig.2 Specificity test of the duplex nano-PCR for E. necatrix and C. perfringens
2.6 双重纳米PCR敏感性试验
利用优化好的双重纳米PCR扩增不同浓度的重组质粒pMD19-T-ITS2和pMD19-T-cpa,双重纳米PCR最低检出质粒量为pMD19-T-ITS2 1.81 copies和pMD19-T-cpa 105 copies。
2.7 临床样品检测
利用本研究所建立2种方法对19份已明确毒害艾美耳球虫和产气荚膜梭菌感染情况的鸡的临床粪便样品检测发现,毒害艾美耳球虫和产气荚膜梭菌的阳性率分别为52.6%和47.4%,双重感染的阳性率为31.6%,与病原学的检测结果一致。
3 讨 论
临床上,宿主感染毒害艾美耳球虫后,肠道黏膜会发生出血性损伤。此时,产气荚膜梭菌若趁机入侵大量繁殖则会继发坏死性肠炎,加重肠道损伤,增加死亡率[18]。随着我国对抗生素使用的限制以及2种病原不同的治疗方式,当临床上出现便血等症状时,对于球虫和梭菌单一或混合感染的判定显得尤为重要。本研究基于毒害艾美耳球虫ITS-2序列和产气荚膜梭菌α毒素基因设计特异性引物,经过反应体系和反应条件的优化,成功建立了能够同时检测毒害艾美耳球虫和产气荚膜梭菌的双重PCR及双重纳米PCR方法。所建立的双重纳米PCR方法在检测毒害艾美耳球虫时最低模板检出量为1.81 copies,敏感性是双重PCR的100倍;而检测产气荚膜梭菌时最低模板检出量为105 copies,敏感性是双重PCR的10倍。同检测其他病原的纳米PCR相比,本研究建立的双重纳米PCR对于检测毒害艾美耳球虫的敏感性为1.81 copies,高于Luo等[19]建立检测猪伪狂犬病毒(敏感性6 copies)和检测猪博卡病毒(敏感性95 copies)的双重纳米PCR,而对于检测产气荚膜梭菌的敏感性为105 copies,略低于检测猪博卡病毒的敏感性。目前国内外建立的多重纳米PCR多用于样品中病毒的特异性检测,敏感性差异较大,多为2~1 000 copies,这可能与纳米PCR体系、基因位点选取和引物设计的不同有关[20-23]。2种方法对已明确毒害艾美耳球虫和产气荚膜梭菌感染情况的鸡的临床粪便样品检测结果与病原学检测结果一致,表明2种方法可用于鸡的临床粪便样品检测。
随着我国禽养殖的规模逐渐扩大,毒害艾美耳球虫和产气荚膜梭菌感染的病例逐渐增加,迫切需要更加快速、简便的检测方法应用于临床实践。但目前国内尚未有关于毒害艾美耳球虫和产气荚膜梭菌双重PCR检测方法的商品化应用,限制了对临床上常见的2种重要病原体的检测和防控。本研究在前人研究的基础上,建立了简便快捷的双重 PCR和双重纳米PCR方法,操作简单,灵敏度高,特异性好,未来将对所建方法的临床应用进行进一步的评估,以满足临床对于毒害艾美耳球虫和产气荚膜梭菌2种病原的检测需求。
4 结 论
本研究成功建立了适用于临床检测E.necatrix和C.perfringens特异、敏感的双重PCR和双重纳米PCR检测方法。
