葛根素干预软骨氧化应激和Nrf2/HO-1通路改善PTOA大鼠软骨退变的机制
2023-10-09阮红日马天文李亚楠杨雯越魏成威
陈 鸿,阮红日,马天文,李亚楠,苗 雪,杨雯越,高 利,魏成威
(东北农业大学动物医学学院,黑龙江省动物疾病致病机制与比较医学重点实验室,哈尔滨 150030)
骨关节炎是兽医临床中常见的退行性骨关节病,该病的主要特征是软骨退变导致的关节稳态失衡[1],临床表现为疼痛、关节畸形和活动受限等症状[2]。正常的衰老、性别、遗传的生理现象以及肥胖、代谢障碍、饲养管理不规范和外伤等多因素可驱使其发生,有时单因素存在,但常见的骨关节炎是由多种因素联合导致的结果[3]。目前,兽医临床上骨关节炎常使用非甾体类抗炎药治疗,但仅能减轻疼痛并不能逆转疾病,并且副作用多[4]。因此,筛选有效、安全高效的骨关节炎防治药物尤为重要。
机体氧化应激是骨关节炎软骨中活性氧(reactive oxygen species,ROS)过量积累的结果,能够导致软骨细胞稳态失衡,诱导炎症和软骨细胞凋亡的发生[5]。将软骨细胞暴露于过氧化氢(hydrogen peroxide,H2O2)、甲萘醌和3-吗啉基苯胺等促氧化剂可上调其炎症因子和趋化因子水平[6],这表明氧化应激能够诱导软骨细胞的炎症反应。核转录因子E2相关因子2(nuclear transcription factor E2 related factor 2,Nrf2)是一种负责调控细胞氧化还原平衡的核转录因子。正常状态下,Nrf2保持低转录水平,而在氧化应激条件下,活化的Nrf2会与抗氧化元件结合,调控抗氧化酶血红素氧合酶1(heme oxygenase 1,HO-1)、丙二醛(malondialdehyde,MDA)表达及多种抗氧化酶的活性,发挥抗氧化作用,从而提高机体抗氧化应激的防御能力[7]。研究发现,使用曲古抑菌素A靶向激活Nrf2/HO-1信号通路能够有效抑制IL-1β诱导的软骨细胞外基质(extracellular matrix,ECM)代谢标志物基质金属蛋白酶3(matrix metalloproteinase 3,MMP3)、基质金属蛋白酶13(matrix metalloproteinase 13,MMP13)和血小板反应蛋白解整合素金属肽酶4(a disintegrin and metalloproteinase with thrombospondin 4,ADAMTS4)的表达[8]。促炎细胞因子在骨关节炎的发病机制中起核心作用,可以诱导软骨ECM降解并增加II型胶原酶的表达,促进软骨细胞凋亡[9]。近期研究发现,激活Nrf2能够靶向抑制NF-κB通路防止LPS诱导软骨细胞中IL-1β和IL-6的上调[10]。因此,基于Nrf2/HO-1通路对于解析骨关节炎致病机制及开发临床骨关节炎靶点药物具有潜在价值。
葛根素是从葛根的根部分离的一种异黄酮,其药用价值得益于其广泛的药理学特性,包括抗炎、抗氧化、抗肿瘤、缓解疼痛和免疫调节等[11]。目前发现葛根素对骨关节炎软骨退变具有改善作用,但具体机制尚不明确。研究认为葛根素能够激活AMPK通路,通过促进骨关节炎大鼠软骨细胞的线粒体生物发生减轻线粒体功能障碍[12]。在碘乙酸诱导的小鼠骨关节炎模型中,使用葛根素干预可抑制受累关节单核细胞聚集并降低C-C趋化因子配体2的表达[13]。然而,葛根素对创伤后骨关节炎(post-traumatic osteoarthritis,PTOA)大鼠的软骨氧化损伤作用和具体分子机制尚未可知。因此,本试验通过前十字韧带切断(anterior cruciate ligament transection,ACLT)方法建立大鼠PTOA模型,以Nrf2/HO-1通路为切入点,拟探究葛根素改善PTOA大鼠骨关节炎软骨退变的作用机制,为葛根素治疗骨关节炎的机制提供新思路,为药物研发和临床应用提供理论依据。
1 材料与方法
1.1 主要试剂
葛根素(纯度≥99%)购自美国Sigma公司;塞来昔布购自美国辉瑞制药有限公司;异氟烷购自北京友诚盛达生物科技有限公司;MDA、SOD、GSH-Px和CAT测定试剂盒均购自武汉亚科因生物技术有限公司;大鼠IL-1β、IL-6、TNF-α、CTX-Ⅱ和COMP的ELISA试剂盒均购自上海酶联生物科技有限公司。BCA试剂盒、RIPA裂解液和高敏型ECL化学发光检测试剂盒均购自上海碧云天生物技术有限公司。GAPDH和ADAMTS4抗体购自武汉爱博泰克生物科技有限公司,Nrf2和HO-1抗体购自英国Abcam公司,MMP3和MMP13抗体购自江苏亲科生物研究中心有限公司。总RNA提取试剂盒购自北京天根生化科技有限公司。ChamQ Universal SYBR qPCR Master Mix试剂盒购自南京诺唯赞生物科技股份有限公司。
1.2 主要仪器
倒置光学显微镜(Leica,德国);Epoch多功能酶标仪(BioTek,美国);超微量分光光度计(Thermo,美国);电泳仪(Bio-Rad,美国);全自动化学发光/荧光图像分析系统(Tannon,中国);罗氏480实时荧光定量PCR仪(Roche,德国)。
1.3 实验动物及分组
雄性Sprague-Dawley大鼠40只(体重200~220 g),购自哈尔滨医科大学第二附属医院动物实验中心。所有动物均饲养在温度适宜,通风良好的环境中。本研究所用实验动物和试验设计均遵循东北农业大学动物实验伦理审查相关规定。
将40只Sprague-Dawley大鼠随机分为4组:对照组(n=8)、模型组(n=8)、塞来昔布组(n=8)和葛根素组(n=16)。葛根素组随机分为低剂量组(n=8)和高剂量组(n=8)。
1.4 大鼠PTOA模型建立和药物干预
适应性饲养7 d后,采用ACLT方法建立大鼠PTOA模型。使用异氟烷吸入麻醉。大鼠右后肢剃毛,碘伏消毒,75%酒精脱碘。于大鼠右膝内侧做2 cm切口,分离皮下组织,剪开关节囊后髌骨移位,屈曲膝关节,使用手术刀切断前十字韧带。进行抽屉试验确保前十字韧带完全切断,生理盐水冲洗关节腔,可吸收缝线闭合关节囊和皮肤,碘伏消毒后放回笼中不限制其活动。建立模型12 h后所有大鼠正常进食和饮水。对照组只切开关节囊后缝合进行假手术。
手术建模后,葛根素组的大鼠每日灌胃葛根素(低剂量组按50 mg·kg-1、高剂量组按100 mg·kg-1),葛根素的干预剂量参考先前的研究[14],每天同一时间灌胃,连续干预5周。对照组和模型组大鼠给予等量生理盐水,塞来昔布组大鼠灌服2.86 mg·kg-1塞来昔布[15]。给药结束后,所有大鼠实施安乐死。
1.5 大鼠关节肿胀和疼痛行为学检测
在手术建模之前,各组大鼠进行右膝关节肿胀程度和疼痛行为学检测,记录为第0周。然后在建模后的第1、2、3、4和5周各检测一次,共计6次。
1.5.1 关节肿胀程度检测 根据Abo-Zalam等[16]的方法,使用电子游标卡尺测量每组大鼠的膝关节宽度(单位:cm),计算与第0周的差值代表大鼠膝关节的肿胀程度。
1.5.2 冷敏感反应检测 根据Katri等[17]的方法,将大鼠放在金属网地板安静15 min后,从金属网下方将丙酮涂抹在大鼠右后爪中部,观察各组大鼠20 s内的行为变化并评分。评分标准:0=无反应;1=快速回缩右后爪或迅速拍打,反应时间<1 s;2=长时间回缩或重复拍打,反应时间1~3 s;3=重复回缩或舔右后爪,反应时间3~10 s;4=长时间舔右后爪,反应时间>10 s。每只大鼠重复操作3次,每次间隔10 min,记录3次评分总和。
1.5.3 膝关节伸膝发声检测 根据前人的方法[18]。同一助手固定大鼠右侧大腿,使膝关节处于静息状态(自然微屈),握住踝关节,使膝关节伸展(在膝关节运动的生理范围内进行),关节伸展引起大鼠“吱吱声”反应行为记1分,无反应记0分。连续5次,记录伸展期间大鼠的发声总分。
1.6 大鼠膝关节病理改变及Mankin评分
将各组大鼠胫骨和股骨样本固定于4%多聚甲醛固定液中,对样本进行脱钙、包埋、制作石蜡切片,进行HE染色。HE染色结束后,通过显微镜捕获图像,并通过改良的Mankin分级系统[19]进行病理组织学评估。
1.7 微板法检测大鼠氧化应激标志物
取大鼠右膝关节软骨组织,加入RIPA后用超声破碎仪进行裂解,4 ℃下13 000g离心10 min,过滤并取上清。严格按照试剂盒说明书,对软骨组织中MDA含量进行检测。采集大鼠血液,室温1 000g离心20 min,取上清液。按照试剂盒说明书,对血清中氧化应激指标超氧化物岐化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和过氧化氢酶(catalase,CAT)活性进行检测,使用多功能酶标仪测定吸光值。
1.8 ELISA法检测大鼠血清中软骨代谢标志物和炎症标志物
严格按照试剂盒说明书,使用ELISA法对软骨代谢标志物II型胶原羧基末端肽(C-terminal type II collagen telopeptide,CTX-II)和软骨寡聚基质蛋白(Cartilage oligomeric matrix protein,COMP)以及炎症因子IL-1β、IL-6和TNF-α含量进行检测,使用多功能酶标仪测定吸光值。
1.9 qRT-PCR检测软骨中Nrf2和HO-1 mRNA变化
使用Trizol试剂提取软骨组织总RNA。使用Nanodrop 2000型超微量紫外分光光度计检测各组RNA浓度及纯度。按照反转录试剂盒说明书获取样品cDNA模板,以ChamQ Universal SYBR qPCR Master Mix试剂进行荧光定量PCR,检测软骨组织Nrf2和HO-1 mRNA的表达。引物序列如表1,其中,GAPDH为内参基因。20 μL反应体系:2×ChamQ Universal SYBR qPCR Master Mix 10 μL,上、下游引物各0.4 μL,cDNA 2 μL,补充无RNA酶水至20 μL。PCR反应条件:预变性95 ℃ 30 s;循环反应95 ℃ 10 s和60 ℃ 30 s,共40个循环。使用2-ΔΔCt法计算各基因相对表达水平。
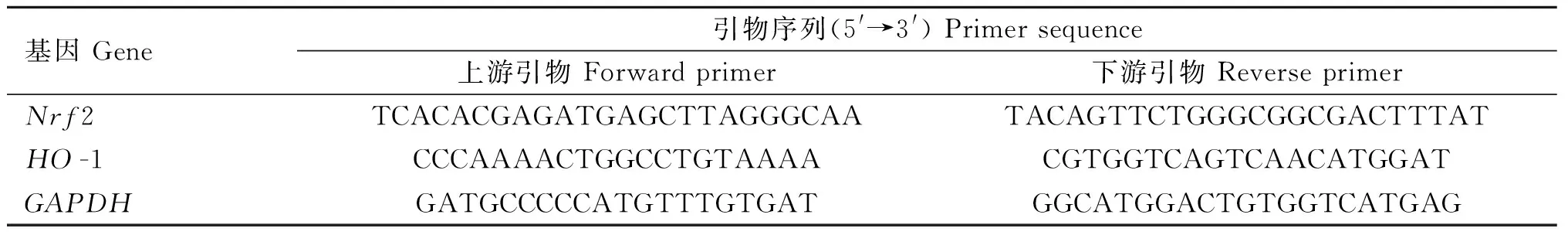
表1 qRT-PCR检测的引物序列Table 1 The primer sequences used in qPCR assay
1.10 Western blot检测软骨中Nrf2/HO-1通路及ECM代谢标志物的表达
取大鼠右膝关节软骨组织,加入1 mL PBS匀浆化。使用RIPA裂解液从软骨组织中提取总蛋白。使用BCA试剂盒测定蛋白质浓度后,使用8%~12% SDS-PAGE凝胶分离相同数量的蛋白质。将蛋白质条带转移到PVDF膜上。用5%脱脂牛奶封闭1.5 h后,4 ℃下与一抗孵育过夜,比例如下:Nrf2(1∶1 500)、HO-1(1∶1 000)、MMP3(1∶1 000)、MMP13(1∶1 000)、ADAMTS4(1∶1 000)和GAPDH(1∶2 000)。二抗室温孵育1 h后,使用高敏型ECL化学发光试剂在Tannon自动凝胶图像分析系统获得蛋白印迹条带。使用ImageJ软件分析蛋白质灰度值。
1.11 统计学分析
2 结 果
2.1 葛根素对PTOA大鼠关节肿胀和疼痛的影响
2.1.1 葛根素缓解PTOA大鼠关节肿胀 葛根素干预后,大鼠膝关节关节肿胀程度检测结果如表2所示,术后的5周内,模型组大鼠关节宽度差逐渐增加,与对照组相比变化极显著(P<0.01),关节肿胀严重。塞来昔布组和葛根素高剂量给药组从给药第3周至给药结束,关节宽度差与模型组相比呈显著下降趋势(P<0.05);葛根素低剂量组给药第5周关节宽度差与模型组相比出现极显著减少(P<0.01)。
表2 葛根素干预后PTOA大鼠关节肿胀程度检测结果Table 2 Detection results of joint swelling degree of PTOA rats after puerarin intervention cm
2.1.2 葛根素缓解PTOA大鼠疼痛症状 葛根素干预后,大鼠冷敏感反应结果如表3所示,术后的5周内,与对照组相比,模型组大鼠冷敏感反应评分极显著增加(P<0.01)。塞来昔布组和葛根素高剂量给药组从给药第2周至给药结束,冷敏感反应评分与模型组相比呈极显著下降趋势(P<0.01)。
表3 葛根素干预后PTOA大鼠冷敏感反应评分检测结果Table 3 Detection results of cold sensitivity score of PTOA rats after puerarin intervention
葛根素干预对大鼠膝关节伸膝发声检测结果如表4结果所示,与对照组比较,术后的5周内,模型组发声次数极显著增加(P<0.01)。与模型组相比,塞来昔布组和葛根素高剂量给药组从给药第2周至给药结束,发声次数极显著减少(P<0.01);葛根素低剂量组从给药第3周至给药结束,发声次数极显著减少(P<0.01)。以上结果说明,葛根素能够有效减少ACLT诱导的大鼠关节肿胀,改善冷敏感和伸膝发声行为,对缓解PTOA大鼠关节肿胀和疼痛症状具有积极作用。
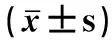
表4 葛根素干预后PTOA大鼠伸膝发声(次数)检测结果Table 4 Detection results of knee extension sound (number) in PTOA rats after puerarin intervention
2.2 葛根素对PTOA大鼠关节软骨病理损伤的影响
各组大鼠胫骨和股骨的HE染色代表图像如图1所示。A1~E1为胫骨图像,A2~E2为股骨图像。对照组(图1A1、A2)关节软骨表面光滑,结构完整,层次清晰,软骨细胞排列规则。模型组(图1B1、B2)软骨损伤严重,表面凹凸不平,软骨细胞排列紊乱且丢失严重。塞来昔布组(图1C1、C2)软骨表面不光滑,表层软骨细胞排列较规则。葛根素低剂量组(图1D1、D2)软骨表面较粗糙,炎性细胞浸润较多,软骨细胞空泡化较模型组少。葛根素高剂量组(图1E1、E2)软骨表面轻微粗糙,表层软骨细胞排列较规则,软骨细胞无肥大和丢失情况。如图2所示,与对照组相比,模型组和葛根素低剂量组Mankin评分极显著升高(P<0.01),葛根素高剂量组评分与对照组相比无差异显著。以上结果说明,葛根素干预有效地减少了PTOA造模导致的大鼠软骨细胞丢失,改善软骨损伤,且高剂量葛根素组的效果更好。

A1、A2.对照组; B1、B2.模型组; C1、C2.塞来昔布组; D1、D2.葛根素低剂量组; E1、E2.葛根素高剂量组A1, A2. Control group; B1, B2. Model group; C1, C2. Celecoxib group; D1, D2. Puerarin low-dose group; E1,E2. Puerarin high-dose group图1 PTOA大鼠膝关节病理组织学观察Fig.1 Histopathological observation of PTOA rats knee joint

与对照组比较,*. P<0.05,**. P<0.01Compared with the control group, *.P<0.05,**.P<0.01图2 PTOA大鼠膝关节Mankin评分Fig.2 Mankin score of PTOA rats knee joint
2.3 葛根素对PTOA大鼠软骨中ECM代谢标志物的影响
如图3所示,与对照组相比,模型组软骨中MMP3、MMP13和ADAMTS4含量极显著升高(P<0.01)。与模型组相比,塞来昔布组软骨中MMP3和MMP13含量极显著下降(P<0.01);葛根素低剂量组MMP3和ADAMTS4含量显著下降(P<0.05);葛根素高剂量组软骨中MMP3和ADAMTS4含量极显著下降(P<0.01),MMP13含量显著下降(P<0.05)。以上结果说明,葛根素干预能有效地降低软骨ECM代谢标志物的含量,发挥抗PTOA软骨基质降解的作用。
与对照组比较,*. P<0.05,**. P<0.01;与模型组比较,#. P<0.05,##. P<0.01;下图同Compared with the control group, *. P<0.05,**. P<0.01. Compared with the moderl group, #. P<0.05,##. P<0.01. The same as below图3 葛根素对PTOA大鼠软骨中ECM代谢标志物含量的影响Fig.3 Effect of puerarin on the content of ECM metabolic markers in the cartilage of PTOA rats
2.4 葛根素对PTOA大鼠软骨中MDA含量的影响
如图4所示,与对照组相比,模型组软骨中MDA含量极显著升高(P<0.01)。与模型组相比,葛根素高剂量组和塞来昔布组软骨中MDA含量极显著下降(P<0.01),葛根素低剂量组显著下降(P<0.05)。

图4 葛根素对PTOA大鼠软骨中MDA含量的影响Fig.4 Effect of puerarin on the content of MDA in cartilage tissue of PTOA rats
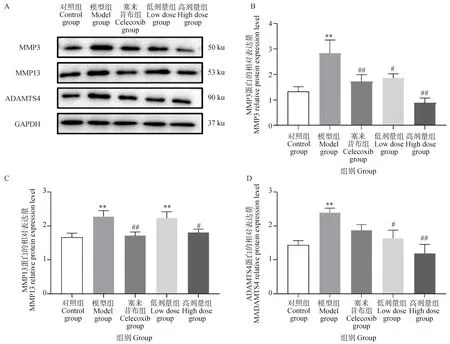
2.5 葛根素对PTOA大鼠血清中抗氧化酶活力的影响
如图5所示,与对照组相比,模型组SOD和GSH-Px活力极显著下降(P<0.01),CAT活力显著下降(P<0.05)。与模型组相比,葛根素高剂量组和塞来昔布组血清中SOD、GSH-Px和CAT活力极显著升高(P<0.05)。以上结果说明,葛根素干预能有效地增强大鼠抗氧化酶活力,增强机体抗氧化应激的能力。
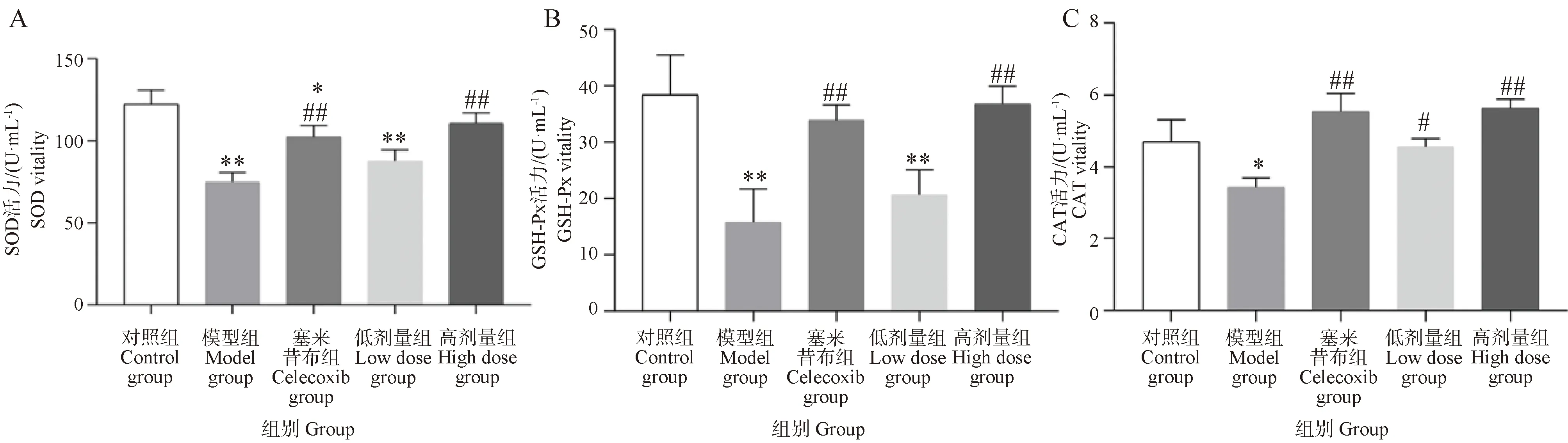
图5 葛根素对PTOA大鼠血清中SOD、GAH-Px和CAT活力的影响Fig.5 Effect of puerarin on the activity of SOD, GAH-Px and CAT in serum of PTOA rats
2.6 葛根素通过Nrf2/HO-1通路改善PTOA大鼠软骨氧化损伤
如图6所示,与对照组比较,模型组大鼠膝关节软骨中Nrf2和HO-1 mRNA水平无显著性变化,塞来昔布组和葛根素高剂量组中Nrf2和HO-1 mRNA水平显著极升高(P<0.01)。与模型组比较,塞来昔布组Nrf2 mRNA水平显著极升高(P<0.01),HO-1 mRNA水平显著升高(P<0.05),葛根素高剂量组中Nrf2和HO-1 mRNA水平极显著升高(P<0.01)。如图7所示,与对照组比较,模型组大鼠膝关节软骨中Nrf2和HO-1蛋白表达无显著性变化,塞来昔布组和葛根素高剂量组中Nrf2和HO-1蛋白表达极显著升高(P<0.01)。与模型组比较,葛根素高剂量组中Nrf2和HO-1蛋白表达水平极显著(P<0.01)升高。综上所述,葛根素能够激活大鼠软骨的Nrf2/HO-1通路,通过调控Nrf2/HO-1通路改善骨关节炎大鼠氧化损伤。
图6 葛根素对PTOA大鼠软骨Nrf2/HO-1通路mRNA表达的影响Fig.6 Effect of puerarin on mRNA expression of Nrf2/HO-1 pathway in cartilage tissue of PTOA rats
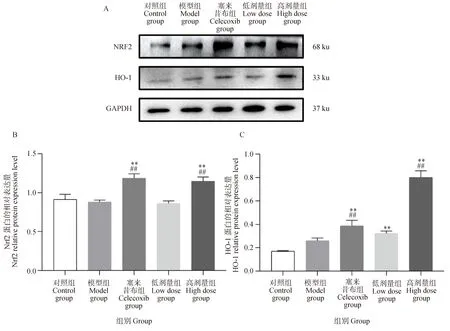
图7 葛根素对PTOA大鼠软骨Nrf2/HO-1通路蛋白质表达的影响Fig.7 Effect of puerarin on protein expression of Nrf2/HO-1 pathway in cartilage tissue of PTOA rats
2.7 葛根素对PTOA大鼠血清中炎症因子IL-1β、IL-6和TNF-α的影响
由图8所示,与对照组相比,模型组和葛根素低剂量组血清中的IL-1β、IL-6和TNF-α浓度极显著升高(P<0.01),塞来昔布组血清IL-1β和IL-6浓度显著升高(P<0.05)。葛根素高剂量组和塞来昔布组血清中的IL-1β、IL-6和TNF-α浓度与模型组相比显著下降(P<0.01),葛根素高剂量组IL-1β、IL-6和TNF-α与对照组相比较无显著差异。以上结果说明,葛根素干预能降低机体炎症因子的水平。

图8 葛根素对PTOA大鼠血清中IL-1β、IL-6和TNF-α的影响Fig.8 Effects of puerarin on IL-1β, IL-6 and TNF-α in serum of PTOA rats
2.8 葛根素对PTOA大鼠血清中软骨代谢标志物CTX-Ⅱ和COMP的影响
如图9所示,与对照组相比,模型组和葛根素低剂量组血清中CTX-Ⅱ和COMP浓度极显著升高(P<0.01),塞来昔布组血清中CTX-Ⅱ和COMP浓度与对照组相比有显著差异(P<0.05)。与模型组相比,葛根素高剂量组血清中CTX-Ⅱ浓度极显著下降(P<0.01),COMP浓度显著下降(P<0.05),塞来昔布组CTX-Ⅱ和COMP浓度显著下降(P<0.05);与对照组相比,葛根素高剂量组COMP浓度无显著变化。以上结果说明,葛根素干预能有效地降低血清中软骨代谢标志物CTX-Ⅱ和COMP的水平。

图9 葛根素对PTOA大鼠血清中CTX-II和COMP的影响Fig.9 Effects of puerarin on CTX-II and COMP in serum of PTOA rats
3 讨 论
骨关节炎是一种渐进性关节疾病,如不能及时发现和治疗,将对动物骨关节造成不可逆性损伤,导致动物运动障碍,严重影响动物的健康和生活质量,同时也造成巨大的经济损失。临床常用的非甾体类抗炎药副作用大,且治疗效果欠佳,临床兽医师对许多顽固性骨关节炎依然束手无策。葛根素具有抗炎、抗氧化和缓解疼痛等药理作用[11]。本研究通过检测各组大鼠的膝关节肿胀和疼痛反应,并在给药结束后关节软骨病理切片进行观察与评分,对血清中软骨代谢标志物(CTX-II和COMP)、抗氧化酶(SOD、GSH-Px和CAT)活性、炎症因子(IL-1β、TNF-α和IL-6)以及软骨中MDA含量、ECM代谢标志物(MMP3、MMP13和ADAMTS4)含量和Nrf2/HO-1通路的蛋白和基因进行检测。结果发现,葛根素能够改善PTOA大鼠关节肿胀和疼痛程度,并通过调控Nrf2/HO-1通路改善软骨氧化损伤和炎症反应,抑制大鼠骨关节炎进展,为兽医临床防治骨关节炎提供更多的选择。
在骨关节炎病理状态下,软骨细胞的线粒体功能障碍导致ROS过度产生[20]。机体内存在的天然ROS清除系统,主要包括SOD、CAT和GSH-Px。SOD常与MDA共同反映机体清除ROS的能力以及机体受ROS损伤的严重程度,CAT和GSH-Px反映清除过氧化氢和脂质过氧化物的水平,反映机体抗氧化损伤的能力。抗氧化酶的活性受到抑制会导致机体对ROS的清除率降低,引起氧化和抗氧化失衡,积累的ROS能够通过调节NF-κB[21]、MAPK和Nrf2[22]等途径诱导软骨细胞凋亡和坏死,同时下调软骨ECM的合成代谢标志物(Ⅱ型胶原和蛋白聚糖)的表达,上调分解代谢标志物(MMP3、MMP13和ADAMTS4)的表达,破坏ECM的代谢平衡,从而导致软骨退变。氧化应激除直接导致软骨损伤,还参与骨关节炎炎症的发生。LPS刺激软骨细胞产生的ROS能够导致NLRP3炎症小体的激活,而抑制Nrf2抗氧化途径能够导致NLRP3介导的骨关节炎炎症反应上调[23]。IL-1β是骨关节炎发展的主要促炎因子,通过增强ECM代谢标志物MMP3、MMP13和ADAMTS4的表达促进软骨ECM降解,同时刺激线粒体产生ROS导致软骨细胞发生细胞凋亡和坏死,引起关节软骨结构和功能的损伤[24]。TNF-α和IL-6除了与IL-1β相似的作用,还能促进软骨细胞分泌纤维蛋白溶酶,直接或间接诱导炎症反应[25]。此外,IL-1β、TNF-α和IL-6可以诱导前列腺素的产生,并抑制蛋白聚糖和II型胶原蛋白的合成[26]。II型胶原降解后CTX-II会释放到血液循环系统中后随尿液排出,COMP是软骨中的非胶原蛋白成分,能够反映软骨退变程度。骨关节炎会引起血清中CTX-II和COMP水平升高,并随着骨关节炎严重程度的增加,CTX-II和COMP水平也会相应增加[27],可以潜在地预测早期关节软骨的破坏。在本研究中,ACLT方法诱导大鼠PTOA模型5周后,模型组软骨中MDA以及ECM代谢标志物MMP3、MMP13和ADAMTS4的含量升高,血清中抗氧化酶SOD、GSH-Px和CAT活力显著降低,炎症因子IL-1β、IL-6和TNF-α的表达量显著升高,软骨代谢标志物CTX-II和COMP含量显著升高。而使用高剂量葛根素干预后,与模型组相比,软骨中MDA以及ECM代谢标志物MMP3、MMP13和ADAMTS4的含量显著下降,血清中抗氧化酶SOD、GSH-Px和CAT活力显著升高,炎症因子IL-1β、IL-6和TNF-α的表达量显著下降,软骨代谢标志物CTX-II和COMP含量显著下降。这说明葛根素干预能够有效改善PTOA大鼠的氧化应激和炎症水平,提高机体的抗氧化能力,降低软骨ECM代谢标志物的表达,抑制炎症因子导致的软骨ECM降解。
ROS升高能够使细胞质中的Keap1失活,导致软骨细胞的Nrf2的清除受阻,积累的Nrf2易位到细胞核中,促进HO-1的产生,诱导细胞自噬,发挥抗氧化作用[7],并通过增加抗氧化蛋白的表达,减少炎症和氧化应激[28]。有研究发现,敲除Nrf2可加速骨关节炎的发展[29]。目前已经发现许多天然产物可以通过Nrf2/HO-1通路平衡软骨细胞的氧化还原状态[30-32]。葛根素作为一种异黄酮,具有良好的抗氧化能力[33]。在本研究中,ACLT方法诱导大鼠PTOA模型5周后,模型组软骨中Nrf2和HO-1的基因和蛋白与对照组无显著性差异。而使用高剂量葛根素干预后,Nrf2和HO-1的基因和蛋白水平均上调,说明Nrf2/HO-1通路被激活。这表明,葛根素能够激活PTOA大鼠中的Nrf2/HO-1通路并提高抗氧化能力。各组PTOA大鼠在葛根素干预后的关节肿胀和疼痛行为学检测结果以及关节软骨病理切片的评分的变化表明,葛根素能够有效缓解PTOA引起的关节肿胀和疼痛症状,改善软骨退变,抑制骨关节炎进展。
综上所述,本试验发现葛根素能够激活PTOA大鼠软骨中的Nrf2/HO-1通路,发挥抗氧化和抗炎作用,抑制大鼠软骨退变。此外,发现葛根素能够减轻PTOA疼痛程度,但具体作用机制需要进一步研究。本试验为今后葛根素在兽医临床上的应用提供资料和研究基础,为相关靶点药物的研究提供理论依据。
4 结 论
葛根素能够抑制创伤后骨关节炎大鼠的关节肿胀和疼痛反应,并通过激活Nrf2/HO-1通路发挥抗炎和抗氧化作用,从而改善大鼠软骨退变。
