柠檬苦素诱导塔宾曲霉UA13高产柠檬苦素转化酶的研究
2023-10-09陈钰亭李文杰杨睿昕雷生姣王顺顺杨丹丹欧阳侬非
陈钰亭,李文杰,杨睿昕,雷生姣*,王顺顺,杨丹丹,欧阳侬非
1(三峡大学 生物与制药学院,湖北 宜昌,443002)2(河南工业大学 国际教育学院,河南 郑州,450000)
柑橘类水果兼具营养价值与药用价值,富含人体生长发育必须的维生素、膳食纤维、以及类黄酮类等生物活性物质[1],具有抗氧化[2]、抗癌[3]、肝脏保护[4]、延缓衰老[5]和预防各种慢性疾病等功效[6],深受消费者的喜爱。相较于国外柑橘深加工业,我国的发展仍处于初级阶段,柑橘加工业滞后于种植业,具有非常大的增长空间。柠檬苦素类化合物(limonoids)的典型代表物——柠檬苦素(limonin),是柑橘类水果出现苦味和“后苦味”的主要物质[7],极大地影响了柑橘汁的口感,而“后苦味”则严重制约了柑橘加工业的发展,亟待解决。柠檬苦素[8]又称柠碱,是一种三萜化合物,在水溶液中的苦味阈值为1.0 mg/L,在果汁中的苦味阈值为3.4 mg/L,约为柚皮苷的20倍[9]。柠檬苦素在鲜果或鲜榨果汁中含量较低,多以无苦味的柠檬苦素A-环内酯存在于细胞质内,但长时间放置或热处理等会使其苦味加剧[10]。如图1所示,这种“后苦味”现象是由于在酸性条件(pH<6.5)下,柠檬苦素A-环内酯在柠檬苦素D-环内酯水解酶催化下转化为有苦味的柠檬苦素[11]。果肉组织在冰冻[12]、机械损伤[13]或热处理[14]等条件下,其酸度均会增强,进而促进了加工或贮藏过程中柠檬苦素的生成[15]。
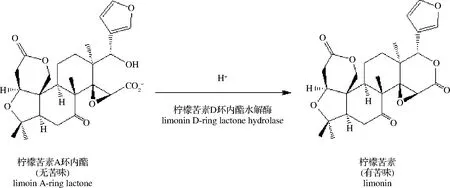
图1 柠檬苦素A环内酯催化为柠檬苦素的示意图Fig.1 Schematic diagram of the catalysis of limonin A-cyclic lactone to limonin
前期研究显示,本实验室选育的ARTP诱变菌株塔宾曲霉UA13[16]能同时水解柚皮苷和柠檬苦素,但对柠檬苦素的水解能力较弱。因此,本研究在前期试验的基础上,以柠檬苦素为诱导物对该菌株进行产酶诱导,以期提高其产柠檬苦素转化酶的能力。在摇瓶发酵基础上进行1 L发酵罐优化实验,确定最佳发酵产酶条件,并对所得到的酶进行性质研究,为建立可同时水解两种柑橘苦味物质的酶制剂技术奠定理论基础,并为微生物发酵技术提供研究依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
实验室菌株塔宾曲霉(Aspergillustabin)UA13,保藏编号M 2022989,本实验室初次分离诱变保藏。
1.1.2 培养基
固体培养基[16](g/L):MgSO4·7H2O 1.0,KH2PO41.0,(NH4)2SO41.5,KCl 0.5,KNO31.5,CaCl20.1,酵母提取物 2.0,柠檬苦素1.0 mg/L,琼脂粉 10.0,自然pH。
种子培养基(g/L):柠檬苦素4.0 mg/L,MgSO4·7H2O 5.0,K2HPO45.0,KCl 5.0,FeSO4·5H2O 0.1,琼脂粉10.0,自然pH,接种量10%(体积分数)。
发酵培养基(g/L):MgSO4·7H2O 0.5,KH2PO41.5,K2HPO41.5,(NH4)2SO44.0,ZnSO4·7H2O 0.1,CaCl20.1,酵母提取物 1.0,豆粉 2.0,蛋白胨 2.0,柠檬苦素4.0 mg/L,自然pH,接种量10%(体积分数)。
1.1.3 试剂
柠檬苦素(标准品≥98%)、对-二氨基苯甲醇(分析纯),上海阿拉丁生化科技股份有限公司;柚皮苷(分析纯),上海源叶生物科技有限公司;CH3COOH、CH3COONa、一缩二乙二醇(diethylene glycol,DEG)、95%乙醇、无水乙醇、NaOH、H2SO4、FeCl3(均为分析纯),国药集团化学试剂有限公司。
1.2 仪器与设备
ME204E电子天平,梅特勒-托厉多仪器(上海)有限公司;ZW0615062604紫外可见光分光光度仪,上海光谱仪器有限公司;HENCZI红外快速干燥箱,上海跃进医疗器械有限公司;SX700高压蒸汽灭菌锅,日本TOMY公司;SW-CJ-2FD超净工作台、SPX-605-II生化恒温培养箱,上海新苗医疗器械制造有限公司;IS09001恒温摇床,世平实验设备有限公司;FUG-1L×4-P发酵罐,上海国强生化工程装备有限公司;LG10-2.4A离心机,上海安亭科学仪器厂;HH-2恒温水浴锅,常州国华电器有限公司;XSP-7CZ生物显微镜,上海长方光学仪器有限公司;涡旋振荡仪,上海舜宇恒平科学仪器有限公司。
1.3 实验方法
1.3.1 发酵培养
孢子悬浮液:将实验室贮藏的斜面菌株塔宾曲霉UA13接种于平板培养基上,30 ℃培养3~4 d至孢子成熟。用0.85%的无菌生理盐水洗下孢子并打散,得到菌悬液。对孢子悬液进行镜检计数,将浓度调整为107个/mL左右即可。
种子液:将调整好浓度的孢子悬浮液按10%(体积分数)的接种量接入种子培养基中,于30 ℃、180 r/min的恒温摇床中培养。
菌种发酵:将调整好的孢子悬浮液用无菌枪头吸取5 mL(接种量10%,体积分数)接入已灭菌的装液量50 mL/250 mL的发酵培养基中(5颗玻璃珠)。于30 ℃、180 r/min的恒温摇床中培养72 h。
1.3.2 酶活力测定
a)粗酶液的制备:取摇瓶发酵培养72 h的发酵液于离心管中,5 000 r/min离心20 min。
b)柠檬苦素含量的测定:参照王菁等[17]方法并进行改进,分别取0.3、0.6、0.9、1.2、1.5、1.8 mL的200 μg/mL的柠檬苦素标准溶液置于25 mL具塞试管中,无水乙醇补足至2 mL,再各加入5 mL显色液,充分摇匀后静置显色30 min,在500 nm下测定吸光度。以柠檬苦素含量为横坐标,吸光度为纵坐标得标准曲线方程,为A=0.003 8C+0.037 9,R2=0.999 7。
显色液的配制(现配现用):精确称取125 mg的对二氨基苯甲醛溶解于100 mL的硫酸-无水乙醇混合液,V(对二氨基苯甲醛):V(硫酸-无水乙醇)=65:35(冷却后使用),再加入0.5 mL,体积分数0.9%的FeCl3,混匀即可。
c)柠檬苦素转化酶活力测定:参照田庆国等[18]方法并进行适当改进,于具塞试管中加0.5 mL、200 μg/mL底物柠檬苦素,再加入0.1 mL一定浓度的酶液,用无水乙醇补足到2 mL。将其置于60 ℃的恒温振荡器(150 r/min)中酶解30 min,取出酶解液立即置于100 ℃的沸水浴中灭活5 min;于酶解液中添加5 mL的显色液,混匀后静置显色30 min。取出注入1 cm比色皿内,用分光光度计在500 nm处测定吸光值。
所有样品平行测定3次,取平均值进行分析(下同)。
酶活力定义:在60 ℃,pH 4.0的条件下,1 min消耗1 μg柠檬苦素所需的酶量定义为1个酶活力单位(U)。计算如公式(1)所示:

(1)
相对酶活力定义:同组实验中最高酶活定义为100%,其他条件下酶活力值与最高值之比×100定义为相对酶活力(%)。
1.4 产酶条件优化
1.4.1 摇瓶发酵优化
以柠檬苦素转化酶活力为评价指标,采用单因素试验探究菌株的最佳产酶条件。在初始培养条件下,接种一定种龄的种子液,改变发酵培养基的接种量(4%~16%,体积分数)、发酵温度(25~40 ℃)、发酵液初始pH值(4.0~9.0),确定菌株最佳的发酵环境。
1.4.2 1 L发酵罐优化试验
1 L发酵罐四联罐同步连续发酵,将种子液同步培养后接种至600 mL的已灭菌发酵液中(接种量10%,体积分数)。在通气量0.4 L/min,搅拌转速300 r/min,初始pH值为5.0的初始条件下进行放大培养。在摇瓶优化结果的基础上,分别对搅拌转速(200~350 r/min)、发酵温度(25~40 ℃)、发酵初始pH值(4.0~7.0)进行优化,通过对发酵过程中菌株生长与产酶情况确定最适产酶条件。
酶活力提高倍数的分析以摇瓶发酵优化后的酶活力为基础进行比较研究。
1.5 酶的底物亲和性和酶的最适反应条件研究
酶最适反应条件:发酵液离心后的上清液即为粗酶液。探究粗酶液在不同酶解温度(30~70 ℃)和pH值(2.0~8.0)对酶活力的影响及其对酶稳定性的影响。以同组实验中测定最高酶活力为100%,计算其他条件下的相对酶活力。
酶的底物亲和性:测定酶催化3种底物(柠檬苦素、柚皮苷、橙皮苷)的米氏常数Km值,探究酶对底物的亲和性,采用双倒数法(Linewear-Burk)求得Km。
2 结果与分析
2.1 产酶条件优化
2.1.1 菌株接种量对产酶的影响
种子液的浓度以及菌种的生理状态会直接影响发酵效果[19]。种子培养基培养的时间一定程度上决定了种子活力的强弱,特别是丝状真菌,其菌体的形态和养分传质都会受到影响。在前期研究的基础上,以不同接种量接种48 h的种子培养基到摇瓶中发酵培养,菌株产酶活力如表1所示。

表1 不同接种量对菌株UA13产酶的影响Table 1 Effects of different inoculum amounts on enzyme production by strain UA13
接种量的多少对发酵周期有直接的影响,接种量过低,菌株密度小,生长周期延长;接种量过高,营养物质和氧气供应不足,菌体营养不良,产酶能力也会下降[20]。由表1可知,接种量对菌株发酵产酶的活力影响较小。接种量在4%~10%(体积分数)范围内时,菌株产酶能力均维持在相对较高的水平,活力最高达6.68 U/mL。综合考虑产酶活力与发酵时间,本研究确定接种量10%(体积分数)作为后续研究的基础(下同)。
2.1.2 菌株发酵温度对产酶的影响
改变发酵温度,探究菌株产柠檬苦素转化酶的最适培养温度,结果如表2所示。

表2 发酵温度对菌株UA13产酶的影响Table 2 Effects of different fermentation temperature on enzyme production by strain UA13
不同微生物适宜的培养温度不同,温度会影响菌株的代谢及生长状态,从而影响产酶能力[21]。由表2 可知,菌株在25~40 ℃发酵培养时,菌株产酶活力随培养温度的增加呈现先增加后下降的趋势,酶活在35 ℃时达到最大(10.09 U/mL)。因此,本研究采用发酵温度35 ℃进行后续实验。
2.1.3 初始pH值对产酶的影响
培养基的初始pH值会对酶的结构和功能、细胞的结构、细胞膜的电荷状况等造成影响[22]。微生物在生长过程中产生的代谢产物也会造成培养基的pH值发生变化。不同菌株生长代谢及产酶的适宜pH值范围不同。由表3可知,发酵初始pH值为5.0~6.0时,菌株发酵产酶能力较强,初始pH 5.0时,酶活力最高可达11.60 U/mL。因此,本研究采用初始pH 5.0进行后续实验。

表3 发酵初始pH值对菌株UA13产酶的影响Table 3 Effects of different fermentation initial pH on enzyme production by strain UA13
在单因素试验基础上,以9.0 mg/L的柠檬苦素为碳源兼诱导物,接种10%(体积分数)发酵48 h的种子培养基,在初始培养基pH 5.0,发酵温度35 ℃条件下发酵72 h,菌株UA13产柠檬苦素转化酶的最高酶活力可达11.60 U/mL。
2.2 发酵罐优化实验
为了提高微生物发酵水平,在摇瓶实验的基础上,开展实验室小型发酵罐优化实验。发酵过程中溶氧的变化能够反映菌株生长状态[23]。如图2所示,发酵开始24 h菌体处于迟滞期,溶氧急剧下降,培养基中的氧气被充分利用。随后,溶氧开始逐渐上升,酶的生物合成开始,菌体进入生长指数期,酶活力开始持续增加,发酵72 h酶活力达到最高,为25.48 U/mL,与优化后摇瓶发酵的最高酶活力(11.60 U/mL)相比提高了119.7%。培养基的pH值是动态变化的,其值从发酵开始迅速下降,随后逐渐上升,最后在4.3~4.8波动。
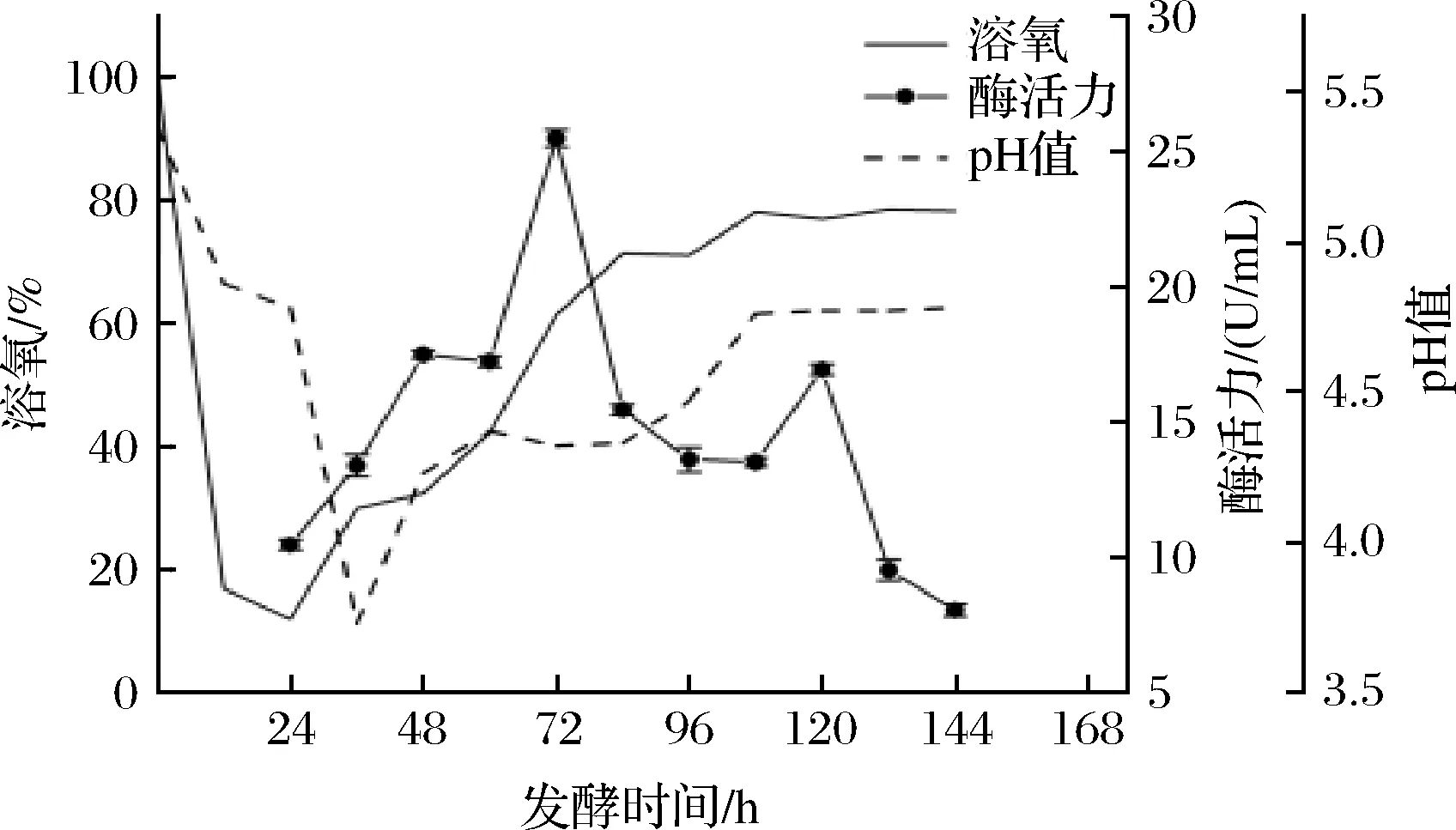
图2 未优化发酵条件下菌株UA13于1 L发酵罐中的发酵曲线Fig.2 Fermentation curve of strain UA13 in 1 L fermenter under unoptimized fermentation conditions
2.2.1 搅拌转速对产酶的影响
在摇瓶培养时通过摇床转动以及添加适量的玻璃珠来促进各物质的融合,避免菌丝体结团而影响发酵产酶。从摇瓶放大至发酵罐中,搅拌参数的控制很大程度上决定着罐体内物质混合和发酵产酶的效率。若搅拌速度过快,过大的剪切力会影响细胞的生成和组成,对菌体发酵产酶造成不利影响[24];若搅拌转速过低,菌丝体缠绕成团,不利于发酵生产。
如图3所示,搅拌转速为200 r/min时,由于搅拌转速较低,菌丝体生长较慢,迟滞期较长,36 h进入生长对数期。菌体产酶能力在48 h时达到最大,为34.04 U/mL,随后持续下降。而摇瓶实验可知菌株通常在72 h时产酶活力达到最高,造成差异的原因可能是发酵罐的转速过低,菌丝体在后续未继续断裂繁殖,而是大量缠绕成球在罐内挡板上影响产酶;搅拌转速为350 r/min时,发酵罐中的溶氧增加,但过高的剪切力会加速菌丝体的衰亡,发酵60 h时酶活力达到最高(33.78 U/mL);转速为250、300 r/min时的发酵变化趋势相差不大:菌株在250 r/min转速下,于48 h时酶活力达到最高(42.61 U/mL),提高了267.3%。菌株在300 r/min转速下,于60 h时酶活达到最高(43.23 U/mL),提高了272.7%。考虑到实际发酵中节省能源,且两种转速下的酶活力相差不大,选择250 r/min为最优转速更为适宜。
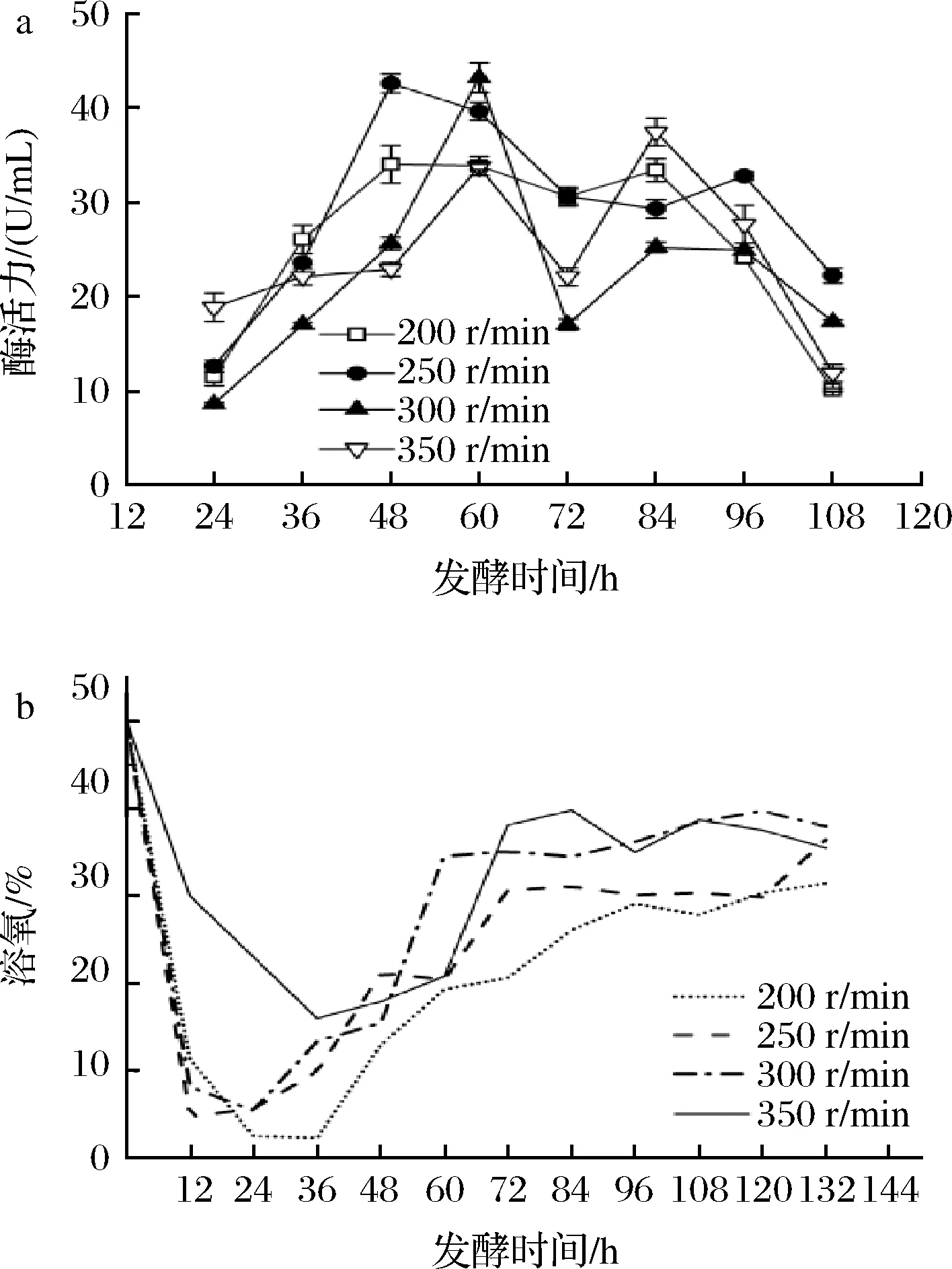
a-酶活;b-溶氧图3 搅拌转速对菌株UA13产酶的影响Fig.3 Effects of different stirring speeds on enzyme production by strain UA13
2.2.2 发酵温度对产酶的影响
发酵温度会通过影响发酵液的性质和溶氧而对酶的生物合成造成影响,适宜的发酵温度有利于微生物的生长和产物的积累[25]。
如图4所示,不同温度下的菌株发酵曲线趋势基本一致:当发酵温度控制在25 ℃和40 ℃时,酶活力均在48 h达到最高,分别为28.80 U/mL和30.46 U/mL,酶活力相对较低,与摇瓶发酵情况一致;在30、35 ℃时,菌株产酶活力在36 h分别达到40.10、35.61 U/mL,在发酵60 h时两者均出现二次生长。综上所述,菌株在30~35 ℃均有良好的产酶能力,在30 ℃的培养温度下,菌株提前在36 h酶活力就达到最高40.10 U/mL,相较于优化前提高了245.7%,缩短了发酵周期。因此,选择培养温度30 ℃进行后续发酵罐优化实验。
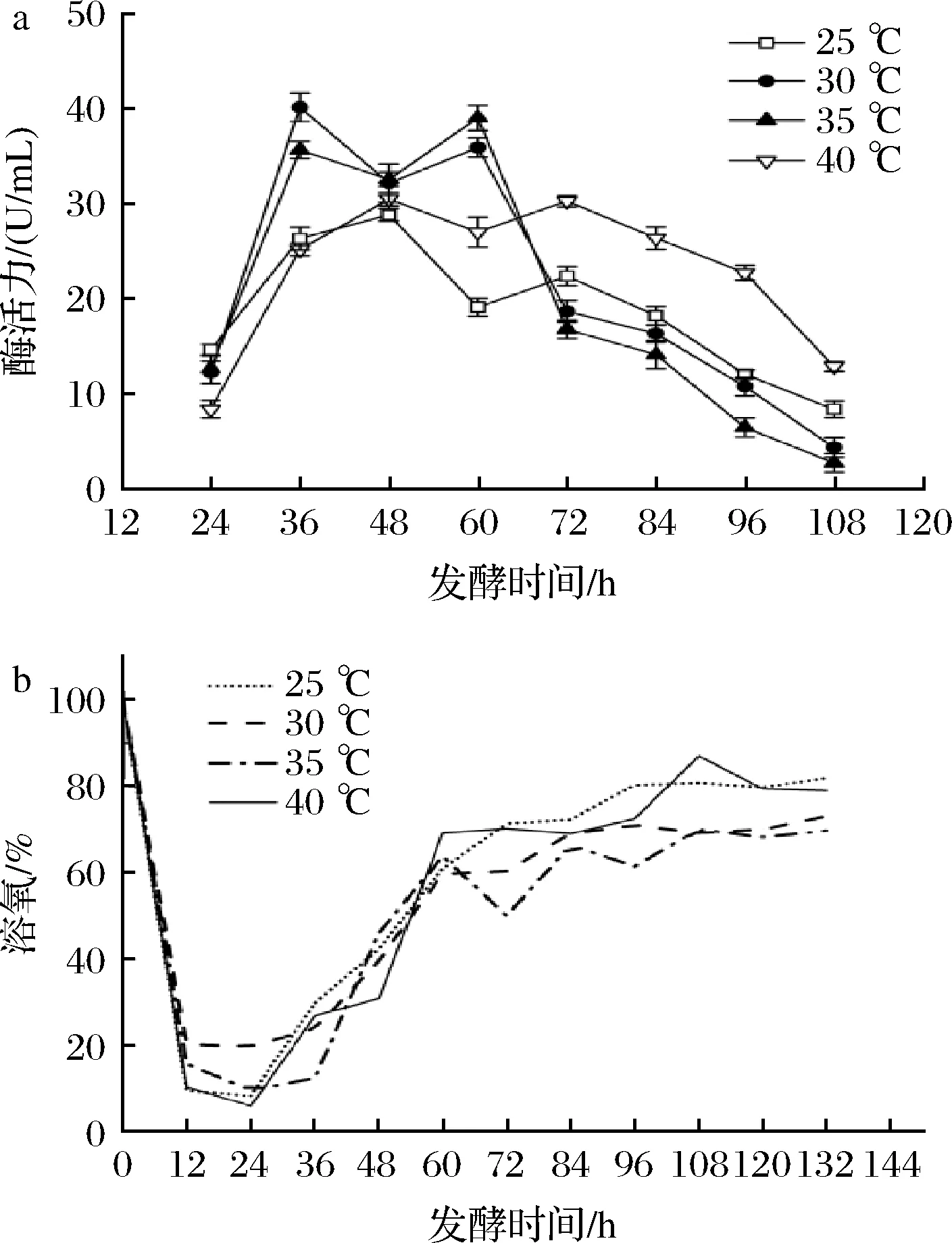
a-酶活;b-溶氧图4 发酵温度对菌株UA13产酶的影响Fig.4 Effects of different fermentation temperatures on enzyme production by strain UA13
2.2.3 发酵液初始pH值对产酶的影响
如图5所示,在初始pH 5.0条件下,发酵前12 h,溶氧迅速下降。在12~48 h,发酵罐的溶氧趋近于零,基本维持10%以下,说明初始pH 5.0条件下菌株代谢旺盛,更适宜生长,与摇瓶实验结果一致。在48 h时,柠檬苦素转化酶活力已达到48.52 U/mL,相较于优化前提高了318.3%;在发酵初始pH 6.0条件下,菌株在48~72 h都维持着较好的产酶能力,酶活最高可达40.16 U/mL,提高了246.2%;发酵液初始pH 4.0时,酶在96 h时达到最高活力,为38.82 U/mL,提高了234.7%。综上所述,发酵液的最适初始pH值为5.0,且塔宾曲霉UA13在初始pH 4.0~6.0的生长和产酶能力较强,此菌株更适宜在偏酸环境中生存,与摇瓶实验结果一致。
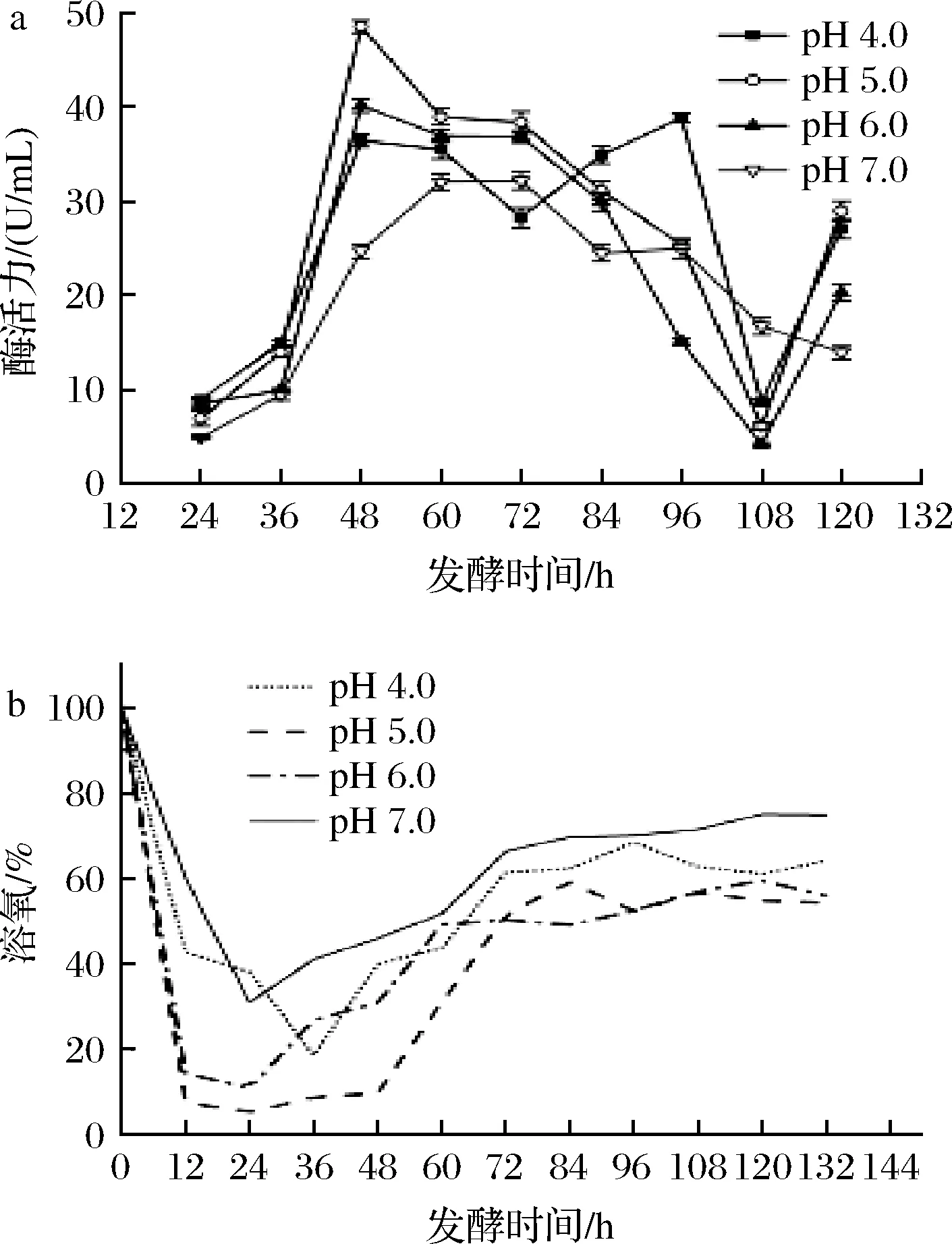
a-酶活力;b-溶氧图5 发酵液初始pH值对菌株UA13产酶的影响Fig.5 Effects of different fermentation initial pH on enzyme production by strain UA13
2.3 柠檬苦素转化酶性质研究
2.3.1 柠檬苦素转化酶最适酶解温度的研究
温度是影响底物转化效率的重要因素。温度过低时,许多酶分子未被激活,酶解效果极低。温度过高超过酶热稳定性范围时,酶蛋白失活[26]。适宜的酶解温度可以使底物的转化效率达到最大。
由表4可知,酶解温度在30~70 ℃时,柠檬苦素转化酶的活力随温度升高呈先增加后下降的趋势,在60 ℃时酶活力达到最高,为16.50 U/mL;当酶解温度为70 ℃时,柠檬苦素转化酶活力仍有59.5%。同时,对转化酶的粗提物在不同温度下的稳定性进行研究,确定了此酶活力在4 ℃条件下保存240 min,其活力下降了55.1%,在20 ℃条件下保存240 min,其活力仅下降了39.5%。因此,本研究的柠檬苦素转化酶具有良好的耐热性,且采用酶解温度60 ℃进行后续实验。何玉兰等[27]对黑曲霉重组酸性果胶裂解酶进行研究,该酶在30~50 ℃能保持80%以上的相对酶活,最适反应温度为50 ℃。

表4 酶解温度对柠檬苦素转化酶活力的影响Table 4 Effects of different enzymolysis temperatures on the activity of limonin debitrase
2.3.2 柠檬苦素转化酶最适酶解pH值的研究
一般情况下,真菌产柚苷酶的最适pH值在3.0~6.0[28]。不适宜的pH值会对酶蛋白的构象造成影响,从而使酶活降低。
由表5可知,菌株UA13在酶解pH 2.0~8.0的酶解环境下,酶活力呈现先增加后下降的趋势。在酶解pH 5.0时,酶活力最高可达21.33 U/mL;pH 3.0时相对酶活力有90.6%;pH 7.0时相对酶活力有81.1%。且实验可知此酶在pH 3.0~5.0稳定性良好,在pH 3.0环境下仍能保留61.2%的活力。因此,此酶具有良好的耐酸性,能较好地适用于柑橘果汁加工业。彭程等[29]研究了黑曲霉α-L-阿拉伯呋喃糖苷酶的特性,该酶在pH 3.0~8.0具有良好的活力,且最适酶解pH值也为5.0。
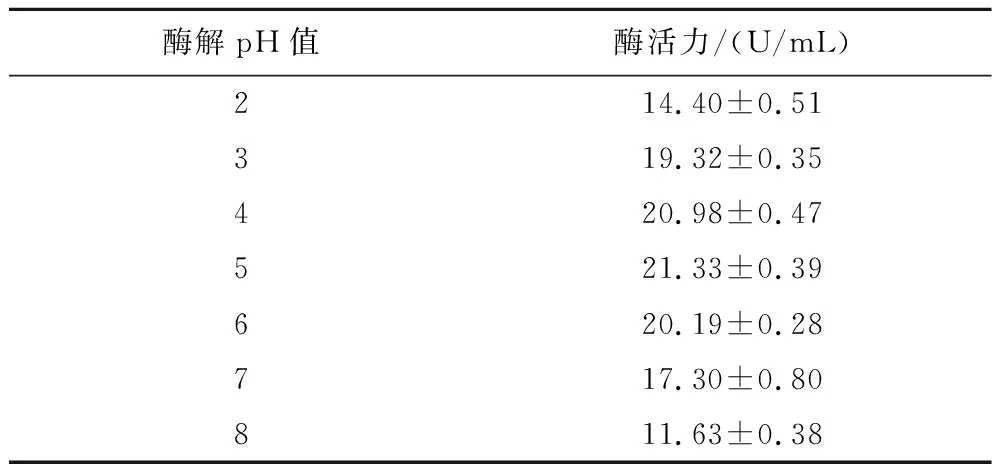
表5 不同酶解pH值对柠檬苦素转化酶活力的影响Table 5 Effects of different enzymolysis temperatures on the activity of limonin debitrase
2.4 底物亲和性研究
测定本实验室的柠檬苦素转化酶粗酶液在不同底物浓度下的反应速率,利用Linewear-Burk曲线得出相应的动力学参数。本研究发现经柠檬苦素诱导后的菌株发酵产酶催化3种不同底物(柠檬苦素、橙皮苷、柚皮苷)的反应皆符合米氏动力学规律(图6)。
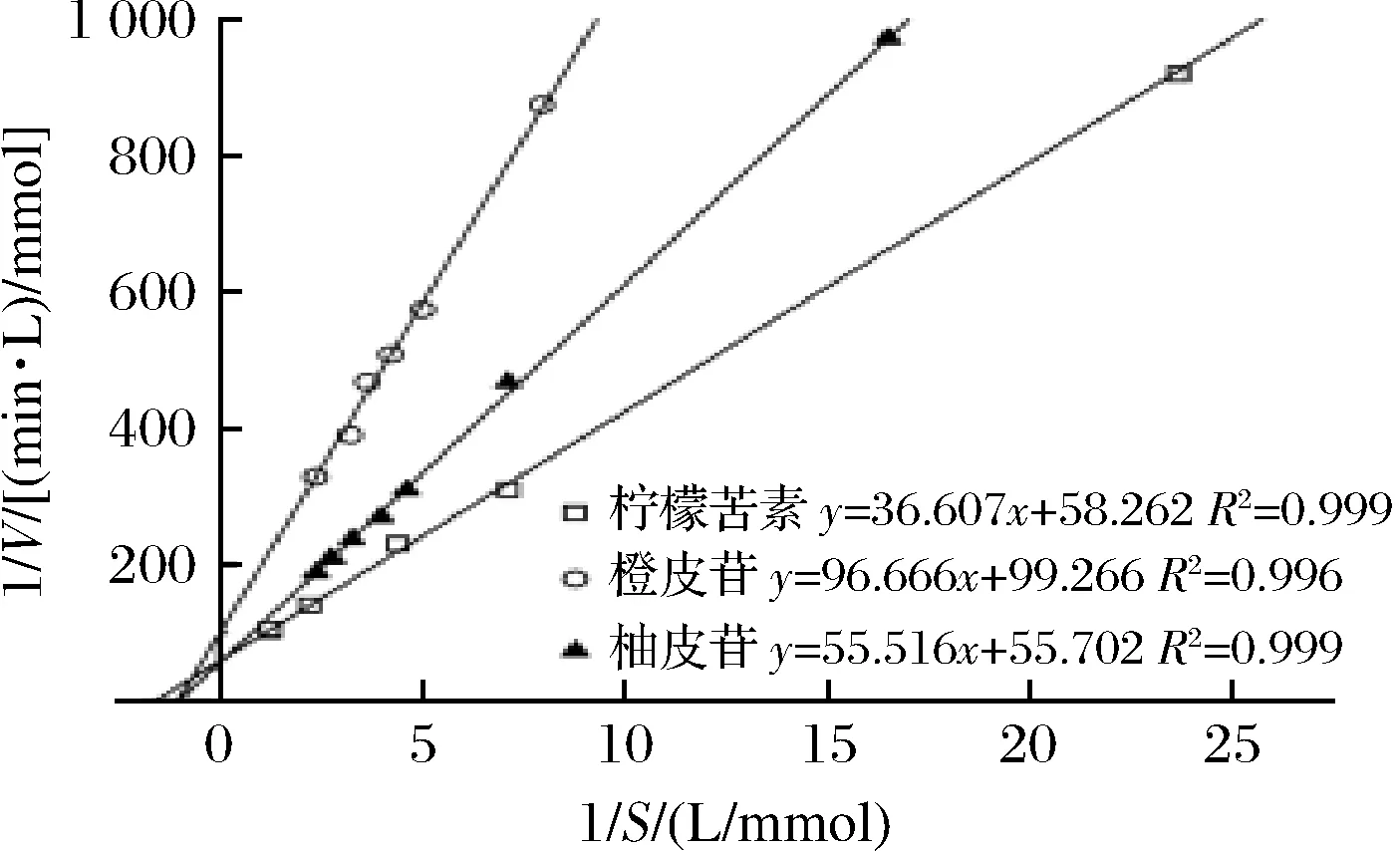
图6 柠檬苦素转化酶催化不同底物的Linewear-Burk曲线Fig.6 Linewear-Burk curves of different substrates catalyzed by limonin debitrase
实验可知,底物为柠檬苦素时,Km=0.622 mmol/L,Vmax=0.017 mmol/(L·min);底物为橙皮苷时,Km=0.967 mmol/L,Vmax=0.010 mmol/(L·min);底物为柚皮苷时,Km=0.999 mmol/L,Vmax=0.018 mmol/(L·min)。此粗酶液具有水解柠檬苦素、橙皮苷、柚皮苷的能力,且水解的动态规律符合酶促反应动力学。由Km值可知此粗酶液对底物亲和性大小为柠檬苦素>橙皮苷>柚皮苷。因此,此酶对柠檬苦素的亲和性优于柚皮苷,这可能是由于柠檬苦素在菌株生长中作为诱导物兼碳源导致的结果。
大多数脱苦酶对柚皮苷有着更高的底物亲和性[30-31]。本实验室前期研究以柚皮苷为诱导物对菌株进行发酵培养,探究酶对底物亲和性的大小,发现柚皮苷诱导后的酶对柚皮苷亲和性更高(Km=0.480 mmol/L),对柠檬苦素的底物亲和性较差(Km=91.920 mmol/L)。因此,可以推断诱导物的不同对菌株生长产酶有着很大的影响,经长期诱导和优化后的菌株对相应的诱导物的底物亲和性会更好,酶解相应的苦味物质能力更强。
3 结论
本研究采用单因素试验,确定菌株UA13发酵产柠檬苦素转化酶的最适种龄、接种量、发酵温度以及发酵液的初始pH值。在此基础上,对菌株进行了1 L 发酵罐优化试验,确定菌株更适宜在250 r/min、30 ℃、pH 5.0环境下生长,酶活力最高可达48.52 U/mL,相较于优化前提高318.3%,且缩短了发酵周期,为柠檬苦素转化酶的工业化量产奠定了基础。
通过对柠檬苦素转化酶的性质和底物亲和性进行研究,结果表明此酶可同时酶解柑橘加工中的两种苦味物质(柠檬苦素、柚皮苷),对两者的底物亲和性都较好,这是目前大多数转化酶所不具备的。同时柠檬苦素转化酶具有较好的耐热性和耐酸性,能够更好的适用于柑橘加工业,具有较好的商业价值。
