衡水湖不同生态区沉积物与上覆水水质相关性研究
2023-10-08张志强
张志强
(衡水学院生命科学系,河北 衡水 053000)
近年来,随着人类活动的加剧及气候的变化,对河流、湖泊等水环境造成了严重的影响,其中最为突出的影响就是富营养化[1]。富营养化本是河流、湖泊自然演化过程中的一种自然现象,但是因为人类活动造成大量污染物质的流入,超过了河流、湖泊自身的自净能力,从而大大地加速了富营养化的进度[2]。富营养化会造成藻类的过度繁殖、水体溶解氧下降、动植物的大量死亡。而氮和磷含量超标是水体富营养化的直接威胁因子[3]。水体中氮磷等营养物物质会沉积到水体底部,从而使沉积物成为氮磷等营养物质的储存库[4]。当沉积物受到风浪扰动、温度急剧变化或者厌氧的情况下,就会加速向水体中释放营养物质,从而对水体形成“二次污染”[5]。
目前,衡水湖的水位较浅,平均水深约为2~3m。衡水湖周边河流众多,但是没有常年注水的径流,每年只能依靠引用黄河水或者岳城水库的水向衡水湖注水。常年引水带来的大量营养物质沉积到衡水湖湖底,成为衡水湖“二次污染”的来源。一旦水位下降、水温升高、溶解氧下降等情况发生,沉积物中各种物质的含量就会造成湖水水质下降。因此,为了治理和恢复衡水湖的水生态健康,除了对外源治理,还需要考虑湖泊内源的治理。本次研究衡水湖上覆水水质因子与沉积物理化特性的相关性,对衡水湖水体保护具有重要意义。
1 研究区域概述
衡水湖位于河北省衡水市,是华北平原上第1个国家级湿地自然保护区,同时也是华北地区珍稀鸟类和湿地生物多样性保护的重要基地。衡水湖由东湖和西湖2个湖区组成,湖面面积约75km2,总库容达1.88亿m3。东湖被一条人工隔堤分为大库和小库2部分,其中大库面积32.36km2,库容9100万m3,小库面积10.14km2,库容3200万m3。衡水湖补水来源以引水为主,并以黄河水为主要来源。
2 材料与方法
2.1 采样点布设
根据衡水湖的生态分布特征,按一定规则划分网格进行采样点布设,将衡水湖划分为深水区、沉水植物区和挺水植物区。其中,沉水植物区设计2个采样点(H1、H2),挺水植物区设计3个采样点(H3、H4、H5),深水区设计4个采样点(H6、H7、H8、H9)。具体采样见图1。
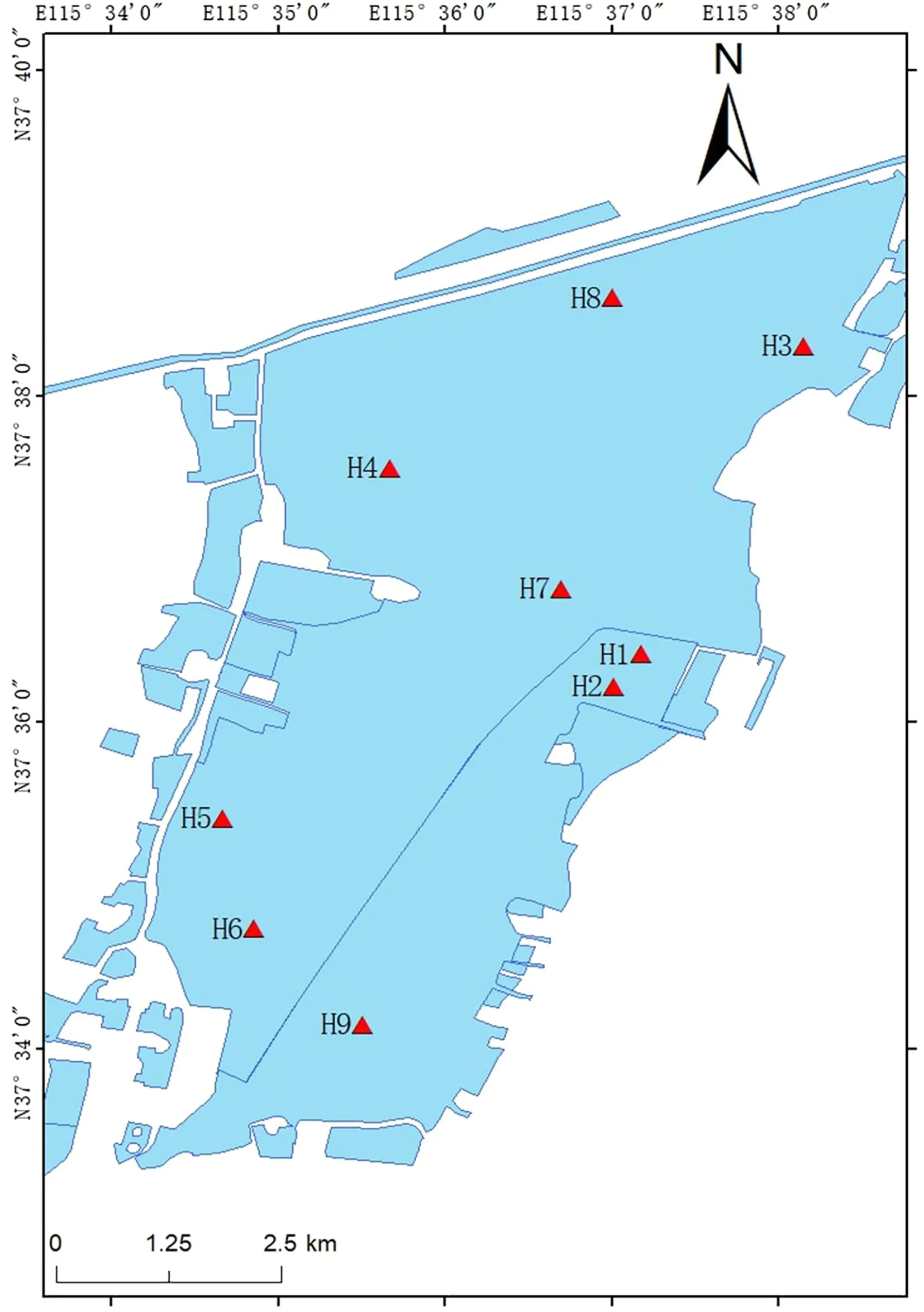
图1 衡水湖采样位点分布图
2.2 样品采集与预处理
2022年8—10月对衡水湖进行样品的采集,采集频率为每月2次。
2.2.1 水样的采集
用有机玻璃取水器在水面以下50cm处采集水样1000mL,装入提前清洗过的样品瓶中,加入硫酸,酸化至pH<2,在4℃的冰箱中保存待测。
2.2.2 沉积物的采集
选取抓斗式采泥器采取表层沉积物。样品装入干净的聚乙烯袋,排出袋中空气封口标记,保存于保温箱中,立即带回实验室。将沉积物样品运回实验室后,用冷干机进行冷干,剔除杂物,研磨过100目筛后装瓶密封,低温(4℃)保存待用。
2.3 测定指标及方法
对上覆水的水温、pH、DO、NH4+-N、TN、TP、COD、TOC等指标进行检测。其中,pH值采用玻璃电极法测定;DO采用便携式溶氧仪法测定;NH4+-N采用纳氏试剂分光法测定;TN采用碱性过硫酸钾消解紫外分光光度法测定;TP采用钼酸铵分光光度法测定;COD采用重铬酸盐滴定法测定;TOC采用燃烧氧化-非分散红外法测定。
对沉积物中pH、NH4+-N、TN、TP、TOC等指标进行检测。其中,pH值采用玻璃电极法测定;NH4+-N采用纳氏试剂分光法测定;TN采用凯氏定氮法测定;TP采用SMT法提取加钼酸铵分光光度法测定;TOC采用燃烧氧化-非分散红外法测定。
3 实验结果
3.1 上覆水水质因子测定结果
衡水湖上覆水各指标统计情况见表1。由表1可知,衡水湖pH值变化范围为7.96~8.67,平均值为8.33,水体成弱碱性;不同生态区平均pH值相差不大,排布情况表现为深水区>挺水植物区>沉水植物区。衡水湖溶解氧的变化范围为4~8.9mg·L-1,平均值为6.65mg·L-1;不同生态区的溶解氧存在一定的差异,其中,挺水植物区溶解氧平均含量最高,为7.2mg·L-1,沉水植物区溶解氧平均含量最低,为6.05mg·L-1。衡水湖总氮含量变化范围为0.73~1.79mg·L-1,平均值为1.22mg·L-1;不同生态区平均总氮含量相差不大,排布情况表现为沉水植物区>深水区>挺水植物区。衡水湖总磷含量变化范围为0.064~0.14mg·L-1,平均值为0.092mg·L-1;不同生态区的总磷含量存在一定的差异,其中沉水植物区和深水区的总磷含量明显高于挺水植物区。衡水湖TOC含量变化范围为12.64~17.92mg·L-1,平均值为14.87mg·L-1;不同生态区平均TOC含量相差不大,排布情况表现为挺水植物区>深水区>沉水植物区。衡水湖氨氮含量变化范围为0.092~0.407mg·L-1,平均值为0.196mg·L-1;其中,挺水植物区的氨氮平均含量为0.147mg·L-1,沉水植物区氨氮平均含量为0.167mg·L-1,深水区氨氮平均含量为0.241mg·L-1,深水区氨氮平均含量高于沉水植物区和挺水植物区。衡水湖COD含量变化范围为14.9~30.56mg·L-1,平均值为21.12mg·L-1;不同生态区平均COD含量相差不大,排布情况表现为沉水植物区>深水区>沉水植物区。
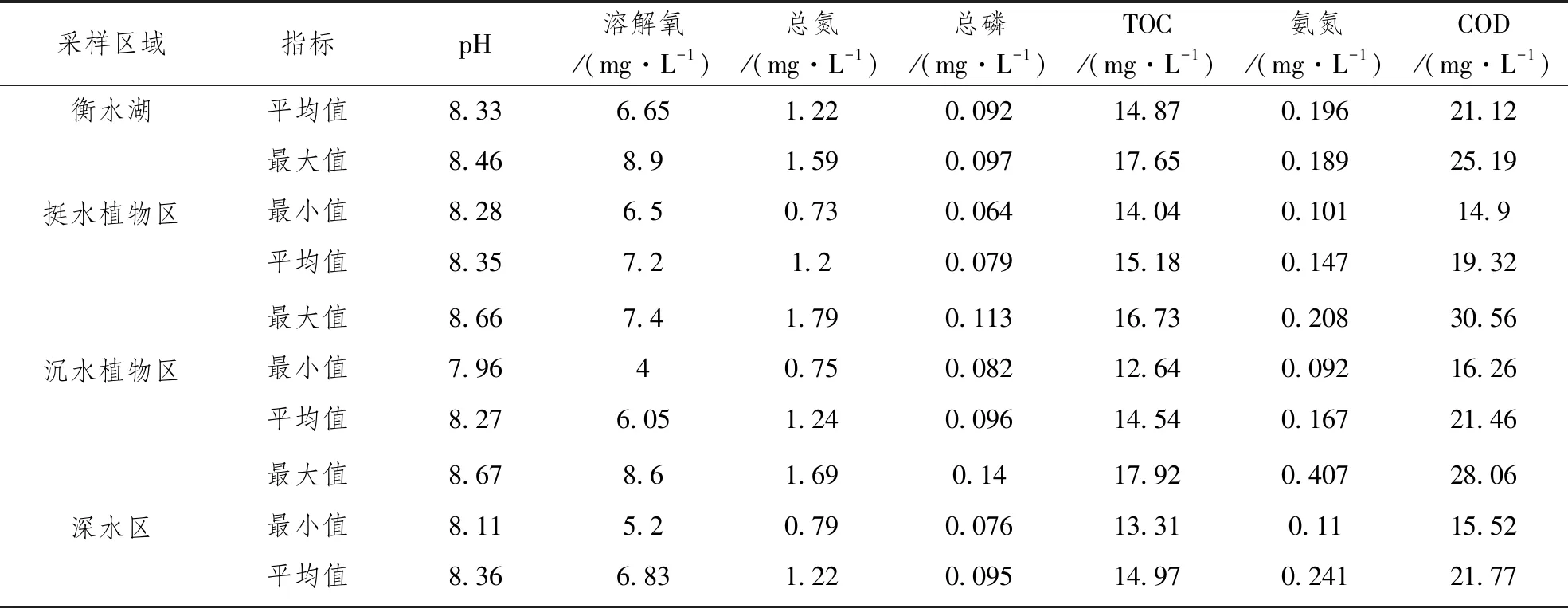
表1 衡水湖上覆水水质指标统计表
3.2 沉积物理化性质测定结果
衡水湖沉积物测定结果见表2。衡水湖沉积物pH值变化范围为7.46~7.85,平均值为7.66;其中,挺水植物区pH值为7.65,沉水植物区pH值为7.66,深水区pH值为7.67,不同生态区pH值无明显差异。衡水湖沉积物中总氮含量为443.1~2422.1mg·kg-1,总氮平均值为1345.3mg·kg-1;挺水植物区和深水区的总氮含量均高于1300mg·kg-1,而沉水植物区的总氮含量低于1000mg·kg-1。尹德超等研究发现白洋淀表层沉积物底泥层TN含量均值为2859.91mg·kg-1,与同为华北平原的白洋淀相比,衡水湖沉积物中总氮含量明显偏低[6]。相关资料显示,武汉黄家湖、贵州百花湖、大庆大通湖泊总氮平均值在800mg·kg-1左右,大通湖甚至达到1.2g·kg-1[7-9],相对来说衡水湖沉积物中总氮含量偏高。衡水湖沉积物中总磷平均含量为495.92mg·kg-1,其中,沉水植物区总磷平均含量最低,为400.2mg·kg-1,而挺水植物区和深水区总磷平均含量分别为520.9mg·kg-1和533.34mg·kg-1,两者之前差异不大。相关资料显示,长沙市梅溪湖表层沉积物中总磷含量为512.60±281.39mg·kg-1,衡水湖沉积物中总磷含量与其相差不大[10]。衡水湖沉积物中TOC含量介于9.63~21.62g·kg-1,平均含量为14.92g·kg-1;其中,挺水植物区的TOC平均含量为14.38g·kg-1,沉水植物区的TOC平均含量为17.36g·kg-1,而深水区的TOC平均含量最低,为13.9g·kg-1。衡水湖沉积物中氨氮含量介于52.2~451.2mg·kg-1,平均值为243.31mg·kg-1,不同生态区氨氮含量排序为深水区>沉水植物区>挺水植物区。
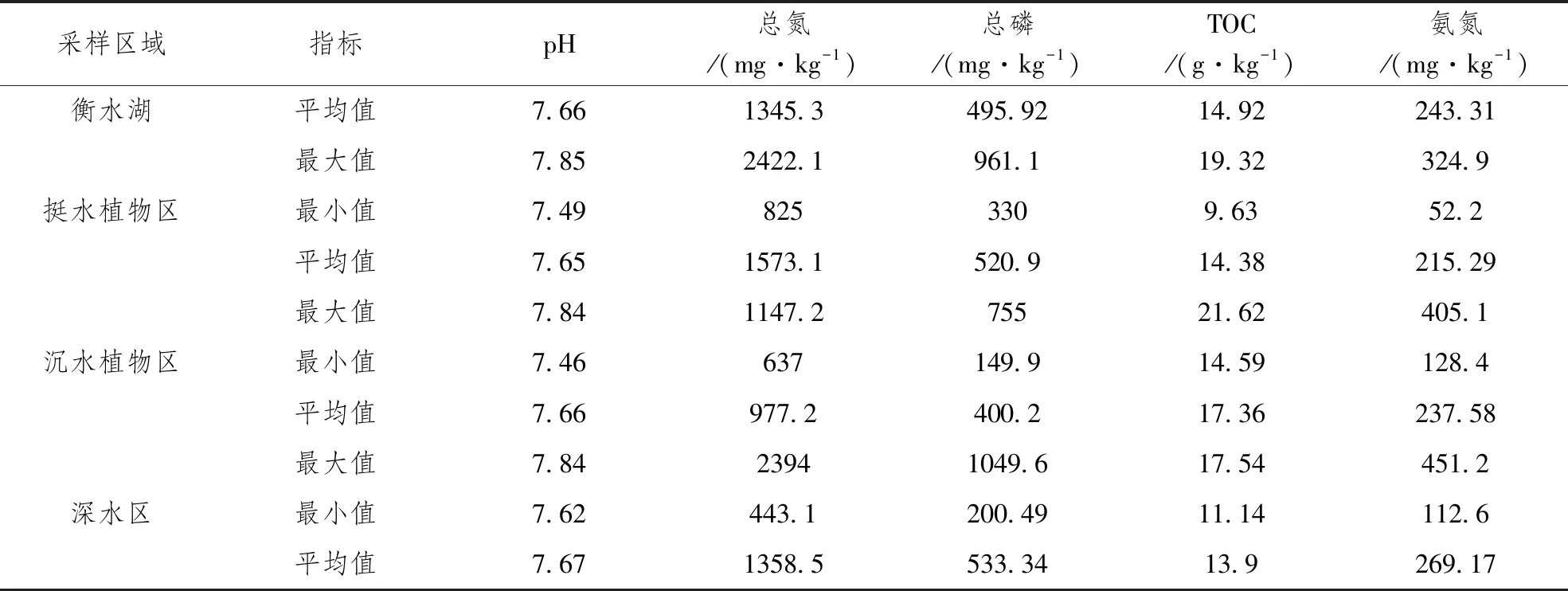
表2 衡水湖沉积物主要化学指标统计表
3.3 上覆水水质因子与沉积物理化特性相关性分析
采用Spearman相关系数法对衡水湖上覆水水质因子与沉积物理化特性进行相关性分析,计算结果用秩相关系数rs进行表示,其中rs介于-1~1,rs<0为负相关,rs>0为正相关,绝对值越大,相关性越强[11]。衡水湖上覆水水质因子与沉积物理化特性相关性分析结果见表3,由表3可知,水体总磷与沉积物总磷呈极显著正相关,水体总磷与沉积物总氮呈显著正相关;水体总氮与沉积物总氮呈极显著正相关;水体溶解氧与沉积物总氮呈极显著负相关,水体溶解氧与沉积物氨氮呈显著正相关;水体pH与沉积物pH呈极显著正相关,水体pH与沉积物氨氮呈显著正相关;水体TOC与沉积物TOC呈极显著正相关;水体氨氮与沉积物氨氮呈显著相关。衡水湖水体中溶解氧与沉积物总氮、沉积物总磷呈负相关,说明高溶解氧有利于抑制沉积物中氮、磷等营养物质的释放。衡水湖水体中总氮与沉积物中总氮呈极显著正相关,水体中总磷与沉积物中总磷呈极显著正相关,说明衡水湖沉积物中营养盐的释放成为衡水湖污染的主要来源,因此在有效控制外源的情况下,加强对内源污染的防控。
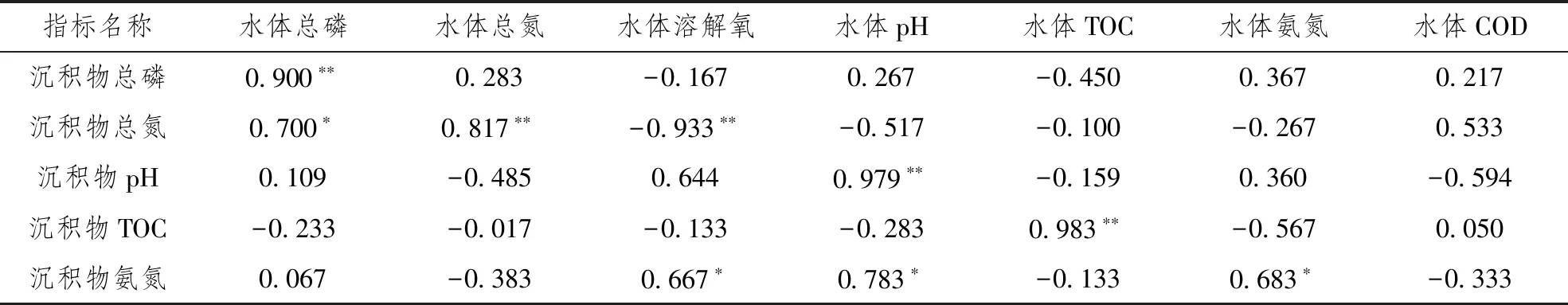
表3 衡水湖上覆水水质因子与沉积物理化特性相关性分析
4 结果与建议
对衡水湖上覆水进行检测,结果显示,衡水湖pH值变化范围为7.96~8.67;溶解氧变化范围为4~8.9mg·L-1;总氮含量变化范围为0.73~1.79mg·L-1;总磷含量变化范围为0.064~0.14mg·L-1;TOC含量变化范围为12.64~17.92mg·L-1,平均值为14.87mg·L-1;氨氮含量变化范围为0.092~0.407mg·L-1,平均值为0.196mg·L-1;COD含量变化范围为14.9~30.56mg·L-1,平均值为21.12mg·L-1。
衡水湖沉积物中pH平均值为7.66,沉积物中总氮平均值为1345.3mg·kg-1,沉积物中总磷平均含量为495.92mg·kg-1,沉积物中TOC平均含量为14.92g·kg-1,沉积物中氨氮平均值为243.31mg·kg-1。
衡水湖水体中总氮与沉积物中总氮呈极显著正相关,水体中总磷与沉积物中总磷呈极显著正相关,水体pH与沉积物pH呈极显著正相关,水体中TOC与沉积物中TOC存在极显著正相关,说明衡水湖沉积物中营养盐的释放成为衡水湖污染的主要来源,因此需加强对内源污染的防控。
