木蝴蝶苷B 对大鼠肾间质纤维化的作用及机制研究
2023-10-07李佳凌陈波
李佳凌,陈波
(西南医科大学基础医学院人体解剖与组织胚胎学系,四川泸州 646000)
肾间质纤维化是几乎所有类型慢性肾脏疾病的共同病理特征。近5年来,文献报道了多种治疗慢性肾病纤维化的抗纤靶点,其中大麻素受体-1(cannabinoid receptor 1,CB1)被认为具有较高的临床应用价值,是重要的抗纤维化靶点之一(Nastaseet al.,2018;Liu & Zhuang,2019;Prakouraet al.,2019)。Lecru 等(2015)的研究证实在慢性肾病纤维化过程中,CB1 的编码基因Cnr1是10 个最显著上调的基因之一,以CB1 为靶点的抗纤维化治疗能显示出独特的疗效。Prakoura 等(2019)指出抑制CB1 具有抗纤维化作用,这主要与抑制促炎和促纤维化细胞因子分泌、抑制氧化应激和内质网应激、抑制肌成纤维细胞增殖和细胞外基质成分产生有关。CB1 属A 类G 蛋白偶联受体家族,是人脑中表达最高的G蛋白偶联受体,在全身均有表达,以中枢神经系统中的表达水平最高(Yanget al.,2022)。CB1 存在于整个肾脏中,如传入和传出小动脉、肾小球、肾小管、Henle 环和集合管,它也在不同的肾细胞中表达,如足细胞、近端和远端肾小管上皮细胞,以及系膜细胞等(Joseph,2016)。
肾纤维化过程中,肾小管上皮细胞会向间充质表型转化,形成成纤维细胞和肌成纤维细胞,并产生细胞外基质,即上皮-间充质转化(epitheliummesen chymal transition,EMT)。EMT 的特征是上皮标志物的丧失、细胞骨架重组和间充质标志物的获得。上皮细胞标志物E 钙黏蛋白(E-cadherin)对维持上皮细胞的功能发挥了重要作用。肌成纤维细胞标志物α 平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)是间充质表型的特征性细胞骨架蛋白,随间充质表型细胞增多而增加。细胞外基质的重要蛋白——纤维连接蛋白(fibronectin,FN)的表达在纤维化早期会显著增加,并随细胞外基质增多而升高。锌指转录因子(Snail)被认为是启动和维持EMT 的重要转录因子之一,Snail 的再表达与纤维化有关,具有促进EMT 的作用。检测上述标记物可以评估EMT(Canoet al.,2000;Boutetet al.,2006;Willis & Borok,2007;Liet al.,2012;Ohnukiet al.,2012;Martiniet al.,2014;Grandeet al.,2015;Lovisaet al.,2015;Simon & Hertig,2015,2017;Chenet al.,2019)。抑制细胞中的CB1 可以减弱蛋白激酶B(Akt)信号(Linet al.,2015),而抑制Akt信号和Snail的表达能抑制纤维化(Zhuet al.,2019)。
目前针对CB1 的中药抗肾纤维化研究尚未见报道。本课题组在实验前期利用药物筛选软件Schrodinger Maestro 11.4 以CB1 为靶点对中药单体进行虚拟筛选,从中药单体数据库中评估了许多靶向CB1(PDB ID:6N4B)的中药单体小分子,其中之一是木蝴蝶苷B(oroxin B,OB)。OB 分子式C27H30O15,分子量594.52 g·mL-1,属于黄酮类单体化合物,存在于常用中药木蝴蝶中,木蝴蝶是紫葳科Bignoniaceae 木蝴蝶Oroxylum indicum的干燥成熟种子,具有广泛的药理作用,如抗氧化、抗微生物、抗炎等,能清肺利咽、疏肝和胃(国家药典委员会,2015;Rojsangaet al.,2017;胡晓茹等,2020;Fenget al.,2021)。本研究旨在探讨OB 通过抑制CB1 抗肾间质纤维化的潜在机制,为OB 的抗肾纤维化研究提供科学依据。
1 实验材料和方法
1.1 实验材料
正常人肾小管上皮(HK-2)细胞购自北京创联生物技术有限公司(编号:BNCC339833)。32 只健康成年雄性大鼠Rattus norvegicus(平均体重235 g±10 g)由西南医科大学实验动物中心提供;动物实验的相关操作均符合实验动物的管理条例,获得西南医科大学动物伦理委员会批准(编号:SWMU20210257)。
OB(MedChemExpress,USA),DMEM/F-12(1∶1)培养基(Gibco/Life Technologies,Grand Island,NY),FBS 胎牛血清(Gibco/Life Technologies,Grand Island,NY),二甲基亚砜(DMSO;Solarbio,北京),重组人转化生长因子-β1(TGF-β1;PeproTech,Rocky Hill NJ,USA),花生四烯基-2-氯乙基酰胺(ACEA;MACKLIN,上海),GAPDH 抗体(1∶30 000;Proteintech,USA),α-SMA 抗体(1∶4 000;Proteintech,USA),Snail 抗 体(1∶1 000;Cell Signaling,USA),Akt 抗 体(1∶1 000;Cell Signaling,USA),Phospho-Akt 抗体(1∶1 000;Cell Signaling,USA),Fibronectin 抗体(1∶1 000;Abcam,UK),E-cadherin抗体(1∶1 000;Abcam,UK),Kim-1 抗体(1∶1 000;SAB,USA),CB1R 抗体(1∶1 000;Abcam,UK),腺嘌呤(Ade;Sigma,USA),辣根过氧化物酶(HRP)标记的山羊抗兔或小鼠抗体(中杉金桥,北京),HRP化学发光底物(Solarbio,北京),CCK8 试剂盒(DOJINDO,Japan),BCA试剂盒(Thermo,USA),Scr和BUN 测试盒(南京建成生物,南京),HE 染色液和Masson染色液(Solarbio,北京)。
不同浓度的OB 工作液制备:按照OB 说明书先用DMSO 将OB(粉末状)溶解,再依据说明书的配制比例,用培养基将OB 溶解液稀释为所需浓度的工作液。0.75 mmol·L-1浓度的ACEA 工作液制备:按照ACEA 说明书配制比例,用培养基将ACEA 原 液 稀 释 为0.75 mmol·L-1浓 度 的 工 作 液。含10%FBS 的DMEM/F-12(1∶1)培养基配制:将DMEM/F-12(1∶1)培养基与FBS 按照10∶1 的比例进行配制。
1.2 实验仪器
ELX800 型酶标仪(Biotek,USA),PowerPac 型电泳仪和转膜仪(BioRad,USA),6000Exp型化学发光成像仪(CliNX,上海),5910R 型高速冷冻离心机(Eppendodf,Germany),恒温水浴锅(常州市金坛友联仪器研究所),MC0-18AI 型二氧化碳培养箱(Panasonic,Japan)。
1.3 细胞培养
HK-2 细胞用含10%FBS 的DMEM/F-12(1∶1)培养基培养,并放入37 ℃含有5%的CO2培养箱中。细胞培养至对数生长期后备用。
1.4 CCK-8试剂盒检测细胞活力
将HK-2 细胞以5 000 个/孔接种在96 孔板中,分为正常对照组(添加培养基)、浓度梯度组(添加稀释浓度分别为0 µmol·L-1、6.25 µmol·L-1、12.5 µmol·L-1、25 µmol·L-1、50 µmol·L-1、100 µmol·L-1、200 µmol·L-1、400 µmol·L-1的OB 工作液,每组4 个重复孔。根据CCK8 试剂盒说明书检测各组细胞在实验12 h、24 h、48 h时的细胞活力。
1.5 OB 抗TGF-β1 诱导HK-2 细胞纤维化的浓度测定
将HK-2细胞(2×105)接种于6 cm培养皿中,随机分为正常对照组(添加培养基)、TGF-β1组(模型组)、TGF-β1+DMSO 组和TGF-β1+OB 梯度浓度(100 µmol·L-1、50 µmol·L-1、25 µmol·L-1、12.5 µmol·L-1、6.25 µmol·L-1)组。TGF-β1组使用15 ng·mL-1TGF-β1诱导48 h 建立纤维化模型;TGF-β1+DMSO 组使用TGF-β1 组添加1 mL·L-1DMSO 干预24 h;TGF-β1+OB 梯度浓度组使用TGF-β1 组添加浓度分别为100 µmol·L-1、50 µmol·L-1、25 µmol·L-1、12.5 µmol·L-1和6.25 µmol·L-1的OB 工作液干预24 h。根据BCA试剂盒说明书对各组细胞总蛋白浓度进行定量分析。为测定OB 抗TGF-β1 诱导HK-2 细胞纤维化的浓度,Western Blotting 检测各组细胞CB1、α-SMA、FN、E-cadherin蛋白的表达。
1.6 OB 抗TGF-β1 诱导HK-2 细胞纤维化的时间测定和AKT信号、EMT的变化监测
将HK-2细胞(2×105)接种于6 cm培养皿中,随机分为正常对照组(添加培养基)、DMSO组、TGF-β1组(模型组)、TGF-β1+OB 不同时间(12 h、24 h)组。DMSO 组为正常组添加1 mL·L-1DMSO 干预48 h;TGF-β1 组使用15 ng·mL-1TGF-β1 诱导48 h 建立纤维化模型;根据步骤1.5 确认OB 抗HK-2 纤维化的最佳浓度为25 µmol·L-1,故TGF-β1+OB 不同时间(12 h、24 h)组使用TGF-β1组添加25 µmol·L-1OB工作液分别干预12 h 和24 h。根据BCA试剂盒说明书对各组细胞总蛋白浓度进行定量分析。Western Blotting检测各组细胞CB1、α-SMA、FN、E-cadherin、P-Akt、Akt、Snail蛋白的表达,测定OB抗TGF-β1诱导HK-2 细胞纤维化的时间和监测AKT 信号、EMT的变化。
将HK-2细胞(2×105)接种于6 cm培养皿中,随机分为正常对照组(添加培养基)、TGF-β1组(模型组)、TGF-β1+ACEA组和TGF-β1+OB组。TGF-β1组使用15 ng·mL-1TGF-β1 诱导HK-2 细胞48 h 建立纤 维 化 模 型;TGF-β1+ACEA 组先用0.75 mmol·L-1CB1激动剂ACEA 干预1 h,再用TGF-β1诱导48 h;TGF-β1+OB 组使用TGF-β1 组添加25 µmol·L-1OB工作液干预24 h。根据BCA 试剂盒说明书对各组细胞总蛋白浓度进行定量分析。为监测由CB1 引起的AKT 信号改变和EMT 变化,Western Blotting检测各组细胞CB1、P-Akt、Akt、Snail、α-SMA、FN、E-cadherin蛋白的表达。
1.7 腺嘌呤构建大鼠肾间质纤维化模型和OB给药
32 只大鼠饲养于24 °C、50%相对湿度、无特定病原体的环境下,进行12 h 光/暗循环。随机分为正常对照组、Ade 肾病组(模型组)、Ade+低剂量OB 组(Ade+OBL 组)、Ade+高剂量OB 组(Ade+OBH 组),每组8 只。除正常对照组灌胃等量生理盐水,其余3组均以150 mg·kg-1Ade灌胃建立肾间质纤维化模型,每日灌胃1 次,连续25 d。模型建立后,Ade+OBL组和Ade+OBH组分别用5.0 mg·kg-1和20.0 mg·kg-1OB 灌胃。正常对照组和Ade 肾病组灌胃等量生理盐水,每日灌胃1次,连续14 d。
1.8 血清肌酐(Scr)和血尿素氮(BUN)检测
在灌胃前1 天、灌胃的第25天和灌胃的第39天(即OB 灌胃的第14 天),32只大鼠禁食不禁水12 h,分3 次抽尾静脉血1 mL,按照Scr 和BUN 测试盒说明书检测各组大鼠的Scr和BUN 水平,并监测各组大鼠肾功能的变化。
1.9 组织学分析
第3次血样采集完成后,32只大鼠逐一进行麻醉,每只大鼠均取双侧肾脏制作组织切片,采完肾组织随即处死大鼠。用HE 和Masson 三色对切片(4.5 µm)进行染色,并通过显微镜观察:通过HE染色评估肾损伤,按Tang 等(2021)报告的盲评法进行评分,即根据肾小管坏死、管型形成和肾小管扩张的分级进行损伤评估;通过Masson 染色评估胶原沉积,使用Image Pro Plus 6.0(Media Cybernetics,Silver Spring,USA)在每只大鼠的5~10 个等效皮质HPF(200×)中进行胶原沉积量化或胶原沉积面积评分。
1.10 Western Blotting检测大鼠肾组织蛋白
肾脏采集完成后,将32 只大鼠的双肾沿其长轴纵切分为前后2 部分,双肾前部均用于切片制作,双肾后部均用于组织总蛋白提取。组织总蛋白提取后进行低温离心,10 000 r·min-115 min。按照BCA 试剂盒说明书对肾组织总蛋白浓度进行定量。Western Blotting 检测:将蛋白质样本加载到10%SDS-PAGE 凝胶中,再转移到PVDF 膜上。用5%脱脂乳封闭膜后,使用以下抗体:GAPDH 抗体,α-SMA 抗体,Snail 抗体,Akt 抗体,Phospho-Akt 抗体,Fibronectin 抗体,E-cadherin 抗体,CB1R 抗体孵育膜,4 ℃过夜。用辣根过氧化物酶(HRP)偶联的山羊抗兔或小鼠抗体孵育膜2 h,再让膜与HRP化学发光底物反应。使用化学发光成像仪显示蛋白条带,并用ImageJ对蛋白条带进行定量分析。
1.11 统计学方法
所有数据用xˉ±SD 表示,每个实验均经过3 次及以上的重复。应用GraphPad Prism 8.0 进行方差齐性分析后进行单因素或双因素方差分析,事后检验采用Turkey 法比较组间差异。P<0.05 表示组间具有统计学差异。
2 结果
2.1 OB对HK-2细胞增殖的影响
CCK8 结果显示,HK-2 细胞存活率随OB 浓度和时间的增加而降低。OB 浓度≤12.5 µmol·L-1时,12 h、24 h、48 h 组的细胞存活率均在90%以上(P<0.05);与正常对照组相比,50 µmol·L-1浓度OB干预细 胞12 h 及以上 或25 µmol·L-1浓度OB 干预细胞48 h,细胞存活率明显降低(P<0.05);当OB 浓度>100 µmol·L-1时,24 h、48 h 的细胞存活率急剧下降(P<0.05)(图1)。
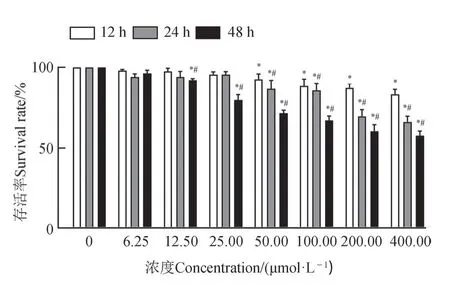
图1 不同浓度OB处理HK-2细胞后的存活率(n=4)Fig. 1 Survival rate of HK-2 cells after the treatment of OD at different concentrations (n=4)
2.2 OB对TGF-β1诱导HK-2细胞纤维化的影响
2.2.1 不同浓度OB 对HK-2 细胞纤维化的影响与正常对照组相比,模型组(TGF-β1组)中α-SMA、FN 蛋白的表 达显著增加,CB1R、E-cadherin 蛋白的表达显著减少(P<0.05)。与模型组相比,TGF-β1+OB(6.25 µmol·L-1)组 和TGF-β1+OB(12.5 µmol·L-1)组中CB1R 蛋白的表达显著减少(P<0.05),但α-SMA、E-cadherin 和FN 蛋白的表达未见显著变化。TGF-β1+OB(≥25 µmol·L-1)组中CB1R蛋白的表达呈梯度下降趋势,其中,TGF-β1+OB(25 µmol·L-1)组的下降趋势最多,且与模型组相比,FN 蛋白的表达显著减少,E-cadherin 蛋白的表达显著增加(P<0.05)(图2)。
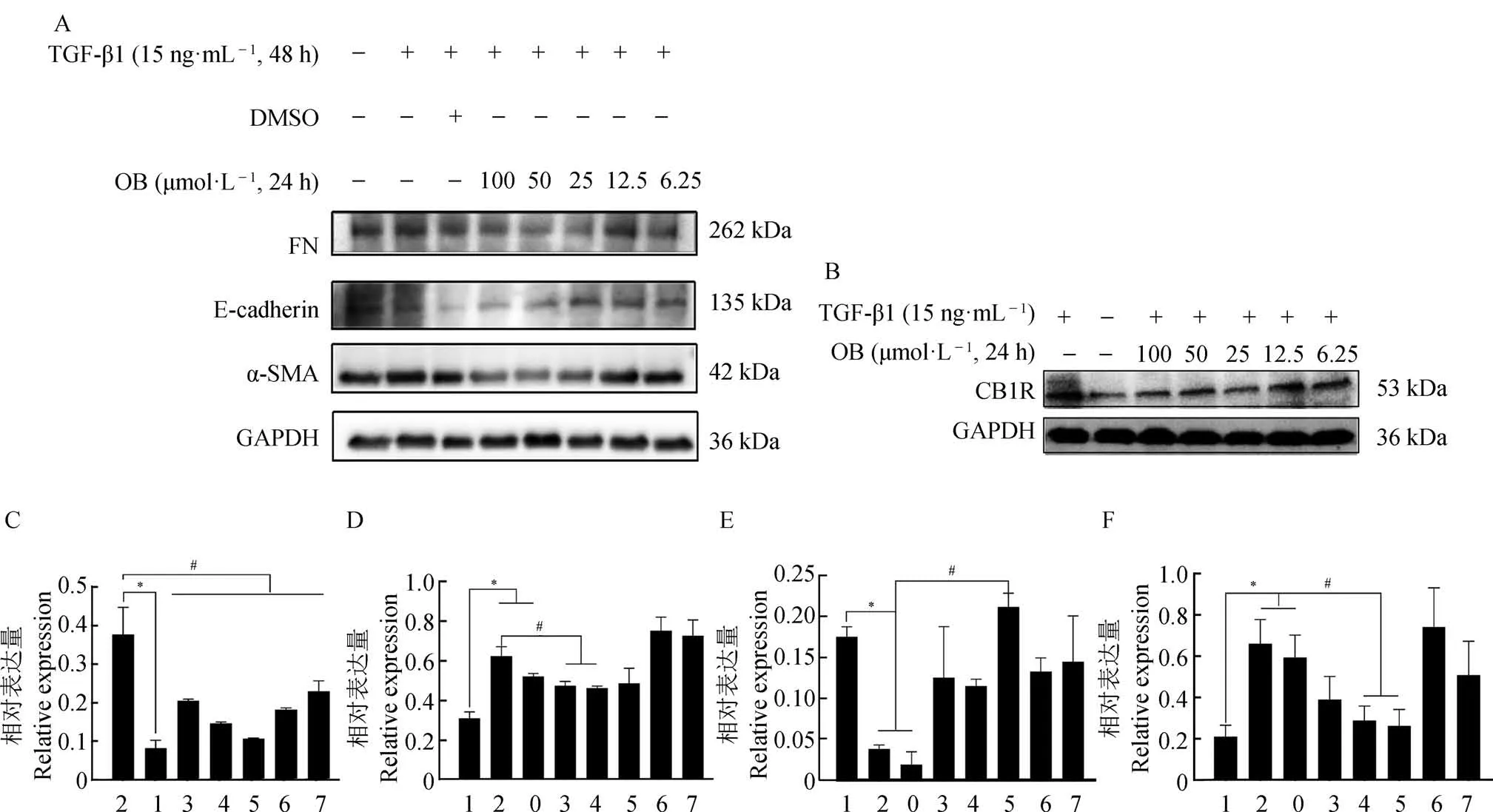
图2 OB对TGF-β1诱导HK-2细胞纤维化中相关蛋白表达的影响(n=3)Fig. 2 Effect of OB on the expression of related proteins in HK-2 cell fibrosis induced by TGF-β1 (n=3)
2.2.2 不同时间的OB(25 µmol·L-1)对HK-2 细胞纤维化的影响与正常对照组和DMSO 组相比,模型组(TGF-β1 组)中CB1R、α-SMA 和FN 蛋白的表达显著增加,E-cadherin 蛋白的表达显著减少(P<0.05)。与模型组相比,TGF-β1+OB(25 µmol·L-1,12 h)组和TGF-β1+OB(25 µmol·L-1,24 h)组 的CB1R、α-SMA、FN 蛋白表达显著减少,E-cadherin蛋白的表达显著增加,随着时间的延长,CB1R、α-SMA、FN 蛋白的表达进一步减少,而E-cadherin蛋白的表达显著增加(P<0.05)(图3:B,F,G,H)。
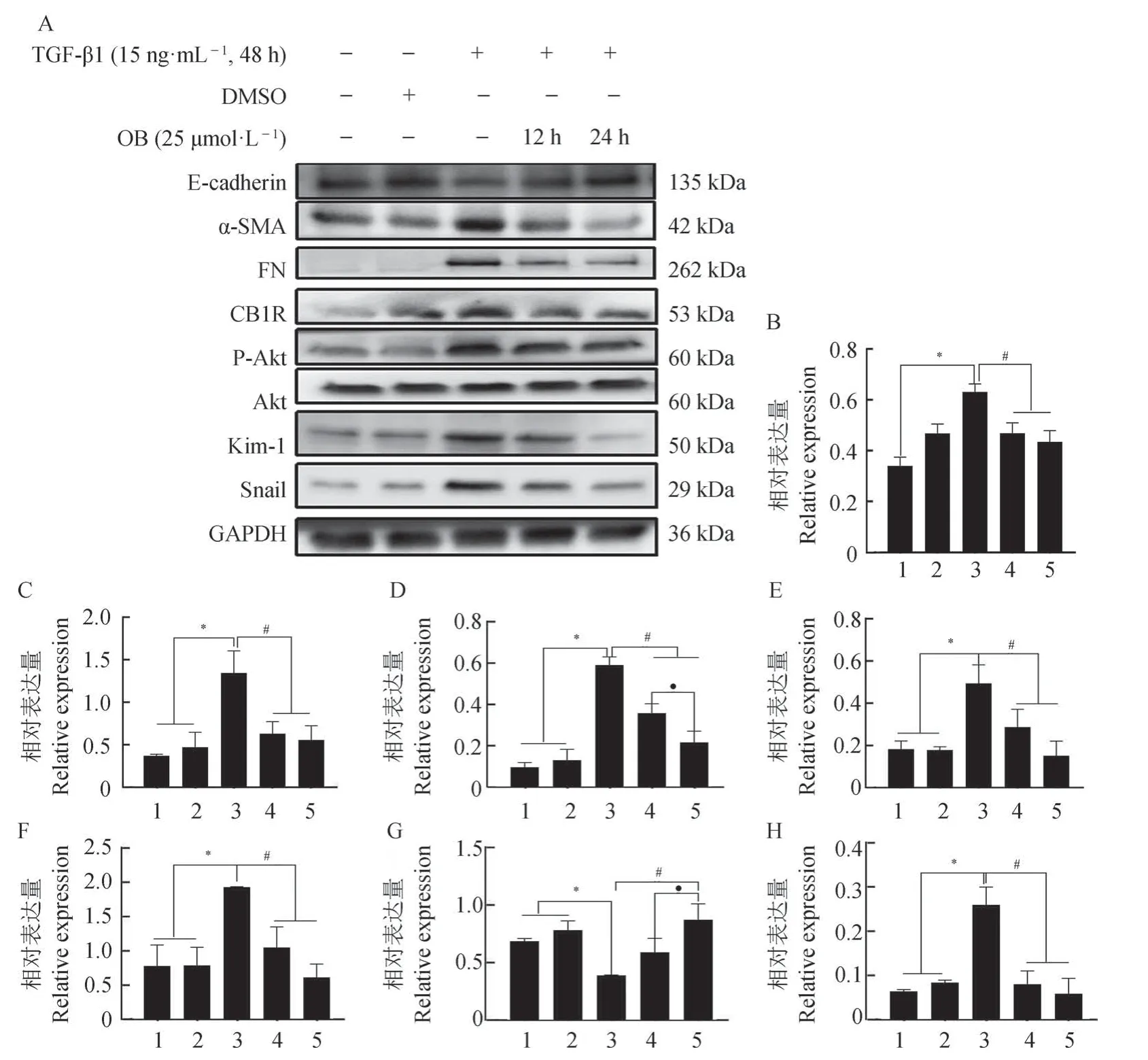
图3 OB对TGF-β1诱导HK-2细胞纤维化中的Akt/Snail信号通路的影响(n=3)Fig. 3 Effect of OB on the Akt/Snail signal pathway in HK-2 cell fibrosis induced by TGF-β1 (n=3)
2.3 OB 对HK-2 细胞CB1/Akt/Snail 信号通路和EMT的影响
与正常对照组和DMSO 组相比,模型组的P-Akt/Akt 显著上升,Snail 蛋白的表达显著增加(P<0.05)。与模型组相比,TGF-β1+OB(25 µmol·L-1,12 h)组和TGF-β1+OB(25 µmol·L-1,24 h)组的P-Akt/Akt 显著下降,Snail 蛋白的表达显著减少(P<0.05),且Snail 蛋白的表达随OB 干预时间的增加而减少,且差异显著(P<0.05)(图3:C,D)。与模型组相比,TGF-β1+ACEA 组中CB1R、α-SMA、FN、Snail 蛋白的表达和P-Akt/Akt 显著增加,E-cadherin 蛋白的表达显著减少(P<0.05);而与TGF-β1+ACEA 组相比,TGF-β1+OB 组中CB1R、α-SMA、FN、Snail蛋白的表达和P-Akt/Akt显著减少,E-cadherin蛋白的表达显著增加(P<0.05)(图4)。

图4 OB对HK-2细胞CB1/Akt/Snail信号通路及EMT的影响(n=3)Fig. 4 Effects of OB on the CB1/Akt/Snail signal pathway and EMT-related proteins (n=3)
2.4 OB 对肾间质纤维化大鼠肾功能和肾脏病理的影响
Ade 诱导的大鼠肾间质纤维化模型建立25 d时,Ade 肾 病 组、Ade+OBL 组、Ade+OBH 组Scr、BUN 浓度较正常对照组均显著升高(P<0.05)。与Ade 肾 病组 相比,OB 干 预14 d 后,Ade+OBL 组、Ade+OBH 组Scr、BUN 浓度均不同程度降低,且差异显著(P<0.05)(图5:A,B)。
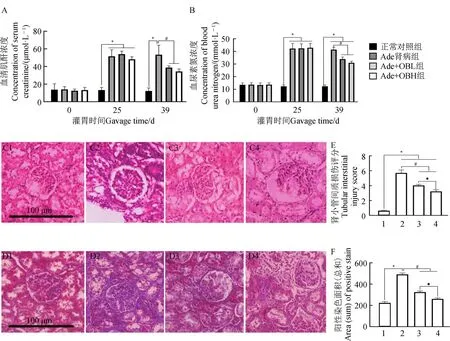
图5 OB对肾间质纤维化大鼠肾功能和肾脏病理的影响(n=8)Fig. 5 Effect of OB on renal function and renal pathology in rats with renal interstitial fibrosis(n=8)
Ade 肾病组的肾小管上皮细胞明显脱落,部分管腔扩张,炎性细胞浸润间质,胶原成分增加。Ade+OBL组、Ade+OBH 组肾脏病理损伤、胶原沉积较Ade 肾病组均有不同程度的改善,Ade+OBH 组改善程度明显更优(图5:C,D)。
2.5 OB 对大鼠肾组织CB1/Akt/Snail 信号通路和EMT的影响
与正常对照组相比,模型组(Ade 肾病组)中α-SMA、FN、Snail、CB1R 蛋白的表达明显增加,P-Akt/Akt 明显上升,E-cadherin 蛋白的表达显著减少(P<0.05)。与模型组相比,Ade+OBH 组α-SMA、Snail、CB1R 蛋白的表达显著减少,P-Akt/Akt 显著下降,而E-cadherin 蛋白的表达显著增加(P<0.05);Ade+OBL 组仅CB1R 蛋白的表达显著减少(P<0.05),而Snail、FN、α-SMA、E-cadherin 蛋白的表达和P-Akt/Akt未见变化(图6)。
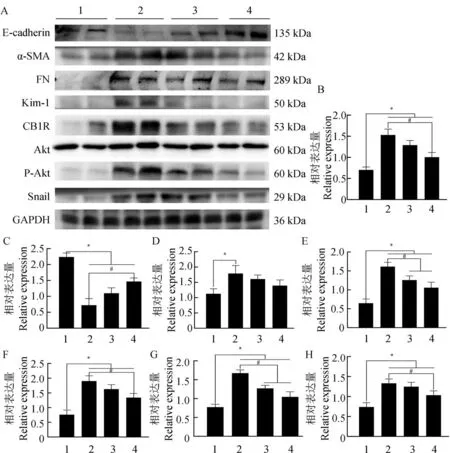
图6 OB对大鼠肾组织CB1R/Akt/Snail信号通路和EMT的影响(n=8)Fig. 6 Effects of OB on the CB1R/Akt/Snail signal pathway and EMT in rats with renal interstitial fibrosis(n=8)
3 讨论
靶向药物治疗肾间质纤维化是纤维化研究的方向之一。CB1受体被临床视为重要的抗纤靶点,其信号传导能促进氧化应激和炎症、导致细胞凋亡和纤维化(Baruttaet al.,2018)。特别是在肾小管上皮细胞、足细胞和间质肌成纤维细胞中,CB1的药理学阻断或抑制能降低肾纤维化的发生,具有保护肾脏的作用(Lecruet al.,2015;Daoet al.,2019)。
本课题组前期以CB1 为靶点,利用计算机虚拟筛选分子对接,从中药单体数据库中获得了100 个中药单体小分子,并选择目前尚未用于抗纤研究的OB 进行实验。本研究的体外实验结果显示,CB1 激动剂ACEA 对纤维化HK-2 细胞起着积极的促纤作用,ACEA 增加了纤维化HK-2 细胞CB1、Snail、α-SMA、FN 蛋白的表达和P-Akt/Akt,减少了E-cadherin 蛋白的表达(P<0.05);而OB 降低了纤维化HK-2 细胞CB1、Snail、α-SMA、FN 蛋白的表达和P-Akt/Akt,增加了E-cadherin 蛋白的表达(P<0.05)。说明OB 可以通过抑制HK-2 细胞的CB1 蛋白表达,从而抑制Akt/Snail信号传导、EMT,进而抑制TGF-β1 诱导的纤维化。Lin 等(2015)指出通过抑制心肌成纤维细胞的CB1 蛋白表达来减弱Akt信号,抑制心脏纤维化;Zhu等(2019)的研究证实,通过抑制人脐静脉内皮细胞的Akt 信号和Snail 蛋白的表达能抑制内皮-间充质转化和纤维化。这与本研究的体外实验结论基本一致:通过抑制肾小管上皮细胞(HK-2)的CB1 蛋白表达可以抑制Akt 信号和Snail 蛋白的表达,从而抑制EMT,进而抑制纤维化。
本研究体内实验结果显示,高剂量和低剂量的OB 均能改善间质纤维化大鼠的肾功能和肾脏病理情况,并抑制其肾组织中的CB1 蛋白表达;且高剂量的OB 能下调纤维化大鼠肾组织中的Snail和α-SMA 蛋白表达,并上调E-cadherin 蛋白的表达,降低P-Akt/Akt。说明OB 能通过抑制大鼠肾组织中的CB1,抑制Akt/Snail信号传导、抑制EMT,进而抑制大鼠肾间质纤维化。这与本研究的体外实验结论基本一致:OB 能通过抑制肾脏的CB1 抑制Akt 信号和Snail 蛋白的表达,从而抑制EMT,进而抑制纤维化。但OB 抗肾间质纤维化是否还通过其他途径发挥作用,尚需进一步研究阐明。
中药单体OB 能通过抑制肾组织中CB1/Akt/Snail 信号传导,从而抑制EMT,进而抑制大鼠肾间质纤维化。OB的抗肾纤维化能力及机制研究为靶向CB1的OB抗慢性肾病纤维化提供了科学依据。
