基于中职化学学科核心素养的课堂教学研究
2023-10-06苏李婕
苏李婕

本文以中职化学“氧化还原反应”为例,阐述了基于中职化学学科核心素养的课例研究和教学内容设计。以氧化还原反应概念的发展为主线,围绕“得氧失氧—化合价升降—电子转移”等重点内容,深挖学科核心素养内涵与教学内容的联系,注重知识体系的构建,整合宏观元素反应与微观电子变化之间关系,力求培养学生的化学学科核心素养,帮助学生在学习氧化还原反应的过程中养成发现、分析、解决相关问题的能力
1 对中职化学学科核心素养在课堂教学中的思考
化学是一门在原子、分子水平上研究物质的组成、结构、性质、转化及其应用的一门基础学科,是现代科技发展的重要基础。对于中等职业学校学生来说,通过学习化学基础知识、基本技能和基本方法,认识物质变化规律,养成发现、分析、解决化学相关问题的能力,提升化学学科核心素养,对其个人素质有着重要的基础作用。学生在获得化学相关知识技能的过程中,更重要的是培养精益求精的工匠精神、严谨求实的科学态度、勇于开拓的创新意识,引领学生逐步形成正确的世界观、人生观和价值观,使学生成为德智体美劳全面发展的高素质劳动者和技术技能人才。
为落实立德树人根本任务,充分挖掘课程的独特育人价值,教育部在2020年发布的《中等职业学校化学课程标准》中提出了中等职业学校化学学科的核心素养,包括宏观辨识与微观探析、变化观念与平衡思想、现象观察与规律认知、实验探究与创新意识、科学态度与社会责任。基于这五个要素,教师需要分析教学内容与学科核心素养的联系,深挖教学内容的育人价值,运用恰当的教学策略,创设合适的教学情境,设计切实的探究活动,才能将学科核心素养落到实处,实现学科育人价值。
结合化学学科的知识特点,为了实现中职化学学科的育人价值,在以中职化学学科核心素养为基础的课堂教学中,学生需要对基础知识以“宏观—微观”为基础、以“结构—性质”为主线建立认知,基于已有的知识和认知经验进行探究并得出结论,获得化学知识,从而了解化学对社会发展和人类生产、生活的重大贡献,以及化学对其所在专业的意义。然而以中职学生的文化基础,要实现这一学习过程有一定的难度。
从宏观角度辨识物质较为立体,学生接受较易,但化学学科的重要特征恰是从原子、分子水平上研究物质,因此更重要的是要求学生从微观结构差异中认识物质,形成“结构决定性质,性质反映结构”的观念;对现象的观察较为直观,学生相对比较容易掌握,然而学习化学更重要的是透过现象看本质,探索现象背后的原因,认识化学反应的规律,利用规律分析和解决实际问题;除了学习课本中的内容,还要将知识迁移到专业相关的实际运用中,培养学生的科学态度和社会责任意识。
为满足这一系列核心素养要求,教师需要进一步理解中职化学学科核心素养的概念内涵,将相关教学内容深植于学科核心素养,以中职化学学科核心素养为基础构建知识体系,使学生在学习知识的同时树立科学态度,提升社会责任感,将“以人为本”的教育理念落到实处。本文以中职药品检验专业中“氧化还原反应”的课堂教学为例,紧密围绕中等职业学校化学课程标准,介绍基于中职化学学科核心素养的教学内容设计。
2 深入分析学情,把握教学重点
2.1 教材分析
氧化还原反应是中职学校化学课程中基础模块“化学反应及其规律”中的内容,教材使用的是中国医药科技出版社于2020年12月出版的《药用化学基础(一)——无机化学》第三版,内容选自第四章《探索化学反应的基本规律》第三节《氧化还原反应》。课本中主要以得氧、失氧—化合价升降—电子转移为主线,从宏观层面的元素逐渐过渡到微观层面的电子,引导学生逐步构建氧化还原反应的概念,为后续学习检验相关基础化学反应奠定基础,同时将氧化还原反应的学习与药品检验专业相联系,让学生认识到化学的实用意义。
2.2 教学目标
(1)知识与技能
了解氧化反应、还原反应和氧化还原反应的概念,认识有化合价变化的反应是氧化还原反应,了解氧化还原反应的本质是原子间电子的转移,知道常见的氧化剂和还原剂。
(2)过程与方法
采用创设情境、设疑引导、自主探究等多种教学方法,运用多媒体、信息化工具等方式辅助教学,培养学生的学习主动性以及发现问题、分析疑点、归纳线索、解决问题的能力。
(3)情感态度与价值观
培养学生对“微观结构决定宏观性质,宏观性质源于微观结构”的理解;通过创设问题情境、自主探究,引导学生积极思考,激发学生的学习兴趣和求知欲;让学生认识到化学知识在专业学习和生活中的应用。
2.3 教学重难点
(1)教学重点
理解氧化还原反应的标志是化合价升降,实质是发生电子转移。
(2)教学难点
理解氧化还原反应的实质是电子转移。
2.4 学情分析
中職药品检验专业一年级学生在初中阶段对氧化反应、还原反应有了初步认识,简单了解到“物质与氧发生的反应属于氧化反应”“含氧化合物里的氧被夺去的反应叫作还原反应”,虽然浅显却也为进一步学习氧化还原反应奠定了一些基础。但中职一年级学生普遍存在基础薄弱、理解能力有限等情况,同时本节课内容的理论概念较多,较为抽象。基于以上,在教学设计中,需立足基础,引导学生思考,逐步调动学生积极性,提高学生参与程度,以学生为课堂主体,与学生职业发展相结合,激发学习兴趣。
2.5 教学方法分析
氧化还原反应的概念较为抽象,为了将抽象概念具体化,教师应从学生的实际出发,创设情境,引入生活中关于氧化还原反应的实例,让学生首先能够在实际生活中感知氧化还原反应的概念。
基于学科核心素养中的“现象观察与规律认识”,引导学生认识到氧化还原反应前后化合价发生变化这一现象,发现氧化还原反应与化合价的变化存在一定规律,以此得出氧化还原反应的标志这一重要知识点。
基于学科核心素养中的“实验探究与创新意识”,在课堂教学中提出四种基本反应类型是否为氧化还原反应这一问題,开设自主探究环节,培养学生分析、推理、归纳、总结等能力。
基于学科核心素养中的“宏观辨识与微观探析”,进一步探析氧化还原反应的本质。可以从化学反应过程中元素化合价变化这一宏观规律入手,借助化合价的意义,逐步过渡到电子转移的微观实质,揭示反应的宏观现象和微观结构本质及其相互关系——氧化还原反应的本质是原子间电子的转移。
基于学科核心素养中的“科学态度与社会责任”,在掌握氧化还原反应的标志及本质后,为了使学生对氧化还原反应的实际意义有更充分的认识,将本专业相关内容与氧化还原反应联系,鼓励学生思考药物中抗氧化剂的反应原理,构建完整的知识体系。
通过联系教学内容与学科核心素养内涵,将中职化学学科核心素养融入课堂教学中,既有助于丰富课堂内容、生动课堂形式,更是旨在促进学生形成正确的价值观念、必备品格和关键能力。
3 “氧化还原反应”的教学过程
3.1 课前预习
课前布置学习任务,要求学生复习该课本第一章所讲的原子结构和初中所学的化合价,预习本节课氧化还原反应的内容。
3.2 课堂教学
课堂教学过程包括每个环节,含2学时,80分钟。
(1)创设情境,引入新课
通过生活中常见的燃烧、铁锈、变质的图片启发学生思考。提出疑问:这些化学反应都需要氧气参与,究竟发生了什么反应?
由此设疑引出初中阶段学习过的“物质与氧发生的反应,属于氧化反应”“含氧化合物里的氧被夺去的反应,叫作还原反应”。例如:
这两个反应中有元素得到氧的同时,也有元素在失去氧,说明氧化反应与还原反应是在同一个反应中发生的,这样的反应我们称为氧化还原反应,由此引出新课。
(2)讲解知识点1:“氧化还原反应的标志”
氧化还原反应不仅仅是简单的得氧或失氧,还存在更具代表性的标志。为活跃课堂教学气氛,使学生化被动接受为主动学习,提出问题:氧化还原反应还具有哪些特征呢?
结合初中阶段已学过的元素价态,学生观察并标出氧化还原反应中反应物与生成物的元素化合价,培养学生化学学科核心素养的现象观察和规律认知,在教师的引导下发现规律。例如在下面第一个反应中可以发现,氢气在发生氧化反应(得氧)的同时,化合价从0变化到+1升高;氧化铜在发生还原反应(失氧)的同时,化合价从+2变化到0降低。同样的,在下面第二个反应中,一氧化碳在发生氧化反应(得氧)的同时,化合价从+2变化到+4升高;氧化铁在发生还原反应(失氧)的同时,化合价从+3变化到0降低。
通过观察以上现象,结合大量反应事实,学生可以发现规律,得出结论:物质在发生氧化反应时,元素化合价升高;物质在发生还原反应时,元素化合价降低。这样,当反应没有氧的参与时,也可以通过化合价的升高或降低来判断反应是否为氧化还原反应。例如下列反应中,反应前后钠元素化合价升高,则可以判断其发生了氧化反应;氯元素化合价降低,则发生了还原反应。由此归纳出氧化还原反应的标志——反应前后有元素化合价发生变化的化学反应就是氧化还原反应。
在该教学环节中引导学生观察发生氧化反应和还原反应的元素化合价变化这一现象,使学生认识到氧化还原反应的标志就是反应前后元素化合价升高或降低这一规律,实现了中职化学学科核心素养中“现象观察与规律认知”的统一。
(3)学以致用,自主探究
为培养学生的实验探究与创新意识学科核心素养,设置自主探究环节。在学生能够判断氧化还原反应的情况下,布置课堂任务:探究四种基本反应类型(化合反应、分解反应、置换反应、复分解反应)是否为氧化还原反应。
根据氧化还原反应的标志,借助四种反应的化学方程式帮助学生进行探究。学生通过观察反应前后化合价是否有变化,可以发现:化合反应与分解反应,反应前后化合价不一定变化,因此可能是氧化还原反应,也可能不是;置换反应前后化合价一定发生变化,故一定是氧化还原反应;复分解反应前后化合价不发生变化,一定不是氧化还原反应。
学生将以上结论用直观的图形来表示,分组讨论后将图示画出并借助信息化工具——微信群,分别将图示上传到班级群,供全班讨论,以此来强化学生对知识的理解与掌握,培养学生的思维能力与自主探究能力。
图1 四种基本反应类型与氧化还原反应的关系
(4)讲解知识点2:“氧化还原反应的实质”
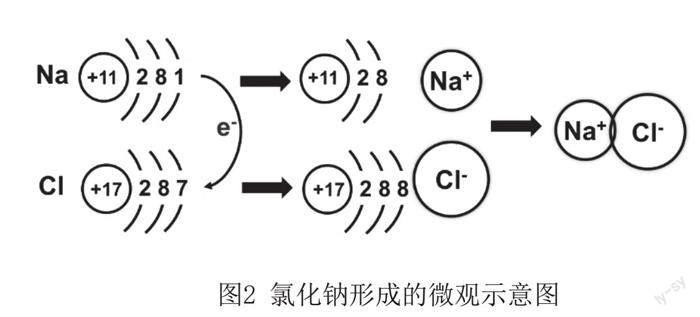
根据本书第一章原子结构,可知化合价就是原子之间互相化合时得失电子的数目。在氧化还原反应中,元素化合价发生变化,说明在氧化还原反应过程中,相应的元素原子发生了电子得失。图2将钠与氯反应的过程进行微观解析:钠原子最外层的一个电子,转移到了氯原子的最外层电子中,使得钠原子Na失去一个电子变成钠离子Na+,氯原子Cl得到一个电子变成氯离子Cl-,二者在离子键作用下形成NaCl化合物。
图2 氯化钠形成的微观示意图
师生共同归纳得出:元素原子失电子,化合价升高,发生氧化反应;元素原子得电子,化合价降低,发生还原反应。由此透过现象看到了氧化还原反应的本质,将宏观现象与微观机理相结合,实现化学学科核心素养中“宏观辨识与微观探析”的统一。
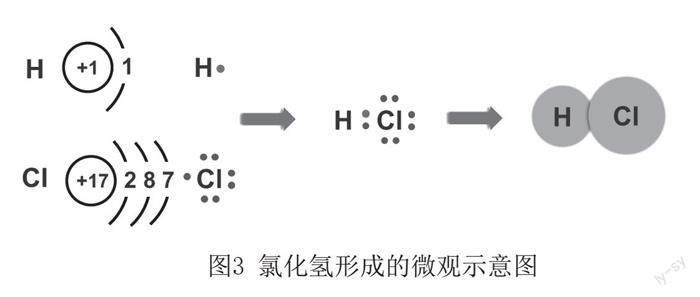
当发生原子最外层电子无法发生得失的情况时,通过共用电子对的偏向及偏移造成的化合价变化,也是氧化还原反应。
图3 氯化氢形成的微观示意图
如图3所示,氢原子的最外层电子受原子核的吸引力较大,无法完全转移到氯原子的电子层,使得氢原子与氯原子利用共用电子对形成共价键,生成化合物HCl。在这个反应的微观过程中,氯原子吸引电子的能力强于氢原子,因此共用电子对更加偏向氯原子而偏离氢原子,因此生成的化合物HCl中,氢元素显+1价,较反应前化合价升高,发生氧化反应;氯元素显-1价,较反应前化合价降低,发生还原反应。
得出结论:元素失电子或者共用电子对偏离,化合价升高,发生氧化反应,这种物质称为还原剂,具有还原性;元素得电子或者共用电子对偏向,化合价降低,发生还原反应,这种物质称为氧化剂,具有氧化性。反应前后化合价变化所揭示的氧化还原反应规律,是基于物质原子水平上的变化,微观结构决定了物质的性质,也决定了物质的用途。
(5)创设情境,认识物质性质
针对药品检验专业的中职一年级学生,为贴近专业现实,激发学生学习兴趣,以药物中的抗氧化剂为例说明生活中常见的氧化剂与还原劑。
氧化还原反应是药物变质的主要原因之一。为了防止药物的变质,通常会在一些药物中加入抗氧化剂。常用的抗氧化剂有亚硫酸钠(Na2SO3)、亚硫酸氢钠(NaHSO3)、硫代硫酸钠(Na2S2O3)、焦亚硫酸钠(Na2S2O5)等。
设置问题引发学生思考:抗氧化剂是氧化剂还是还原剂?为什么可以防止药物变质?学生思考并分组交流讨论。
教师讲解:药物中加入抗氧化剂是为了使氧气首先与抗氧化剂发生反应,以此保护药物不被氧化,因此相较之下抗氧化剂更易被氧化,容易发生氧化反应,这种物质属于还原剂。
借助这一实例,进一步延伸学生的思维广度和深度,氧化还原反应不仅仅存在于课本上,更是与其专业息息相关,以此培养学生的专业认同感,使学生认识到化学对实际生产生活的重要意义,实现化学学科核心素养的科学态度与社会责任。
4 教学反思
本课例的课堂教学以中职化学课程标准中的学科核心素养为基底来设计,融入现象观察与规律认知、宏观辨识与微观探析,设计自主探究环节,培养学生分析、推理、归纳、总结的能力,结合中职学生专业培养科学态度与社会责任。对教学过程的回顾及反思如下:
(1)本节课从初中知识化合价入手,设置学生能够找到并解决的关键问题,构建起化合价变化与氧化还原反应的规律,将二者联系,引导学生自行发现并分析规律,培养其解决实际问题的能力。
(2)注重对学生抽象思维的培养,将宏观物质间发生的反应,通过原子结构的变化图示逐渐转向微观维度,让学生化抽象为具象,直观地理解了氧化还原反应的本质。不仅注重知识的传授,同时也强调学生的内在思维和科学能力培养,使学生在掌握化学知识的同时,培养了核心素养。
(3)强化药品检验专业与化学知识的紧密联系,立足学生专业特点,因材施教,拓宽学生视野。在今后基础学科的教学中,也将更多地搜集专业相关知识,提高教学质量,在提升学生化学学科核心素养的同时,促进学生职业发展。
(作者单位:汕头市卫生学校)
