桃金娘果酒酵母菌的筛选鉴定及生长特性分析
2023-09-28赵广河胡梦琪陆玺文赵丰丽
赵广河,胡梦琪,陆玺文,赵丰丽
(1.广西师范大学 生命科学学院 广西漓江流域景观资源保育与可持续利用重点实验室 珍稀濒危动植物生态与环境保护教育部重点实验室,广西 桂林 541004;2.广西师范大学 应用生物学研究所,广西 桂林 541004)
桃金娘(Rhodomyrtus tomentosa)是桃金娘科桃金娘属常绿小灌木,原产于南亚和东南亚,主要分布于印度、中国的华东及华南、马来西亚和苏拉威西岛(印度尼西亚)的南部[1]。桃金娘果实不仅营养丰富,还含有多酚、多糖、β-胡萝卜素等生物活性物质,其中白皮杉醇含量高达2.3 mg/g干质量,是红葡萄的1 000~2 000倍[2-3],具有抗炎[4]、抗氧化[5-7]、抗动脉粥样硬化[8]、抑菌[9]、抗过敏[9]、抗肿瘤[10]等生理功效。桃金娘果实药用历史悠久,可用于补血、滋养、安胎及病后体虚、神经衰弱、耳鸣和遗精等方面。
桃金娘果实加工成的发酵型饮料“Ruou Sim”在越南南部和中部地区颇受欢迎[11]。我国部分地区采用自然发酵法制作桃金娘果酒。然而,上述方法所制桃金娘果酒口感微涩、品质不稳定。酵母是果酒发酵的关键,性能优良的酵母菌不仅可以缩短果酒发酵时间、提高果酒品质,还可以较好地保持果实自身的风味特性。近年来,研究者采用接种某名牌商用酿酒酵母发酵制备桃金娘果酒[12-14]。然而,果酒风味较为淡薄,无法满足消费者的口味需求。因此,寻找适宜的桃金娘果酒发酵专用酵母成了开发优质桃金娘果酒的关键所在。
本研究从桃金娘叶片、根部土壤、果皮、果实自然发酵液中分离酵母菌,通过WL鉴定培养基分离、纯化菌株,结合2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)显色初筛、发酵性能测试复筛酿酒酵母,通过形态学观察及26S rDNA基因序列分析对其进行鉴定,并对其耐受性进行分析,以期为后续优质桃金娘果酒的开发提供理论依据和技术支持。
1 材料与方法
1.1 材料与试剂
1.1.1 材料桃金娘新鲜叶片、根部土壤、果皮、果实:于2020年10月采集自广西贺州市某桃金娘果园。
1.1.2 试剂
脱氧核糖核酸(deoxyribonucleic acid,DNA)试剂盒:生工生物工程(上海)股份有限公司;葡萄糖、氯化钙、氯化钾、盐酸、氢氧化钠、无水乙醇、磷酸二氢钾、偏重亚硫酸钾(均为分析纯):西陇化工股份有限公司;蛋白胨、酵母粉、琼脂(均为生化试剂):国药集团化学试剂有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖琼脂(yeast extract peptone dextrose agar,YPD)培养基:将10 g酵母粉、20 g蛋白胨、20 g葡萄糖溶于1 L纯净水,115 ℃灭菌20 min。在灭菌后的YPD液体培养基中加入20 g无菌琼脂粉,摇匀、凝固后即为YPD固体培养基。
WL鉴定培养基:将4 g酵母粉、5 g胰蛋白胨、50 g葡萄糖、0.55 g磷酸二氢钾、0.425 g氯化钾、0.125 g氯化钙、0.125 g硫酸镁、0.002 5 g氯化铁、0.002 5 g硫酸锰、22 mg嗅甲酚绿、20 g琼脂溶于1 L纯净水,调整pH值为6.5,121 ℃灭菌15 min。
2,3,5-氯化三苯基四氮唑(TTC)下层培养基:将10 g葡萄糖、1.5 g酵母粉、1 g磷酸二氢钾、20 g琼脂、0.4 g硫酸镁、2 g蛋白胨,溶于1 L纯净水,调整pH值为5.5,115 ℃灭菌20 min。TTC上层培养基:将5 g葡萄糖、0.5 g红四氮唑、15 g琼脂溶于1 L纯净水,115 ℃灭菌20 min。
1.2 仪器与设备
YM75型立式压力灭菌锅:上海三申医疗器械有限公司;BX63型显微镜:日本Olympus公司;ABI3730XL测序仪:美国Applied Biosystems公司;Mini Pro 300V电泳仪:上海力申科学仪器有限公司。
1.3 方法
1.3.1 酿酒酵母的分离与纯化
分别称取新鲜桃金娘叶片、桃金娘根部土壤5 g,加入50 mL无菌水,置于28 ℃、150 r/min摇床培养3 h;称取新鲜桃金娘果皮20 g于200 mL YPD液体培养基中,25 ℃条件下摇床(150 r/min)培养2 d;称取新鲜桃金娘果实200 g充分破碎(过40目筛),加入适量葡萄糖将糖度调整为25°Bx,置于恒温培养箱中25 ℃静置发酵7 d。采用无菌水将上述菌悬液稀释至10-1~10-5倍后,分别吸取100 μL各梯度稀释液涂布于WL鉴定培养基,置于28 ℃恒温培养箱中培养2~5 d。采用平板划线法进行纯化。
1.3.2 酿酒酵母的形态观察及TTC培养基初筛
挑取表面光滑湿润、中间隆起的具有典型酵母菌株形态特征的单菌落继续培养,随后将酵母菌株划线接种于WL鉴定培养基,参照《酵母菌的特征与鉴定手册》[15],观察其菌落形态,并用无菌水稀释菌悬液,通过显微镜观察其细胞形态特征。挑选出特征明显的菌落于YPD固体培养基划线分离,挑选出单菌落,划线于YPD固体斜面,28 ℃恒温培养3 d,将单菌落划线接种于TTC下层培养基,28 ℃恒温静置培养2~4 d;待菌落成型后,倒入TTC上层培养基,28 ℃避光培养2~3 h;3 h后通过观察TTC培养基上菌落的显色反应,TTC会在活酵母细胞中脱氢酶的催化作用下转化为三苯甲臜,且呈红色[16]。通过颜色深浅可以判断酵母中呼吸酶活力的大小,从而判断酵母菌产酒精能力的高低。筛选颜色较深的菌株接种于YPD斜面培养基上,在28 ℃培养箱中培养48 h后置于4 ℃保存,用于后续实验。
1.3.3 酿酒酵母发酵性能测试
将初筛酵母菌接种于YPD斜面培养基上,在28 ℃培养箱中培养48 h,随后将其再次接种于YPD斜面培养基上,在28 ℃培养箱中培养48 h,充分活化菌株;接着将酵母菌接种于YPD液体培养基中,置于28 ℃、150 r/min摇床培养3 d,制成菌悬液,按照2%(V/V)接种量接种于放置有倒置杜氏小管的20 mL YPD液体培养基中,28 ℃静置培养3 d。在这期间,观察记录杜氏小管的产气情况。
1.3.4 产酒精能力测试
将复筛菌株接种于YPD液体培养基,置于28℃、150r/min摇床培养3 d。按照2%(V/V)接种量接种于装液量为100 mL/250 mL的YPD液体培养基中,28 ℃恒温培养5 d。量取100 mL发酵液置于500 mL圆底烧瓶中,再向该烧瓶中加入100 mL水,置于45 ℃旋转蒸发仪中进行蒸馏,收集约96 mL馏出液,取下收集瓶冷却至20 ℃,定容至100 mL,通过酒精计测其酒精度。
1.3.5 菌株的分子生物学鉴定
将筛选出来产酒精能力强的酵母菌株进行26S rDNA序列鉴定。DNA提取:按SK8257(酵母)试剂盒操作说明书提取酵母菌菌株的DNA。利用酵母菌引物NL1(5'-GCATATCAATAAGCGGAGGAAAAG-3')和NL4(5'-GGTCCGTGTTTCAAGACGG-3')对菌株进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR扩增体系(25 μL):DNA模板(40 ng/μL)0.5 μL、10×Buffer(含Mg2+)2.5 μL、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(2.5 mmol/L)2.0 μL、聚合酶0.2 μL、正反向引物(10 μmol/L)各0.5 μL,加双蒸水补充至25 μL。PCR扩增条件:94 ℃预变性4 min,94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,30个循环,72 ℃修复延伸10 min,4 ℃终止反应。将扩增产物送至生工生物工程(上海)股份有限公司测序,将测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)网站的GenBank数据库中进行基本局部比对搜索工具(basic localalignmentsearch tool,BLAST)同源性搜索比对,选取同源性较高的模式菌株的26S rDNA基因序列,采用MEGA7.0软件中的邻接(neighbor-joining,NJ)法构建菌株系统发育树。
1.3.6 菌株生长及耐受性能分析
(1)生长曲线
分别将鉴定菌株接种于YPD液体培养基,置于28 ℃、150 r/min摇床培养3 d,获得筛选菌株种子液,按照2%(V/V)的接种量接种于已灭菌的YPD液体培养基中,28 ℃恒温培养32 h,每隔2 h无菌取样,测其波长600 nm处的吸光度值(OD600nm值)。每个试验重复3次。
(2)耐受性能评价
参照梁裕崴[17]的方法并进行调整,将鉴定菌株制成菌悬液,按照2%(V/V)的接种量分别接种到不同pH值(1.5、2.0、2.5、3.0、3.5、4.0、4.5)、温度(33 ℃、36 ℃、39 ℃、42 ℃、45 ℃)、葡萄糖含量(10 g/L、20 g/L、30 g/L、40 g/L、50 g/L、60 g/L)、酒精度(8%vol、10%vol、12%vol、14%vol、16%vol、18%vol)、SO2含量(100 mg/L、150 mg/L、200 mg/L、250 mg/L、300 mg/L、350 mg/L)的YPD液体培养基中,以未经上述处理的YPD液体培养基为对照,28 ℃恒温培养箱培养3 d,分别考察发酵24 h、48 h和72 h的产气能力。每个试验重复3次。
2 结果与分析
2.1 酿酒酵母的分离、形态学观察及TTC培养基初筛
桃金娘叶片、根部土壤、果皮、果实经WL鉴定培养基分离纯化,共分离筛选得到45株菌株,依次命名为T1~T45。结合形态学观察发现,菌株T3、T6、T7、T8、T11、T27、T29、T30、T32、T33、T35、T38、T39、T41、T43这15株菌株不符合酵母形态特征,故排除。剩余30株菌株菌落呈圆形或椭圆形,表面湿润、光滑、有凸起,大小不一,具有典型的酵母菌形态特征。其中,代表菌株T2(筛选自果皮)的菌落及细胞形态见图1。由图1可知,菌株T2呈绿色、圆形、中间凸起、无褶皱、光滑、湿润;菌体形态无色透明、椭圆、出芽生殖。
采用TTC显色法对上述30株菌株进行初筛。不显色的菌株有2株,为菌株T34、T37,其他28株菌株(编号分别为T1、T2、T4、T5、T9、T10、T12、T13、T14、T15、T16、T17、T18、T19、T20、T21、T22、T23、T24、T25、T26、T28、T31、T36、T40、T42、T44、T45)均呈红色,因此,选取这28株菌株用于后续杜氏小管产气试验。
2.2 酿酒酵母发酵性能测试
2.2.1 杜氏小管产气法复筛
酵母菌分解糖产生二氧化碳[18],菌株的发酵能力与产气情况呈正比,产气速度越快、产气量越大,则发酵能力越强。28株菌株的杜氏小管产气法复筛结果见表1。由表1可知,菌株T10、T14、T15等14株菌株在48 h内均不产气,说明这些菌株为非酵母菌株,可排除。菌株T19在24 h内不产气,在48 h内所产气体仅能充满杜氏管体积的1/3,产气能力较差。菌株T1、T2、T4等13株菌株在48h内所产气体可以将杜氏小管充满,其中,菌株T2、T13、T16、T23、T25、T36均可在24 h内充满气体,而其他7株菌在24 h内仅产生1/3或2/3气体。将48 h内杜氏管能产气的14株菌株用于后续产酒精能力试验。

表1 28株筛选菌株的杜氏小管产气法复筛结果Table 1 Rescreening results of 28 screened strains by Duchenne tube gas production method
2.2.2 筛选菌株产酒精能力测定
筛选菌株产酒精能力测定结果见表2。由表2可知,菌株T2、T19发酵液的酒精度最高,均为2.5%vol,其他菌株发酵液的酒精度为1.5%vol~2.0%vol。因此,选择菌株T2、T19进行分子生物学鉴定。
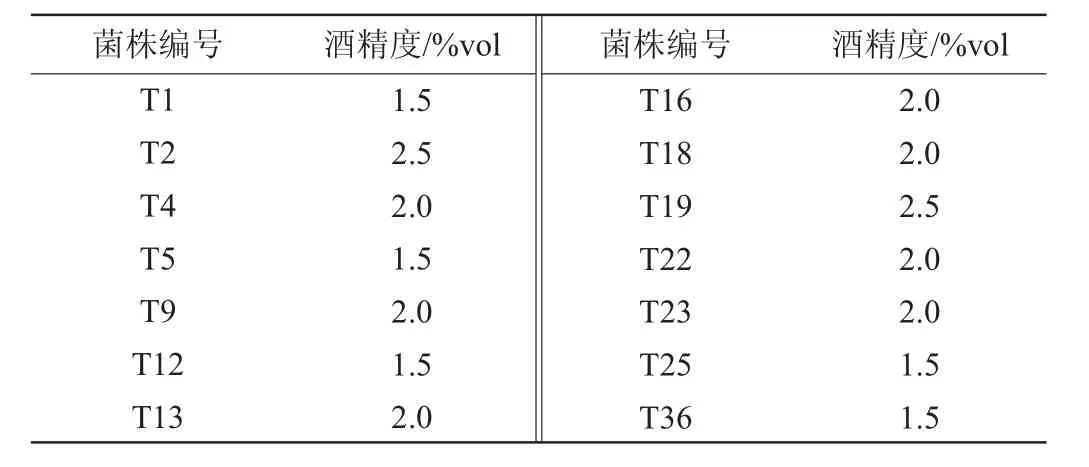
表2 筛选菌株产酒精能力测定结果Table 2 Determination results of alcohol production capacity of screened strains
2.3 筛选菌株的分子生物学鉴定
将菌株T2、T19进行26S rDNA分子生物学鉴定,构建其系统发育树,结果见图2。由图2(A)可知,菌株T2与仙人掌有孢汉逊酵母(Hanseniaspora opuntiae)聚于一支,同源性达100%。因此,菌株T2被鉴定为仙人掌有孢汉逊酵母(Hanseniaspora opuntiae)。由图2(B)可知,菌株T19与长孢洛德酵母(Lodderomyces elongisporus)聚于一支,同源性达100%,将菌株T19被鉴定为长孢洛德酵母(Lodderomyc eselongisporus)。
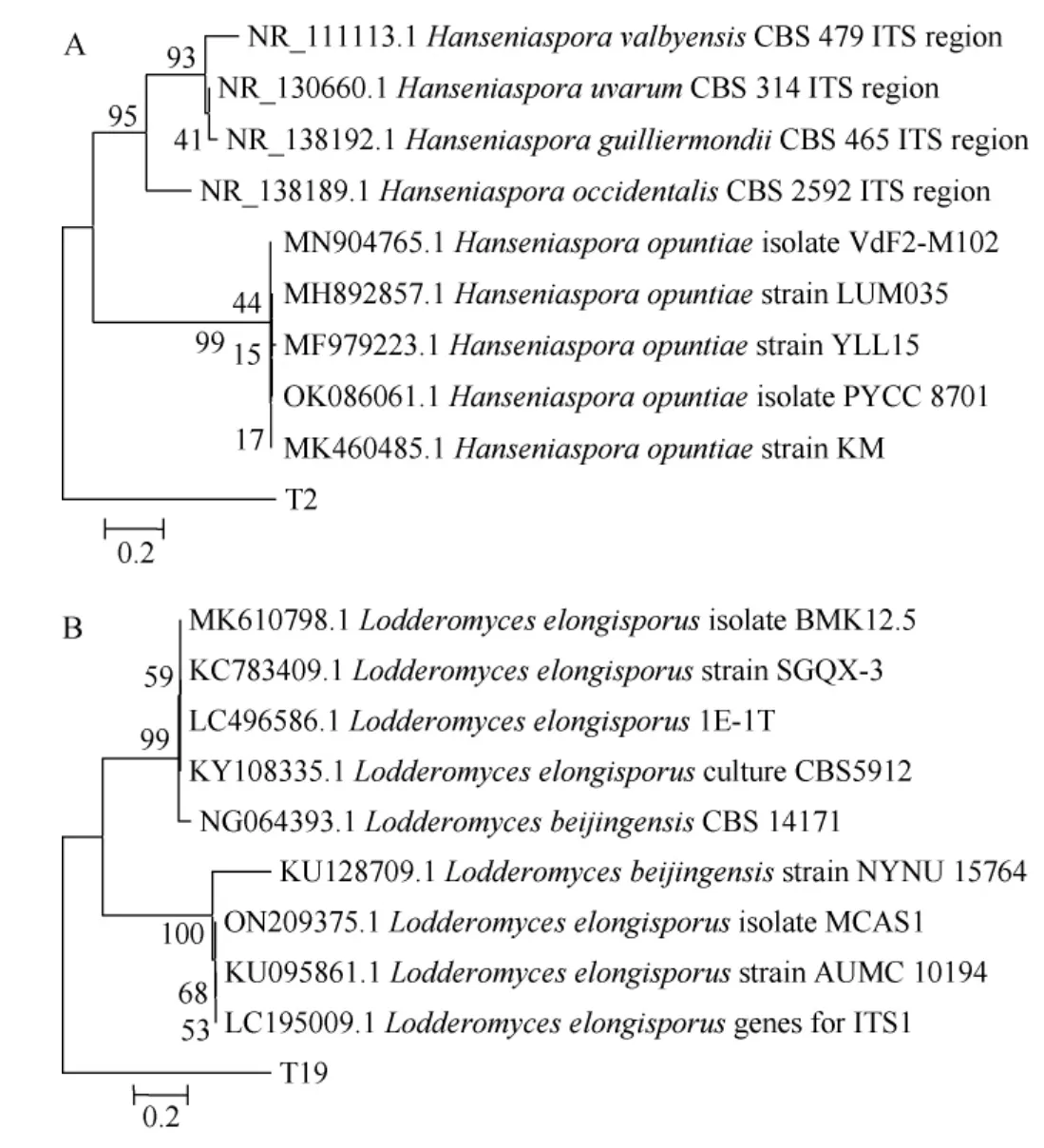
图2 基于26S rDNA基因序列菌株T2(A)和T19(B)的系统发育树Fig.2 Phylogenetic tree of strains T2 (A) and T19 (B) based on 26S rDNA gene sequences
2.4 筛选菌株的生长曲线
菌株T2和T19的生长曲线见图3。
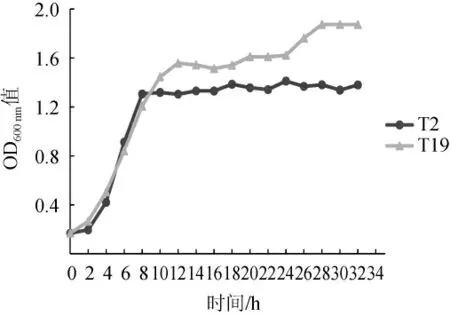
图3 菌株T2和T19的生长曲线Fig.3 Growth curves of strains T2 and T19
由图3可知,菌株T2和T19生长趋势基本一致。发酵时间为0~2 h时,菌株T2生长缓慢,为迟滞期;发酵时间为2~8 h时,菌株快速增殖,为对数生长期;发酵时间>8 h后菌株T2生长趋势较平缓,进入稳定期。菌株T19在0~2 h内生长缓慢,为迟滞期;在2~12 h内快速增长,为对数生长期;发酵时间>12 h后菌株T19呈缓慢增长趋势,进入稳定期。因此,2株酵母菌在12~32 h范围内生长良好。
2.5 筛选菌株耐受性实验
2.5.1 pH耐受性
筛选菌株的pH值耐受性实验结果见表3。在pH<3.0时,菌株T2在24 h内的产气受到抑制。在pH值≤2.0时,菌株T2在24 h内不产气,而在pH值为2.0~4.5时,可使杜氏小管在48 h内充满气体,在pH值为1.5~4.5时,可使杜氏小管在72 h内充满气体。在pH值为1.5~4.5条件下,菌株T19在48 h内均不产气,而在pH值为4.0~4.5时,可使杜氏小管在72 h内充满气体。因此,菌株T2对pH值耐受性能优于菌株T19,具有较强的耐酸性。
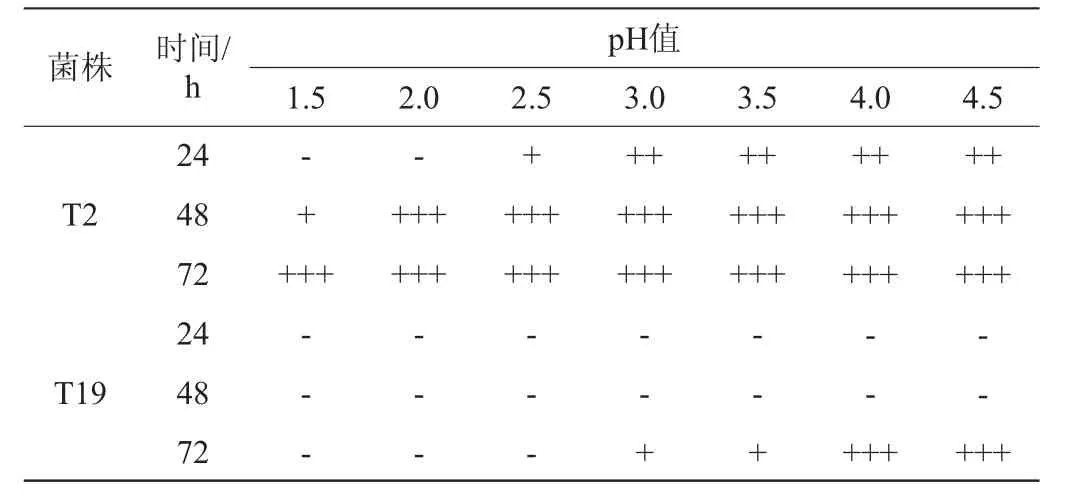
表3 筛选菌株的pH值耐受性实验结果Table 3 Results of pH tolerance tests of screened strains
2.5.2 温度耐受性
温度不仅影响酵母菌对营养物质的代谢转化,而且影响其发酵产物的整体风味[19]。筛选菌株的温度耐受性实验结果见表4。由表4可知,温度为33~36 ℃时,菌株T2可使杜氏小管在48h内充满气体,而菌株T19可使杜氏小管在72 h内充满气体。因此,菌株T2温度耐受性优于菌株T19。
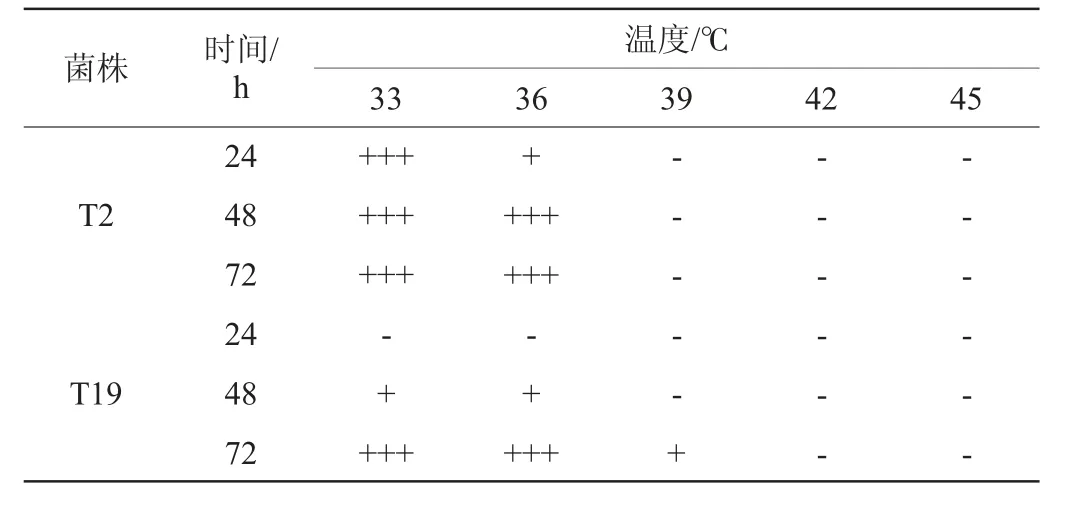
表4 筛选菌株的温度耐受性实验结果Table 4 Results of temperature tolerance tests of screened strains
2.5.3 葡萄糖耐受性
筛选菌株的葡萄糖耐受性实验结果见表5。在葡萄糖含量>30%时,菌株T2在24 h内的产气受到抑制。在葡萄糖含量为10%~30%,菌株T2可使杜氏小管在48 h内充满气体,而在葡萄糖含量为10%~60%,可使杜氏小管在72 h内充满气体。在葡萄糖含量为10%~40%时,菌株T19可使杜氏小管在72 h内充满气体,但48 h内均不产气。上述结果与管庆林等[20-21]的研究结果一致,因为高浓度葡萄糖溶液所形成的高渗透压环境导致酵母菌细胞破裂、水分流失从而抑制了酵母菌的生长[22]。因此,菌株T2的葡萄糖耐受性能优于菌株T19。
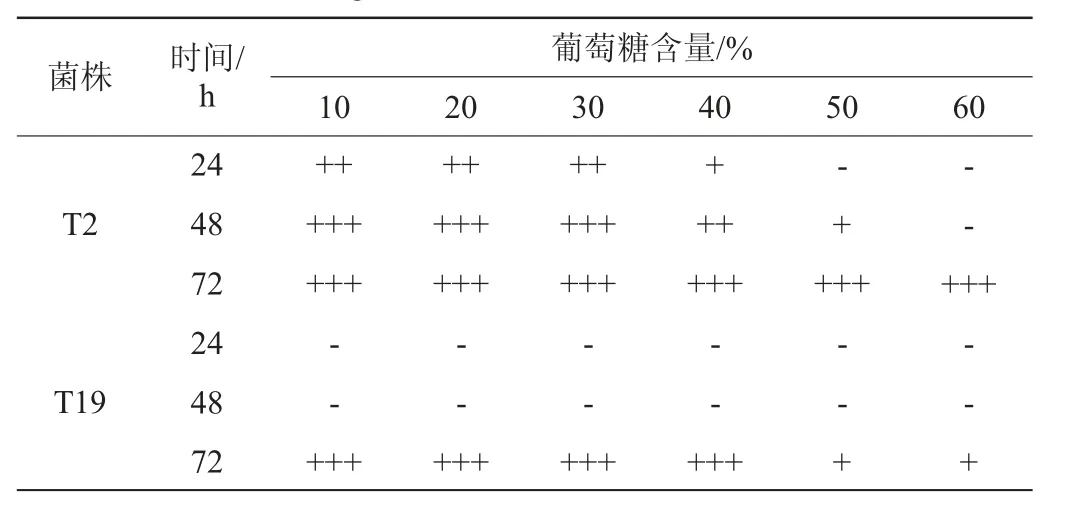
表5 筛选菌株的葡萄糖耐受性实验结果Table 5 Results of glucose tolerance tests of screened strains
2.5.4 酒精耐受性
醇类会影响酵母菌的相关膜及代谢通道的稳定性、糖代谢能力从而阻碍酵母菌的生长[23-24]。筛选菌株的酒精耐受性实验结果见表6。由表6可知,菌株T2在酒精度8%vol~10%vol条件下仅在48 h内有产生少量气体产生,在其他酒精度条件下均不产气;而菌株T19在酒精度8%vol~18%vol条件下在72 h内均不产气。因此,菌株T2对酒精耐受能力略优于菌株T19,但两者对酒精耐受能力均较弱,更适合应用于低醇饮品的生产。

表6 筛选菌株酒精耐受性实验结果Table 6 Results of alcohol tolerance tests of screened strains
2.5.5 SO2耐受性
SO2在果酒发酵过程中不仅可以提高有机酸含量、降低挥发酸含量,而且可以有效抑制细菌的生长繁殖[25]。筛选菌株SO2耐受性实验结果见表7。在SO2质量浓度>200 mg/L时,菌株T2在24 h内的产气受到抑制,而在SO2质量浓度为100~350 mg/L时,可使杜氏小管在48 h内充满气体。在SO2质量浓度为100~350 mg/L时,使菌株T19在48 h内的产气均受不同程度的抑制,但可使杜氏小管在72 h内充满气体。因此,菌株T2的SO2耐受性优于菌株T19。
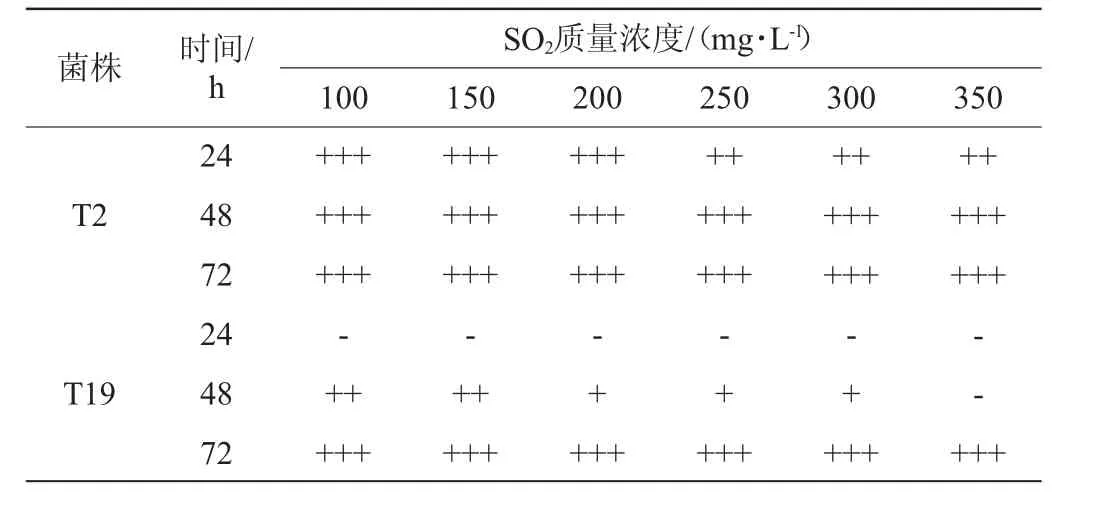
表7 筛选菌株的SO2耐受性实验结果Table 7 Results of SO2 tolerance tests of screened strains
3 结论
本研究以桃金娘叶片、根部土壤、果皮、果实为实验材料,通过WL鉴定培养基纯化、TTC显色初筛和发酵性能测试复筛筛选出两株酵母菌T2、T19。经26S rDNA序列分析,将菌株T2和T19分别鉴定为仙人掌有孢汉逊酵母(Hanseniaspora opuntiae)和长孢洛德酵母(Lodderomyces elongisporus),均为非酿酒酵母。耐受性试验结果显示,菌株T2的耐受性能优于T9,菌株T2可耐受pH、葡萄糖含量和SO2含量分别为3.0、30%和200 mg/L。本研究结果可为优质桃金娘果酒的开发提供理论和技术支持。
