混菌发酵对‘123’苹果酒香气成分的影响
2023-09-28王燕荣胡海霞史晓霞刘乐红
王燕荣,胡海霞,史晓霞,刘乐红
(内蒙古农业大学 职业技术学院,内蒙古 包头 014109)
‘123’苹果,又名‘金红’小苹果,水分含量为85%,糖含量为10%~14.2%,苹果酸含量为0.38%~0.60%,此外还有蛋白质、抗坏血酸、尼克酸、胡萝卜素、硫胺素、钙、磷、铁等多种营养成分[1]。果酒由水果发酵而成,保留水果的营养,且酒精含量低,风味各异,成为时尚消费品。酵母菌是发酵果酒的主要微生物,是影响果酒口感和香气的重要因素之一。
酿酒酵母(Saccharomyces cerevisiae)酒精发酵能力强,但酿酒过程中原料具有的风土特色香气物质难以被释放,产品的特点不突出[2]。非酿酒酵母通过分泌酶降解糖苷键释放芳香化合物,以及通过自身代谢直接合成或调整风味成分,使得果酒气味芬芳,酒体典型性突出[3-6]。利用酿酒酵母与非酿酒酵母共同发酵来改善果酒风味成为研究热点之一。曾朝珍等[7]研究表明,在异常汉逊酵母与酿酒酵母的协同作用下有效促进了苹果白兰地中酯类、醇类物质的合成,降低了脂肪酸的含量。祝霞等[8]研究发现,戴尔凯氏有孢圆酵母与酿酒酵母混菌发酵,可提高贵人香低醇甜葡萄酒中酯类、高级醇以及萜烯类香气物质,赋予了酒样强烈的花香、果香。申静云等[9]利用不同有孢汉逊酵母与酿酒酵母混合发酵威代尔冰葡萄酒,促进了酯类和萜烯类物质的合成,总量分别增加88.61%和21.40%,显著增强花果香和黄油味。LÓPEZ S等[10]筛选出汉逊酵母应用于Muscat葡萄酒的增香酿造,并验证了所产糖苷酶活力及其水解特性。陶永胜等[11]评价了野生胶红酵母的糖苷酶对媚丽新酒中香气糖苷的水解潜力。张曼等[12]使用美极梅奇酵母与商业酿酒酵母间隔48 h顺序接种发酵脆李果酒,结果表明在香气方面,辛酸乙酯、癸酸乙酯、月桂酸乙酯、芳樟醇显著提高。因此,酿酒酵母与非酿酒酵母混合发酵成为酿酒行业新的发展趋势。筛选酿造‘123’苹果酒适合非酿酒酵母,优化混菌发酵接种方案,对开发‘123’苹果酒具有积极意义。
本研究利用优选的卡利比克迈耶氏酵母(Meyerozyma caribbica)、葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)两株非酿酒酵母分别与一株商业酿酒酵母(Saccharomyces cerevisiae)混合发酵‘123’苹果酒,以单菌种发酵为对照,分析不同酒样理化指标、香气成分以及感官香气特征的差异性,确定‘123’苹果酒混合发酵方案,以期为生产风味独特的‘123’苹果酒提供理论依据。
1 材料与方法
1.1 材料与试剂
‘123’苹果:2021年9月23日取自内蒙古自治区包头市土右旗,还原糖含量为142 g/L,总酸含量为6.37 g/L。
卡利比克迈耶氏酵母(Meyerozyma caribbica)、葡萄汁有孢汉逊酵母(Hanseniaspora uvarum):均由内蒙古特色果酒系列产品产学研科技创新平台实验室分离筛选并保存;商业酿酒酵母(Saccharomyces cerevisiae)DS:法国诺盟公司。
酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrosemedium,YPD)培养基(生化试剂):青岛海博生物技术有限公司;甲醇、2-辛醇、乙酸乙酯、丁酸乙酯、异丁醇、1-己醇、异戊醇、异戊酸、辛酸、癸酸、苯甲醇、苯乙醇、苯甲醛等香气物质标准品(均为色谱纯):美国Sigma公司。
1.2 仪器与设备
QP2020 SYSTEM气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)仪:日本岛津公司;BS-1E振荡培养箱:上海高致精密仪器有限公司;SA2202S-CW电子天平:德国赛多利斯公司;2000JP果汁离心机:南通金橙机械有限公司。
1.3 方法
1.3.1 酵母培养与计数
将保藏的非酿酒酵母在YPD固体培养基上划线培养,28 ℃条件下培养48 h后重复活化一次。挑取菌落特征明显的菌株接种于200 mL YPD液体培养基中,28 ℃、180 r/min条件下培养24 h,取培养液用无菌生理盐水稀释计数并配制成浓度为1×106CFU/mL的酵母种子液,将酵母种子液接种于果汁中进行发酵。酿酒酵母DS按照产品说明进行活化后用无菌生理盐水稀释计数配制酵母种子液。发酵过程中每48 h取样,根据酿酒酵母和非酿酒酵母在WL培养基上的菌落形态进行分类计数。
1.3.2‘123’苹果酒酿造工艺流程与操作要点

操作要点:
分选清洗:选择成熟度较好,无腐烂发霉的‘123’苹果,清洗控干水分。
榨汁、糖度调整:‘123’苹果榨汁后添加白砂糖,调整糖度为200 g/L。
灭菌装罐:将苹果汁70 ℃灭菌15 min,分装于用亚硫酸灭菌处理的20 L玻璃发酵罐中,每罐装10 L苹果汁。
接种酵母:将非酿酒酵母和酿酒酵母单菌种和混合培养(混菌接种比例为1∶1)按照总接种量为6%接种到10 L果汁中进行发酵。
酒精发酵:控制发酵温度不超过30 ℃,当糖含量<4 g/L或连续48 h不再变化时视为发酵结束。
倒罐陈酿:发酵结束后将上清酒液倒入空罐中,加入50 mg/L SO2,自然陈酿2个月,取样用于后续分析。每个处理重复3次。
1.3.3 发酵组设计
对照组:设置三个对照组,分别为接种单一酿酒酵母(CK),单一葡萄汁有孢汉逊酵母(HU),单一卡利比克迈耶氏酵母(MC)。
混合发酵组:葡萄汁有孢汉逊酵母与酿酒酵母同时接种发酵(HS1);先接种葡萄汁有孢汉逊酵母,48 h后接种酿酒酵母(HS2);先接种酿酒酵母,48 h后接种葡萄汁有孢汉逊酵母(HS3)。卡利比克迈耶氏酵母与酿酒酵母同时接种发酵(MS1);先接种卡利比克迈耶氏酵母,48 h后接种酿酒酵母(MS2);先接种酿酒酵母,48 h后接种卡利比克迈耶氏酵母(MS3)。
1.3.4 理化指标检测
参考GB/T 15038—2006《葡萄酒、果酒通用分析方法》,测定还原糖、总酸、挥发酸、酒精度[13]。
1.3.5 挥发性香气成分测定
‘123’苹果酒挥发性香气成分检测方法参考尹荐等[14]的方法,采用顶空固相微萃取(head space solid phase microextraction,HS-SPME)-气相色谱-质谱联用技术检测。
样品预处理:取8 mL酒样,2.0 g NaCl,2-辛醇内标(400 μg/L)加入顶空瓶中,在40 ℃水浴中平衡15 min,在40 ℃条件下搅拌吸附萃取30 min,取出插入GC进样口,230 ℃解吸5 min取出。
GC-MS分析条件:进样口温度230 ℃,载气为高纯氦气(99.999%),流速1.5 mL/min,不分流进样。色谱柱为DB-WAXETR(60 m×0.25 mm×0.25 μm),升温程序40 ℃保持5 min,以2 ℃/min的升温速度上升到130 ℃,再以5 ℃/min的速度上升到220 ℃,保持10 min。离子源温度200 ℃,电子能量70 eV,扫描范围35~350 amu,扫描频率0.2 s/次。
定性定量分析:提取挥发性成分质谱图,并根据标准品的保留时间,通过美国国家标准与技术研究院(national institute of standards and technology,NIST)17谱库查询,计算各挥发性成分的保留指数进行定性分析。采用内标法定量。
1.3.6 香气评价
采用定量描述分析法对‘苹果酒的香气进行评价。感官品评小组有8位经过培训的老师和学生组成(4男4女),并从Davis香气轮盘中选取合适的词汇进行香气特征描述确定的感官描述(果香、花香、乙醇味、脂肪味、酸味),按照0~5分对特征香气强烈程度进行评分,无香气特征为0分,香气特征非常弱为1分,香气特征弱为2分,香气特征中等为3分,香气特征强为4分,香气特征非常强为5分。
1.3.7 数据统计分析
运用SPSS 23.0对不同酵母发酵‘123’苹果酒各理化指标和香气物质进行单因素方差分析(one-way analysis of variance,One-way ANOVA)和多重比较分析(multiple com parisonanalysis,MCA),并对香气物质进行主成分分析(principalcomponent analysis,PCA),应用Origin2018作图。
2 结果与分析
2.1 发酵过程中酵母菌生长变化分析
不同接种处理对苹果酒发酵过程中酵母菌生长的影响见图1。
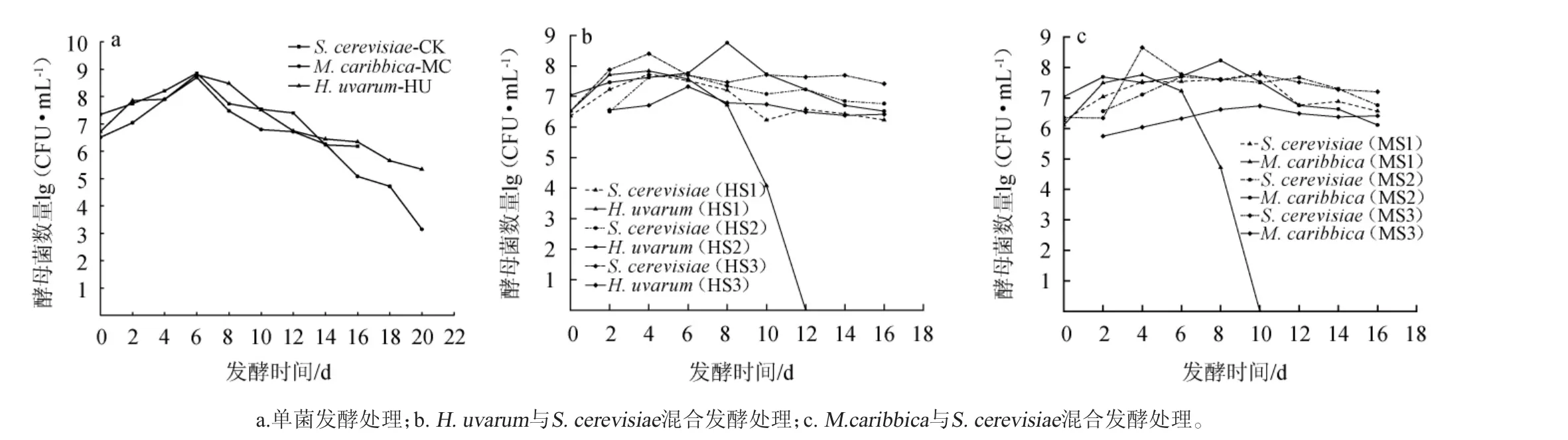
图1 ‘123’苹果酒发酵过程中酵母菌生长变化情况Fig.1 Growth status of yeast during '123' cider fermentation
由图1a可知,单菌发酵S.cerevisiae在第6天数量达到最大,为7.10×108CFU/mL,第16天发酵结束仍在106数量级。M.caribbica与H.uvarum单菌发酵均在第6天数量达到最大值,在第20天发酵终止,M.caribbica数量为1.43×103CFU/mL,H.uvarum数量为2.22×105CFU/mL。冯文倩等[15]的研究表明,H.uvarum在模拟葡萄汁中21 d完成酒精发酵,与本试验有一致结果。可见,由于非酿酒酵母酒精发酵能力弱,延长了发酵时间,随着营养物质的消耗,以及酒精度的增加,使非酿酒酵母在发酵后期数量下降明显。
由图1b、1c可知,混合发酵处理中,同时接种混合菌种时(HS1和MS1),在发酵第12天后和第10天后检测不到H.uvarum与M.caribbica活菌;在HS2、HS3、MS2、MS3顺序接种处理组中两种非酿酒酵母可以贯穿整个发酵周期,且整个发酵过程中非酿酒酵母数量稳定在(106~107)数量级,但在发酵后期酿酒酵母数量要高于非酿酒酵母数量。尤雅等[16]研究也有相似结果。同时接种相同数量的酿酒酵母和非酿酒酵母,最能反映酵母之间的竞争能力,试验结果表明H.uvarum与S.cerevisiae的竞争力优于M.caribbica。混合发酵中酿酒酵母的代谢产物乙醇、中链脂肪酸、杀伤毒素以及多肽,两种酵母的细胞接触,基质中的营养竞争等都是影响非酿酒酵母生长的因素[17-18]。
由上述结果可知,在‘123’苹果酒酿造过程中,酿酒酵母与非酿酒酵母存在竞争,同时接种方案中非酿酒酵母生长受到明显抑制,而顺序接种中非酿酒酵母在整个发酵进程中能保持一定数量。
2.2 苹果酒基本理化指标分析
发酵结束后‘123’苹果酒基本理化指标见表1。由表1可知,S.cerevisiae参与发酵的处理组还原糖含量均低于4 g/L,酒精发酵完全,酒精度为9.28%vol~10.88%vol。H.uvarum与M.caribbica单菌种发酵的处理组酒精发酵缓慢,发酵结束后酒精度分别较CK低23%和28%,并且还原糖含量较高;混菌发酵处理组酒精度显著低于CK组(P<0.05),有研究表明大多数非酿酒酵母酒精发酵能力较低,H.uvarum约消耗19 g/L糖产生1%vol的酒精[19]。非酿酒酵母的氧化代谢消耗葡萄糖而不形成乙醇,通过其他代谢途径转换为甘油等化合物[20]。
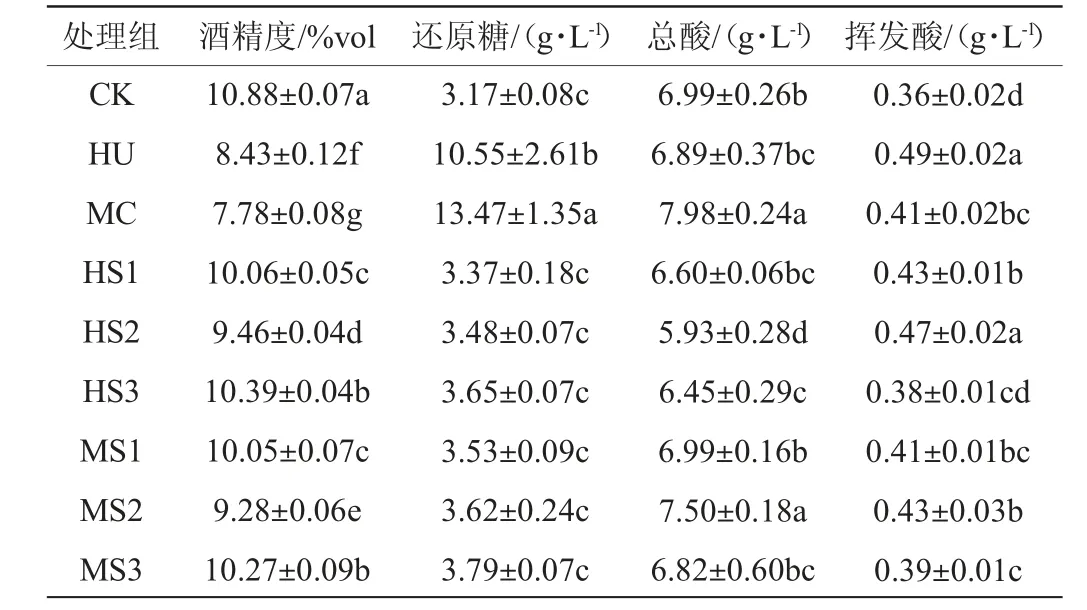
表1 ‘123’苹果酒的基本理化指标Table 1 Physiochemical indexes of '123' cider
总酸检测结果表明,MC与MS2处理组总酸含量显著高于其他组(P<0.05),可能与M.caribbica代谢产生酸类物质有关。本试验所有处理组的挥发酸含量均符合GB 15037—2006《葡萄酒》规定(<1.2 g/L)[21],非酿酒酵母发酵酒样挥发酸含量均高于对照组,其中HU组最高,较CK增加了36%,提前接种非酿酒酵母处理组HS2与MS2挥发酸含量也显著高于CK。夏鸿川等[22]同样发现提前接种H.uvarum会增加酒样中挥发酸含量。
混菌发酵过程中,由酿酒酵母主导酒精发酵,同时接种和先接种酿酒酵母的发酵酒样均获得较高的酒精度;M.caribbica使果酒中总酸含量增加;两种非酿酒酵母发酵增加了果酒中挥发酸含量。
2.3‘123’苹果酒香气成分分析
发酵结束的各酒样中香气成分测定结果见表2。由表2可知,共检出挥发性香气成分56种,包括品种香气成分11种、发酵香气成分45种,有高级醇11种、酯类化合物20种、脂肪酸类化合物7种、其他香气化合物7种。其中,香气化合物浓度与嗅觉阈值的比值,即香气活力值(odor active value OAV)>1的有10种,OAV为0.1~1.0的香气化合物有11种。HS2酒样中香气物质总含量最高,为9 302.20 μg/L;单菌发酵处理组也有较高的香气物质,HU酒样香气物质总含量(9 259.37 μg/L)显著高于CK(P<0.05),MC酒样香气物质总含量与CK没有显著差异(P>0.05);在混菌发酵中,先接种非酿酒酵母的酒样中香气物质总含量显著高于同时接种和后接种非酿酒酵母的处理组(P<0.05)。
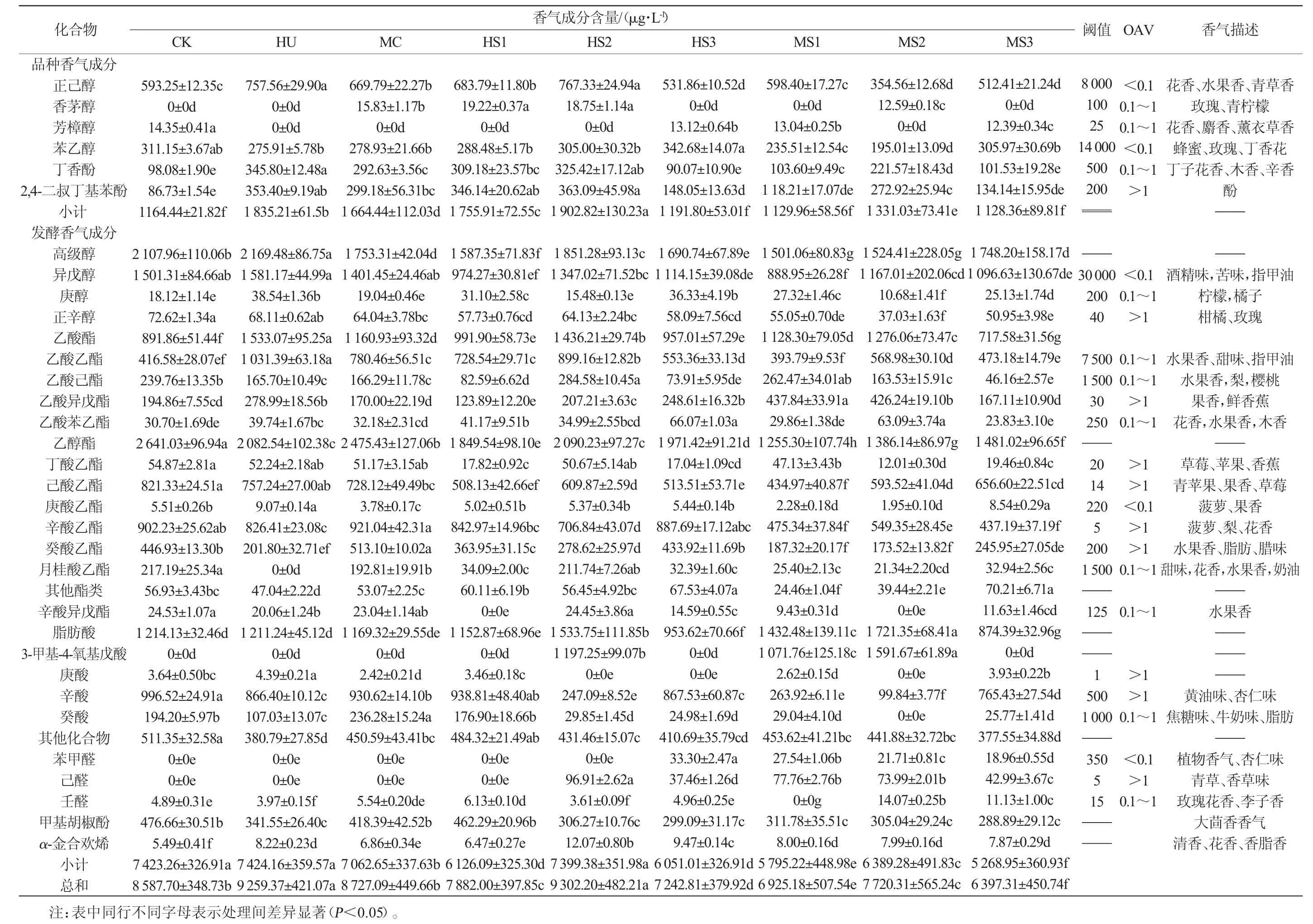
表2 ‘123’苹果酒香气成分测定结果Table 2 Determination results of volatile aroma components of '123' cider
2.3.1 品种香气成分分析
样品中品种香气成分包括1种C6化合物(正己醇)、2种萜烯醇(香茅醇、芳樟醇)、1种苯衍生物(苯乙醇)、2种挥发性酚(丁香酚、2,4-二叔丁基苯酚)。9个酒样中有6个酒样(HU、HS1、HS2、HS3、MC、MS2)的品种香气物质含量高于对照组,其中酒样HS2最高为1 902.80 μg/L,较CK增加了63.4%,其次是HU为1 835.21 μg/L,表明H.uvarum发酵有利于品种香气物质的生成。M.caribbica单菌种发酵酒样中品种香气成分表现较好,但混菌发酵酒样中品种香气成分不同程度有所降低,可能由于两种菌互作影响品种香气物质的代谢。
2.3.2 发酵香气成分分析
样品的发酵香气中有高级醇3种,酯类11种,脂肪酸4种,其他化合物5种,其中正辛醇、乙酸异戊酯、丁酸乙酯、己酸乙酯、辛酸乙酯、癸酸乙酯、庚酸、辛酸、己醛9种化合物的OAV>1。
高级醇类物质是糖类或氨基酸代谢的副产物,含量<300 mg/L时能衬托酯香,促进香气的协调性和复杂性[23]。试验酒样的高级醇含量为1 501.06~2 169.48 μg/L,均<300 mg/L,高级醇含量最高的为HU、CK、HS2,分别是2 169.48 μg/L、2 107.96 μg/L、1 851.28 μg/L,均显著高于其他处理组(P<0.05)。酒样中含量最高的为异戊醇,含量为888.95~1 581.17 μg/L,异戊醇具有苹果白兰地香气,是杂醇油的主要成分[24],含量高会引起头晕,本研究中混菌发酵酒样中异戊醇含量均低于单菌种发酵酒样。各酒样中正辛醇的OAV>1,赋予了酒样柑橘和玫瑰的香气。庚醇的OAV为0.1~1.0,增加了酒样柠檬和橘子的香气。
酯类化合物是酒精发酵的副产物之一,能赋予果酒花香和果香气味[25]。酯类化合物中以乙酸酯和乙醇酯为主,酒样HU中乙酸酯含量最高为1 533.07 μg/L,可能是由于H.uvarum酯酶活性较高。除MS3乙酸酯含量低于对照组,其余酒样中乙酸酯含量均显著高于对照组(P<0.05),说明两种非酿酒酵母在苹果酒发酵中产乙酸酯的能力较强。乙酸异戊酯嗅觉阈值较低,且在所有酒样中OAV>1,能赋予果酒果香和鲜香蕉的气味。酒样中检测到的乙醇酯中丁酸乙酯、己酸乙酯、辛酸乙酯、癸酸乙酯OAV>1,其中辛酸乙酯具有最高的OAV(87.44~180.45),为果酒带来草莓、菠萝和梨的香气。CK中乙醇酯含量显著高于其他组(P<0.05),这与LEE P等[26]研究结果类似,酿酒酵母菌株发酵能代谢较高的乙醇酯,而非酿酒菌株能生产较高的乙酸酯。
脂肪酸含量接近气味阈值时,可赋予果酒奶酪、黄油等风味,使酒体香气平衡[27]。MS2与HS2酒样中脂肪酸含量分别为1 721.35 μg/L和1 533.75 μg/L,显著高于其他组(P<0.05),说明先接种非酿酒酵母混菌发酵有利于果酒脂肪酸含量的提高。所有处理酒样中辛酸含量最高,且CK、HU、HS1、HS3、MC和MS3酒样中辛酸OAV>1,使果酒具有黄油的香气。
在酒样中还检测到了3种醛类化合物、1种酚类化合物和1种烯类化合物,CK酒样中这些物质总含量显著高于其他组。每个酒样中均检测到了甲基胡椒酚、α-金合欢烯,其中甲基胡椒酚的含量最高,有大茴香的气味,α-金合欢烯则有花香和脂香。
混菌发酵中,先接种非酿酒酵母有利于提高香气物质总量及脂肪酸含量;H.uvarum发酵可增加苹果酒中品种香气含量;两种非酿酒酵母均表现出有较强的乙酸酯生产能力,而酿酒酵母则是乙醇酯生产能力强。
2.3.3 特征香气成分主成分分析
一般认为,OAV>0.1的香气物质与相似的香气物质叠加能够一定程度增加酒体的香气及协调性,OAV>1的香气物质可能直接影响酒体香气,被认为是特征香气物质[28-29]。为进一步分析各处理酒样之间挥发性香气成分的差异,对不同处理酒样及其OAV>0.1的21种挥发性香气物质进行主成分分析(PCA),结果见图2。

图2 ‘123’苹果酒中特征香气化合物主成分分析Fig.2 Principal component analysis for characteristic aroma compounds in '123' cider
由图2可知,主成分PC1方差贡献率占33.2%,PC2方差贡献率占21.4%,前两个主成分累计方差贡献率为54.6%。9种酒样在置信区间被很好地区分开,对照组CK与混菌发酵组均不在同一象限内,说明混菌发酵对‘123’苹果酒风味有显著影响。HU、MC和HS1在同一象限,且距离较近,与香气物质乙酸己酯、月桂酸乙酯和辛酸乙酯相关较大;虽然MS2和HS2在同一象限,但距离较远,HS2与香茅醇、丁香酚、乙酸乙酯和2,4-二叔丁基苯酚相关性较大;MS2与己醛、壬醛和乙酸苯乙酯相关性较大。MS1、MS3和HS3与乙酸异戊酯相关性较大。而与CK相关性较大的香气物质是庚酸、辛酸和庚醇。
2.4 苹果酒感官香气分析
不同接种方式发酵的‘123’苹果酒感官香气评价雷达图见图3。由图3可知,所有非酿酒酵母发酵的处理组乙醇味均低于CK,与理化指标检测结果一致。CK的脂肪味也最强烈,与主成分分析中CK酒样脂肪酸相关性较大的结果一致。各组酸味比较接近。如图3a所示,果香、花香和酸味较突出的是H.uvarum单菌发酵的酒样,其次是同时接种和先接种H.uvarum酒样,后接种H.uvarum会明显影响果酒的香气。HU K等[30]的研究也表明,H.uvarum在混菌发酵中能够增加葡萄酒的花香和水果香气。如图3b所示,M.caribbica单菌种发酵酒样有较好的果香与花香,但与S.cerevisiae混菌发酵明显降低了酒样的花香与果香,可能与S.cerevisiae影响了M.caribbica的生长代谢有关。2种非酿酒酵母可以提高‘123’苹果酒的感官香气品质。
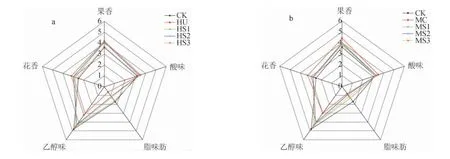
图3 ‘123’苹果酒感官香气评价雷达图Fig.3 Sensory evaluation radar map of '123' cider
3 结论
本实验主要研究H.uvarum与M.caribbica分别与S.cerevisiae混合发酵对‘123’苹果酒香气成分的影响。总体来看,在发酵过程中,不同的顺序接种对非酿酒酵母的生长有影响;混菌发酵降低了‘123’苹果酒中乙醇含量,M.caribbica酵母使酒样总酸含量增加,H.uvarum增加酒样的挥发酸含量。非酿酒酵母有利于酒中品种香气化合物和乙酸酯的生成,其中,先接种H.uvarum再接种S.cerevisiae组香气物质总量最高,且显著高于CK,并以2,4-二叔丁基苯酚、正辛醇、乙酸异戊酯、己酸乙酯、辛酸乙酯等物质为特征香气物质;先接种非酿酒酵母的混菌发酵酒样中香气物质总量显著高于同时接种与后接种非酿酒酵母处理组。H.uvarum参与的混菌发酵的酒样中品种香气物质含量显著高于CK,而CK则有较高的发酵香气物质含量。M.caribbica单菌种发酵酒样中香气物质含量表现好于混菌发酵。
混菌发酵可以改变‘123’苹果酒的香气特征,先接种H.uvarum再接种S.cerevisiae(HS2)混菌发酵在完成酒精发酵的同时,最大程度的发挥了非酿酒酵母的产香特性,挥发性香气物质总量最高,且品种香气物质较CK增加了63.4%,果香和花香突出,此接种方案在‘123’苹果酒增香酿造方面有应用潜力。后续将通过转录组及代谢组学深入研究H.uvarum与S.cerevisiae相互作用机理,进一步确定发酵调控参数,以期为‘123’苹果酒酿造提供理论依据。
