复方苦参注射液对原发性肝癌pokemon表达的影响机制
2023-09-28张全乐邢雅娟
张全乐, 刘 刚, 邢雅娟, 郭 红, 李 亚
(沧州中西医结合医院消化科, 河北 沧州 061000)
原发性肝癌是肝细胞或肝内胆管细胞发生的癌变,主要包括肝细胞癌、肝内胆管癌和混合型肝细胞癌-胆管癌3种不同病理学类型[1]。原发性肝癌是世界范围内最常见的恶性肿瘤之一,其发病率居恶性肿瘤第6位,在恶性肿瘤引起的死亡原因中居第4位[2]。目前,原发性肝癌常见治疗方法包括肝切除术、肝移植术、消融治疗、经导管肝动脉化疗栓塞术(Transcatheter arterial chemoembolization,TACE)、 放射治疗、系统抗肿瘤治疗等,针对不同分期的肝癌患者选择合理的治疗方法可达到最佳的疗效[3]。但由于大多数肝癌患者确诊时已为中晚期,常常合并肝硬化、血小板降低、凝血功能障碍等禁忌症,且受到病灶位置、数量、合并疾病所限,不能行手术切除、肝移植等治疗措施,临床预后较差[4]。复方苦参注射液是以苦参为主要成分的中药制剂,具有抑制肿瘤细胞增殖、血管形成、上皮间质转化等作用[5]。研究显示,复方苦参注射液对肝癌有明显的抑制作用,但其作用机制尚不完全清楚[6]。本研究探究复方苦参注射液联合TACE治疗原发性肝癌的治疗效果及作用机制,现报道如下。
1 资料与方法
1.1 一般资料以2018年1月-2021年12月河北省沧州中西医结合医院消化科收治的100例原发性肝癌患者为研究对象,其中男性61例,女性39例,年龄39~78岁,平均年龄(48.9±9.9)岁。原发性肝癌诊断标准[3]:(1)肝脏结节符合CT增强的典型影像学表现;(2)肝脏结节CT影像学表现不典型者,通过肝脏穿刺活组织检查病理证实。以上标准符合其一即可诊断为肝癌。纳入标准:(1)靶病灶2 cm~8 cm;(2)存在手术切除或肝移植禁忌症或不同意以上治疗。排除标准:(1)肿瘤巨大,占肝脏体积超过70%;(2)门静脉主干或主要分支、下腔静脉、胆管癌栓形成;(3)食管胃底静脉重度曲张;(4)Child-Pugh肝功能分级为C级;(5)大量腹水;(6)肾功能不全;(7)全身一般状况差,不能耐受介入治疗;(8)碘造影剂过敏;(9)参与其它肝癌治疗临床研究。本研究通过沧州中西医结合医院伦理委员会审批,患者均签署知情同意书。
1.2 试剂与仪器pokemon ELISA试剂盒(英国ABCAM公司);Trizol RNA试剂(南京金思特公司);MmLV逆转录酶、RNasin、Taq酶、羊抗兔二抗(加拿大Fermentas公司);兔抗人pokemon一抗(英国ABCAM公司);pokemon上下游引物(上海生工公司);DNA凝胶回收试剂盒(美国Axygen公司);PCR仪(美国Bio-Rad公司);凝胶图像分析仪(上海培清公司);DNM-9602A酶标分析仪(北京普朗新技术公司)。
1.3 治疗方法将100例原发性肝癌患者随机分为治疗组与对照组,每组50例。对照组单纯行TACE治疗,具体操作如下:穿刺股动脉置管成功后,进行肝固有动脉造影确定肿瘤位置及血管供应情况。将药物(由40 mg 5-氟尿嘧啶,上海旭东海普药业有限公司;90 mg顺铂,广东岭南制药有限公司;20 mg多柔比星,辉瑞制药有限公司;10 mL超液化碘油,上海旭东海普药业有限公司混合而成)沿导管缓慢注入血管内,然后在供血动脉处行栓塞术。每4周为1个周期,连续治疗2个周期。治疗组在TACE治疗的基础上,加用复方苦参注射液治疗(山西振东制药股份有限公司),具体用法如下:0.9%氯化钠注射液200 mL+复方苦参注射液20 mL,静脉滴注,每日1次,连续10 d为1个周期,间隔4周治疗1次,连续治疗2个周期。
1.4 指标的测定
1.4.1 肝癌患者血清中pokemon表达量检测 治疗前1天及治疗结束后1个月抽取患者空腹静脉血5 mL,静置20 min后, 4℃下2 000 r/min离心10 min,取上清液,采用酶联免疫吸附法,按照试剂盒说明书操作检测血清中pokemon表达量。
1.4.2 HepG2细胞中pokemon mRNA表达量检测 培养肝癌HepG2细胞株,分为空白对照组、阴性对照组和实验组。空白对照组加入不含药物的培养基,阴性对照组及实验组在使用培养基的基础上,分别加入0.9%氯化钠注射液及浓度为5 mg/mL的复方苦参注射液2 mL孵育24 h。采用Trizol法提取各组细胞的总RNA,逆转录合成cDNA,然后使用pokemon及内参β-actin的上下游引物进行PCR扩增。取5 μL扩增产物进行1.5%琼脂糖凝胶电泳,在紫外凝胶成像仪上进行拍照,QuantiScan软件分析电泳条带灰度值,计算mRNA表达的相对强度。mRNA表达的相对强度=pokemon条带灰度值/β-actin条带灰度值。
1.4.3 HepG2细胞中pokemon蛋白表达量检测 采用RIPA裂解液提取“1.4.2”项下各组细胞中的总蛋白,Bradford法测定蛋白浓度,置于-80℃冰箱保存备用。进行Western blot时,首先制作10%分离胶和5%浓缩胶,从冰箱中取出蛋白样品,加入5×SDS缓冲液,煮沸5 min,然后进行上样,每个孔的上样量为40 μg。设置起始电压为8 V/cm,当溴酚兰进入分离胶时电压调整为15 V/cm,电泳至溴酚兰涌出时结束。电泳完毕后将凝胶中蛋白转移至NC膜上,5%的封闭液封闭2 h后,加入一抗(兔抗人pokemon蛋白多克隆抗体,1∶200),4℃过夜;洗膜,再加入二抗(羊抗兔IgG-HRP,1∶10 000)孵育1 h,洗膜后进行ECL显色,计算pokemon蛋白表达的相对强度。pokemon蛋白表达的相对强度=pokemon条带灰度值/β-actin条带灰度值。
1.4.4 HepG2细胞增殖检测 收集对数生长期的HepG2细胞,以5 000个/孔接种至96孔板,每孔加入100 μL,5%CO237℃孵育至细胞单层铺满孔底,将细胞分为3组,即空白对照组、阴性对照组和实验组。空白对照组为不含药物的培养基,阴性对照组及实验组为分别加入0.9%氯化钠注射液或含5 mg/mL的复方苦参注射液各100 μL,5%CO237℃孵育24 h,弃去培养基,PBS清洗3次,每孔加入5 mg/mL的MTT溶液20 μL继续培养2 h,弃去MTT,各孔加入150 μL的DMSO,室温下低速震荡10 min,用酶标仪测定490 nm处各孔的吸光(OD)值,计算细胞增殖抑制率。细胞增殖抑制率=1-OD实验组或阴性对照组/OD空白对照组×100%。
1.4.5 临床有效率的测定 采用肝脏多层螺旋CT测定治疗前及治疗后1个月肿瘤病灶变化,肿瘤病变按照国际通用的实体瘤疗效评价标准1.1(Response Evaluation Criteria in Solid Tumors,RECIST 1.1)[7]进行评估,分为完全缓解(Complete remission,CR):肿瘤完全消失,持续>4周;部分缓解(Partial remission,PR):肿瘤病灶长径总和减少≥30%,维持>4周;疾病稳定(Stabilization of disease,SD):肿瘤病灶总和减少但未达到 PR;疾病进展(Progression disease,PD):肿瘤基线病灶长径增加≥20%,或出现新病灶。临床有效率=(CR+PR)/总病例数×100%。

2 结果
2.1 两组治疗效果比较治疗组临床有效率为88%(44/50);对照组有效率为70%(35/50),两组比较差异有统计学意义(P=0.048),见表1。
2.2 影响治疗效果变量分析将年龄(>45岁vs≤45岁)、性别(男性vs女性)、肿瘤位置(肝左叶vs肝右叶)、肿瘤大小(2 cm<直径≤5 cmvs5 cm<直径<8 cm)、肿瘤数量(1~3个vs大于3个)、pokemon表达量、治疗方式(复方苦参注射液联合TACEvsTACE)7个因素,进行单因素条件Logistic回归分析。结果显示,pokemon表达量、复方苦参注射液治疗为影响患者治疗效果的变量,其OR分别为1.698(95%CI:1.004~5.886)、4.518(95%CI:2.347~6.271),见表2。
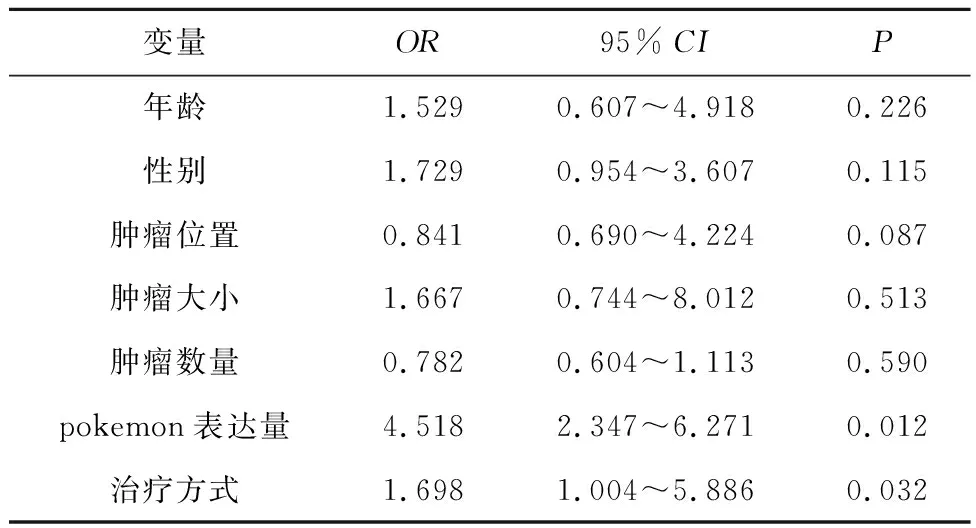
表2 影响治疗效果变量分析
2.3 两组pokemon的表达量比较治疗组治疗前pokemon表达量为(122.35±16.12) ng/mL,治疗后pokemon的表达量为(20.90±1.94) ng/mL,治疗前后相比,差异有统计学意义(t=6.059,P=0.000 2);对照组治疗前pokemon的表达量为(110.92±13.98) ng/mL,治疗后pokemon的表达量分别为(31.90±3.11) ng/mL,治疗前后相比,差异有明显统计学意义(t=5.058,P=0.001);治疗组与对照组治疗后pokemon表达量相比,差异有统计学意义(t=-2.905,P=0.017),见表3。
表3 两组pokemon表达量比较
2.4 实验组与阴性对照组HepG2细胞增殖抑制率比较实验组HepG2细胞增殖抑制率在24、48、72 h时高于阴性对照组(F=196.98,P=0.000;F=129.73,P=0.000;F=7.86,P=0.049);在96、120 h时实验组与阴性对照组HepG2细胞增殖抑制率比较差异无统计学意义(P>0.05),见表4。

表4 实验组及阴性对照组HepG2细胞增殖抑制率
2.5 三组HepG2细胞pokemon mRNA表达量比较空白对照组细胞pokemon mRNA表达的相对强度为(0.68±0.12),阴性对照组细胞pokemon mRNA表达的相对强度为(0.60±0.18),实验组细胞表达的相对强度为(0.17±0.01)。三者相比,实验组细胞pokemon mRNA表达的相对强度明显低于空白对照组及阴性对照组(F=12.721,P=0.001),而空白对照组与阴性对照组相比,差异无统计学意义(F=2.468,P=0.340),见图1。
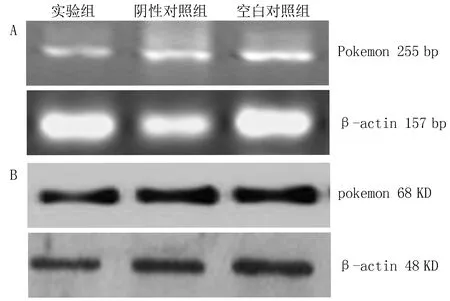
图1 三组HepG2细胞pokemon mRNA(A)及蛋白(B)表达量
2.6 三组HepG2细胞pokemon蛋白表达量比较空白对照组pokemon蛋白表达的相对强度为(11.87±2.63),阴性对照组相对强度为(12.05±1.97),实验组相对强度为(8.47±0.87)。三者相比,实验组细胞pokemon蛋白表达的相对强度明显低于空白对照组及阴性对照组(F=10.409,P=0.003),而空白对照组与阴性对照组相比,差异无统计学意义(F=2.357,P=0.364),见图1。
3 讨论
复方苦参注射液由苦参、白土苓组成,主要活性成分为氧化苦参碱、苦参碱、槐定碱[8]。研究显示,复方苦参注射液对肝癌有明显的抑制作用。阳卫立等[9]通过对复方苦参注射液联合肝动脉化疗栓塞术治疗原发性肝癌的临床疗效及安全性meta分析显示,复方苦参注射液联合TACE疗法能明显改善原发性肝癌患者的临床疗效和远期生活质量,提高患者的1年生存期,减少TACE治疗的临床不良反应。姚华等[10]研究显示,复方苦参注射液联合TACE临床总有效率、肿瘤控制率、AFP降低值、肿瘤体积缩小值、MELD评分降低值及KPS增高值均明显升高,且CD4+、CD4+/CD8+、CD3+T淋巴细胞及自然杀伤细胞等免疫指标亦明显增高,以上指标均优于单独TACE治疗。本研究显示,复方苦参注射液联合TACE治疗临床有效率亦高于单独TACE治疗,进一步通过Logistic回归分析影响治疗效果的变量发现,复方苦参注射液治疗为影响患者治疗效果的变量。由此可见,复方苦参注射液可明显提升TACE的治疗效果,延长患者的生存期,改善患者的生活质量和免疫状态。但不同临床研究报道的临床有效率存在差异,推测可能与研究方法、病例选择、样本数量、统计性方法不同有关。另外,目前复方苦参注射液联合TACE治疗肝癌仍缺乏高质量的循证医学研究证据,有待于进一步研究。
复方苦参注射液对肝癌细胞生长抑制的作用机制尚未完全明确。张大为等[11]研究表明,复方苦参注射液对肝癌 HepG2细胞增殖、侵袭具有抑制作用,且该作用与抑制JAK2/STAT3信号通路有关。阳卫立等[12]研究发现,复方苦参注射液可诱导LC3及SQSTM1的转录水平升高,导致细胞发生自噬现象,从而抑制人肝癌细胞SMMC-7721的增殖,且作用呈浓度依赖性。复方苦参注射液对肝癌细胞中pokemon的作用尚未明确,本研究选择pokemon作为复方苦参注射液的可能作用靶点进行检测,基于以下考虑:(1)pokemon基因控制着肝癌细胞突变的整个过程,c-myc、H-ras、N-ras等癌基因不具备类似的功能[13-15]。(2)本研究单因素条件Logistic回归分析结果显示,pokemon表达量、复方苦参注射液治疗为影响患者治疗效果的变量,两种变量之间可能存在相关性。(3)本课题组既往研究显示,肝癌组织中pokemon mRNA及蛋白表达均高于癌旁组织,且pokemon的表达量与患者肿瘤大小有关,而与患者年龄、肿瘤组织分化程度、门静脉癌栓形成、淋巴结转移、肝外远处转移以及肿瘤TNM分期均无相关性。肝癌患者血清中pokemon表达量高于良性肝病患者及正常人,且pokemon的表达量与肿瘤直径有关[16-17]。这提示pokemon基因的表达与肝癌存在密切关系,其在肝癌中表达量增加可能与肝癌细胞的恶性增殖有关。本研究显示,在体内复方苦参注射液治疗后pokemon的表达量较治疗前明显降低;在体外复方苦参注射液能明显抑制HepG2细胞的生长活性, 复方苦参注射液干预的HepG2细胞中pokemon mRNA及蛋白表达强度明显低于空白对照组及阴性对照组。由此推测复方苦参注射液通过影响pokemon表达,继而抑制肝癌细胞的增殖。
综上所述,复方苦参注射液对原发性肝癌有一定的临床疗效,其机制可能与减少肝癌细胞中pokemon的表达量有关。
