影像组学在急性缺血性卒中中的应用进展
2023-09-28范萍岳奎涛李爱媛赵喆谢海吴春艳第一作者
范萍,岳奎涛,李爱媛,赵喆,谢海,吴春艳(*第一作者)
卒中已经成为影响我国伤残调整生命年的首要原因,给我国医疗卫生系统带来了巨大负担,其中急性缺血性卒中(acute ischemic stroke,AIS)是最常见的卒中类型[1]。AIS的早期诊断和治疗与患者预后密切相关。目前,头颅CT和MRI是诊断AIS最常用的辅助检查方法,然而,其诊断准确性很大程度上受到医师的个人经验影响,且在判断AIS亚型及预测AIS预后中,传统的CT和MRI存在一定局限性。因此,需要寻找一种客观、可靠的影像学方法来诊断AIS、识别不同亚型并预测预后,进而为临床决策提供支持。影像组学是定量成像中的一个新兴领域,可客观和定量地判读AIS的影像学特点[2-3]。影像组学的出现与应用,使得疾病的诊断与鉴别诊断可以避免影像医师的主观影响,且使得疾病的诊断结果更加可靠。近年来,随着影像组学的快速发展,在AIS的诊断、预后预测中的应用也越来越广泛。本文介绍影像组学的一般原理和典型的工作流程,及其在AIS领域的应用、局限性和前景。
1 影像组学工作流程
与传统影像学不同,影像组学是一种利用机器提取影像特征来客观和定量地描述病变的新技术。其主要工作流程如下:①图像采集工作;②感兴趣区(region of interest,ROI)和感兴趣体积(volume of interest,VOI)的分割;③高通量影像组学特征提取;④统计学分析和预测模型建立(图1)。影像组学作为一种高通量数据分析方法,对采集数据的标准化、特征提取算法的可重复性以及模型预测的准确性都提出了较高的要求,因此其工作流程中的每一步都至关重要。
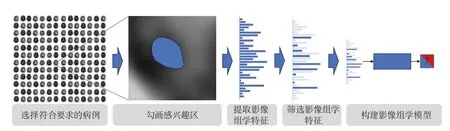
图1 影像组学流程图Figure 1 Flow chart of radiomics
1.1 图像采集 图像采集是至关重要的一步[4-6]。研究人员期望获取高质量、标准化的医学影像数据。然而,由于影像组学研究多为回顾性,因此所获得的数据会因为不同的成像技术而存在较大差异,表现为图像信号和图像纹理之间的差异[7]。获取的成像数据差异较大时,可能会引入非AIS病理特征引起的信号变化,从而导致影像组学模型的灵敏度和特异度无法达到预期。此外,还需要获取大量图像以满足影像组学图像分析的需要。
1.2 急性缺血性卒中感兴趣区和感兴趣体积的分割 ROI和VOI的分割即勾勒医学图像中的病变面积和体积[4-5]。ROI和VOI的分割是否可靠,与所提取的影像组学特征组成的影像组学模型能否发挥稳定预测效果密切相关。因此,分割必须是可重复的和可靠的。对于医师来说,手动分割ROI和VOI费时费力,且结果受观察者主观性影响,不适合大规模队列研究,因此,在大规模队列研究中往往采用自动图像分离。影像组学可以避免观察者间和观察者内部的异质性,结果更可靠,且省时省力[8]。需要注意的是,对图像进行预处理是在特征提取之前的关键步骤,通过预处理可以减少不同扫描方式差异导致的结果误差。
1.3 高通量影像组学特征提取和筛选 影像组学的核心步骤之一是使用相应的数学算法从医学图像中提取高通量影像组学特征[2]。这一过程需要使用经过充分验证的软件(如PyRadiomics)来提取影像组学特征,以保证提取特征的可靠性[9]。影像组学特征包括形状特征、一阶特征和二阶特征等。形状特征用以表示ROI的几何形态,如梗死灶体积、长轴比、表面积/体积比等;一阶特征为体素值的分布,是数值上的概念,如体素强度的均值、中值、标准差和峰值;二阶特征又称纹理特征,表现空间内的体素分布情况,是梗死灶内部异质性的体现[10]。
1.4 统计学分析和预测模型建立 高通量影像组学特征提取获得海量的影像组学特征,可能会造成模型的过度拟合。为避免这种情况发生,需要通过统计学分析进行特征降维。研究人员通常采用机器学习来进行统计学分析工作,过去的研究已经证实了机器学习是一种功能强大的统计学分析工具,可用于影像组学特征的提取和筛选。机器学习常见算法包括决策树、随机森林、逻辑回归、贝叶斯模型、支持向量机(support vector machine,SVM)以及最近备受关注的深度学习[11-12]。机器学习已广泛用于开发各种AIS预测模型。
2 影像组学在急性缺血性卒中中的应用
近年来,影像组学在AIS中的应用主要侧重于影像组学对AIS及其亚型的诊断,以及指导AIS临床治疗决策和预测AIS预后等方面。
2.1 急性缺血性卒中及其亚型的诊断 AIS的治疗及预后具有极强的时间依赖性,影像组学通过识别和量化缺血核心、缺血半暗带、动脉闭塞部位和侧支血流等,可有效缩短AIS的诊断时间、提高患者预后[13]。Stib等[14]通过提取三时相脑CTA影像组学特征建立临床模型,在自动诊断大动脉闭塞上显示出良好的检测效能(AUC为89%,灵敏度为100%,特异度为77%)。Takahashi等[15]基于影像组学开发了一种基于CT平扫检测大脑中动脉供血区梗死患者点征的自动化方法,最大灵敏度高达97.5%。Ortiz-Ramón等[16]从MRI图像和训练的SVM分类器中提取纹理特征,可识别AIS病变,AUC准确度在0.70~0.83。
目前确诊AIS的影像学技术(如CT、MRI、DSA、TCD等)已较为成熟,基于精准医疗的要求,如何在无创的前提下识别AIS亚型在现阶段显得更重要。近期有研究证实,基于影像组学的机器学习算法在区分不同AIS亚型方面具有良好的性能。目前基于影像组学的AIS亚型研究多基于MRI图像,如Wu等[17]利用深度学习方法,基于MRI DWI序列,自动分割AIS患者的病变体积,并将其用于AIS亚型的分类,但其缺乏关于AIS分型的基因分析支持。此外,相较于CT,MRI存在检查耗时长、禁忌证多的缺点,且AIS患者发病急、治疗受时间窗严格限制,故基于CT的影像组学方法在判断AIS亚型中更具优势。在最近的研究中,Chen等[18]通过对AIS患者CTA图像的深度挖掘,构建了稳定有效的AIS亚型分型模型,该模型将卷积神经网络模型的深度学习特征与传统的影像组学特征相结合,从而定量评价栓子特征,实现了对AIS患者的亚型分类,其最佳亚型分型模型的AUC值和准确度分别为0.9018和0.8929。
构建AIS亚型识别模型,可以对不同AIS亚型进行早期诊断和准确分型,从而为临床提供合理、有针对性的治疗方案和预后判断方法,可提高不同亚型患者的治疗效果,并有效改善患者预后,具有重要的临床意义。
2.2 指导急性缺血性卒中临床治疗决策AIS的治疗策略受多方面影响,如患者的人口学特征、症状特点、梗死灶的位置及大小等,临床医师需要综合考虑多方面因素来进行临床决策,这很大程度上依赖医师的个人经验。有研究显示,影像组学可帮助早期预测卒中相关并发症的发生,从而指导临床制订治疗计划、进行疗效检测以及避免因不恰当的治疗方式给患者造成的经济负担。
无论采用静脉溶栓治疗(intravenous thrombolysis,IVT)还是机械血栓切除术治疗,出血转化(hemorrhagic transformation,HT)和恶性脑水肿均是AIS患者治疗过程中的严重并发症[19]。近期研究显示,与临床特征融合的影像组学模型在HT风险预测方面显示出极大的优势。如Ren[20]等通过使用从CT平扫图像和临床特征中提取的影像组学指标,建立了一个可以预测发展性HT的临床—影像组学模型,可有效预测接受IVT治疗患者发生HT的风险,其AUC可达0.950,预测性能高于单一的临床组学模型或影像组学模型。Meng等[21]的研究通过统计学分析和单特征预测相结合的方法筛选出预测能力较强的临床特征,并与影像组学特征进行融合,采用随机森林算法构建基于融合特征的HT预测模型,其预测效能良好(AUC为0.911,准确度为0.894)。该研究团队还进一步发现,即使在正常ROI中没有病变,该模型也能为HT的预测提供特征信息。这些可靠的影像组学模型可以帮助临床识别HT等并发症风险,进行个体化风险评估,为临床决策提供支持。
另外,对缺血半暗带的评估也是影响临床治疗决策的重要方面。缺血的脑组织可分为缺血核心、缺血半暗带和良性少血部位[22]。影像组学在评估半暗带方面表现出了较大的潜力。Zhang等[23]的研究表明,基于ADC图谱的影像组学模型可以有效确定AIS患者是否存在缺血半暗带,其验证集的准确度、灵敏度、特异度分别为0.88、0.80和0.74,可安全应用于临床实践。但该研究仅从每位AIS患者显示的最大病变区域切片中提取特征,可能无法充分反映ADC减少区域的总体情况。此外,Wang等[24]使用三维伪连续动脉自旋标记(pseudo-continuous arterial spin labeling,pCASL)来预测AIS患者未行IVT治疗前缺血半暗带的体积,发现深度学习算法可以预测pCASL中动态磁化率对比度定义的低灌注区域,其准确度达0.92、灵敏度达0.89、特异度达0.95,可以更有效地辅助选择合适的AIS患者进行溶栓治疗。
综上,影像组学可以通过对缺血半暗带的预测和评估来进一步辅助临床医师做出综合性判断并指导临床决策,且随着影像组学的深入发展,其效能也将逐渐提高。
2.3 预测急性缺血性卒中预后 近年来,不同影像组学模型已广泛应用于预测AIS患者的预后,并且展现了较大的发展前景。Qiu等[25]应用源自CT平扫和CTA的血栓影像组学特征来预测IVT治疗近端血管闭塞AIS患者的再通情况,发现其优于既往血栓影像学特征(如长度、体积和通透性等)的预测效能。并且,近期多项关于影像组学预测AIS预后的研究表明,研究者已经不再局限于单独的影像组学模型研究,逐渐开始关注临床特征与影像组学融合模型的探索与开发。如Wang[26]使用多元逻辑回归模型构建了包含临床特征(年龄、出血、24 h NIHSS评分)和影像组学特征的影像组学列线图,在训练组和验证组中该模型预测预后的AUC分别为0.80和0.73,在预测缺血性卒中预后方面表现出良好的性能。Han等[27]开发了一种临床—影像组学列线图,纳入了年龄、NIHSS评分、2个影像组学特征(基于DWI序列),以预测接受血栓切除术的前循环闭塞AIS患者3个月的不良结局,其在训练集和验证集中的AUC分别为0.892和0.872,但该研究的样本量较小(仅140例),因此结果的可靠性尚待验证。Zhou等[28]基于522例患者的资料开发出了一种结合影像组学特征和临床指标的模型,纳入了更多的临床特征(如糖尿病、卒中病史等),其在训练集和验证队列中的AUC分别达到了0.868和0.890,证明其能更准确地预测AIS患者出院后6个月的结果。
此外,影像组学还在预测卒中后认知障碍、机械血栓切除术后结局、不同梗死部位神经系统症状进展以及AIS复发等方面发挥作用[29-31]。结合基于不同影像组学特征和不同临床特征的影像组学模型可以对不同情况的AIS患者进行个体化预测,有助于制定个性化的治疗方案。
3 总结与展望
影像组学使用先进的成像特征来客观和定量地描述AIS,避免了因医师个人知识和临床经验所造成的主观性和局限性。与其他组学(基因组学、蛋白质组学和代谢组学等)相比,影像组学可以与临床数据,甚至与病理学更优化地结合,使模型能够深度剖析AIS的发生发展,进而在指导临床诊断、治疗及预后方面发挥巨大作用。
近年来,大量文献显示,影像组学在AIS应用研究中取得了明显的成果,有望提高疾病的诊断准确率和速度,进而及早为患者提供必要的治疗。然而,这些研究还存在一定的局限性。首先,部分研究只关注了单一影像序列,鉴于其他序列也可能有用,单一序列的孤立评估不能完全体现AIS特征。其次,基于影像组学的机器学习的诊断性能没有与其他人工智能技术(如决策树、随机森林等)进行比较。再次,大多数研究的样本量较小,需要更大人群的研究来验证结果。为了实现这一目标,需要拥有一个覆盖范围广、患者资料完善的通用数据库,以方便研究人员从数据库中获得大量病例作为外部验证队列。最后,由于不同机构使用的CT、MRI扫描仪获取的图像存在相当大的差异,研究人员无法保证影像组学模型对外部数据集的诊断能力。在后续的研究中,这些都是需要注意并改进的。
利益冲突所有作者均声明不存在利益冲突。
