重庆酸雨区不同林型对土壤酸化和真菌群落的影响
2023-09-28倪秀雅冯永霞李如华
倪秀雅,冯永霞,李如华,尚 鹤,陈 展
中国林业科学研究院森林生态环境与自然保护研究所,国家林业和草原局森林生态环境重点实验室,北京 100091
酸沉降是全球面临的主要环境问题之一,由于酸沉降对生态系统的负面影响,已引起了学界和政府的广泛关注[1—2]。我国由于人口众多,工业快速发展,酸雨已成为一个比较严重的环境问题。我国政府采取了一系列措施控制SO2和NOX等酸性气体的排放[3—4],SO2排放量在2000年代显著下降,NOx的排放量在2012—2015年间也降低了约20%[5]。同时,近年来我中国政府尤其关注控制农业源NH3的排放[5],但不容忽视的是大气中的NH3在中和酸性降水中起着重要的作用,能有助于减轻酸雨[6]。而大气中NH3水平降低可能会加剧酸性降水使得陆地生态系统面临酸雨污染,尤其是我国南方和西南地区的土壤缓冲能力较低对酸雨尤其敏感[7]。Liu等[5]研究发现,如果在SO2和NOX减排15%的同时,NH3减排50%的话,则会显著加剧降水的酸化,雨水pH值在北方降低1个单位之多,而南方也将降低0.1—0.5个单位,且重酸雨面积会相应地大幅增加。鉴于我国南部和四川盆地的降水酸度要大得多,即使pH值小幅下降也会使本已严峻的局势恶化[5],因此,酸沉降在我国南方仍然是一个严重的环境问题[2, 8—9]。

重庆铁山坪是我国酸雨研究的热点地区之一,自2000年以来,铁山坪就已成为中挪合作的中国酸沉降综合影响观测研究项目的五个观测点之一[19]。铁山坪的森林主要为起源于20世纪60年代天然林皆伐后自然更新形成的马尾松次生林,因受酸沉降危害造成森林衰退,因此,20世纪80和90年代以来,陆续在马尾松林下及其采伐迹地、火烧迹地补植了阔叶树种,或结合森林防火栽植或补植了防火树种木荷,现已形成了马尾松纯林(PinusmassonianaLamb)、香樟林[Cinnamomumcamphora(Linn) Presl]、木荷林(SchimasuperbaGardn. et Champ)以及针阔混交林等多种森林类型镶嵌分布的空间格局。土壤pH值是土壤微生物的一个重要驱动因子,土壤酸化必然引起土壤微生物的响应。土壤微生物在土壤碳氮磷等元素循环中起着至关重要的作用,与土壤健康密切相关。不同森林类型的土壤细菌群落差异可能影响土壤酸化缓冲能力。研究发现,在重庆铁山坪受损马尾松林改造成香樟纯林或马尾松-香樟混交林后,其土壤中一些有利于土壤团聚体形成的细菌以及增强环境胁迫抗性细菌的相对丰度较高,而产酸和嗜酸菌丰度较低;相比之下,马尾松纯林和种植木荷的土壤pH值较低,且产酸菌和嗜酸菌丰度较高[20]。土壤真菌是另一类重要的土壤微生物,相比于细菌,真菌更直接地依赖于凋落物和树木的营养相互作用,许多真菌是专一性根共生体或病原体[21—22];且真菌更倾向于酸性环境[23],土壤酸化必将对土壤真菌产生影响。因此,了解土壤酸化背景下不同林型的土壤真菌群落结构有助于我们更好地了解不同营林措施对酸化土壤及其森林质量的影响,为酸雨区森林生态系统健康可持续发展提供科学依据。
本研究以重庆铁山坪林场的马尾松纯林(Pi)、香樟纯林(Ci)、木荷纯林(Sc)、马尾松-香樟混交林(Pi_Ci)以及马尾松-木荷(Pi_Sc)混交林为研究对象,通过对土壤理化性质、土壤真菌群落结构的分析,探讨在酸雨区将马尾松纯林改造成针阔混交林或阔叶林后对土壤酸化和土壤真菌群落结构的影响,以及对森林生态系统功能可能存在的潜在影响。
1 材料与方法
1.1 研究区概况
研究地点为重庆市铁山坪林场(N29°38′, E106°41′),位于重庆市中心东北方向约25 km处,属四川盆地低山丘陵区,海拔变化在242—579 m,坡度变化在5—30°。该地为亚热带湿润气候,年降水量1100 mm,年均气温18 ℃。土壤以砂岩上发育的山地黄壤为主,厚度50—80 cm,土壤密度1.25—1.64 g/cm3,土壤酸化比较严重(pH值3.80—4.84)[18]。铁山坪林场现有森林1200 hm2,以20世纪60年代破坏后天然更新形成的马尾松次生林为主,马尾松纯林林龄平均为62年。香樟林为20世纪80年代初在马尾松林采伐迹地营造的人工林,林龄约为37年。木荷林是20世纪90年代初在马尾松林火烧迹地上营造的人工林,林龄约为29年。马尾松-香樟混交林是20世纪80年代初在马尾松林下通过星状补植香樟形成的,平均林龄50年。马尾松-木荷混交林是20世纪90年代初建设生物防火隔离带时,在马尾松林下带状栽植木荷形成的,平均林龄45年。
1.2 研究方法
1.2.1样地设置
2018年6月,选择土壤、地形条件基本一致的代表性地点,每种林型设置规格为20 m × 20 m 的典型样地各4个,共20个。
1.2.2土壤取样及分析
2018年8月,在各个样地内按“S”型布设10个取样点,每个取样点挖取一个土壤剖面,分别采集腐殖质层(O层)和淋溶层(A层)的土壤样品。每个样地10个点的土壤分层混合,每层一个混合土壤样品,分别表示为Pi_O(马尾松纯林O层土壤),Pi_A(马尾松纯林A层土壤),Ci_O(香樟纯林O层土壤),Ci_A(香樟纯林A层土壤),Sc_O(木荷纯林O层土壤),Sc_A(木荷纯林A层土壤),Pi_Ci_O(马尾松-香樟混交林O层土壤),Pi_Ci_A(马尾松-香樟混交林A层土壤),Pi_Sc_O(马尾松-木荷混交林O层土壤),Pi_Sc_A(马尾松-木荷混交林A层土壤)。采集的土壤分成两部分,一部分运输至实验室,用于土壤性质的分析;另一部分-80℃保存,用于土壤真菌群落结构的分析。
土壤性质测定:土壤pH测定采用电位法;土壤阳离子交换量(CEC)采用草酸铵-氯化铵浸提后用半微量凯氏定氮法测定;土壤有机碳(SOC)用重铬酸钾容量-外加热发测定;土壤全氮(TN)利用H2SO4-H2O2消煮后半微量定氮法测定;土壤全磷(TP)采用NaOH熔融-钼锑抗比色法分析;土壤全钾(TK)利用NaOH熔融-火焰光度法测定;氨氮和硝氮则采用0.01mol/L氯化钙浸提后利用AA3流动注射分析仪进行分析测定。
DNA提取和聚合酶链式反应(PCR)扩增:根据试剂盒 E.Z.N.A.® soil DNA kit (Omega Bio-tek, 诺克罗斯,乔治亚州,美国)说明书进行微生物群落总DNA抽提,使用1%的琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop2000测定DNA浓度和纯度;使用ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GCTGCGTTCTTCATCG ATGC-3′)对ITS1基因进行PCR扩增,扩增程序如下:95℃预变性3 min,37个循环(95℃变性30 s,55℃退火30 s,72℃延伸45 s),然后72℃稳定延伸10 min,最后在4℃进行保存(PCR仪:ABI GeneAmp®9700型)。PCR反应体系为:5×TransStartFastPfu缓冲液4 μL,2.5 mmol/L dNTPs 2 μL,上游引物(5 μmol/L)0.8 μL,下游引物(5uM)0.8 μL,TransStartFastPfuDNA聚合酶0.4 μL,模板DNA 10 ng,ddH2O补足至20 μL。每个样本3个重复。
Illumina Miseq 测序:将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用试剂盒AxyPrep DNA Gel Extraction Kit (Axygen Biosciences, 联合市,加利福尼亚州,美国) 进行回收产物纯化,经2%琼脂糖凝胶电泳检测,并用QuantusTMFluorometer (Promega, 美国) 对回收产物进行检测定量。使用NEXTflexTMRapid DNA-Seq Kit(Bioo Scientific,美国)进行建库:(1)接头链接;(2)使用磁珠筛选去除接头自连片段;(3)利用PCR扩增进行文库模板的富集;(4)磁珠回收PCR产物得到最终的文库。利用Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司)。
1.2.3数据处理及统计分析
(1)土壤性质数据
本文目的之一是探讨不同林型与土壤酸化间的关系,为了更直观地表现不同林型之间土壤性质的差异,将各林型不同土层的土壤合并后运用SPSS18对土壤性质进行单因素方差分析(ANOVA)和Tukey′s显著性检验(HSD),检测不同林型间土壤酸化指标和土壤养分之间的显著性水平。
(2)土壤真菌群落数据
使用fastp[24](https://github.com/OpenGene/fastp,version 0.20.0)软件对原始测序序列进行质控,使用FLASH[25](http://www.cbcb.umd.edu/software/flash,version 1.2.7)软件进行拼接:(1)过滤测序仪单次测序所得到的碱基序列(简称“序列reads”)尾部质量值20以下的碱基,设置50bp的窗口,如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,过滤质控后50bp以下的reads,去除含N碱基的reads;(2)根据两条具有物理关系的一对序列(PE reads)之间的重叠(overlap)关系,将成对reads拼接(merge)成一条序列,最小overlap长度为10 bp;(3)拼接序列的overlap区允许的最大错配比率为0.2,筛选不符合序列;(4)根据序列首尾两端的条码(barcode)和引物区分样品,并调整序列方向,barcode允许的错配数为0,最大引物错配数为2。
使用UPARSE[26]软件(http://drive5.com/uparse/,version 7.1),根据97%[26—27]的相似度对序列进行操作分类单元(OTU)聚类并剔除嵌合体。利用RDP分类器[28](http://rdp.cme.msu.edu/,version 2.2) 对每条序列进行物种分类注释,比对unite8.0/its_fungi,设置比对阈值为70%。
本研究利用美吉生物云平台(https://cloud.majorbio.com/)完成高通量测序数据分析。利用Mothur软件计算Alpha多样性指数(Shannon,Sobs,Chao1,Ace),为了更直观地表现不同林型之间土壤真菌群落多样性的差异,将各林型不同土层的土壤合并后运用SPSS18对多样性指数进行单因素方差分析。利用R软件(version3.3.1)基于Bray-cutis距离算法进行主坐标分析(PCoA分析)区分不同林型土壤真菌群落结构特征,结合PERMONAVA分析确定林型、土层对土壤真菌群落结构的影响。用97%相似性的样本OTU表进行消除趋势对应分析(DCA),其结果显示土壤真菌数据适合用冗余分析(RDA分析)探讨土壤性质与土壤真菌群落结构的相互关系。为找出造成不同林型土壤真菌群落差异的主要菌群,利用SPSS18对合并土层的真菌属水平分类单位丰度进行单因素方差分析。
2 结果与分析
2.1 土壤酸化和土壤养分状况
将Pi改造成Ci以及Pi_Ci后,土壤pH值显著提高0.43个单位,而NH4∶NO3则显著降低三倍;而改造成Sc和Pi_Sc后pH值没有显著变化,但Sc的NH4∶NO3与Pi相比显著提高了约35%。Pi的改造对土壤SOC和TN含量都没有显著影响,但改造成Ci显著提高了TP含量,而改造成Sc和Pi_Sc后TP、TK含量均显著低于Pi(表1)。

表1 不同林型土壤酸化指标及土壤养分Table 1 Soil acidification and nutrients in five forest types
2.2 土壤真菌群落
通过对不同林型不同土层的土壤样本进行高通量测序,按最小样本序列上进行样本序列抽平处理后,共得到优化序列2105668条,经分析属于7门、29纲、88目、216科、451属、727种、3713OTUs。
2.2.1真菌群落多样性
除Shannon指数外,Chao1、Sobs及Ace指数均以Ci林型最高,且Chao1指数显著高于Pi和Pi_Sc样本,Sobs指数显著高于Pi_Ci和Pi_Sc,Ace指数显著高于Pi。虽然Sc林型的Shannon指数最高,但Pi、Ci以及Pi_Ci与其没有显著差异(表2)。所以,总体来讲,五种林型中Ci林型土壤真菌多样性更丰富。相关性分析表明(表3),土壤pH值与Chao1和Sobs指数显著正相关;CEC与Shannon、Chao1、Sobs和Ace均呈正相关;而NH4∶NO3则与Chao1和Sobs呈显著负相关;TK与Chao1指数显著正相关。
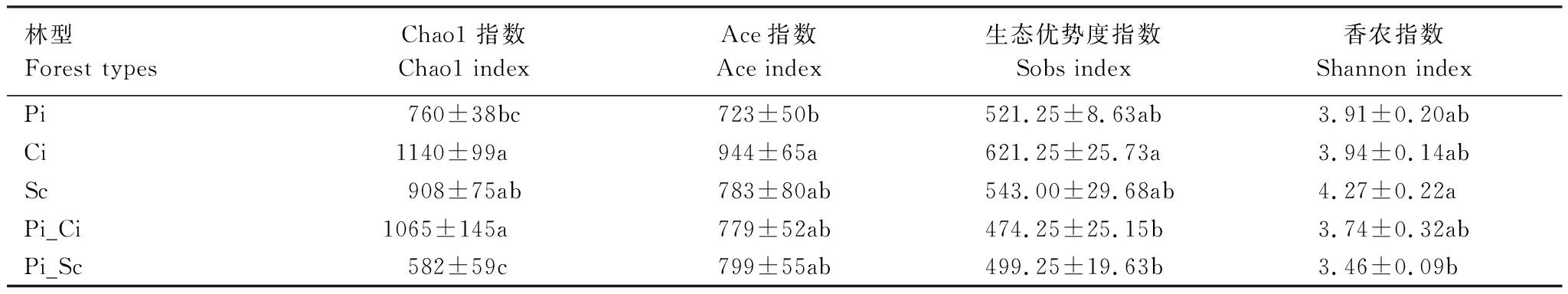
表2 不同林型土壤真菌的alpha多样性指数Table 2 Alpha diversity index of soil fungi in five forest types

表3 真菌多样性指数与土壤性质相关性分析Table 3 The correlation between soil fungal diversity and soil properties
2.2.2真菌群落组成
从图1可以看出,在Ci和Pi_Ci两林型O层和A层土壤样品中的优势物种表现一致,子囊菌门(Ascomycota)相对丰度最高(平均为43.44%),其次为被孢霉门(Mortierellomycota)(18.24%),担子菌门(Basidiomycota)和罗兹菌门(Rozellomycota)相对低一些(平均相对丰度分别为11.11%和6.06%)。而Pi、Sc及Pi_Sc的O层和A层土壤样品中,相对丰度排在前两位的优势物种比较一致,分别是子囊菌门(37.72%)和担子菌门(22.63%)。而相对丰度排在第三位的物种在O层和A层中表现不同,O层中为罗兹菌门(平均22.83%),而A层中相对丰度排在第三位的则是被孢霉门(平均为8.39%)。子囊菌门在各样本中分布比例比较均衡(25.20—63.16%);担子菌门分布比例差别较大,Pi_A中分布比例达48.62%,而在Pi_Sc_O中分布比例只有(6.13%);被孢霉门在Ci_O中分布比例最大(32.33%),同样在Pi_Sc_O中分布比例最少(2.99%);而Pi_Sc_O中罗兹菌门分布比例高达35.12%,而在Pi_A中分布比例只有1.61%。由此可见,不同林型的不同土层样本之间土壤真菌群落组成存在差异。

图1 不同林型不同土层土壤真菌门水平群落组成Fig.1 Soil fungal communities at the phylum level under different five forest typesPi_O,马尾松纯林O层土壤; Pi_A,马尾松纯林A层土壤;Ci_O,香樟纯林O层土壤;Ci_A,香樟纯林A层土壤;Sc_O,木荷纯林O层土壤;Sc_A,木荷纯林A层土壤; Pi_Ci_O,马尾松-香樟混交林O层土壤; Pi_Ci_A,马尾松-香樟混交林A层土壤;Pi_Sc_O,马尾松-木荷混交林O层土壤; Pi_Sc_A,马尾松-木荷混交林A层土壤;O层:腐殖质层土壤;A层:淋溶层土壤
2.2.3群落结构及其与土壤环境因子间的关系
主坐标分析(PCoA)结果表明(图2),PC1轴解释了土壤真菌群落结构变异量的21.97%,且该轴将不同林型的土壤真菌群落区分为两个大的类群,由图2中可以看出,Pi、Sc、Pi_Sc的土壤真菌群落分布在PC1轴的右侧,而Ci和Pi_Ci则分布在左侧。而PC2轴解释了土壤真菌群落结构变异量的19.68%,且不同土层在PC2轴上区分开来,O层基本分布在PC2轴的下半部分,而A层则聚集在PC2轴的上半部分。置换多元(因素)方差分析(PERMANOVA)分析结果表明,森林类型、土层及两者交互作用均对土壤真菌群落结构产生显著影响(P=0.001);林型和土层交互作用的R2值为0.84041,林型的R2值为0.4112,土层的R2值为0.17492,说明林型对土壤真菌群落结构的影响大于土层。

图2 不同林型不同土层土壤真菌群落PCoA分析Fig.2 Principal coordinates analysis of soil fungal communitiesPCoA分析:主坐标分析 Principal co-ordinates analysis; PC: 主成分 Principal component
RDA分析结果(图3)表明,土壤pH值对真菌群落影响最大(P=0.001),其次为CEC和SOC(P值分别为0.002和0.003),TN含量也显著影响真菌群落结构(P=0.004),而TP和TK对真菌群落结构的影响不显著。

图3 不同林型不同土层土壤真菌群落与土壤性质的RDA分析Fig.3 Redundancy analyses to reveal soil fungal communities in different forest types and correlations with edaphic propertiesRDA分析:冗余分析 Redundancy analysis; 环境因子箭头的长短可以代表环境因子对于物种数据的影响程度的大小; NH4_NO3; 硝态氮与铵态氮的比值,即NH4∶NO3;pH:酸碱度 Potential of hydrogen;TP:土壤全磷 Total phosphorus;TN:土壤全氮 Total nitrogen;CEC:土壤阳离子交换量 Soil cation exchange capacity;SOC:土壤有机碳 Soil organic carbon
2.2.4不同林型中差异菌分析
通过分析发现,除Pi_Ci外,其他林型都有一些特征菌(表4)。Russula、Geminibasidium、Tomentella、Sebacina属及Russulaceae和Herpotrichiellaceae科在Pi土壤中的相对丰度显著高于其他四个林型,且其他四个林型中这些真菌的丰度很低或未检出。Ci土壤中的Mortierella属相对丰度是Pi、Sc及Pi_Sc三个林型的三倍之多,且Hygrocybe属只出现在Ci林型中。而Sc土壤中Cladophialophora、Sarcodon、Paecilomyces、Chloridium及Chamaeleomyces的相对丰度显著高于其他林型。而Venturiales目和Penicillium属在Pi、Sc及Pi_Sc中丰度都相对较高,且Pi_Sc中这两类真菌含量显著高于Ci和Pi_Ci,且Ci和Pi_Ci中未检出Venturiales。

表4 不同林型之间有显著差异的土壤真菌的相对丰度Table 4 The abundance of soil fungi showing significant difference in five forest types
表5相关性分析表明,Ci中含量丰富的Mortierella和Hygrocybe与土壤pH值、总磷含量及硝态氮含量呈显著正相关,且Mortierella与土壤NH4∶NO3呈显著负相关。Pi中含量高的Russulaceae与土壤TN、SOC及NO3-N呈负相关,而Sebacina与pH呈显著负相关。Sc中相对丰度最高的Sarcodon、Chloridium及Chamaeleomyces均与TK呈显著负相关,后两者与NH4-N呈显著正相关;且Sarcodon与CEC、TN、TP及TK呈显著负相关,与NH4∶NO3呈正相关。而Venturiales除了与pH无相关性、与NH4∶NO3呈正相关外,与其他所有土壤指标呈显著负相关关系;且Penicillium也与大多数土壤性质呈显著负相关,与pH、SOC、及NH4-N无相关性。

表5 不同林型差异菌与土壤性质的相关性分析Table 5 The correlation between significantly different fungi and soil properties
3 讨论

土壤微生物是生态系统中重要的分解者,其多样性和组成在土壤健康调控中起关键作用[32]。而真菌是土壤微生物的重要组成部分,在营养物质循环、能量流动过程中起着重要作用,土壤真菌是评价土壤质量的关键指标[33]。在酸沉降区域,对受损马尾松纯林进行阔叶林替代或林下补值阔叶树种形成针阔混交林是常用的营林措施[18]。研究发现种植香樟,如香樟纯林和马尾松-香樟混交林,其土壤细菌群落结构和组成优于马尾松纯林、木荷纯林以及马尾松-木荷混交林,有利于缓解土壤酸化[18, 20]。
研究发现,香樟纯林的土壤真菌多样性高于其他林型,这应该与香樟纯林土壤酸化没有其他林型严重有关;且多样性指数与土壤酸化指标(pH值、CEC、NH4∶NO3)显著相关,说明土壤酸化缓解后有利于土壤真菌多样化,这与对细菌多样性的影响一致[20]。张义杰等[34]发现,在酸化土壤中施用生石灰后能提高土壤pH的同时,也显著增加了真菌多样性指数,这与本文研究结果一致。土壤真菌群落多样性发生变化的同时,不同林型的真菌群落结构也发生显著变化,而且从PCoA图可以看出土壤O层和A层的真菌群落结构分化明显,Stone等[35]同样发现土壤深度是影响微生物群落结构的主要因子,这主要是由于不同深度土壤理化性质的差异造成的[36],而这种理化性质之间的差异主要是由于地上凋落物和细根周转对表层土壤的影响要大于深层土壤[37]。从PCoA图上还可以看出,不同林型的真菌聚成两大类,香樟纯林和马尾松-香樟混交林的真菌群落结构更相似,而马尾松纯林、木荷纯林与马尾松-木荷混交林的真菌群落结构更接近,这与五个林型下土壤细菌群落结构表现一致[20]。同样,RDA分析结果表明,反应土壤酸化特征的pH、CEC对真菌群落结构的影响最显著,真菌群落多样性与这些指标呈正相关,表明土壤真菌群落多样性和结构的差异与不同林型下土壤酸化程度存在密切相关性。其次,SOC、TN两项土壤性质也同样显著影响真菌群落结构,这与刘立玲等[38]的研究结果是一致的,均认为SOC、TN与真菌群落结构的变化密切相关[39]。这是因为碳和氮是真菌的营养元素,为真菌提供养分来源。同时土壤的碳氮水平影响着真菌分解有机物的酶的合成,从而对真菌群落结构产生影响[40]。又有研究表明,无论是松树林、橡树林还是草地,土壤的SOC和TN含量随着土层变深而递减,其垂直分布呈“倒三角”趋势[41],这也很好地解释了PCoA图中显示的土壤O层和A层的真菌群落结构分化明显的现象。
通过对不同林型土壤真菌多样性差异的分析,发现在香樟纯林中Mortierella和Hygrocybe这两属真菌明显高于其他林型。Mortierella为溶磷菌,是参与土壤磷循环的重要微生物类群,能增加土壤中有效磷含量,对植物生长有促进作用[42],而且也有利于其他微生物对磷的吸收利用[43]。在本研究中,Mortierella与土壤有效磷呈显著正相关(表4),表明该菌的丰度越高土壤中的磷含量越多,这与土壤总磷含量结果也一致,从而有利于植物生长。Zhang等[44]研究证实土壤酸化显著降低了Mortierella的相对丰度,这与本文研究结果一致,相关性分析表明该菌丰度与土壤pH呈显著正相关,土壤pH越低的土壤中该菌丰度相对较低。另外,有研究表明,Mortierella属的很多种类参与降解植物残体以及土壤有机污染物的降解,能有效促进土壤碳循环,保持土壤的健康状况[45—46];且该属真菌对土传病菌镰孢菌(Fusariumspp.)有一定的抑制能力[47—48]。因此,在受损马尾松林地种植香樟后,Mortierella丰度大大提高,有利于土壤健康和植物生长。只在香樟林中出现的Hygrocybe的营养模式和功能还不甚清楚[49]。
马尾松是典型的外生菌根树种。本文在马尾松纯林土壤中检测出Russulaceae、Russula、Tomentella以及Sebacina的相对丰度较高,而在其他林型中相对丰度则较低或未检出。Russula不仅是外生菌根真菌,也是嗜酸菌[50],偏好酸性环境,同时也产生丁酸[51]。作为外生菌根菌Sebacina属真菌能在逆境中提高宿主植物对土壤中营养元素的吸收,有利于宿主在逆境条件下存活[52]。Sebacina属真菌也是一类嗜酸菌,出现在低pH值和高腐殖质环境中[53],这与本研究结果一致,即Sebacina相对丰度与土壤pH值呈负相关,与SOC呈正相关。Geminibasidium为腐生菌,在马尾松纯林中丰度较高,该林型土壤pH值也是五个林型中较低的。王楠等[54]在对毛竹阔叶林土壤真菌结构的研究中发现,模拟酸雨胁迫下Geminibasidium相对含量发生显著变化,在酸度最高的酸雨处理下其相对丰度最高,由此认为该属真菌可以作为酸雨胁迫下土壤真菌群落结构变化的指示物种之一。

本文研究发现Venturiales和Penicillium真菌在马尾松纯林、木荷纯林以及马尾松-木荷混交林土壤中相对丰度比较高。Venturiales目中许多真菌都是重要的植物病原菌[61]。而Penicillium在自然界中分布极其广泛,促进碳氮磷等多种元素循环,是最有力的N2O产生菌之一[62],因此,在马尾松、木荷及其混交林土壤中该菌含量丰富可能会促进N2O的排放。Penicillium也是嗜酸菌和产酸菌,能产生大量有机酸[58]。在木荷纯林及其与马尾松混交林土壤中发生大量产酸菌,可进一步加速土壤酸化,丰富的植物病原菌则会对森林健康产生威胁。
4 结论
(1)马尾松纯林改造成香樟林后可缓解土壤酸化,提高土壤养分;而改造成木荷林后可能进一步加剧土壤酸化,降低土壤养分含量。
(2)不同林型土壤真菌群落多样性以香樟林最为丰富,且土壤pH值、CEC和NH4∶NO3显著影响真菌多样性。
(3)林型和土壤厚度均对真菌群落结构具有显著影响,且林型影响土壤酸度进而对真菌群落结构产生显著影响。香樟纯林中有益菌较多,而马尾松纯林以外生菌根真菌占优势,木荷及其与马尾松的混交林则含有更多的植物病原真菌和产酸菌。
