产前超声软指标联合染色体微阵列分析评估先天性心脏病胎儿预后
2023-09-27宋佳好向菁菁邓学东
宋佳好,姜 纬*,潘 琦,张 俊,杨 忠,向菁菁,唐 慧, 王 挺,邓学东
(1.南京医科大学姑苏学院 南京医科大学附属苏州医院 苏州市立医院超声中心,2.生殖与遗传中心,江苏 苏州 215002)
先天性心脏病(congenital heart disease, CHD)是最常见的出生缺陷,在活产儿中发病率约9/1 000[1-2],主要包括室间隔缺损(ventricular septal defect, VSD)、房间隔缺损(atrial septal defect,ASD)、房室间隔缺损(atrioventricular septal defect, AVSD)、圆锥动脉干畸形、左右心室流出道梗阻、复杂心脏畸形、内脏异位综合征及肺静脉异位连接等[3],病因复杂,具有高度异质[4],且目前对于基因型-表型关系及我国人群与CHD相关复发性拷贝数变异(copy number variant, CNV)尚未完全明了。本研究观察产前超声软指标联合染色体微阵列分析(chromosomal microarray analysis, CMA)评估CHD胎儿预后的价值。
1 资料与方法
1.1 研究对象 回顾性分析2019年1月—2022年9月320胎于南京医科大学附属苏州医院经产前超声心动图诊断为CHD且接受CMA的单胎胎儿,孕妇年龄18~45岁、中位年龄29.0岁,侵入性产前诊断时孕周15~33周、中位孕周24.9周,经出生后超声心动图或经病理解剖证实CHD,且临床资料完整。排除凝血功能异常、穿刺部位感染或有致畸物质接触史孕妇。本研究经院伦理委员会批准(编号:K-2022-121-K01),检查前孕妇及家属均签署知情同意书。
1.2 仪器与方法 采用Philips Affiniti 70及Samsung WS80A彩色多普勒超声诊断仪。嘱孕妇仰卧,由1名具有5年以上产前超声诊断经验的超声科医师以CDFI及频谱多普勒观察胎儿心脏[5]并结合超声软指标[6-10](表1)将其分为A组(单一心脏畸形,n=153)、B组(多发心脏畸形组,n=70)、C组(心脏畸形合并超声软指标异常,n=75)、D组(心脏畸形合并心外畸形,n=14)及E组(心脏畸形合并超声软指标异常及心外畸形,n=8)。

表1 常见超声软指标异常及诊断标准
1.3 CMA 采用Affymetrix©CytoScanTMSNP array技术平台进行CMA及数据分析。参考美国医学遗传学会指南[11]将CNV分为致病性、可能致病性、临床意义不明、可能良性及良性。
1.4 随访 随访至引产后或出生后3~6个月,记录妊娠结局、新生儿超声心动图检查结果、生长发育情况及术后情况等。不良妊娠结局包括流产、引产及新生儿死亡等。
1.5 统计学分析 采用SPSS 26.0统计学分析软件。以χ2检验或Fisher精确概率法比较计数资料;采用二元logistic回归分析影响妊娠结局的因素。P<0.05为差异有统计学意义。
2 结果
2.1 胎儿超声心动图及CMA VSD为最常见心脏畸形[49.38%(158/320)];35胎(35/320,10.94%)CMA结果异常。见表2。
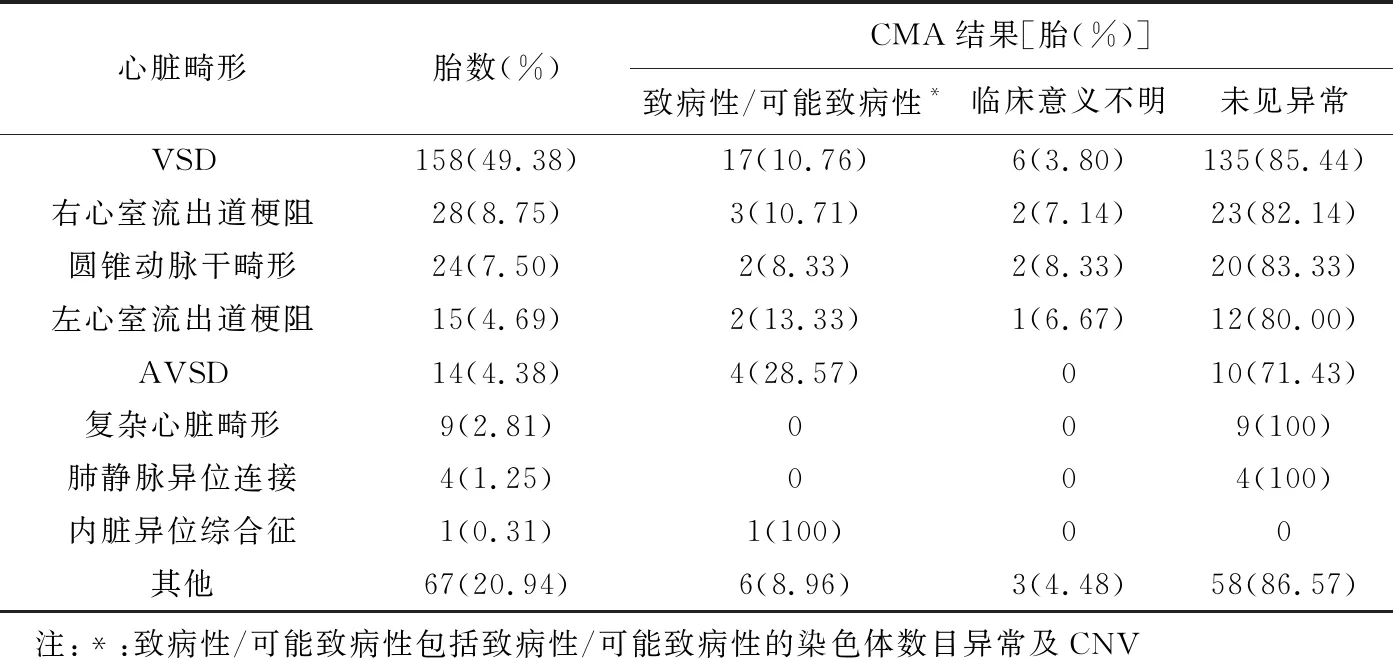
表2 320胎CHD CMA结果
35胎CMA异常,其中32胎(32/35,91.43%)为致病性变异,包括14胎为染色体数目异常(6胎21三体、3胎18三体、3胎47,XXN、2胎45,X)、14胎微缺失/微重复(片段≤5 Mb,分别为4胎22q11.21微缺失、17q12、1q21微重复各2胎、1胎22q11.21微缺失合并17q12微缺失、17q23、16p13.3、16p11.2及15q11.2微缺失各1胎、16p11.2微重复1胎)、4胎缺失或重复(片段>5 Mb,含图1所示22q13.2q13.33和4p16.3p16.1、15q11.2q13.1及18p11.32p11.21缺失各1胎),其余3胎为可能致病性CNV(Xp21.1微重复、3q26.33q27.3微缺失及15q26.3微缺失各1胎);其CNV位点以1q21、15q11.2、16p11.2、17q12及22q11.21异常较多。
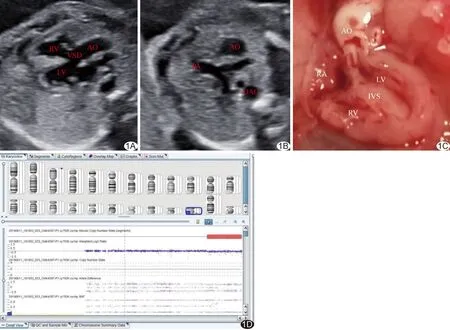
图1 法洛四联症胎儿,妊娠20周 A.产前超声左心室流出道切面图示VSD及主动脉骑跨; B.三血管切面图示肺动脉内径小于主动脉; C.引产标本图示主动脉骑跨室间隔; D.CMA显示胎儿染色体22q13.2q13.33区域存在7.60 Mb DNA片段嵌合型缺失(红色长方形) (RV:右心室;LV:左心室;AO:主动脉;PA:肺动脉;DAO:降主动脉;RA:右心房;IVS:室间隔)
21胎致病性/可能致病性CNV片段大小为0.22~12.21 Mb;其中16胎父母未接受芯片验证,5胎经父母芯片验证发现1胎遗传自表型正常父体、2胎遗传自表型正常母体、2胎为新发拷贝数变异。
2.2 其他异常超声表现 A~E组致病性/可能致病
性染色体异常率分别为5.23%(8/153)、10.00%(7/70)、17.33%(13/75)、21.43%(3/14)及50.00%(4/8);C组及E组均高于A组(χ2=8.82,P=0.003;P=0.001)。C组62胎(62/75,82.67%)单一超声软指标异常,其中9胎(9/62,14.52%)为致病性/可能致病性染色体异常;13胎(13/75,17.33%)多发超声软指标异常,其中4胎(4/13,30.77%)为致病性/可能致病性染色体异常;其间致病性/可能致病性染色体异常率差异无统计学意义(χ2=1.01,P>0.05)。合并鼻骨发育不良、轻度肾盂扩张、心室点状强回声时,致病性/可能致病性染色体异常率分别为50.00%(3/6)、28.57%(2/7)及16.67%(1/6)。心外畸形中,颈部淋巴水囊瘤、肺囊腺瘤及唇腭裂发病率较高,分别为1.25%(4/320)、0.94%(3/320)及0.63%(2/320)。
2.3 随访及预后 277胎随访资料完整,随访成功率86.56%(277/320)。其中71胎(71/277,25.63%)妊娠结局不良(不良组),包括69胎人工流产、1胎自然流产及1例新生儿死亡;206胎妊娠结局良好(良好组)。出生后超声心动图显示产前漏诊1胎VSD、1胎原发孔型ASD,误诊1胎右心室双出口为完全型大动脉转位,其余274例出生后超声心动图或病理解剖结果与产前所见相符。组间产前超声及CMA结果差异均有统计学意义(P均<0.001),见表3。二元logistic回归分析结果显示,侵入性产前诊断时孕周[OR=0.82,95%CI(0.68,0.98),P=0.025]、产前超声所见[OR=10.97,95%CI(4.37,27.58),P<0.001]及CMA结果[OR=37.22,95%CI(10.12,136.85),P<0.001]均为CHD胎儿预后的独立影响因素。

表3 不同妊娠结局胎儿产前心脏超声及CMA结果比较(胎)
3 讨论
本研究CHD胎儿致病性/可能致病性染色体异常率为10.94%(35/320),低于既往报道[12-13];AVSD、左心室流出道梗阻及VSD胎儿CMA异常占比较高。本组AVSD胎儿多染色体数目异常,亦存在致病性CNV,提示对于此类胎儿应早行CMA以除外相关遗传性疾病。
本研究C、E组胎儿致病性/可能致病性染色体异常率显著高于A组,提示产前超声发现CHD时检测超声软指标具有重要意义[14];B组致病性/可能致病性染色体异常率高于A组,但差异无统计学意义,与既往报道[15-16]相符,表明复杂心脏畸形可能由多种因素所致。
CNV与CHD相关[17-18],目前CMA已可检出CNV的位置、大小和类型。本研究结果显示,CHD胎儿中致病性/可能致病性CNV位点以22q11.21、1q21、17q12、16p11.2及15q11.2检出率较高。22q11.21微缺失综合征最为常见,其发病率约1/4 000,且胎儿多伴CHD、腭裂等表现[19],相关CHD类型以圆锥动脉干畸形如法洛四联症、共同动脉干等为主[20],但本组病例未见胸腺发育不良或缺如。末端1q21.1微重复外显率约29.1%[21],临床表现包括发育迟缓、自闭综合征及CHD等畸形[22],Cx40基因缺失小鼠可见AVSD或VSD[23]。17q12微重复外显率约21.1%,临床表现包括智力发育迟缓、食管闭锁、肾脏异常等。HNF1β基因突变可致肾脏囊性改变[24-25]。本研究未见胎儿肾脏异常,但1胎新发17q12微重复胎儿产前超声见右位主动脉弓伴左位动脉导管、迷走左锁骨下动脉。16p11.2微缺失综合征临床表现为智力发育迟缓、椎体畸形、CHD等。30.86%(25/81)的16p11.2微缺失综合征胎儿存在CHD,且以VSD为主[26]。位于断裂点1和2(BP1-BP2)之间的15q11.2缺失与CHD如左心室流出道梗阻、VSD及主动脉缩窄等相关[27]。
综上,产前超声及CMA结果对于评估CHD胎儿预后具有重要意义;超声软指标异常提示基因组异常风险增高。
