孕囊型与包块型剖宫产瘢痕妊娠的超声特征及临床特点分析
2023-09-27胡孝辉桂霜
胡孝辉,桂霜
作者单位:1.201204 上海,同济大学附属第一妇婴保健院妇科;2.201999 上海,上海交通大学医学院附属第九人民医院超声医学科
近年来随着剖宫产术的增加及国家生育政策的放宽,剖宫产瘢痕妊娠(cesarean scar pregnancy,CSP)的发病率逐年上升,根据其超声内部回声可总体分为孕囊型剖宫产瘢痕妊娠(gestational cesarean scar pregnancy,GCSP)与包块型剖宫产瘢痕妊娠(mass cesarean scar pregnancy,MCSP),MCSP为GCSP流产不全,残留妊娠组织种植于薄弱的下段瘢痕处,不断长大侵蚀前壁肌层并出血所形成的[1],MCSP比GCSP发展更快,凶险性极高,需临床高度重视。本研究比较分析GCSP与MCSP的超声特征及临床特点,旨在获取经验和教训,避免出现难以控制的大出血、周围脏器损伤甚至子宫破裂等威胁妇女健康的事件发生。
1 资料与方法
1.1 研究对象及一般临床资料
收集2016年8月至2021年12月在上海交通大学医学院附属第九人民医院经临床随访或病理确诊的CSP患者108例,孕周≤12周,根据超声特征分为GCSP 86例,MCSP 22例。GCSP组86例,均为首次在我院就诊的病例,无关于本次妊娠的手术史及药物流产史;年龄21~45岁,平均(30.19±5.49)岁,停经35 d~84 d,平均(42.97±7.49)d,剖宫产史次数为1~2次,平均(1.35±0.48)次,距离前次剖宫产手术时间0.75~15年,平均(7.60±3.76)年,人工流产次数为0~3次,平均(1.70±0.617)次,术前血β-hCG值687~105 353 U/L,平均(33 552.87±32 696.43)U/L,术后3 d血β-hCG值100.9~29 524 U/L,平均(6 259.35±8 020.00)U/L,阴道出血60例。
MCSP组22例,其中13例为外院不全清宫后,9例为药物流产后,并排除正常宫内孕不全流产的妊娠残留及滋养细胞疾病;年龄32~46岁,平均(33.11±3.00)岁,停经42~66 d,平均(45.50±4.06)d,剖宫产史次数1~2次,平均(1.43±0.51)次,距离前次剖宫产手术时间3.5~12.8年,平均(7.67±2.76)年,人工流产次数为1~3次,平均(2.05±0.50)次。术前血β-hCG值457~25 688 U/L,平均(9 665.18±9 935.82)U/L,术后3 d血β-hCG值107.55~20 356 U/L,平均(598.43±749.65)U/L,阴道出血21例。本研究通过医院伦理委员会审批(伦理号为:KS23216),且患者知情同意。
1.2 仪器与方法
1.2.1 仪器 采用GE-voluson E8及SAMSUNG-WS80A超声诊断仪,腔内探头,频率为5.0~9.0 MHz;经腹探头,频率为2.0~5.0 MHz。
1.2.2 超声检查方法及分析内容 超声检查取膀胱截石位,经阴道检查需排空膀胱,经腹检查需适度充盈膀胱。超声图像及数据均由2名工作5年以上高年资超声医师采集。先对患者子宫及双侧卵巢、附件区行超声检查,重点观察子宫位置、宫底部子宫内膜厚度、病灶着床位置、大小、形态、边界、内部回声、有无卵黄囊、胚芽、盆腔积液、病灶局部与瘢痕的位置关系及瘢痕处剩余肌层的厚度。采用彩色多普勒超声(color doppler flow imaging,CDFI)观察病灶内部及周边的血流情况,血流分级标准采用何萍分级标准[2]:① 未见血流:未探及明显血流;② 少许血流:有1~2个点状血流,血流稀疏;③ 较丰富血流:3~4个点状血流,1~2条短线状血管;④ 丰富血流:多于4个点状血流、多于2条短线状血管,或成簇血流。并测量收缩期峰值流速(peak systolic velocity,PSV)及阻力指数(resistance index,RI)。
1.3 CSP超声诊断标准及分型标准
诊断标准[3]:① 宫腔上段及宫颈管内空虚,未见妊娠囊;② 妊娠囊着床于前壁下段瘢痕处肌层内,部分妊娠囊内可见卵黄囊、胚芽或胎心搏动;③ 子宫下段瘢痕处妊娠囊与膀胱之间的肌层明显变薄(≤5 mm)、甚至消失或仅见浆膜层;④ CDFI显示病灶周边或部分内部可见点状或短线状血流信号,频谱为高速低阻血流信号。分型标准[4]:① 孕囊型:子宫下段前壁瘢痕部位或下段宫腔内可见典型的妊娠囊声像,呈“双环征”;② 包块型:子宫下段前壁瘢痕部位(前次剖宫产切口处)见回声杂乱的混合回声团块,正常前壁瘢痕处肌层菲薄或消失,切口与肌层分界模糊。
1.4 手术方式选择及病理诊断
所有病例术前均行子宫动脉栓塞术(uterine artery embolization,UAE)。GCSP组86例,对于生命体征平稳的,孕周≤8周,孕囊仅局限于子宫下段未突向膀胱的80例行UAE+超声引导下清宫术,6例因下段孕囊较大突向膀胱、剩余肌层<3 mm行UAE+宫腔镜下妊娠物清除术。MCSP组22例,10例包块较小(最大径<25 mm)且局限于下段行UAE+超声引导下清宫术,2例包块较大(最大径<35 mm)、剩余肌层厚度>3 mm行UAE+宫腔镜下妊娠物清除术+放置宫内节育器,10例因首次治疗失败、包块较大(最大径>45 mm)、阴道出血多、剩余肌层厚度<3 mm、血供丰富且有生育要求行UAE+开腹(6例)或腹腔镜(4例)下子宫下段切开妊娠物清除+下段瘢痕修复术,手术病理证实为瘢痕处CSP或妊娠组织残留。术中出血量取纱布重量+吸引器中集血量,1 g纱布≈1 mL血量。
1.5 统计学方法
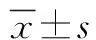
2 结果
2.1 两组超声特征比较
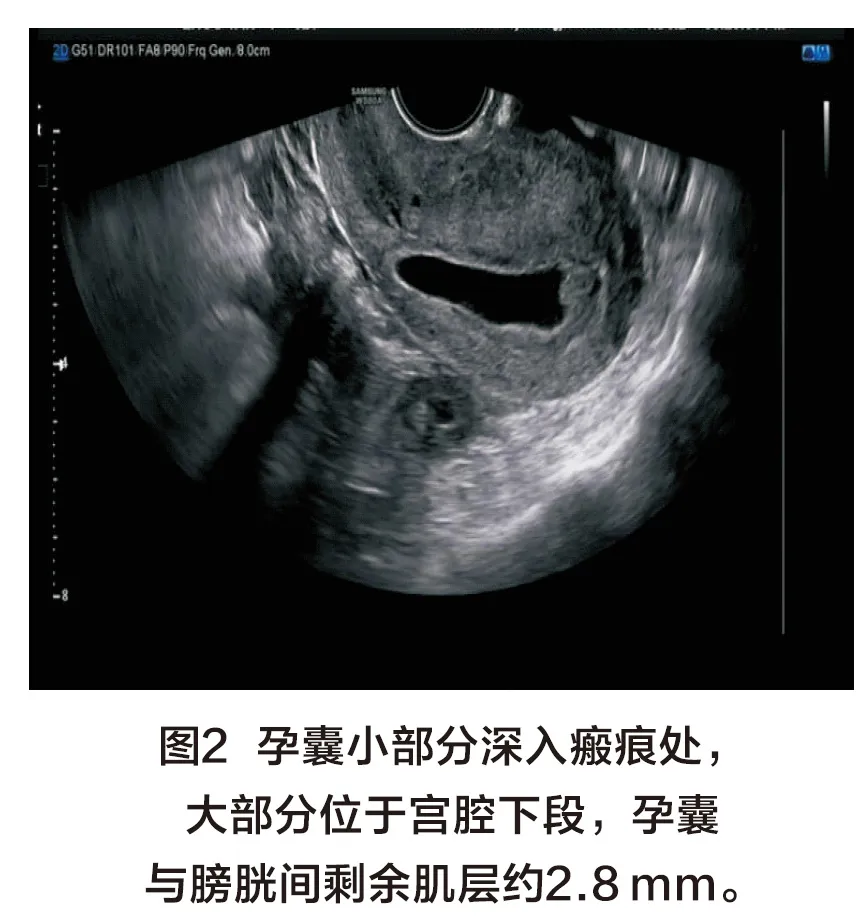
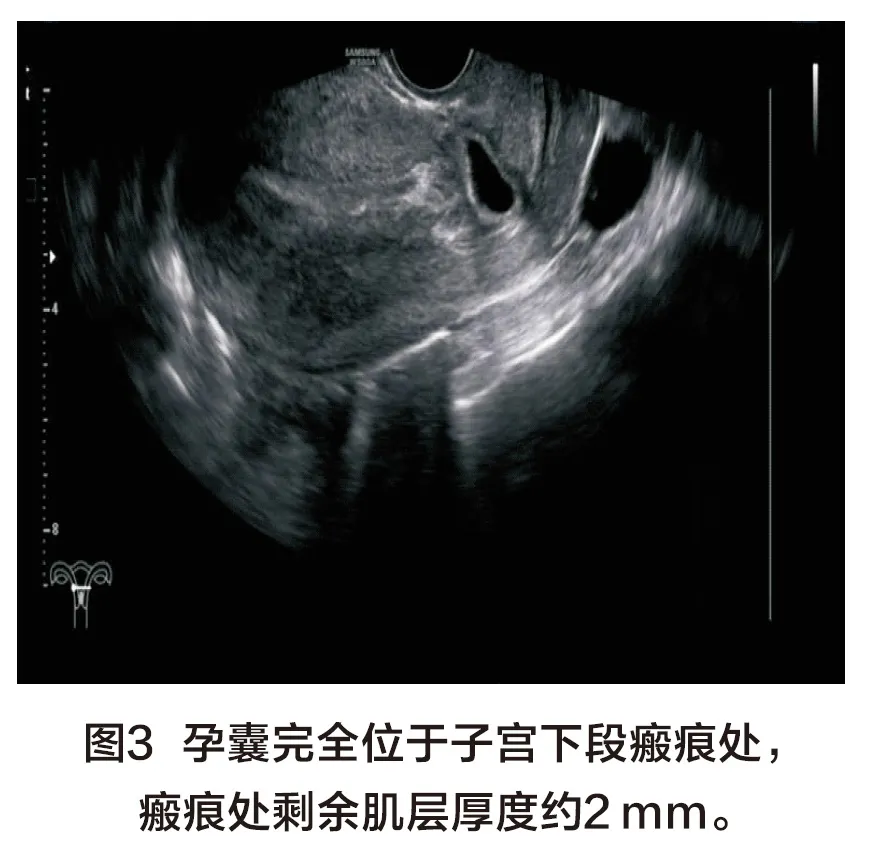
86例GCSP超声特征:超声表现为下段瘢痕处肌层内可见无回声孕囊样结构,宫腔及宫颈管内未见孕囊,孕囊最大径为12~65 mm,测量范围包括无回声孕囊和周围高回声绒毛组织。66例表现为孕囊小部分伸入或附着于瘢痕处,部分或大部分位于宫腔下段,其中38例(图1)瘢痕处剩余肌层>3 mm,28例(图2,彩插1)瘢痕处剩余肌层厚度≤3 mm;20例 (图3,彩插1)表现为孕囊完全位于瘢痕处肌层内,较大者可突向膀胱,剩余肌层明显变薄;在本组下段前壁瘢痕处剩余肌层厚度为1~5 mm,宫底部子宫内膜厚度约为6~17 mm;盆腔积液21例。CDFI:下段瘢痕处肌层可见滋养层血流信号,少许26例,较丰富及丰富60例,PSV:21~58 cm/s,RI:0.40-0.65。22例MCSP超声特征:子宫下段前壁瘢痕处可见强弱不等的混合回声包块(图4~5,彩插1),最大直径为16~82 mm,多为残留的妊娠组织及血块,没有明确的卵黄囊及胚芽结构,体积较大者突向膀胱,剩余肌层厚度明显变薄、甚至消失,本组瘢痕处剩余肌层厚度约0~3 mm;宫底部子宫内膜厚度约6~17 mm;盆腔积液6例。CDFI:包块周边及部分内部可见滋养血流信号,来源于瘢痕处肌层及子宫下段肌层内,少许血流1例,较丰富或丰富血流21例,PSV:25~60 cm/s,RI:0.35-0.55。GCSP与MCSP超声特征相比,在子宫位置、宫底部子宫内膜厚度及盆腔积液方面相比差异均无统计学意义(P>0.05);但在MCSP组内部回声更复杂,子宫下段病灶更大,血供较丰富、瘢痕处肌层更薄(P均<0.05),详见表1。
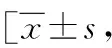
表1 两组超声特征比较例(%)]
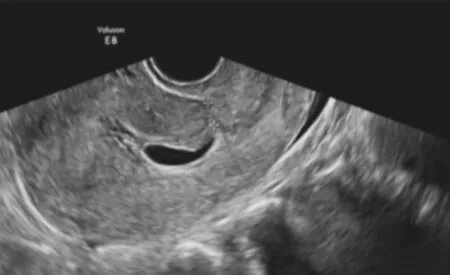
图1 GCSP组:孕囊小部分伸入瘢痕处,大部分位于宫腔下段,孕囊与膀胱间肌层厚度约5 mm,CDFI:孕囊周边少许血流信号

2.2 两组临床特点比较
两组在剖宫产次数、距离前次剖宫产时间方面比较差异均无统计学意义(P>0.05)。但MCSP组较GCSP组年龄大,停经天数长,流产次数、阴道出血病例多(P均<0.05)。手术方式上,GCSP组,80例行UAE+超声引导下清宫术,6例行UAE+宫腔镜下妊娠物清除术,术中出血量10~50 mL。MCSP组,10例行UAE+超声引导下清宫术,2例行UAE+宫腔镜下妊娠物清除术,10例行UAE+腹腔镜或开腹下子宫下段瘢痕处妊娠物清除术+瘢痕修复术,术中出血量35~500 mL;与GCSP组相比,MCSP组UAE+开腹或腹腔镜下子宫下段瘢痕处妊娠物清除术+瘢痕修复术比例高,术中出血量多,但术前及术后血β-hCG值均较低(P<0.05),详见下页表2。
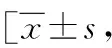
表2 GCSP组与MCSP组临床特点及诊疗情况比较例(%)]
3 讨论
CSP是指受精卵着床于前次子宫下段剖宫产切口处,仅限于早孕期(孕周≤12周),是一种少见的异位妊娠,发病率约为1∶1 800~1∶2 226[5]。关于CSP的发生机制尚不清楚,国内外学者认为由于剖宫产手术及宫内有创操作使内膜基底层及肌层受到损伤,愈合过程中形成瘘道或裂隙[6],当受精卵在瘘道周围位置着床,被子宫肌层及纤维组织包围后,就形成了CSP[7]。超声以其简单、无创、可重复性高等优点,已成为诊断CSP首要的影像学检查手段。CSP由于子宫下段肌层菲薄,临床不及时诊断处理会发生大出血、子宫破裂危及患者生命安全[8]。本研究总结分析CSP的超声特征和临床特点,获取经验,避免危险事件的发生。
根据超声内部特征,本研究将108例CSP总体分为GCSP与MCSP。两组的超声特征如下:① 内部回声及结构:86例GCSP超声均表现为瘢痕处见无回声孕囊样结构,66例表现为孕囊小部分位于瘢痕处大部分位于宫腔下段,其中38例瘢痕处剩余肌层>3 mm,28例瘢痕处剩余肌层厚度≤3 mm;20例表现为孕囊完全位于瘢痕处肌层内,不突向宫腔,瘢痕处剩余肌层厚度≤3 mm;部分发育良好的孕囊内可见卵黄囊、胚芽、甚或胎心。22例MCSP组超声均表现为瘢痕处可见混合回声包块,为GCSP盲目清宫或流产不全后残留的妊娠组织出血与周围组织共同形成混合性包块[1],因此内部无法探测到发育正常的卵黄囊及胚芽结构。② 病灶最大径:GCSP组最大径测量包括无回声孕囊和周围高回声绒毛组织,MCSP组取混合回声最大径。病灶最大径MCSP组大于GCSP组,可能与MCSP组中残留妊娠组织在子宫下段不断生长、出血、向外膨胀所致。③ 瘢痕处剩余肌层厚度:MCSP组明显薄于GCSP组,可能与残留的妊娠物使下段肌层的收缩力削减,在瘢痕处继续生长、相互粘连并不断侵蚀前壁肌层向浆膜层生长使肌层变薄所致。④ 病灶血供情况:MCSP组血供较GCSP组丰富,可能与GCSP首次清宫或盲目流产失败后,有创操作使瘢痕处肌层内病灶血供形成动静脉瘘有关。⑤ 两组子宫位置、宫底部内膜厚度、盆腔积液差异无统计学意义。前位或后位子宫不会对瘢痕处肌层的愈合造成影响,不会影响裂隙的形成及受精卵着床于此,MCSP由GCSP演变而来,因此两组子宫位置差异无统计学意义。GCSP组与MCSP组在β-hCG影响下宫底部内膜均呈蜕膜样反应,因此厚度方面差异无统计学意义。本研究中GCSP与MCSP均局限于子宫内,未发生肌层断裂及子宫破裂,因此盆腔积液差异无统计学意义。
两组临床特点如下:86例GCSP为首次在我院就诊的病例,无关于本次妊娠的手术史及药物流产史;22例MCSP均有不良手术或治疗史,其中13例为外院不全清宫后,9例为药物流产后,并排除正常宫内孕流产后的妊娠残留及滋养细胞疾病;前者为结合正常宫内孕病史,不全流产后宫腔或宫腔下段可见混合回声,CDFI:周边及内部可见血流信号,与瘢痕位置疏远;后者是滋养细胞的异常增殖引起的,超声显示宫腔内团状无回声区,呈‘落雪征’,周边及内部可见较丰富的高速低阻型滋养层血流,类似于动静脉瘘,与瘢痕关系不密切,β-hCG异常增高(高于正常的5~10倍)。① 两组一般临床资料:MCSP组较GCSP组年龄大、停经天数长、流产次数多,因此对于高龄、有多次流产史、停经天数长的育龄期妇女,应警惕GCSP清宫术或流产失败后发展成MCSP的危险。MCSP组中阴道出血病例多,可能与MCSP多为胚胎发育不良或有治疗史有关。② 术前血β-hCG:GCSP组术前血β-hCG值比MCSP组高,与姜丽等[10]学者研究结果不符,GCSP多为胚胎发育较好的妊娠,符合临床情况;也可能因为本组MCSP为GCSP不全清宫或服用流产药后,妊娠组织被部分清除或杀死,活性减低有关。③ 手术方式:MCSP组UAE+开腹或腹腔镜下瘢痕处妊娠物清除术+瘢痕修复术比例较GCSP组高。在GCSP组,对于生命体征平稳,孕周≤8周的,80例(80/86,93.0%)行UAE+超声引导下清宫术,及后续甲氨蝶呤口服治疗,该治疗方式简便、出血少、恢复快[11]。6例(6/86,7.0%)行UAE+宫腔镜下妊娠物清除术,报道称[12-14],宫腔镜下妊娠物清除术具有一定效果,但缺乏临床数据,且宫腔镜仅局限于妊娠物清除,不能切除瘢痕及修复薄弱的子宫前壁肌层。在MCSP中,10例(10/22,45.5%)行UAE+超声引导下清宫术,2例(2/22,9.0%)行UAE+宫腔镜下妊娠物清除术。对于子宫下段包块较大,瘢痕处肌层菲薄甚至消失,血供丰富的,且有生育要求并希望修补子宫恢复正常结构的采用开腹或腹腔镜下治疗[13-15],本组中10例行UAE+腹腔镜或开腹子宫下段瘢痕处妊娠物清除术+瘢痕修补术(10/22,45.5%)。④ 术中出血量:MCSP组开腹或腹腔镜下手术治疗比例高,因此术中出血量多于GCSP组。⑤ 术后3 d血β-hCG值:MCSP组在术后3 d血β-hCG值小于GCSP组,可能因为MCSP组多在可视情况下腹腔镜或开腹直接清除妊娠物有关。
CSP是一种危险的妊娠,对于有剖宫产史再次妊娠孕妇,超声可较准确判断孕囊与瘢痕切口的位置关系,能早期且准确地诊断。MCSP较GCSP超声特征更复杂、临床处理更棘手,因此对于GCSP,一定要提高初次治疗的成功率,避免发展为MCSP。
利益冲突所有作者均声明不存在利益冲突。
