辣椒根腐病生防菌的筛选鉴定及生防作用
2023-09-26李树江张韵霞周闯闯张芝琴杨友联张晓勇
李树江 张韵霞 刘 羽 周闯闯 张芝琴 冯 道 杨友联 吴 迪 张晓勇*
(1 六盘水师范学院生物科学与技术学院,贵州六盘水 553004;2 六盘水市农业科学研究院,贵州六盘水 553000)
辣椒根腐病是典型的土传病害,可引起辣椒根系和近地面茎秆木质部、韧皮部坏死,导致辣椒不能输送水分和营养物质,在发病初期植株叶片会出现白天萎蔫,晚上恢复状态的现象,发病后期地下部分根系和茎秆全部坏死,地上部分干枯死亡,引起辣椒严重减产(郝蓉蓉 等,2015)。多种病原菌可引起辣椒根腐病,其中镰刀菌属(Fusarium)病原菌最多,如串珠镰刀菌(F.moniliforme)、半裸镰刀菌(F.semitectum)、茄镰刀菌(F.solani)、尖孢镰刀菌(F.oxysporum)、爪哇镰刀菌(F.javanicum)、拟枝孢镰刀菌(F.sporotrichioides)、黄色镰刀菌(F.culmorum)、 木贼镰刀菌(F.eguiseti)、短肥镰刀菌(F.brachygibbosum)和藤仓镰刀菌(F.fujikuroi)(陈彦 等,2008;方晓翠,2016;Li et al.,2018;Naz et al.,2018)等,存在着明显的多样性。目前农业生产上主要运用农业防治和化学防治方法来防控辣椒根腐病,但长期大量施用化学杀菌剂极易造成土壤污染、农作物农残超标、引起土壤菌群失调和提高病原菌的抗药性等诸多问题,最终加重土壤的连作障碍(姜飞 等,2010;张秀玲,2013)。
生物防治是近年研究的热点,相较化学防治方法,生物防治具有生产安全、健康环保、无公害等优点(李凯和袁鹤,2012)。近年来国内外针对辣椒根腐病的生物防治技术开展了大量研究,如解淀粉芽孢杆菌(Bacillusamyloliquefaciens)、枯草芽孢杆菌(B.subtilis)、黄绿木霉(Trchoderma aureoviride)和短密木霉菌(T.brevicompactum)等相关微生物活体菌剂可通过与病原菌营养竞争、微寄生、分泌抑菌物质以及诱导植物产生抗性等对辣椒根腐病发挥良好的防治效果,已被广泛运用于农业生产中(高亮,2015;朱萍萍 等,2015;李晓宇,2018;申君 等,2022)。
本试验拟开展辣椒根腐病高效生防菌的筛选,通过形态学、分子生物学方法对生防菌进行鉴定,对生防菌的抑菌活性和对辣椒根腐防治效果进行检测,并探究生防菌最佳培养条件,以期为辣椒根腐病生物防治提供理论及技术支撑。
1 材料与方法
1.1 试验材料
供试辣椒根腐病病原菌为六盘水地区辣椒根腐病主要种茄镰刀菌(F.solani),由六盘水师范学院微生物课题组分离及鉴定。将茄镰刀菌单点接种于PDA 培养基内,在25 ℃条件下培养3 d 进行活化。
供试辣椒品种为澳冠8899 线椒(河北省青县艾森蔬菜优良品种推广中心选育)。
1.2 生防菌株的分离和筛选
试验于2021 年5—12 月在六盘水师范学院基础生物学实验中心开展。从健康辣椒根际土壤和腐殖质中分离辣椒根腐病生防菌。将土样放置于室内自然风干后,随机称取1.0 g 土样加入盛有9 mL无菌水的小三角瓶中,加入10 粒直径为2 mm 的灭菌玻璃珠,于150 r · min-1、25 ℃的摇床中震荡60 min 获得1 × 10-1倍的土壤悬浊液,再对悬浊液进行梯度稀释后获得1 × 10-4倍的稀释液,静置10 min 后取100 μL 上清液,在双抗PDA(100 mL 的PDA 培养基灭菌冷却至60 ℃时分别加入10 mg 硫酸链霉素和青霉素并混匀)平板上涂布均匀后置于25 ℃下培养,24 h 后用无菌解剖刀从菌落边缘挑取菌块至PDA 平板中进行1~2 次纯化,获得生防菌待筛菌株(陈梦 等,2021)。
以辣椒根腐病病原菌茄镰刀菌(F.solani)作为指示菌,以三点对峙培养法筛选对茄镰刀菌生长具有高效抑制效果的菌株。用孔径4 mm 无菌打孔器打取活化的茄镰刀菌菌落边缘菌块,接种于直径9 cm 的PDA 平板的中央,在中央菌块的上、左、右3 个方向且距离培养皿边缘1 cm 处分别接种待筛菌株直径为4 mm 的菌块。于25 ℃、自然光照下培养,待指示菌下侧菌丝长至平板的边缘后,测量对峙侧的菌落半径(mm),并计算生防菌对病原菌的抑制率(朱萍萍 等,2015),3 次重复。
抑菌率 = (对照侧半径-对峙侧半径)/对照侧半径×100%
在生防菌与茄镰刀菌菌丝对峙区域斜插1 片灭菌的盖玻片,培养3 d 后取下盖玻片制作临时装片,在显微镜下观察生防菌对茄镰刀菌的重寄生(hyperparasitism)情况。
1.3 生防菌株的鉴定
1.3.1 生防菌形态学鉴定 将生防菌接种于PDA平板上,25 ℃、自然光照下培养,待菌落表面产孢后,以乳酸酚棉兰染液为载浮剂制作临时装片,用奥林巴斯(Olympus)BX53 显微成像系统拍摄生防菌形态特征并测量大小。
1.3.2 生防菌分子鉴定 用无菌刀片刮取培养3 d 的生防菌菌丝,用改良的CTAB 法提取DNA(张颖慧 等,2008)。扩增的目的序列为内部转录间隔区(ITS),使用ITS 通用引物ITS4(TCCTCCGCTTATTGATATGC)和ITS5(GGAAGTAAAAGTCGTAACAAGG)(Nishikawa &Nakashima,2020)对待测生防菌ITS 序列进行PCR 扩增,扩增条件为94 ℃预变性3 min,94 ℃变性30 s,50 ℃退火20 s,72 ℃延伸30 s,循环35 次后于72 ℃延伸7 min(Woudenberg et al.,2013)。扩增产物经1.5%琼脂糖凝胶电泳检测后,由北京擎科生物科技有限公司进行纯化和双向测序。将所得序列在GenBank 数据库中进行对比,使用软件MEGA 11.0 采用NJ 法构建系统发育树,确定生防菌的分类地位。
1.4 生防菌发酵代谢产物对病原菌的抑制效果检测
在250 mL 的三角瓶里加入100 mL PD 液体培养基(去皮马铃薯200 g,葡萄糖20 g,水1 000 mL,自然pH),接入3 块直径为4 mm 的生防菌菌块,于25 ℃、160 r · min-1下震荡培养7 d 获得生防菌发酵液;将发酵液于10 000 r · min-1下离心10 min 后吸取上清液,再用0.22 μm 无菌微孔滤膜过滤2 次,得到无菌的发酵代谢产物粗溶液。待融化的PDA 培养基冷却至60 ℃后依次在其中分别加入体积分数为5%、10%、15%、20%的生防菌无菌代谢产物溶液,充分摇匀后倒成直径9 cm 平板,以不加代谢产物的PDA 平板作为对照。在上述平板正中央接种1 块4 mm 的茄镰刀菌小菌块,于25℃、自然光照下培养,待对照中茄镰刀菌长满平板时用十字交叉法测量各处理的菌落生长直径,计算代谢产物对茄镰刀菌菌丝生长的抑制率(张晓勇等,2021),3 次重复。
抑制率 = (对照菌落直径-处理菌落直径)/对照菌落直径× 100%
1.5 生防菌对辣椒根腐病的防治效果测定
在100 mL 的PD 液体培养基内分别接种3 块直径为4 mm 的茄镰刀菌和生防菌菌块,于25 ℃、160 r · min-1下震荡培养3 d 获得病原菌茄镰刀菌和生防菌液体菌种;将茄镰刀菌和生防菌液体菌种用无菌水分别稀释10 倍后获得茄镰刀菌菌液和生防菌菌液。
盆栽试验于2022 年3—8 月在六盘水市农业科学研究院科研温室开展。选取健康、饱满的澳冠8899 线椒种子,用1%次氯酸钠浸泡1 min,无菌水清洗5 次后播种至经高温灭菌的草炭土中,放置在25 ℃、光照时间10 h · d-1的光照室内进行隔离培养。待辣椒幼苗株高长至15 cm 时移栽至盛有灭菌草炭土的16 cm × 18 cm 育苗钵内,每钵6 株。待幼苗缓苗后根部接种生防菌(表1),测定生防菌对辣椒根腐病的防治效果和安全性。
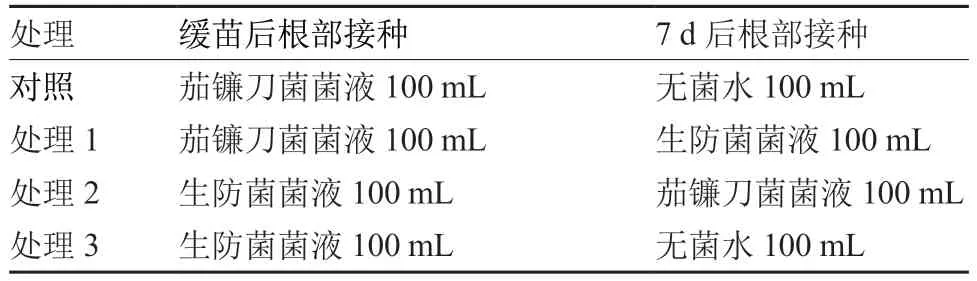
表1 生防菌株对辣椒根腐病防治效果测定处理设置
每个处理设置5 次重复,接种后置于25 ℃、自然光照条件下进行培养。15 d 后统计辣椒植株根腐病病株数,计算病株率(%);并采用0~9 级标准统计辣椒植株根腐病发病级别,计算病情指数(曲春鹤 等,2012)。
辣椒根腐病发病级别:0 级,根系正常生长;1 级,部分须根坏死变褐色;3 级,须根和主根部分坏死变褐色;5 级,坏死根系占30%~50%,植株叶片轻度萎蔫,傍晚可恢复;7 级,坏死的根系占50%~80%,植株地上部分萎蔫且不可恢复;9级,根系全部坏死并扩展至近地面茎部,地上部分全株枯萎。
病情指数 = ∑(各级病株数×病害级值)/(各处理总株数× 9)
相对防效 = (对照病情指数-处理病情指数)/对照病情指数× 100%
1.6 生防菌培养特性测定
1.6.1 pH 对生防菌菌丝生长量的影响 用1.0 mol ·L-1的HCl 或NaOH 将PD 液体培养基pH 值调节为3、4、5、6、7、8、9、10、11,然后分装入250 mL 三角瓶中,每瓶100 mL;在每瓶培养基中接种3 块直径4 mm 的生防菌菌块,于25 ℃、160 r ·min-1中震荡培养4 d。将纱布裁剪成10 cm × 10 cm小块,放入烘箱中烘至恒重后称量纱布质量(g);将培养后的生防菌菌液倒在3 层纱布上进行过滤,菌丝和纱布一起放于60 ℃下烘干至恒重并称量总质量(g),总质量减去纱布质量即为菌丝生长量(g)。
1.6.2 温度对生防菌菌丝生长的影响 在100 mL的pH 值为7.0 的PD 液体培养基中接种3 块直径4 mm 的生防菌菌块,并置于10、15、20、25、30、35 ℃和40 ℃的摇床中,160 r · min-1震荡培养4 d,菌丝生长量测定方法同1.6.1。
1.6.3 不同碳源对生防菌菌株生长的影响 以察氏液体培养基(硝酸钠3.0 g,磷酸氢二钾1.0 g,硫酸镁0.5 g,氯化钾0.5 g,硫酸亚铁0.01 g,蔗糖30.0 g,蒸馏水1 000 mL)(龙巧芳 等,2022)为基础液体培养基,将其中的蔗糖分别同质量替换为淀粉、葡萄糖、果糖、麦芽糖、乳糖、甘油,并将pH 值调节至7,在100 mL 的不同碳源液体培养基中分别接种4 块直径4 mm 的生防菌菌块,于160 r ·min-1、25 ℃中震荡培养4 d。菌丝生长量测定方法同1.6.1。
1.6.4 不同氮源对生防菌菌株生长的影响 以察氏液体培养基为基础液体培养基,将其中的硝酸钠分别同质量替换为尿素、蛋白胨、硝酸铵、酵母粉、牛肉膏和氯化铵,pH 值调节至7,在分别为100 mL 的不同氮源液体培养基中接种4 块直径4 mm的生防菌菌块,于160 r · min-1、25 ℃中震荡培养4 d。菌丝生长量测定方法同1.6.1。
1.7 数据处理与分析
使用DPS v7.05 软件进行方差分析,采用Microsoft Excel 2016 软件进行统计图绘制。
2 结果与分析
2.1 生防菌株的分离和筛选
从辣椒根际土壤和有机质土壤中分离出17 个真菌菌株,与茄镰刀菌(F.solani)进行三点平板对峙培养,筛选出2 株对茄镰刀菌生防效果达70%以上的菌株,其中编号为M20210527-2 的菌株抑制率高达79.29%,并能快速占据平板的大部分空间,对茄镰刀菌菌丝生长形成高效的抑制(图1-A、1-B)。通过插片培养,并于40×10 显微镜下进行观察,M20210527-2 菌株的菌丝能够缠绕重寄生于茄镰刀菌菌丝上,抑制茄镰刀菌菌丝生长(图1-C)。
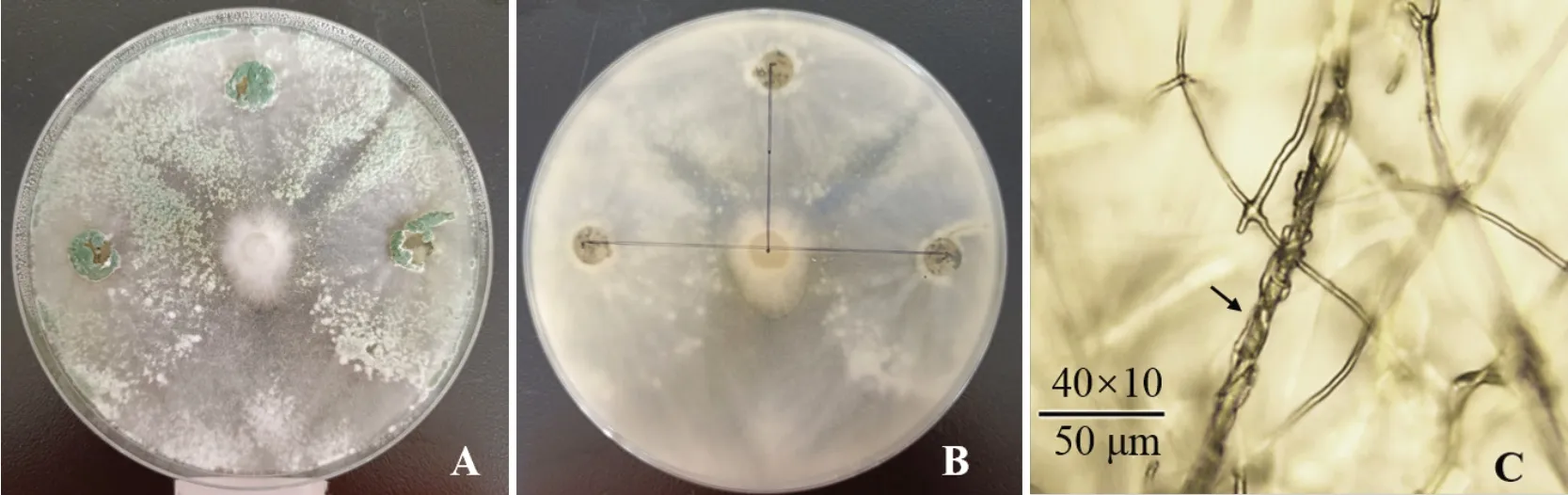
图1 生防菌株M20210527-2 对茄镰刀菌的抑制效果及生防特征
2.2 生防菌株的鉴定
2.2.1 形态学鉴定 生防菌株M20210527-2 在PDA 培养基上生长快速,生长速率为30 mm · d-1,前期菌落白色,蓬松,有明显的放射状纹,中央略隆起,老化产孢后表面呈青绿色(图2-A)。分生孢子梗直接在顶端形成瓶梗或二次分枝(图2-B);瓶梗轮状排列,安瓿瓶状,直或略弯曲,基部膨大,顶端尖细,长6.6~18.0 μm,宽2.0~4.7 μm;分生孢子单生,球形或卵圆形,在瓶梗顶端聚合成分生孢子头,大小(2.5~3.5)μm ×(2.2~3.4)μm,平均(3.0 ± 0.2)μm × (2.6 ± 0.2)μm(n= 40)(图2-C、2-D)。初步将菌株M20210527-2 鉴定为哈茨木霉(Trichodermaharzianum)。
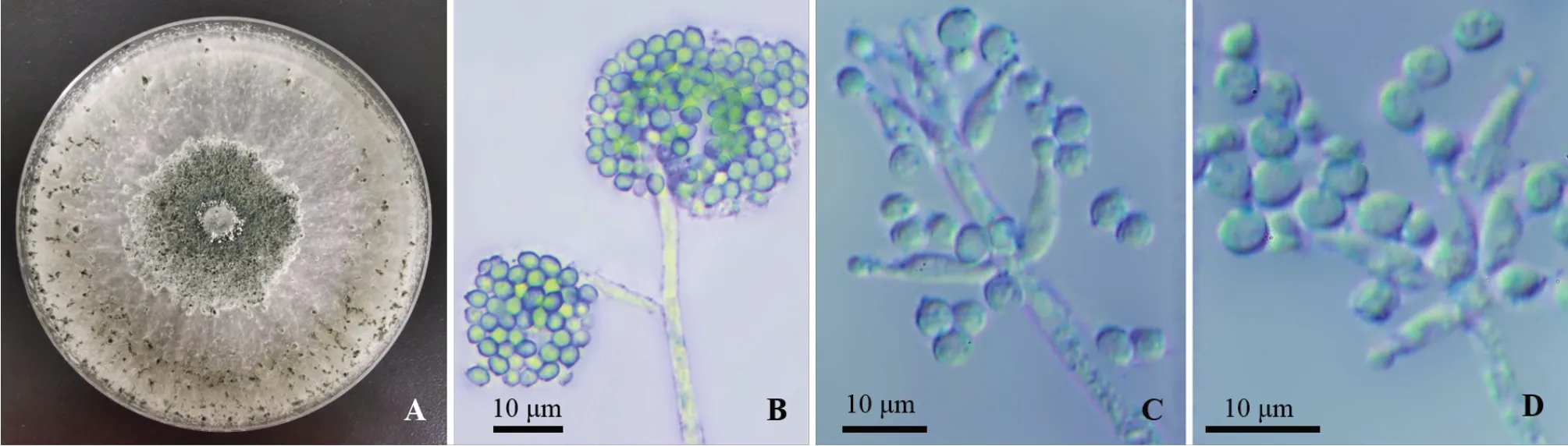
图2 M20210527-2 的菌株形态结构特征
2.2.2 分子系统学鉴定 将菌株M20210527-2的ITS 序列输入GenBank 的BLATS 中进行同源性对比,下载17 个模式菌株或公认菌株的ITS序列,构建NJ 系统发育树,如图3 所示,菌株M20210527-2 与哈茨木霉TrichodermaharzianumCRC32、CRC7 和AR75 以100% 的支持率聚为一支,且无支长差异。结合形态学特征和分子生物学分析,将菌株M20210527-2 鉴定为哈茨木霉(Trichodermaharzianum)。
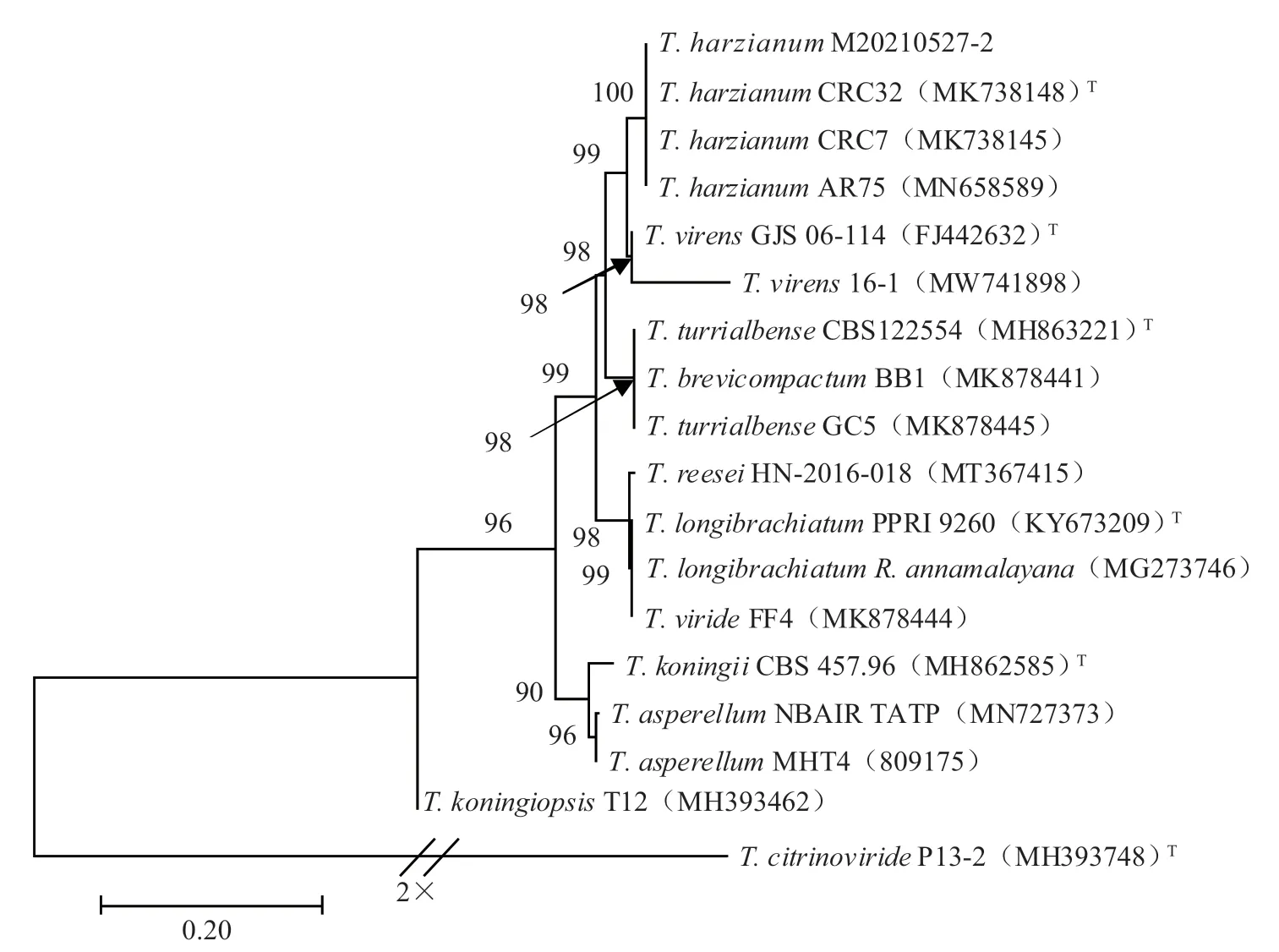
图3 基于ITS 序列构建的NJ 系统发育树
2.3 生防菌发酵代谢产物对病原菌的抑制效果
菌株M20210527-2 发酵代谢产物显著抑制茄镰刀菌菌丝生长,菌落直径随代谢产物添加浓度的增大而显著减小(图4、表2),体积分数为15%和20%时,对茄镰刀菌抑制率达到55.97%和75.51%(表2)。说明菌株M20210527-2 代谢产物对茄镰刀菌具有显著的抑制作用。
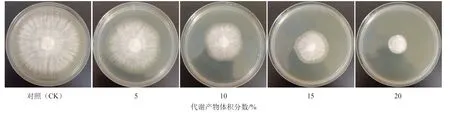
图4 菌株M20210527-2 发酵产物对茄镰刀菌菌丝生长的影响
表2 菌株M20210527-2 发酵产物对茄镰刀菌菌丝的抑制效果
2.4 生防菌对辣椒根腐病防治效果
盆栽试验结果表明(表3),先接种生防菌株M20210527-2,7 d 后接种辣椒根腐病病原菌(处理2)病株率和病情指数均显著低于先接种辣椒根腐病病原菌,7 d 后接种生防菌株M20210527-2(处理1),相对防效高达94.25%,说明生防菌株M20210527-2 对辣椒根腐病预防效果最佳,发病前使用可显著降低辣椒根腐病病株率和发病程度。病原菌侵染后再接种生防菌M20210527-2 虽可显著降低辣椒根腐病发病程度,但仍有56.67%的植株发病,说明其防治根腐病效果一般。单独接种生防菌株M202100527-2(处理3)的辣椒植株未发病,说明该菌株对辣椒根部无致病性,安全性好。
表3 生防菌株M20210527-2 对辣椒根腐病的防治效果
2.5 不同pH 和温度对生防菌菌丝生长的影响
不同pH 和温度对生防菌株M20210527-2菌丝生长量的影响达到显著水平(图5),菌株M20210527-2 在pH 值6~7(图5-A)、温度为25℃时(图5-B)菌丝生长量显著高于其他处理;在以蔗糖、淀粉和葡萄糖为碳源时菌丝生长量显著高于其他碳源处理,果糖和麦芽糖次之,甘油最差(图5-C);在以蛋白胨、酵母粉和牛肉膏为氮源时菌丝生长量最大,硝酸钠、硝酸铵、氯化铵次之,尿素最差(图5-D)。说明菌株M20210527-2 最佳培养pH 值为6~7,最佳培养温度为25 ℃,最适生长碳源为蔗糖、淀粉和葡萄糖,最适氮源为蛋白胨、酵母粉和牛肉膏。
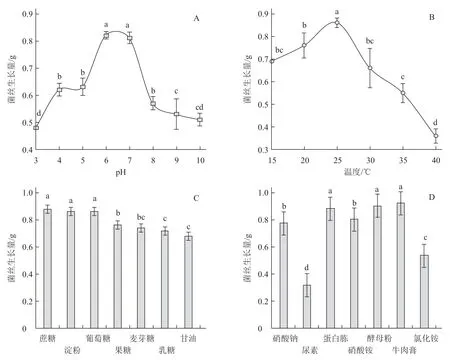
图5 不同pH(A)、温度(B)、碳源(C)和氮源(D)对生防菌M20210527-2 菌丝生长的影响
3 讨论与结论
木霉属(Trichoderma)真菌广泛分布于植物根际土壤、体表和组织内部,其中很多类群对镰孢菌属真菌具有抑制、重寄生、空间和营养竞争作用等(Mendoza et al.,2015;王丹 等,2021)。梁晓洁等(2020)研究表明木霉菌在植物根际土壤中的丰度与植物抗土传病害能力呈现正相关关系。哈茨木霉(T.harzianum)是木霉属中拮抗能力最突出、抗菌谱最广的真菌之一,对镰刀菌属(Fusarium)(Srivastava et al.,2010)、疫霉属(Phytophthora)(Fatima et al.,2015)、轮枝菌属(Verticillium)和丝核菌属(Rhizoctonia)(Santamarina & Rosello,2006)等的病原真菌具有较强的拮抗能力。本试验中,哈茨木霉M20210527-2 菌丝能够缠绕重寄生于茄镰刀菌菌丝上吸取茄镰刀菌菌丝的营养,并能快速争夺病原菌的生长空间而起到显著的抑菌效果。
本试验中,哈茨木霉M20210527-2 的发酵产物还能显著抑制茄镰刀菌的生长,说明哈茨木霉还能向外分泌高活性抑菌物质。哈茨木霉分泌的低分子量次级代谢产物如丁烯酸内酯类、2,5-二叔丁基酚、邻苯二甲酸二叔丁酯、邻苯二甲酸二异丁酯、十八碳酸甲酯等对很多真菌生长具有强烈抑制作用(Reino et al.,2008;沙莎 等,2013;杨立宾 等,2013)。
本试验结果表明,哈茨木霉M20210527-2对辣椒根腐病病原菌茄镰刀菌的抑制率达到了79.29%,对辣椒根腐病的相对防效也高达94.25%,具有良好的应用前景。哈茨木霉除了其突出的病原菌拮抗、抑菌和重寄生性能,还能改善土壤微生物菌群结构,降低病原菌丰度和提高农作物抗病性,可有效缓解土壤连作障碍,降低土传病害的发生程度(董瑞利 等,2013;Bader et al.,2020);哈茨木霉还对高盐、干旱、低温和低营养等极端环境具有较强的耐受性,扩大了其田间病害防治的应用范围(唐永庆 等,2008;朱萍萍 等,2015)。
综上所述,哈茨木霉M20210527-2 通过快速竞争性抑制、重寄生和分泌抑菌活性成分等多种途径,可以强烈抑制辣椒根腐病病原菌茄镰刀菌生长。盆栽试验表明该生防菌可显著降低辣椒根腐病发病率和病情指数,防治效果理想,在辣椒根腐病绿色、高效防治中具有广阔的应用前景。
