干扰LINC00334对地塞米松处理的BMSCs增殖、凋亡和成骨分化的影响
2023-09-26田中青李金洲曹丕健
田中青 李金洲 曹丕健
(1菏泽市中医医院骨科,山东 菏泽 274000;2菏泽市巨野县人民医院骨科;3菏泽市牡丹人民医院骨科)
骨质疏松是一种骨量减少,微结构退化和脆性骨折的疾病,好发于老年人和绝经后妇女;促进骨形成是预防和治疗骨质疏松的方式之一〔1,2〕。骨髓间充质干细胞(BMSCs)是骨髓中具有较强的增殖能力和多向分化的潜能干细胞,分化失衡是引发骨质疏松的关键,促进其向成骨方向分化可防治骨质疏松;因此,寻找决定BMSCs分化方向的关键因子,可为骨质疏松的治疗提供新思路〔3〕。研究表明长链非编码RNA(lncRNA)能调控成骨细胞、破骨细胞和BMSCs进而影响骨代谢进程,lncRNA表达失调与关节炎、骨质疏松和骨癌等多种骨疾病密切相关,有望作为预测骨疾病的生物标志物〔4〕。研究报道LINC00334在绝经后骨质疏松肾阴虚证中上调表达,其可能参与绝经后骨质疏松肾阴虚证的发生发展过程〔5〕。而LINC00334对BMSCs增殖、凋亡及成骨分化的影响尚不清楚。
研究报道ras同源家族(Rho)A/Rho激酶(ROCK)信号通路在骨质疏松BMSCs中表达降低,可能是骨质疏松发病的重要原因之一〔6〕。激活RhoA/ROCK信号通路可促进成骨分化和BMSCs增殖〔7〕。地塞米松(Dex)是糖皮质类激素,研究显示较低浓度的Dex抑制BMSCs增殖及成骨分化,从而导致骨质疏松的发生〔8〕。本实验用Dex处理BMSCs,研究LINC00334对Dex处理BMSCs增殖、凋亡和成骨分化的影响及其可能的作用机制是否与RhoA/ROCK信号通路有关。
1 材料与方法
1.1材料 小鼠BMSCs购自上海博湖生物科技有限公司;α-MEM培养基、青链霉素、Dex购自美国Sigma公司;RhoA/ROCK信号通路抑制剂Y27632购自深圳欣博盛生物科技有限公司;Trizol试剂购自上海酶研生物科技有限公司;SYBR Premix ExTaqTM试剂盒购自武汉科昊佳生物科技有限公司;四甲基偶氮唑盐比色法(MTT)试剂盒购自上海谷研实业有限公司;放射免疫沉淀(RIPA)蛋白裂解液、二喹啉甲酸(BCA)试剂盒购自上海江莱生物科技有限公司;膜联蛋白Ⅴ-异硫氰酸荧光素/碘化丙啶(Annexin Ⅴ-FITC/PI)凋亡检测试剂盒购自大连美仑生物技术公司。
1.2细胞处理与分组 BMSCs细胞用含1%青链霉素和10%胎牛血清的α-MEM培养基培养,用10-6mol/L Dex处理BMSCs作为骨质疏松模型组,正常培养的细胞作为对照组;将si-NC、si-LINC00334转染至BMSCs后用10-6mol/L Dex处理,记为模型+si-NC组、模型+si-LINC00334组;将si-LINC00334转染至BMSCs后用10-6mol/L Dex和RhoA/ROCK信号通路抑制剂Y27632处理,记为模型+si-LINC00334+抑制剂组。
1.3实时荧光定量聚合酶链反应(RT-qPCR)检测LINC00334、骨桥蛋白(OPN)mRNA、Run相关基因(Runx)2 mRNA、RhoA mRNA和ROCK mRNA表达水平 收集细胞提取总RNA,合成cDNA,按照试剂盒说明进行PCR,相对表达量用2-△△Ct法计算。以GAPDH为内参,LINC00334上游引物:5′-CGTGGGTTCTCCTTTGAGAG-3′,下游:5′-GGAAGCCCA-ATACATCCAAA-3′;OPN上游引物:5′-ACCCTTCCAAGTAAGTCC-3′,下游:5′-TGATGTCCTCGTCTGTAG-3′;Runx2上游引物:5′-CCGGTCTCCTTCCA-GGAT-3′,下游:5′-GGGAACTGCTGTGGCTTC-3′;RhoA上游引物:5′-TGATGGCTATTATGGACG-3′,下游:5′-GGAAGGCACAAATGAGAT-3′;ROCK上游引物:5′-CTGCGGGTACGAAGGTATCG-3′,下游:5′-AGCATCCAATCCATCCAGCA-3′;GAPDH上游引物:5′-TGTTGCCATCAATCACCCCTT-3′,下游:5′-CTCCACGAC-GTACTCAGCG-3′。
1.4MTT检测细胞增殖抑制率 收集培养48 h的各组细胞,按试剂盒说明进行,每孔分别加入5 mg/ml的MTT溶液20 μl,于培养箱中继续孵育4 h后弃去上清液,每孔加入二甲基亚砜(DMSO)150 μl,振荡反应10 min使沉淀溶解,用酶标仪检测490 nm处吸光度(OD)值。细胞增殖抑制率(%)=1-OD实验组值/OD空白对照组值×100%。
1.5克隆形成实验检测细胞克隆形成数 各组细胞消化后接种于6孔板,每孔100个细胞,培养2 w出现肉眼可见克隆时终止培养,磷酸盐缓冲液(PBS)清洗2遍,甲醇固定15 min,吉姆萨染色30 min,然后计数>50个细胞的集落。
1.6Western印迹检测Ki67、裂解的天冬氨酸特异性半胱氨酸蛋白酶(Cleaved-caspase)3、caspase3前体(Pro-caspase3)蛋白表达提取总蛋白,BCA试剂盒定量后进行电泳,转膜、封闭后加入一抗4 ℃孵育过夜,然后再加入二抗室温孵育2 h,最后加入电化学发光液(ECL)显影,检测蛋白条带灰度值,计算蛋白相对表达水平。
1.7流式细胞术检测细胞凋亡 收集培养48 h的各组细胞,用预冷的PBS漂洗2次,加入500 μl的结合缓冲液重悬,加入10 μl的Annexin V-FITC,再加入5 μl的PI,混匀后避光孵育10 min;然后上流式细胞仪检测细胞凋亡率。
1.8统计学分析 采用SPSS20.0软件进行t检验、方差分析。
2 结 果
2.1干扰LINC00334对Dex处理的BMSCs增殖的影响 与对照组相比,模型组和模型+si-NC组LINC00334表达水平明显升高(t=41.590、41.723,P<0.05),细胞增殖抑制率明显升高(t=46.538、46.867,P<0.05),克隆形成数明显减少(t=25.899、25.756,P<0.05),Ki67表达水平明显降低(t=26.112、26.112,P<0.05);与模型组和模型+si-NC组相比,模型+si-LINC00334组LINC00334表达水平显著降低(t=27.550、27.683,P<0.05),细胞增殖抑制率显著降低(t=26.793、27.123,P<0.05),克隆形成数明显升高(t=14.676、14.533,P<0.05),Ki67表达水平明显升高(t=17.234、17.234,P<0.05),见表1、图1。
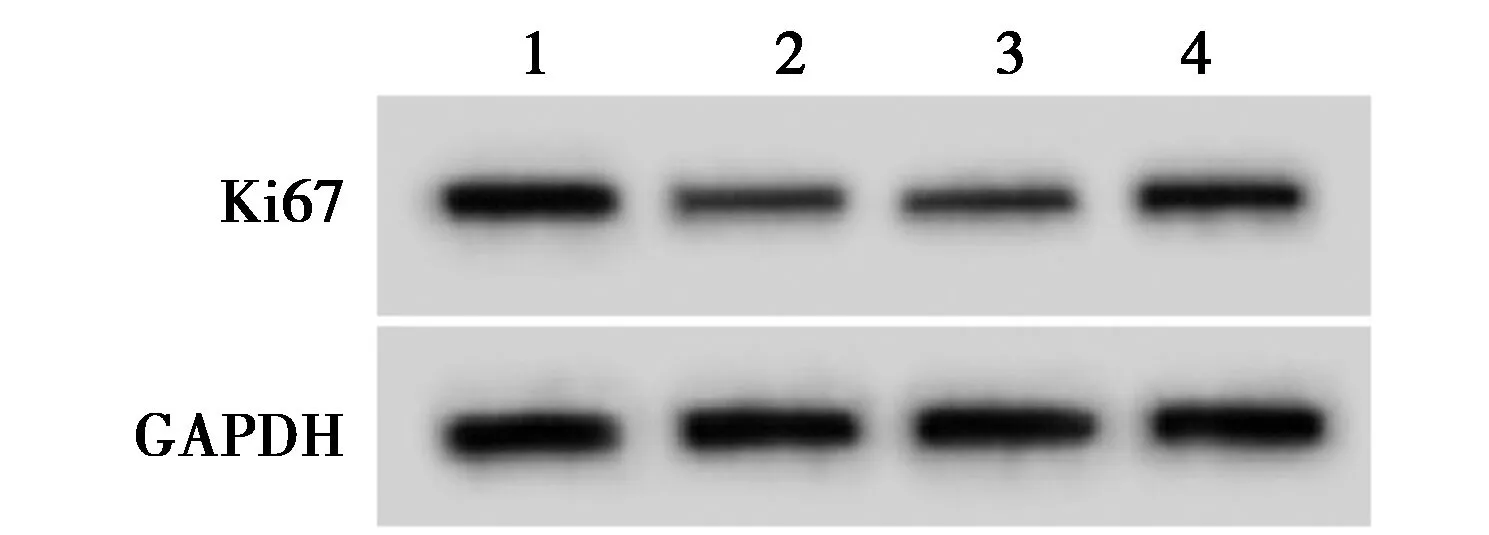
1~4:对照组,模型组,模型+si-NC组,模型+si-LINC00334组,图3同图1 干扰LINC00334对Dex处理的BMSCs中Ki67蛋白表达的影响
表1 干扰LINC00334对Dex处理的BMSCs增殖的影响
2.2干扰LINC00334对Dex处理的BMSCs凋亡的影响与对照组相比,模型组和模型+si-NC组细胞凋亡率明显升高(t=40.498、40.525,均P<0.05),Cleaved-caspase3表达水平明显升高(t=18.783、18.783,均P<0.05),Pro-caspase3表达水平明显降低(t=23.515、23.515,均P<0.05);与模型组和模型+si-NC组相比,模型+si-LINC00334组细胞凋亡率明显降低(t=21.424、21.451,均P<0.05),Cleaved-caspase3表达水平明显降低(t=17.709、17.709,均P<0.05),Pro-caspase3表达水平明显升高(t=20.785、20.785,均P<0.05),见表2、图2、图3。
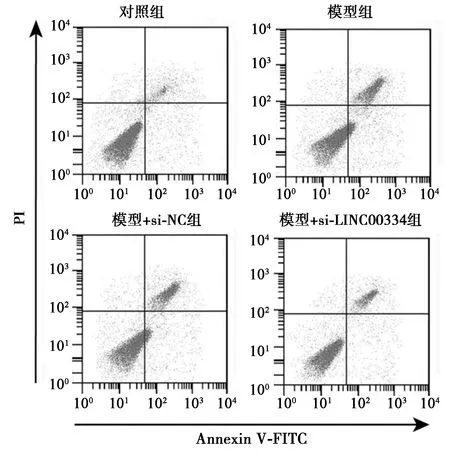
图2 干扰LINC00334对Dex处理的BMSCs凋亡率的影响

1~4:对照组、模型组、模型+si-NC组、模型+si-LINC00334组图3 干扰LINC00334对Dex处理的BMSCs中caspase3蛋白表达的影响
表2 干扰LINC00334对Dex处理的BMSCs凋亡、OPN、Runx2 mRNA及RhoA/ROCK信号通路的影响
2.3干扰LINC00334对Dex处理的BMSCs中OPN、Runx2 mRNA的影响 与对照组相比,模型组和模型+si-NC组OPN和Runx2 mRNA表达水平明显降低(t=13.175、13.760、18.142、18.520,均P<0.05);与模型组和模型+si-NC组相比,模型+si-LINC00334组OPN和Runx2 mRNA表达水平明显升高(t=8.490、9.076、10.961、11.339,均P<0.05),见表2。
2.4干扰LINC00334对Dex处理的BMSCs中RhoA/ROCK信号通路的影响 与对照组相比,模型组和模型+si-NC组RhoA和ROCK mRNA表达水平明显降低(t=26.944、26.595、20.502、19.932,均P<0.05);与模型组和模型+si-NC组相比,模型+si-LINC00334组RhoA mRNA和ROCK mRNA表达水平明显升高(t=19.246、18.896、15.376、14.807,均P<0.05),见表2。
2.5RhoA/ROCK抑制剂能减轻干扰LINC00334对Dex处理的BMSCs增殖凋亡的影响 与模型+si-LINC00334组相比,模型+si-LINC00334+抑制剂组细胞增殖抑制率明显升高,克隆形成数明显减少,Ki67表达水平明显降低,细胞凋亡率明显升高,Cleaved-caspase3表达水平明显升高,Pro-caspase3表达水平明显降低,OPN和Runx2 mRNA表达水平明显降低(P<0.01,P<0.001),见表3、图4、图5。

图4 RhoA/ROCK抑制剂能减轻干扰LINC00334对Dex处理的BMSCs凋亡率的影响
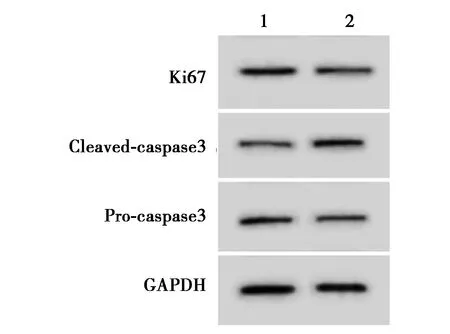
1,2:模型+si-LINC00334组,模型+si-LINC00334+抑制剂组图5 RhoA/ROCK抑制剂能减轻干扰LINC00334对Dex处理的BMSCs中Ki67和caspase3蛋白表达的影响
表3 RhoA/ROCK抑制剂能减轻干扰LINC00334对Dex处理的BMSCs增殖凋亡的影响
3 讨 论
BMSCs的分化失衡是引发骨质疏松的重要因素之一。Dex是常用的凋亡诱导剂,研究发现10-6mol/L的Dex抑制BMSCs增殖〔9〕。本实验用结果显示,10-6mol/L的Dex可抑制BMSCs增殖和成骨分化,诱导细胞凋亡,表明模型建立成功。有研究表明lncRNA参与BMSCs的成骨分化和成脂分化〔10〕。如lncRNA AK045490沉默可通过β-catenin/ T细胞因子(TCF)1/Runx2信号轴促进成骨细胞分化和骨形成〔11〕。抑制lncRNA HOTAIR可促进大鼠BMSCs的成骨细胞分化〔12〕。本实验结果提示,LINC00334或可作为骨质疏松症中的生物标志物。OPN、Runx2是成骨分化关键因子,其高表达促进成骨分化〔13,14〕。本实验结果表明,干扰LINC00334可促进BMSCs增殖和成骨分化,抑制Dex处理的BMSCs凋亡。但LINC00334影响BMSCs增殖、凋亡和成骨分化的机制尚不清楚。研究表明RhoA/ROCK信号通路可能通过介导细胞骨架变形来促进人间充质干细胞的成骨分化〔15〕。二甲基草酰甘氨酸通过Rho/ROCK信号促进BMSCs成骨〔16〕。本实验结果表明,干扰LINC00334可能通过调控RhoA/ROCK信号通路促进BMSCs增殖和成骨分化,抑制Dex诱导的BMSCs凋亡。
成骨细胞功能衰减,骨形成不足,最终导致骨量丢失是导致骨质疏松产生的重要原因,而成骨不足与BMSCs分化方向密切相关〔17〕。因此,促进BMSCs向成骨方向分化是防治骨质疏松的重要途径之一。本实验的创新在于LINC00334是首次在BMSCs增殖、凋亡和成骨分化等方面的研究,且表明了其机制与RhoA/ROCK信号通路可能有关。尽管本实验证明了干扰LINC00334可能通过调控RhoA/ROCK信号通路促进BMSCs增殖和成骨分化,抑制Dex诱导的BMSCs凋亡。但本实验主要在细胞中进行的研究,其是否在体内起同样作用还有待进一步的研究。
