Hairless基因敲除小鼠发生炎性衰老的可能机制
2023-09-26杜春燕左培培章金涛朱奎成
杜春燕 左培培 章金涛 朱奎成
(郑州大学 1医学科学院,河南 郑州 450052;2华中阜外医院;3国家心血管病中心华中分中心)
炎性衰老是指机体随年龄增长出现的长期慢性促炎症反应进行性升高的病理性状态,其显著特征是机体随年龄的增长出现炎症稳态的失衡,从而引发细胞和机体逐渐向促炎过程的倾斜,进而发生的炎性衰老症状〔1~3〕。炎性衰老过程中,白细胞介素(IL)-6、IL-1β、肿瘤坏死因子(TNF)-α及C反应蛋白(CRP)等体内多种炎症因子水平普遍升高,机体为对抗外来威胁而进行正常的抗炎作用日益减弱,最终表现为慢性衰老状态〔4〕。
郑州大学实验动物中心(原河南医科大学实验动物中心)在1990年发现一种KM无毛突变小鼠,将其命名为豫医无毛小鼠(YYHL),该小鼠为Hairless(Hr)基因自发突变小鼠,主要特征为无毛小鼠刚出生时仔鼠正常,从14 d开始脱毛,大约持续到21日龄被毛全部脱完,此时皮肤颜色呈肉色,到120日龄时无毛小鼠的皮肤颜色逐渐加深,并有许多油脂黏附其上,皮肤角化过度,眼球变得混浊、不突出,老龄鼠视力低,接触性、敏感性、行动性均降低,寿命约为野生小鼠的1/2,6月龄无毛小鼠衰老特征明显,因此无毛小鼠可作为衰老动物模型。
郑州大学实验动物中心微生物检测室于2016年采用TALENs技术成功构建C57背景来源的Hr敲除小鼠(Hr-KO),该鼠与野生型鼠杂交获得阳性F1子代,然后进行同窝交配,当传至F2代时,小鼠14 d开始脱发,至30 d左右毛发完全脱净,并终身保持无毛〔5〕。这与豫医无毛小鼠形状类似,通过对其寿命观察,发现其同样表现出寿命较正常小鼠短,多为8~9个月。无毛小鼠出现的早期衰老表明其可作为良好的衰老动物模型,用于衰老的相关研究。本文拟探讨Hairless基因敲除小鼠发生炎性衰老的可能机制。
1 材料与方法
1.1动物 6月龄雄性SPF级WT(野生型C57BL/6J)小鼠12只,购自河南省实验动物中心,合格证号编号为SCXK(豫)2017-0001。12只6月龄雄性SPF级Hr-KO小鼠由郑州大学医学科学院实验动物平台。
1.2仪器和试剂 超低温冷冻冰箱购自青岛海尔特种电器有限公司,全自动酶标仪购自上海赛默飞仪器有限公司,实时荧光定量聚合酶链反应(qRT-PCR)仪购自美国BIO-RAD公司,病理相关设备购自德国LEICA公司,水迷宫系统、大小鼠跑步机购自江苏赛昂斯生物科技有限公司,组织破碎研磨仪购自宁波新芝生物科技股份有限公司。苏木素-伊红(HE)染色试剂盒购自北京索莱宝生物科技有限公司,RNA抽提试剂盒、逆转录试剂盒均购自大连Takara公司,IL-6、IL-1β、TNF-α 酶联免疫吸附试验(ELISA)试剂盒购自上海广锐生物科技有限公司,超氧化物歧化酶(SOD)、丙二醛(MDA)试剂盒购自上海恒远生物科技有限公司。
1.3皮肤形态学观察 肉眼观察两组小鼠皮肤面貌和形态学特征。
1.4组织HE染色 取1~2 cm2小鼠背部皮肤组织,脱水、浸蜡、包埋后切片,按照HE染色试剂盒说明进行透明、复水、染色、封片,在光学显微镜下观察病理组织切片并做图像采集。
1.5水迷宫实验检测小鼠学习和记忆能力 行为学实验开始前应进行游泳训练,可让小鼠在水池内自由游泳,每天训练2次,上、下午各1次,每次1 min〔6〕。正式实验时,在水池内固定位置安置平台,离池壁约20 cm。将小鼠放入水中,每天测试1次,每次2 min,连续4 d,记录小鼠寻找并爬上平台所需的时间。2 min内未成功发现平台的,时间标为2 min。定位航行实验结束24 h后,撤除水下平台,任选1个入水点将小鼠面向池壁放入水中,所有小鼠均在同一点入水,记录动物在2 min内第1次跨越平台时间和跨越平台次数等指标。实验期间,室内应保持安静,水温保持在24~25 ℃。水池周围的参照物在实验期间保持不变。
1.6跑步实验检测小鼠运动耐力 实验前1 w内,应进行跑步机适应训练,连续训练3 d。跑道坡度调节为10 °,打开电源开关,将小鼠放入跑道,开启电源,将电流调至合适位置,起始速度设置为10 m/min,按下启停开始,持续时间为10 min。第4天进行正式实验,初始速度定为12 m/min,持续时间为20 min,然后以0.3 m/min的速度加速,直到小鼠力竭〔7〕。应详细记录每个跑道的电击次数及每个速度下的实际跑步时间。力竭判定标准:动物落入电击区域,经连续电击后无反应。
1.7ELISA检测IL-6、IL-1β、TNF-α、SOD、MDA水平 剪尾法取小鼠新鲜血液,室温下在EP管中静置1 h后3 000 r/min离心15 min,取上清。取小鼠背部皮肤1 cm2左右,生理盐水冲洗干净,置于生理盐水,4 ℃下研磨制成10%匀浆,3 000 r/min离心15 min,取上清液。分别按说明书检测血清中IL-6、IL-1β、TNF-α及皮肤组织中SOD、MDA水平。
1.8实时荧光定量-聚合酶链反应(qRT-PCR)检测皮肤组织中弹性蛋白原(tropoelastin)和纤维蛋白(fibrillin)-1表达水平 取小鼠背部皮肤1 cm2,采用组织破碎仪破碎后利用Trizol法提取组织总RNA,反转录后得到cDNA,按照反转录试剂盒说明书进行操作,配制反应体系,上机条件设置如下:95 ℃ 2 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,循环35次。以GAPDH为内参基因。Tropoelastin正向引物:5′-CCCCAAGCTGCCTGGTG-3′,反向:5′-AACCAGCCTTGCCCGC-3′,fibrillin-1正向引物:5′-TGTGTCCAGCGGGGCATTTG-3′,反向:5′-CCCTGCGAG-ATGTGTCCTGC-3′,GAPDH正向引物:5′-TGTGTCCGTCGTCGTGGATCTGA-3′,反向:5′-TTGCTGTT-GAAGTCGCAGGAG-3′。
1.9统计学方法 采用SPSS16.0软件进行t检验。
2 结 果
2.1动物皮肤观察 通过肉眼直接观察可见,与WT组相比,Hr-KO组小鼠全身无毛,且皮肤皱纹和褶痕显著,皮肤呈暗黄色,衰老特征明显。见图1。

图1 两组皮肤形态学比较
2.2HE染色观察小鼠皮肤病理改变 组织学染色发现,与WT组比较,Hr-KO组小鼠毛发生长缺陷,皮肤内毛囊瓦解,并形成许多椭圆囊及真皮包囊,表皮增厚明显,且皮肤不同部位有炎症细胞浸润。见图2。

图2 两组皮肤病理改变(HE染色,×400)
2.3各组皮肤组织中tropoelastin和fibrillin-1 mRNA表达水平 Hr-KO组tropoelastin和fibrillin-1 mRNA表达水平均明显低于WT组(均P<0.05)。见表1。
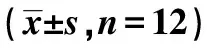
表1 两组tropoelastin和fibrillin-1 mRNA表达水平、水迷宫实验运动时间、距离和穿越平台次数、跑台力竭运动距离及电击次数比较
2.4两组学习和记忆能力比较 与WT组相比,Hr-KO组潜伏时间明显较长,运动距离明显变长,穿越平台次数明显较少(P<0.05)。见表1。
2.5两组运动能力比较 与WT组相比,Hr-KO组力竭运动距离明显较短,且整个实验过程中,被电击次数明显较多(P<0.05),见表1。
2.6各组血清中IL-6、IL-1β、TNF-α水平及皮肤组织中SOD、MDA水平比较 与WT组比较,Hr-KO组血清中炎症因子IL-6、IL-1β、TNF-α表达水平均明显升高;Hr-KO组SOD水平明显低,且Hr-KO组MDA水平明显高(均P<0.05)。见表2。
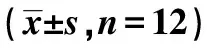
表2 各组血清中炎症因子及皮肤组织中SOD、MDA水平比较
3 讨 论
衰老是一个十分复杂的生命过程,是一种必然发生的生理学现象,伴随着出现各个组织、器官及细胞的生理功能的逐渐退化和丧失〔8~11〕。
炎症是驱动人类衰老的进程的重要因素之一〔12〕。自由基、炎症和衰老三者关系密切且错综复杂,已逐渐成为衰老相关研究的热点问题。炎性衰老过程中,机体慢性炎症反应呈进行性升高的状态,其基本机制主要是衰老机体促炎症细胞因子网络与抗炎症细胞因子网络平衡失调,体内炎性因子水平呈慢性升高状态,最终表现为促炎反应的升高。体内外许多因素被证实与衰老有关,可分为内源性因素和外源性因素,其中内源性因素影响最大的是自由基对身体的伤害,当机体发生氧化应激时,自由基可导致生物分子的氧化损伤,进而引起机体内源性损伤相关分子模式(DAMPS)的产生和细胞因子的大量释放〔13,14〕。细胞因子进而激发模式识别受体(PRRS)的活化,激活下游的核因子(NF)-κB、非受体型酪氨酸蛋白激酶(JAK)和丝裂原活化蛋白激酶(MAPK)等信号通路,从而导致细胞因子和趋化因子释放,招募和激活炎性细胞,激活炎症信号通路,释放炎性因子,最终引起机体系统性慢性炎症反应〔15〕。本文利用Hr-KO无毛小鼠作为衰老的动物模型,初步探讨了敲除Hr基因形成的无毛早衰小鼠在皮肤、学习记忆能力和运动能力等方面与健康小鼠的差异,分析比较了两组动物在炎症因子和抗氧化分子SOD、MDA表达水平的差异,为进一步揭示炎症、氧化损伤与衰老的关系提供了参考。
