黄芪建中汤加减联合化疗治疗Ⅲb~Ⅳ期胃癌临床研究
2023-09-25王珍珍李君艳尚晋文
王珍珍,李君艳,尚晋文
新乡医学院第三附属医院肿瘤内二科,河南 新乡 453000
胃癌起源于胃黏膜细胞,早期症状不明显,确诊时往往已处于Ⅲb~Ⅳ期,而此期患者预后通常较差。化疗是Ⅲb~Ⅳ期胃癌的重要治疗手段之一,在控制癌灶进展及延长生存时间方面有重要意义,但化学药物在杀伤癌细胞的同时会对机体正常细胞造成一定损伤,可引发胃肠道反应、骨髓抑制、白细胞减少等,影响治疗依从性[1]。目前临床治疗胃癌的常用化疗药物包括氟尿嘧啶、奥沙利铂等。中西医结合疗法具有多靶点、多途径的治疗特色,在增强疗效、减轻不良反应、提高机体耐受力、改善生活质量等方面均有一定作用[2]。胃癌归属于中医学癥瘕、积聚范畴,其病机多为饮食失节损伤脾胃,临床以脾胃虚寒证多见[3]。黄芪建中汤源于《金匮要略》,具有温中补虚、健脾益胃、缓急止痛功效,可用于治疗多种消化系统疾病。研究表明,黄芪建中汤对胃癌细胞增殖、转移有一定的抑制作用[4]。肿瘤标志物[糖类抗原724(CA724)、癌胚抗原(CEA)、糖类抗原199(CA199)]及血管内皮生长因子(VEGF)、白细胞介素-6(IL-6)可反映中晚期胃癌的治疗效果及预后[5-6]。本研究观察黄芪建中汤加减联合化疗治疗脾胃虚寒型Ⅲb~Ⅳ期胃癌的临床疗效,以及对肿瘤标志物、VEGF、IL-6 的影响,报道如下。
1 临床资料
1.1 诊断标准参考《中华医学会胃癌临床诊疗指南(2021 版)》[7]中的诊断标准,经病理学检查确诊为胃癌Ⅲb~Ⅳ期。
1.2 辨证标准参考《肿瘤中医诊疗指南》[8]中胃癌的辨证标准辨为脾胃虚寒证。症见胃痛隐隐,喜温喜按,冷痛不适,宿谷不化或泛吐清水,手足欠温,面色苍白,疲乏无力,便溏浮肿,舌苔白滑,脉沉无力。
1.3 纳入标准符合上述诊断及辨证标准;不具备手术指征;年龄18~80 岁;预计生存期≥3 个月;未合并其他恶性肿瘤;认知功能、凝血功能正常;病历资料完整;无化疗禁忌证;签署知情同意书。
1.4 排除标准肝肾功能、心电图、血常规、尿常规等检查结果明显异常者;合并其他器质性病变者;合并精神疾病者;参与研究前有抗肿瘤治疗史,如放化疗、靶向治疗等;过敏体质者;妊娠期或哺乳期妇女。
1.5 剔除标准依从性差,不能坚持治疗者;研究中途出现严重不良反应者;自行要求退出研究者。
1.6 一般资料选取2019年1月—2022年8月在新乡医学院第三附属医院治疗的82 例脾胃虚寒型Ⅲb~Ⅳ期胃癌患者,按照患者入院编号单双数分为观察组和对照组各41 例。82 例患者均完成研究,无剔除。观察组男31 例,女10 例;平均年龄(65.19±5.43)岁;平均体质量指数23.21±1.62;合并症:糖尿病13 例,高血压病18 例;病理类型:腺癌35 例,其他6 例;TNM 分期:Ⅲb 期23 例,Ⅳ期18 例。对照组男29 例,女12 例;平均年龄(66.37±3.28)岁;平均体质量指数22.98±1.54;合并症:糖尿病16 例,高血压病14 例;病理类型:腺癌37 例,其他4 例;TNM 分期:Ⅲb 期26 例,Ⅳ期15 例。2 组一般资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究经新乡医学院第三附属医院医学伦理委员会批准(20181216)。
2 治疗方法
2 组均予以止痛、止呕、护肝、保护胃黏膜、维持体液平衡、营养支持等对症治疗。
2.1 对照组给予奥沙利铂与氟尿嘧啶进行化疗。疗程开始第1 天给予注射用奥沙利铂(昆明贵研药业有限公司,国药准字H20093552)130 mg/m2加5%葡萄糖注射液500 mL 静脉滴注,氟尿嘧啶注射液(天津金耀药业有限公司,国药准字H12020959)400 mg/m2加0.9%氯化钠注射液50 mL 静脉推注,再以2 400 mg/m2氟尿嘧啶持续泵入,维持48 h。3 周为1 个疗程,治疗2 个疗程。
2.2 观察组在对照组基础上,从化疗第1 天开始给予黄芪建中汤加减治疗。处方:白芍30 g,黄芪、甘草各20 g,桂枝15 g,生姜、三七各10 g,三棱、莪术各6 g,大枣6 枚。每天1 剂,煎取药液300 mL,分早晚2 次温服,每次150 mL。治疗6 周,每2 周复诊1 次,根据患者病情随症加减药物。
3 观察指标与统计学方法
3.1 观察指标①临床疗效。②肿瘤标志物。治疗前后以电化学发光法检测血清CEA、CA199、CA724水平。③血清VEGF、IL-6 水平。治疗前后采用酶联免疫吸附法检测血清VEGF、IL-6 水平。④免疫指标。治疗前后采用流式细胞仪检测外周血T 细胞亚群CD4+、CD8+水平,计算CD4+/CD8+值。⑤生活质量。采用Karnofsky 功能状态(KPS)评分评价,满分100 分。KPS 评分较治疗前升高≥10 分为生活质量改善,KPS 评分较治疗前升高或降低未达到10 分为生活质量稳定,KPS 评分较治疗前降低≥10 分为生活质量下降[9]。⑥不良反应发生率。依据《肿瘤化疗不良反应与对策》[10]评价,统计治疗期间胃肠道反应、中性粒细胞减少、周围神经毒性等不良反应发生率。
3.2 统计学方法采用SPSS22.0 统计学软件进行数据分析。计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验,组内治疗前后比较采用配对样本t检验;计数资料以百分比(%)表示,采用χ2检验。P<0.05 表示差异有统计学意义。
4 疗效标准与治疗结果
4.1 疗效标准治疗6 周后,依据《实体瘤治疗疗效评价标准-RECIST》[11]制定。完全缓解(CR):所有病灶完全消失,维持1 个月;部分缓解(PR):所有病灶最大直径总和较治疗前减小>30%,维持1 个月,未出现新病灶;稳定(SD):所有病灶最大直径总和较治疗前减小≤30%或增加≤20%,未出现新病灶;进展(PD):所有病灶最大直径总和较治疗前增加>20%,或可见新病灶。总有效率=(CR 例数+PR例数+SD 例数)/总例数×100%。
4.2 2 组临床疗效比较见表1。治疗后,观察组临床疗效总有效率82.93%,高于对照组58.54%,差异有统计学意义(P<0.05)。
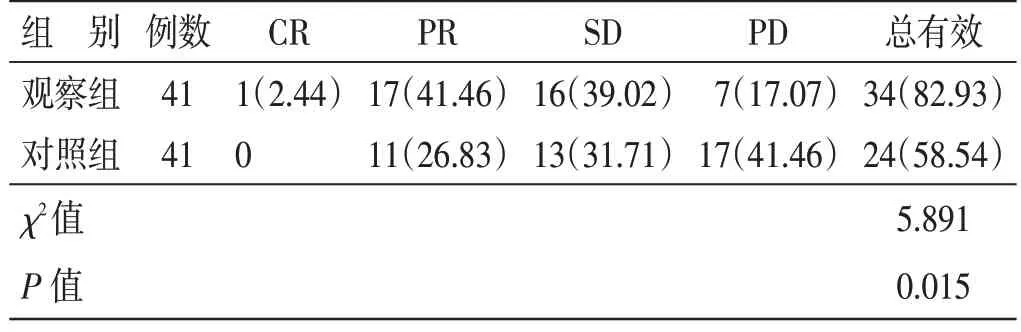
表1 2 组临床疗效比较例(%)
4.3 2 组治疗前后血清CEA、CA199、CA724 水平比较见表2。治疗前,2 组血清CEA、CA199、CA724 水平比较,差异均无统计学意义(P>0.05)。治疗后,2 组血清CEA、CA199、CA724 水平均较治疗前降低(P<0.05),观察组血清CEA、CA199、CA724 水平均低于对照组(P<0.05)。
表2 2 组治疗前后血清CEA、CA199、CA724 水平比较(±s)

表2 2 组治疗前后血清CEA、CA199、CA724 水平比较(±s)
注:①与本组治疗前比较,P<0.05;②与对照组治疗后比较,P<0.05
CA724(U/mL)53.34±7.09 24.60±4.58①②53.41±7.46 37.30±6.37①组 别观察组对照组时 间治疗前治疗后治疗前治疗后例数41 41 41 41 CEA(ng/mL)48.38±5.40 13.24±2.05①②47.21±5.69 18.13±3.88①CA199(U/mL)92.11±9.78 46.17±5.84①②93.47±10.47 55.32±6.63①
4.4 2 组治疗前后血清VEGF、IL-6 水平比较见表3。治疗前,2 组血清VEGF、IL-6 水平比较,差异均无统计学意义(P>0.05)。治疗后,2 组血清VEGF、IL-6 水平均较治疗前降低(P<0.05),观察组血清VEGF、IL-6 水平均低于对照组(P<0.05)。
表3 2 组治疗前后血清VEGF、IL-6 水平比较(±s) pg/mL

表3 2 组治疗前后血清VEGF、IL-6 水平比较(±s) pg/mL
注:①与本组治疗前比较,P<0.05;②与对照组治疗后比较,P<0.05
组 别例数IL-6治疗前179.41±8.42 179.90±8.87治疗后92.94±5.11①②135.20±6.36①观察组对照组41 41 VEGF治疗前459.21±22.12 458.56±24.29治疗后210.18±13.02①②266.80±20.73①
4.5 2 组治疗前后血清CD4+、CD8+水平及CD4+/CD8+值比较见表4。治疗前,2 组血清CD4+、CD8+水平及CD4+/CD8+值比较,差异均无统计学意义(P>0.05)。治疗后,2 组血清CD4+水平及CD4+/CD8+值均较治疗前降低(P<0.05),血清CD8+水平均较治疗前升高(P<0.05);观察组血清CD4+水平及CD4+/CD8+值均高于对照组(P<0.05),血清CD8+水平低于对照组(P<0.05)。
表4 2 组治疗前后血清CD4+、CD8+水平及CD4+/CD8+值比较(±s)

表4 2 组治疗前后血清CD4+、CD8+水平及CD4+/CD8+值比较(±s)
注:①与本组治疗前比较,P<0.05;②与对照组治疗后比较,P<0.05
CD4+/CD8+1.54±0.36 1.34±0.32①②1.56±0.38 1.11±0.25①组 别观察组对照组时 间治疗前治疗后治疗前治疗后例数41 41 41 41 CD4+(%)37.30±3.61 35.89±5.24①②36.52±3.32 31.19±4.55①CD8+(%)24.03±3.70 26.39±2.00①②23.12±3.49 28.13±2.71①
4.6 2 组生活质量改善率比较见表5。治疗后,观察组生活质量改善率75.61%,高于对照组48.78%,差异有统计学意义(P<0.05)。
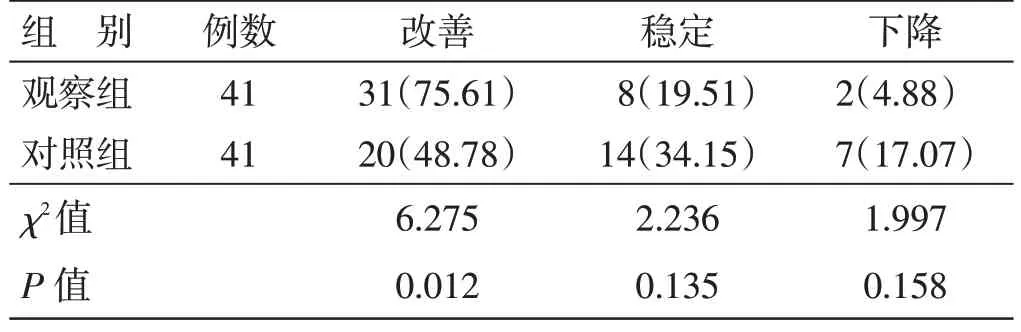
表5 2 组生活质量改善率比较例(%)
4.7 2 组不良反应发生率比较见表6。治疗期间,观察组胃肠道反应、中性粒细胞减少、周围神经毒性发生率均低于对照组,差异均有统计学意义(P<0.05)。

表6 2 组不良反应发生率比较例(%)
5 讨论
奥沙利铂为三代铂类药物,可与脱氧核糖核酸(DNA)分子结合,形成铂链加合物,阻止DNA 复制,抑制肿瘤细胞增殖。氟尿嘧啶为抗代谢类化疗药物,可影响癌细胞尿嘧啶脱氧核苷酸(dUMP)合成,起到抗肿瘤效果[12]。两药联合应用是临床中晚期胃癌的常用化疗方案,有助于缩小肿瘤体积,但化疗药物的不良反应较大,易出现胃肠道反应、中性粒细胞减少、周围神经毒性等[13]。在化疗基础上联合中药治疗,有利于扶助人体正气,增强机体抵抗力,改善患者的生活质量,达到增效减毒的作用,可用于治疗包括胃癌在内的多种恶性肿瘤[14]。
胃癌归属于中医学癥瘕、积聚等范畴。中医学认为,晚期胃癌患者久病不愈,忧思过度,脾胃虚弱,致阴寒内生。治以温中健脾、温阳散寒、和胃止痛为原则。黄芪建中汤中黄芪可升阳举陷、健脾补中;白芍养血柔肝、缓急止痛,桂枝温通经脉、助阳化气,白芍与桂枝配伍可调和营卫;生姜温中止呕,助桂枝温胃散寒;生姜与大枣合用,共同发挥调营卫、和阴阳之效;甘草益气补中、缓急止痛。肿瘤患者正气本虚,日久气滞血瘀,再遇化疗药物之大毒,戕伐正气,耗伤气血,邪毒留滞,皮肉筋脉失荣,导致肢端麻木、疼痛。三七、三棱、莪术合用有破血行气、消积止痛之功效,三者对化疗引起的胃肠道反应及中性粒细胞减少有一定改善作用,并能增强机体免疫力及抗肿瘤效应,以提高化疗耐受性及治疗效果[15-17]。全方合用,共奏温中散寒、补气健脾、和胃止痛、破血逐瘀、消癥散积之效。药理学研究表明:黄芪皂苷具有抗肿瘤和提升机体免疫功能等作用[18];大枣多糖有助于增强机体免疫力[19];甘草提取物具有抗肿瘤作用,能抑制胃癌SGC-7901 细胞增殖[20];白芍总苷对胃癌BGC-823细胞凋亡有促进作用[21];生姜中的活性成分具有抗癌作用[22]。
本研究结果显示,治疗后,观察组临床疗效总有效率高于对照组(P<0.05)。表明黄芪建中汤加减联合化疗治疗Ⅲb~Ⅳ期脾胃虚寒型胃癌疗效确切。治疗后,观察组生活质量改善率高于对照组(P<0.05)。提示上述联合治疗方案可提高脾胃虚寒型Ⅲb~Ⅳ期胃癌患者的生活质量。治疗期间,观察组胃肠道反应、中性粒细胞减少、周围神经毒性发生率均低于对照组(P<0.05)。提示黄芪建中汤加减可有效减少化疗过程中出现的不良反应。Ⅲb~Ⅳ期胃癌患者普遍细胞免疫功能降低,化疗会进一步导致免疫抑制[23]。治疗后,观察组血清CD4+水平及CD4+/CD8+值均高于对照组(P<0.05),血清CD8+水平低于对照组(P<0.05)。提示黄芪建中汤加减对脾胃虚寒型Ⅲb~Ⅳ期胃癌患者的细胞免疫功能有一定改善作用。血清肿瘤标志物CEA、CA199、CA724 在胃癌等多种恶性肿瘤患者体内的表达水平显著上升。VEGF可刺激细胞增殖和迁移,促使肿瘤血管形成,在胃癌患者机体中呈高表达[24]。IL-6 是一种多肽物质,在胃癌患者机体中水平明显升高,且其水平可随TNM 分期进展而上升[25]。治疗后,观察组血清CEA、CA199、CA724、VEGF、IL-6 水平均低于对照组(P<0.05)。提示黄芪建中汤加减联合化疗可降低脾胃虚寒型Ⅲb~Ⅳ期胃癌患者的血清VEGF、IL-6 水平,抑制胃癌细胞增殖。
综上所述,黄芪建中汤加减联合化疗治疗脾胃虚寒型Ⅲb~Ⅳ期胃癌临床疗效较好,能够降低肿瘤标志物、VEGF、IL-6 水平,改善患者的生活质量和免疫功能,减轻不良反应,值得临床借鉴。
