祛瘀清热方对尿酸钠诱导的痛风性关节炎大鼠NLRP6/Caspase-1/IL-1β信号通路的影响
2023-09-25钟秋生杨巧玉邵洁琦黄欢欢陈博王昱
钟秋生,杨巧玉,邵洁琦,黄欢欢,陈博,王昱
东莞市松山湖中心医院,广东 东莞 523326
痛风性关节炎(GA)是一种异质性疾病,通常伴有尿酸钠结晶体的沉积,其沉积部位多位于关节及其周围处。流行病学表明,GA 的发病率高,随着社会经济的发展,本病呈现出明显的上升势头,GA 可累及多个脏器,对人类的健康构成严重威胁。GA 的发病机制与炎症反应密切相关。炎性细胞因子直接或间接参与GA 的炎症反应,炎症因子的释放受到多种相关信号通路的调节,免疫细胞也参与调控。NLRP6 是一种新的NLR 家族成员,在不同的细胞类型中,发挥不同的角色,并参与多个信号通路的调控,如核因子-κB(NF-κB)和MAPK 信号等的转导。本研究团队应用祛瘀清热方治疗GA,取得较好的临床疗效,研究发现,其可明显降低血尿酸水平、中医证候积分和炎性反应指标如C-反应蛋白、血沉[1]。本研究拟通过动物实验,观察祛瘀清热方对尿酸钠诱导的GA 大鼠踝关节肿胀度影响、血清白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)的变化,探讨祛瘀清热方对NLRP6/Caspase-1/IL-1β 信号通路的调控作用。
1 材料
1.1 动物选取雄性大鼠,SPF 级SD,60 只,体质量180~200 g,全部从南方医科大学购买,大鼠随机分空白组、模型组、秋水仙碱组、祛瘀清热高剂量组、祛瘀清热中剂量组和祛瘀清热低剂量组,共6 组,每组各10 只。
1.2 药物祛瘀清热方处方:当归、泽兰、桃仁、泽泻、地龙各10 g,益母草、白茅根、车前子、秦艽各15 g,薏苡仁20 g。生药由东莞市松山湖中心医院中药房提供,并协助煎煮,100 ℃水浴,浓缩至200%,相当于生药2 g/mL,4 ℃保存,备用。秋水仙碱0.5 mg×20 片/盒,由云南植物药业有限公司(国药准字H53020166)提供,切磨成粉状,保存,备用。应用方法:造模后60 min,开始给药。秋水仙碱组:秋水仙碱9 mg/kg,每天1 次,灌胃,连续7 d;祛瘀清热方高、中、低剂量治疗组:分别给予祛瘀清热方100 mg/kg、50 mg/kg、20 mg/kg,灌胃,连续7 d;空白组和模型组:每组大鼠予等容量蒸馏水灌胃,连续7 d。各组大鼠,均每天上午9 时灌胃,每天1 次。
1.3 试剂IL-1β、TNF-α 酶联免疫吸附法(ELISA)试剂盒,购自上海酶联生物科技有限公司,批号均为202104。NLRP6、Caspase-1 Western Blot 购自武汉三鹰生物技术有限公司。
1.4 仪器电子天平、双目显微镜、石蜡切片机、双重纯水蒸馏器、不锈钢水浴锅、恒温培养箱、医用微波炉和显微摄像系统。
2 方法
2.1 分组与造模60 只SD 大鼠,随机分为6 组,每组10 只。造模方法,采用党荣敏等[2]尿酸钠溶液注射关节腔内的方法。
2.2 观察指标及监测方法观察大鼠关节的肿胀度:选取大鼠踝关节,测其周长、肿胀度,监测时间分别为造模前1 h、造模后1 d、2 d 和1 周。
2.3 病理组织形态观察取滑膜组织,固定,脱水,石蜡包埋处理,放在干净载玻片上,在恒温箱中孵化,脱蜡后,染色,流水冲洗,乙醇分化,蒸馏水冲洗,伊红染色,二甲苯透明,封固,观察滑膜的病理情况。
2.4 血清中IL-1β、TNF-α 测定检测血清中的细胞因子TNF-α、IL-1β 选股动脉,采血,在真空采血管中,血静置0.5 h 后,离心15 min,血清采集,保存。
2.5 Western Blot 检测滑膜组织NLRP6、Caspase-1表达水平试剂批号为380625,选取组织样本100 mg,剪碎后,加用裂解液匀浆,进行充分的裂解,使用BCA 法,行蛋白的定量,计算上样量,电泳及电转化,恒流200 mA,1 h,在5%脱脂奶粉溶液中,进行PVDF 膜置,封闭,在室温下1 h,TBST洗膜,抗稀释液4 ℃,孵育,过1 夜,第2 天,TBST 10 min,洗3 次,置二抗稀释液4 ℃中,孵育1 h,后进行TBST 10 min,洗3 次,行显影,应用ECL 液行发光与条带分析。
2.6 统计学方法数据符合正态分布和方差齐性,使用SPSS22.0 统计学软件分析,测量数据以均数±标准差(±s)表示计量资料,以单因素方差分析,进行指标计量资料比较,以LSD-t检验行组间两两比较,取P<0.05 作为差异有统计学意义。
3 结果
3.1 各组大鼠受试踝关节肿胀度比较见表1。与正常组比较,其余各组造模之后,在不同时间点上,受试大鼠踝关节肿胀度有增加(P<0.05)。与模型组比较,祛瘀清热方低、中、高剂量组及秋水仙碱组大鼠,在造模后各时间节点,大鼠踝关节肿胀度降低(P<0.05)。与秋水仙碱组比较,祛瘀清热方低、中、高剂量组受试大鼠,在造模后各时间节点,大鼠踝关节肿胀度增加(P<0.05)。
表1 各组大鼠受试踝关节肿胀度比较(±s)cm

表1 各组大鼠受试踝关节肿胀度比较(±s)cm
注:①与正常组同时间点比较,P<0.05;②与模型组同时间点比较,P<0.05;③与秋水仙碱组同时间点比较,P<0.05
造模后168h 0.030±0.002 0.302±0.039①0.114±0.039①②0.211±0.051①②③0.196±0.038①②③0.139±0.058①②③组 别正常组模型组秋水仙碱组祛瘀清热方低剂量组祛瘀清热方中剂量组祛瘀清热方高剂量组鼠数10 10 10 10 10 10造模前1h 0.031±0.002 0.131±0.036①0.065±0.026①②0.122±0.025①②③0.111±0.041①②③0.093±0.036①②③造模后24h 0.030±0.007 0.335±0.041①0.143±0.036①②0.215±0.039①②③0.198±0.056①②③0.162±0.063①②③造模后48h 0.029±0.005 0.318±0.040①0.162±0.043①②0.255±0.046①②③0.241±0.063①②③0.186±0.062①②③
3.2 各组大鼠血清中IL-1β 及TNF-α 含量比较见表2。模型组中大鼠血清IL-1β、TNF-α 水平较正常组上升(P<0.05)。与模型组比较,在祛瘀清热方低、中、高3 个剂量组及秋水仙碱组中,大鼠血清IL-1β、TNF-α 的水平降低(P<0.05)。与秋水仙碱组比较,祛瘀清热方低、中、高剂量组IL-1β、TNF-α 水平增加(P<0.05)。
表2 各组大鼠血清中IL-1β 及TNF-α 含量比较(±s)pg/mL
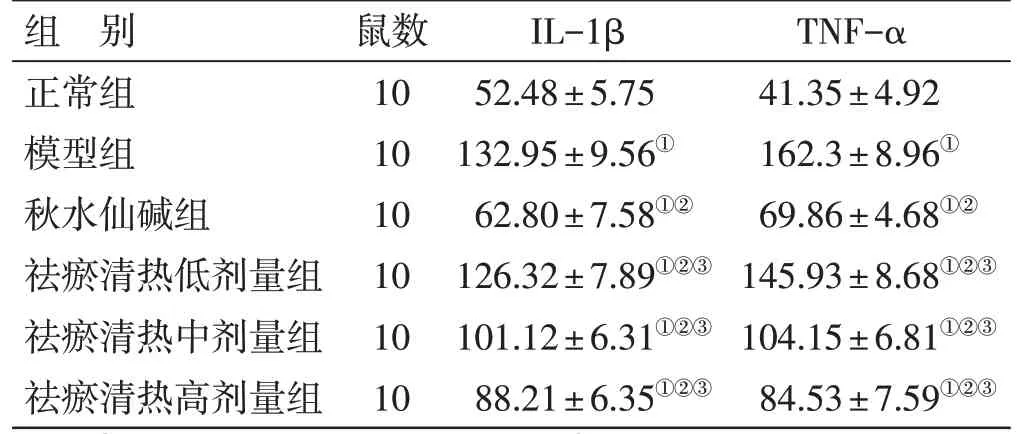
表2 各组大鼠血清中IL-1β 及TNF-α 含量比较(±s)pg/mL
注:①与正常组比较,P<0.05;②与模型组比较,P<0.05;③与秋水仙碱组比较,P<0.05
TNF-α 41.35±4.92 162.3±8.96①69.86±4.68①②145.93±8.68①②③104.15±6.81①②③84.53±7.59①②③组 别正常组模型组秋水仙碱组祛瘀清热低剂量组祛瘀清热中剂量组祛瘀清热高剂量组鼠数10 10 10 10 10 10 IL-1β 52.48±5.75 132.95±9.56①62.80±7.58①②126.32±7.89①②③101.12±6.31①②③88.21±6.35①②③
3.3 各组大鼠滑膜组织中NLRP6、Caspase-1 含量比较见图1、见表3。与正常组比较,模型组及祛瘀清热中、高剂量组滑膜组织NLRP6 蛋白表达下调(P<0.05),模型组Caspase-1 蛋白表达上调(P<0.05)。与模型组比较,祛瘀清热高剂量组滑膜组织NLRP6 蛋白表达上调(P<0.05),Caspase-1 蛋白表达下调(P<0.05)。

图1 各组大鼠踝关节组织NLRP6、Caspase-1相关蛋白表达电泳图
表3 各组大鼠滑膜组织中NLRP6、Caspase-1 含量比较(±s)

表3 各组大鼠滑膜组织中NLRP6、Caspase-1 含量比较(±s)
注:①与正常组比较,P<0.05;②与模型组比较,P<0.05
Caspase-1 0.92±0.06 1.08±0.07①0.94±0.08 0.93±0.05 0.91±0.06 0.78±0.04②组 别正常组模型组秋水仙碱组祛瘀清热低剂量组祛瘀清热中剂量组祛瘀清热高剂量组鼠数10 10 10 10 10 10 NLRP6 1.00±0.09 0.82±0.05①0.90±0.07 0.86±0.06 0.89±0.08①0.99±0.09①②
4 讨论
中医药治疗GA,颇具特色,有用单一的中药治疗,有予中药提取物治疗,其治疗GA 有多成分、多通道、多靶点的作用特点[3-4],已取得了一系列成果,如青藤碱能有效降低GA 大鼠滑膜中TNF-α、IL-1β 水平,抑制炎性细胞因子,从而对GA 起到治疗作用[4]。《中医病证诊断疗效标准》明确将GA 证型分为4 型,并就相应证型提出了详尽治疗原则和方药[5]。一般认为,临床常见的GA 证型,多为湿热蕴结与瘀热阻滞,故祛瘀清热法成为GA 的常用治法之一。研究团队成员曾较系统应用祛瘀清热汤治疗GA,取得较好的疗效[6]。
诸多国外指南指出,快速缓解患者关节疼痛,控制关节炎,是GA 急性期发作治疗的主要目标,或选非甾体抗炎药,或用激素,或口服秋水仙碱,旨在快速抗炎镇痛,说明GA 致病机制与炎症反应有较高程度的相关性,GA 致病特点通常有以下几点,一是嘌呤代谢或排泄障碍,二是血尿酸异常升高,三是关节或其周围可析出尿酸钠结晶,四是诱导关节炎症,出现关节红肿热痛症状。上述过程中,在多种相关信号通路的调控下,免疫细胞参与调节[7-8]。可见,在GA 的发病机制中,部分炎性因子起着重要作用,NLRP6 是NLR 家族的一员,具有调节炎症的功能。NLRP6 参与NF-κB 的转导[9]。NLRP6 在不同细胞中,取决于不同的途径激活。如NLRP6 可与Caspase-1 寡聚化结合,从而成为NLRP6 炎症小体,有助于组织的修复,同时抑制病理性增殖,参与机体免疫应答[10-11]。NLRP6 受体蛋白,可以被外源或内源性信号水解,这个过程中,经过Caspase-1 的参与,分泌IL-1β 等炎性因子,导致炎症的发生或细胞坏死[12]。在一些情况下,NLRP6 存在时,可抑制NF-κB 信号通路的活化,抑制炎性反应,起到分子开关功效[13]。故本研究应用中,把NLRP6 作为祛瘀清热方治疗GA 的观测指标。转录因子NF-κB,在调节应激与免疫反应中,在细胞的凋亡和分化过程中,发挥了重要作用。NF-κB 可被多种刺激激活,从而导致诸多转录程序[14]。依赖NF-κB 的转录,不但受到某些调控机制的控制,而且与其他信号通路关系,也有极为密切的关联[15]。在这种多样而复杂的关系中,NF-κB 成为某些特定的细胞反应的关键分子[16],NF-κB 有着多种生物学功能。TNF-α主要由中性粒细胞和单核巨噬细胞产生,其在尿酸钠晶体性关节炎过程中,具有重要地位,表达升高,可导致炎性因子水平升高,促使其他炎性介质释放。有研究表明,尿酸钠结晶可以直接或间接诱导,促使滑膜细胞释放一些炎性介质,激活NF-κB因子,启动和调节炎性介质的表达[17-18]。本实验显示,模型组血IL-1β、TNF-α 上升,滑膜组织NLRP6表达下调,Caspase-1 表达上调。
祛瘀清热方由当归、桃仁、泽兰、地龙、泽泻、秦艽、车前子、薏苡仁等组成,方中地龙、桃仁、当归、泽兰,活血散瘀,通络止痛,是为君药。臣以泽泻、秦艽、车前子、薏苡仁,清热除湿,健脾祛湿。佐以益母草,祛瘀生新,活血利水,白茅根清热养阴,且益母草、白茅根两药,气血双调,凉血止痛,清热散瘀,活血利水,消肿且不伤阴。全方共奏祛瘀清热、凉血消肿之功。本课题组人员多年前就已对GA 具有一定程度的研究[19-21],本研究结果提示,祛瘀清热方对尿酸钠诱导的GA 大鼠,具有较好的消肿镇痛作用,其作用机制可能与两方面有关,一是降低大鼠血清中IL-1β、TNF-α 含量,二是升高大鼠滑膜组织NLRP6 蛋白表达和下调大鼠滑膜组织Caspase-1 蛋白表达。
本研究目的,旨在利用NLRP6/Caspase-1/IL-1β信号通路及TNF-α 相关炎症因子的研究,为临床GA 治疗提供新的实验依据,然而,GA 的发生与多因素密切关联,本项研究仅关注信号通路、相关炎症因子,未来可在GA 相关的年龄、性别、环境、遗传和高嘌呤饮食等方面进一步探讨。
