不同老年人群同型半胱氨酸、尿酸及血脂水平关系分析
2023-09-23何本进莫舒涵陈誉文杨云飞何丽艳秦娇琴胡才友
何本进 莫舒涵 黎 华 陈誉文 杨云飞 何丽艳 秦娇琴 吕 渊 胡才友 杨 泽
随着全球人口老龄化日益加剧,痴呆已成为老年人常见疾病,其中阿尔茨海默病(Alzheimer’s disease,AD)占60%~80%[1],是导致老年人失能和死亡的主要原因。阿尔茨海默病是一种起病隐匿的慢性神经系统退行性变性疾病,临床上以进行性记忆缺失、智能减退等认知功能障碍、精神行为问题和社会及生活功能丧失为主要特征,其发病与年龄、性别、家族史、携带载脂蛋白E(APOE)ε4等位基因、氧化应激、血管相关危险因素、生活行为方式及社会心理因素等有关[1,2],是一种复杂的多因素疾病。正常情况下,人体主要通过饮食中摄入富含蛋氨酸、维生素B6、B12及叶酸的食物等控制Hcy水平,但在年龄相关的病理情况下,如神经退行性疾病,血浆及脑脊液中的Hcy水平会异常升高,较高水平的Hcy可通过氧化应激等机制增加老年人罹患阿尔茨海默病的风险[3]。血脂异常主要是低密度脂蛋白胆固醇(LDL-C)水平增高,后者被认为具有血管和神经毒性作用,并与阿尔茨海默病的发病机制有关[4]。尿酸(Uric acid,UA)作为人体内强大的抗氧化剂,虽然可引起痛风,且后者与心血管代谢性共病及其后遗症相关,但UA的抗氧化能力可能具有神经保护作用[5,6]。尽管如此,适当高水平的UA是否能成为阿尔茨海默病的一个保护因素,目前结论仍存在争议。本研究旨在分析广西地区60岁以上老年阿尔茨海默病患者、非长寿与长寿健康体检老人体内Hcy、血脂四项和肾功三项水平的变化趋势,探讨上述指标与阿尔茨海默病的相关性。
1.资料与方法
1.1 一般资料
选取2020年12月至2022年10月广西壮族自治区江滨医院门诊及神经内科住院65岁以上阿尔茨海默病患者60例作为AD组,其中男性36例,女性24例,年龄(77.77±8.57)岁。AD组纳入标准:(1)符合美国国立神经病语言障碍卒中研究所-阿尔茨海默病及相关疾病协会(NINCDS-ADRDA)制定的诊断标准:①由临床认知量表测试与神经心理检查确定是痴呆,②记忆及其他认知功能进行性减退,无意识障碍,③有两项及以上认知功能缺损,④不存在导致认知功能和记忆进行性缺损的躯体或脑部疾患;(2)无痛风、肝肾疾病、心脑血管疾病、肿瘤等病史。选择健康管理中心65~89岁非长寿健康体检老人60例作为非长寿组,其中男性36例,女性24例,年龄(76.13±7.15)岁。非长寿组纳入标准:①无记忆障碍、认知障碍及精神病家族史;②无痛风、肝肾疾病、心脑血管疾病、肿瘤等病史。选择经专业培训的调查员于2016年5月入户调查广西桂林市永福县90岁及以上的长寿健康体检老人60例作为长寿组,其中男性22例,女性38例,年龄(97.12±4.03)岁。长寿组纳入标准:①在本地居住1年以上;②无记忆障碍、认知障碍及精神病家族史;③无痛风、肝肾疾病、心脑血管疾病、肿瘤等病史。
上述3组老年人均未接受他汀类药物或其他降胆固醇药物治疗。AD组与非长寿组的性别和年龄差异无统计学意义(P>0.05);AD组与长寿组的性别差异具有统计学意义(P<0.05)。所有入选对象知晓本研究,并签署知情同意书。本研究经广西壮族自治区江滨医院伦理委员会审批通过。
1.2 血清指标检测
抽取研究对象清晨空腹外周静脉血4ml置于无抗凝剂试管,静置10~15分钟后离心10分钟(3500转/分钟),取上清液测定Hcy、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、LDL-C、尿素氮(BUN)、肌酐(Cr)和UA含量。
1.3 仪器与试剂
检测仪器为BECKMAN COULTER AU5800全自动生化分析仪。TC试剂盒(酶试剂法,批号:60143036)、TG试剂盒(酶试剂法,批号:60147495)和HDL-C试剂盒(免疫抑制直接法,批号:60153373)均由德赛诊断系统(上海)有限公司生产;LDL-C试剂盒(直接法-表面活性剂清除法,批号:22041204)、BUN试剂盒(尿素酶-谷氨酸脱氢酶法,批号:22062503)、Cr试剂盒(肌氨酸氧化酶法,批号:22080304)和UA试剂盒(尿酸酶法,批号:22101005)均由北京利德曼生化股份有限公司生产;Hcy试剂盒(酶循环法,批号:22-0815)由北京九强生物技术股份有限公司生产。
1.4 统计学方法
采用SPSS 26.0软件和GraphPad Prism 8.0软件进行数据分析。血清学各项指标的正态性检验使用Kolmogorov-Smirnov检验,不符合正态分布的数据以中位数(P25,P75)表示,组间比较采用Kruskal-Wallis H检验,组间多重比较使用Bonferroni法。采用二元Logistic回归分析TC、TG、HDL-C、LDL-C、BUN、Cr、UA、Hcy与AD的关系。以P<0.05为差异有统计学意义。
2.结果
2.1 3组血清学指标水平比较
除UA、TC和HDL-C外,3组其余血清学指标水平差异均具有统计学意义(P<0.05或P<0.001)。见表1。
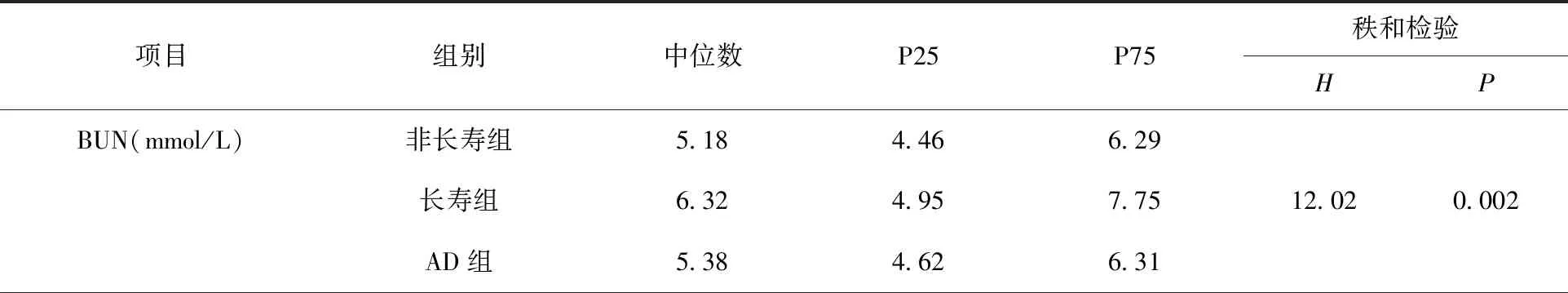
表1 3组血清学各项指标水平比较
2.2 3组间血清学指标水平比较
将3组差异具有统计学意义的血清学指标进行组间两两比较,结果显示,与非长寿组比较,AD组Cr、LDL-C、Hcy水平更高,长寿组BUN、TG、LDL-C、Hcy水平更高,差异均具有统计学意义(P<0.05或P<0.001);与长寿组相比,AD组Cr水平更高,BUN、TG水平更低,差异均具有统计学意义(P<0.05)。见图1。

图1 3组间血清学指标水平两两比较结果
2.3 血清学指标水平与AD的相关分析
以是否为发生AD为因变量(否=0,是=1),以性别、年龄、TC、TG、HDL-C、LDL-C、BUN、Cr、UA、Hcy为自变量,所有变量赋值见表2。二元Logistic回归模型(单独纳入非长寿组为模型1;非长寿组合并长寿组为模型2)结果显示,经校正性别和年龄后,模型1中TG水平增高(OR=12.367,95%CI 2.206~69.330,P=0.004)、LDL-C水平增高(OR=27.305,95%CI 4.264~174.850,P<0.001)、Hcy水平增高(OR=5.167,95%CI 1.882~14.185,P=0.001),均显著增加了阿尔茨海默病的发病风险;模型2中Cr水平增高(OR=3.355,95%CI 1.175~9.580,P=0.024)、LDL-C水平增高(OR=5.765,95%CI 1.449~22.943,P=0.013)、Hcy水平增高(OR=4.810,95%CI 1.933~11.969,P=0.001),均显著增加了阿尔茨海默病的发病风险。见表3。

表2 变量赋值表
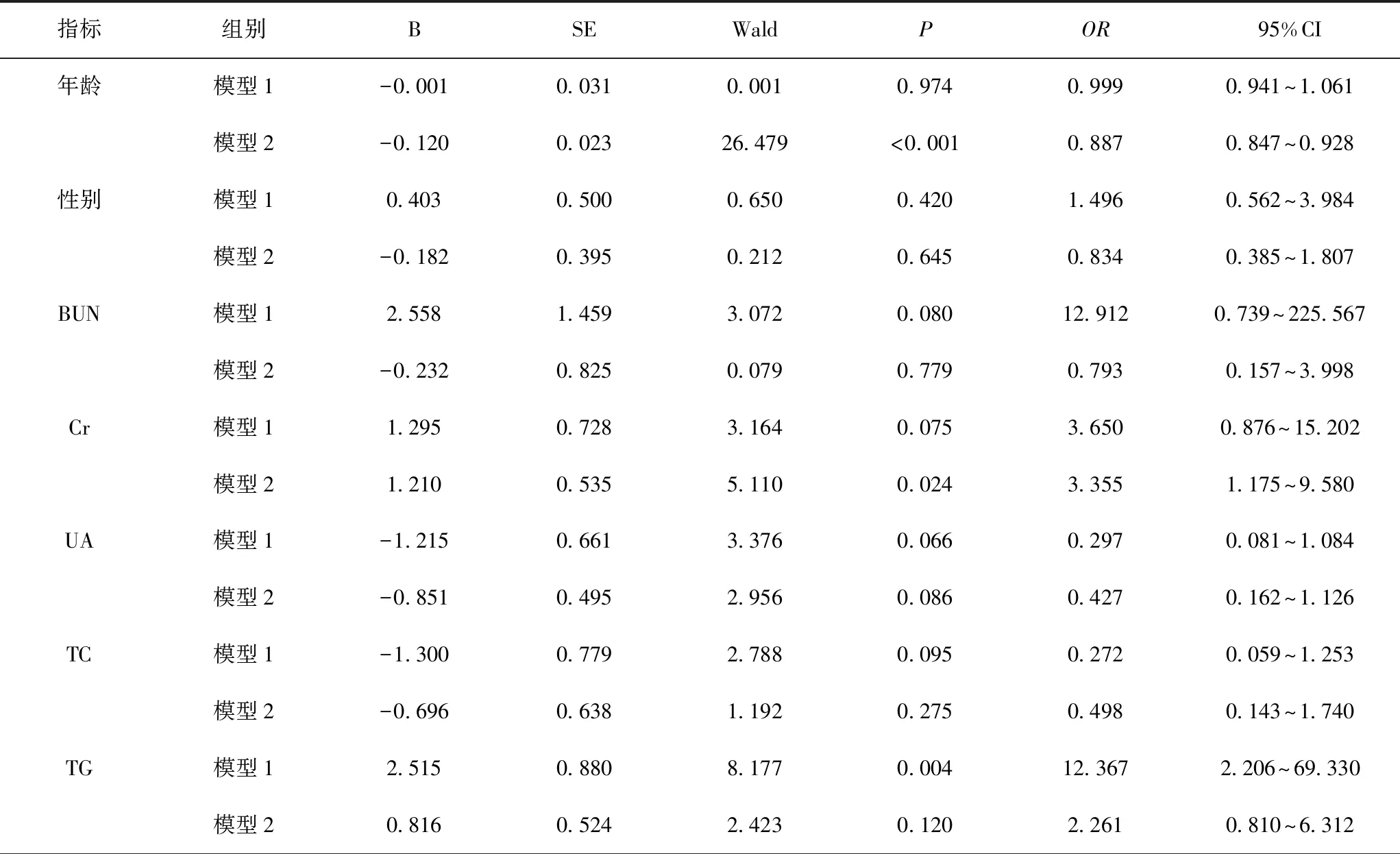
表3 血清学指标水平与阿尔茨海默病的二元Logistic回归分析
3.讨论
根据慢性肾脏疾病流行病学协作(CKD-EPI)方程,血清Cr水平可用于计算估算的肾小球滤过率(eGFR),后者是慢性肾脏病(CKD)诊断和分期的重要指标之一[7],本研究中AD组血清Cr水平显著高于非长寿组和长寿组,而非长寿组和长寿组之间的Cr水平无显著差异。二元Logistic回归分析显示,在校正性别和年龄后,模型2血清Cr水平升高显著增加阿尔茨海默病的发病风险,提示eGFR降低可能与阿尔茨海默病相关,这与最近研究的结论相似[8]。研究发现,尿毒症毒素可能具有直接的神经毒性作用,eGFR、尿白蛋白肌酐比值(UACR)(慢性肾脏病的标志物)与海马萎缩、血浆Aβ水平升高有关[9,10]。然而有研究指出,老年人群eGFR[<60ml/(min·1.73m2)]与认知功能下降之间无显著关联[11]。因此,eGFR降低或患慢性肾脏病的老年人群与阿尔茨海默病的确切关系仍不清楚。此外,本研究结果显示,在3组老年人群中,阿尔茨海默病组血清UA水平最低,但3组间比较无显著差异,二元Logistic回归分析也提示模型1和模型2的UA水平升高均减低阿尔茨海默病的发病风险,但无统计学意义。多项研究表明,阿尔茨海默病患者血清UA水平降低或呈下降趋势,UA水平升高可能对阿尔茨海默病有保护作用,因为其具有强大的抗氧化特性,可降低发病风险,延缓病程[5,6,12]。然而,Wang等[13]发现,由遗传决定的UA水平与阿尔茨海默病风险无关,甚至出现相反结论,即认为遗传预测的高水平UA可能增加阿尔茨海默病的风险。
本研究结果发现,长寿组的TG水平显著高于AD组和非长寿组,AD组的TG水平稍高于非长寿组,但差异无统计学意义;AD组和长寿组的LDL-C水平均显著高于非长寿组,长寿组LDL-C水平高于AD组,但差异无统计学意义,提示TG和LDL-C水平升高均与阿尔茨海默病有一定的相关性,但由于收集各组的例数偏少、部分老人使用降脂药等原因,可能导致长寿组TG和LDL-C水平均高于AD组的假性偏差。二元Logistic回归分析显示,校正性别和年龄后,模型1的TG水平升高明显增加阿尔茨海默病的发病风险;模型1和模型2的LDL-C水平升高均显著增加阿尔茨海默病的发病风险。对于血清TG水平与阿尔茨海默病的相关性,目前研究结果并不一致。有研究指出,与健康对照组相比,AD组血清TG水平更高[14],TC、TG、LDL-C水平升高及HDL-C水平降低与Aβ增加相关,被认为可作为生物标志物用于阿尔茨海默病的早期诊断[15]。也有研究发现TG水平对阿尔茨海默病的影响不显著[16],健康对照组与AD组之间的TG水平无显著差异,认为其可能不是认知障碍的潜在因素[17]。众所周知,LDL-C在血管中合成,在肝脏中降解,是一种将胆固醇携带到外周组织细胞的脂蛋白颗粒,可导致动脉粥样硬化性心血管疾病。胆固醇治疗试验证明,使用他汀类药物每降低LDL-C 1mmol/L,重大血管事件的风险降低21%[18]。前瞻性流行病学研究发现,中年人群的高脂血症是迟发性阿尔茨海默病的危险因素,在尸检和体内成像研究中观察到LDL-C水平升高与大脑中Aβ负荷增加有相关性[19],认为高水平的LDL-C具有血管和神经毒性作用,与阿尔茨海默病的发病机制有关。临床试验也表明,使用他汀类药物可能使阿尔茨海默病患者受益,特别是那些ApoE4纯合子患者的治疗效果可能更好[20]。尽管如此,有研究指出阿尔茨海默病患者与健康对照组之间的LDL-C水平并无显著性差异[21],随机临床试验结果也显示,与接受安慰剂的患者相比,接受他汀类药物以降低LDL-C水平的患者在认知能力下降方面并无差异,提示降低LDL-C水平与认知能力无关[22,23]。因此,LDL-C水平增高与阿尔茨海默病是否存在确切关联,目前仍存在不同观点。
Hcy是一种非编码氨基酸,在转硫途径中,由于胱硫醚-β-合成酶缺乏或活性降低可引起Hcy过量蓄积,从而导致高Hcy血症。本研究结果显示,长寿组和AD组的Hcy水平均较非长寿组显著增高,而长寿组与AD组之间Hcy水平比较,差异无统计学意义。二元Logistic回归分析显示,校正性别及年龄后,模型1和模型2的Hcy水平升高均显著增加阿尔茨海默病的发病风险,这与Zuin M等[3]研究的结论相一致。最近研究[24]发现高剂量的Hcy具有神经毒性作用,降低突触蛋白的水平,增加氧化应激并引起兴奋性传递亢进,还观察到高浓度的Hcy会加速Aβ聚集。尽管血浆Hcy水平升高常被认为是认知功能下降和痴呆发展的一个强大而独立的危险因素,但迄今为止具体机制尚无定论。
综上所述,血清Cr、TG、LDL-C和Hcy水平升高均可显著增加阿尔茨海默病的发病风险,提示控制好体内上述生物标志物的水平,对于老年人群预防阿尔茨海默病的发生具有重要意义。
