红串红球菌感染1例报告并文献复习
2023-09-23周鹏程容鹏飞刘振国
周鹏程,刘 纯,容鹏飞,刘 杨,黄 芳,刘振国
(中南大学湘雅三医院 1. 感染科; 2. 医院感染控制中心; 3. 呼吸与危重症医学科; 4. 放射科; 5. 病理科,湖南 长沙 410013)
红球菌属是一种革兰阳性需氧菌,是人类较少见的条件致病菌,致病力较弱[1]。既往报道的红球菌属感染病例多为免疫缺陷人群中感染马红球菌病例,而红串红球菌(Rhodococcuserythropolis)感染病例较为罕见,目前全球仅报道7例,我国尚缺乏报道。本文通过回顾1例人类免疫缺陷病毒(HIV)阴性感染红串红球菌患者的病例特点和诊疗经过,系统复习相关文献,总结并分析该病的病例特点、诊断与治疗、易感因素及免疫状况,以期为今后在临床上对红串红球菌感染病例的诊断和治疗提供参考。
1 病历资料
1.1 病史及入院检查 患者男性,60岁,湖南涟源人,因“发热12 d”于2023年3月24日入院。患者于2023年3月12日左右无明显诱因出现畏寒、发热,最高体温39.2℃;并有咳嗽、咳痰,咳少许黄白色黏痰,量不多,易咳出;伴有胸闷、头晕、头痛,活动后气促;无尿频、尿急、尿痛。3月21日在当地医院就诊,查血常规:白细胞计数(WBC)12.3×109/L,血红蛋白(HB)152 g/L,中性粒细胞百分比(N%)84.2%,血沉(ESR)35 mm/h,C反应蛋白(CRP)15.46 mg/L,空腹血糖12.38 mmol/L。尿常规:潜血2+。甲、乙型流感:阴性。肺炎支原体:阴性。结核抗体:IgG弱阳性。胸部+上腹部CT平扫:双肺多发结节性病灶,感染性病变?转移性?左肾积水较前明显好转,未见结石影,新见右肾结石(图1)。肝囊肿。诊断为肺部多发结节并发热:感染?肿瘤?给予头孢他啶、左氧氟沙星抗感染,止咳和化痰等治疗,患者体温有所下降,但最高体温仍在38.5℃左右,为求进一步诊治转我院。起病以来精神食欲欠佳,大便正常。

注:A、B、C、D为患者2023年3月22日肺部CT检查结果;E、F、G、H、I、J、K、L为2023年3月29日肺部CT检查结果。
本次起病后发现血糖升高(外院糖尿病未确诊)。既往有高血压病史4年,未规律服用降压药。2022年7月因肾结石行D-J管植入,2022年9月已拔出D-J管。吸烟30余年,约20支/d,有10年矿井工作史,否认尘肺病史。
入院体格检查:体温37.3℃,脉搏89次/min,呼吸21次/min,血压146/86 mmHg。神志清楚,慢性病容,皮肤巩膜无黄染及皮疹,全身浅表淋巴结未触及肿大。双肺呼吸音清晰,未闻及干湿啰音及胸膜摩擦音,心律齐,各瓣膜听诊区未闻及病理性杂音。腹平软,全腹无压痛、反跳痛,肝脾肋下未及,肝肾区无叩击痛。双下肢无水肿。
患者入院后完善相关检查示,血常规:WBC 7.15×109/L,HB 121 g/L,N%为82.1%,淋巴细胞百分比(L%)9.8%。尿常规:葡萄糖3+,余正常。粪便常规:隐血阳性,余正常。降钙素原(PCT)0.209 ng/mL。ESR 66 mm/h。CRP 35.78 mg/L。痰培养:白念珠菌。血气分析:pH 7.45,氧分压96 mmHg,血氧饱和度97.5%,乳酸1.9 mmol/L。凝血功能:纤维蛋白原4.76 g/L,余正常。肝肾功能心肌酶:肌红蛋白137.6 ng/mL,余正常。空腹血糖9.35 mm/L。糖化血红蛋白10.5%。β-羟丁酸0.48 mmol/L。血清铁蛋白:734 g/L。肿瘤标志物:癌胚抗原6.19 ng/mL,甲胎蛋白、总前列腺特异性抗原、游离前列腺特异性抗原、神经元特异性烯醇化酶、糖类抗原125、非小细胞肺癌相关抗原21-1、糖链抗原242、人绒毛膜促性腺激素均为正常。血β-D-葡聚糖(G)试验、半乳甘露聚糖抗原(GM)试验均为阴性。EB病毒和巨细胞病毒DNA定量:阴性。肥达反应:阴性。输血前四项:阴性。抗核抗体、P-ANCA、C-ANCA、抗单链DNA抗体、抗链球菌溶血毒素O:阴性。T-SPOT:阴性。免疫全套:无异常。心电图:窦性心律伴短PR间期,T波改变考虑心肌缺血。心脏彩超:左室后壁正常高值,主动脉瓣退行性病变,左室顺应性下降,二尖瓣、三尖瓣、主动脉瓣、肺动脉瓣轻度返流。头部磁共振:脑内少许缺血变性灶。
1.2 鉴别诊断 患者临床特点:中老年男性患者,病程12 d,以发热、呼吸道症状为主要临床表现,有糖尿病、泌尿系统结石手术病史。体格检查无特殊发现。辅助检查:中性粒细胞比值、CPR、PCT轻度升高,肺部CT提示多发结节性病灶,应重点考虑感染性病变,但肿瘤性病变不能完全排除。
影像学特点:(1)病灶分布为胸膜下,早期渗出为主(图1A、B),逐渐出现实变,实变密度均匀(图1C、D),病灶与胸膜黏连,病情进展后中央有小片状低强化(图1H,提示微小液化坏死)。(2)实变区大部分边缘模糊,少部分边缘清晰,边界无膨隆、无收缩征象(图1F),随着病情进展,渗出病灶减少(图1E、F),纵隔窗显示密度变密实(图1G、H)。(3)空洞,本病例在疾病进展过程中,出现无液性平面空洞,提示有坏死液化,并随支气管排除,空洞形成(图1H)。(4)近端均与血管相连,血管扩张(提示炎症,图1F),增强扫描早期动脉期迅速强化,静脉期CT值达到高峰,随后逐渐减低,呈快进快出型(图1I、J、K、L)。综合以上影像特征分析,倾向于低毒性病原体感染。
结合影像学和临床其重点鉴别的诊断有:(1)隐球菌。患者发热、呼吸道症状,肺部胸膜下有多发结节性病灶,且有糖尿病等免疫缺陷病史,存在隐球菌感染的可能,需进一步完善痰培养、痰真菌培养、血/呼吸道标本的隐球菌荚膜抗原检测明确诊断,必要时可行肺泡灌洗液或肺组织穿刺活检[2]。(2)普通细菌感染(肺脓肿)。患者肺部存在多个结节性病灶,有感染中毒表现,炎症指标升高,不能完全排除迁徙脓肿,但患者炎症反应和临床表现还达不到败血症程度,且未发现其他感染部位,不支持迁徙性脓肿,可进一步完善血培养、心脏彩超等检查明确诊断[3]。(3)结缔组织病。患者有发热、呼吸道症状,肺部存在多发性结节,炎症指标轻、中度升高,需考虑结节病、血管炎等结缔组织病的可能,但患者病程较短,自身抗体阴性,且有一定的感染、中毒症状,无双肺门及纵隔淋巴结对称性肿大,肺部病灶也未沿支气管分布,不支持结节病等结缔组织病,必要时完善结节部位组织病理检查明确诊断[4]。(4)实体肿瘤。原发性肿瘤多为单发,患者为多发结节性病灶,应考虑为转移肿瘤。转移肿瘤的主要特点为:有原发病史,病灶随机分布,边缘清楚,光滑,少有毛刺,少有含气支气管征,少有空泡征,很少边缘收缩;往往合并其他地方转移。该例患者影像学不能完全排除转移肿瘤,但由于病程短,有发热,炎症指标高,不支持肿瘤,可行纤支镜,完善肺组织穿刺病理检查明确诊断。(5)黏膜相关淋巴组织结外边缘区淋巴瘤。无症状,一般不出现高热,在影像学中通常是孤立的、清晰的肺内肿块,可出现血管“淹没征”,本例临床诊治和影像学表现均不支持该诊断[5]。
1.3 诊治经过 入院后给予莫西沙星抗感染、止咳化痰、控制血糖等治疗,患者仍有发热,最高体温达38℃,咳嗽、咳痰稍有减轻,3月29日复查肺部CT提示:双肺多发高密度影,考虑感染性病变可能,肿瘤待删(图1)。血常规:WBC 9.9×109/L,HB 124 g/L,N%为75.3%,L%为16.3%。β-羟丁酸0.02 mmol/L。CRP 37.12 mg/L。考虑患者肺部病变在使用抗菌药物的基础上出现明显进展,3月30日行穿刺组织病理及宏基因组二代测序(mNGS)检测,4月1日结果回报为:细菌、真菌、病毒均未检出,疑似背景菌红串红球菌(特异性序列数43、相对丰度8.03%),假肺炎链球菌(特异性序列数1、相对丰度0.57%),假链状双歧杆菌(特异性序列数1、相对丰度8.03%)。在参考国内外红串红球菌、马红球菌感染治疗方案的基础上[6-7],4月1日给予莫西沙星、利福平、多西环素三联抗感染治疗,患者体温于4月2日恢复正常,咳嗽、咳痰明显减轻,4月4日复查血常规:WBC 7.58×109/L,HB 121 g/L,N%为69.2%,L%为20.9%。CRP 11.51 mg/L。ESR 79 mm/h。病理活检结果回报(图2):左肺结节送检穿刺肺组织,肺泡开放可,部分肺泡腔内炎性纤维素性渗出,间质纤维化增生、玻璃变性,个别肺泡腔内纤维母细胞团插入生长;革兰染色可见阳性杆菌(图2D箭头所示),抗酸染色、六胺银染色、糖原染色均为阴性。4月4日因病情明显好转,出院继续抗感染至4月14日,门诊随访患者无发热、咳嗽、咳痰等不适,复查肺部CT:肺部多发结节性病灶较前明显吸收(图3)。血常规:WBC 6.21×109/L,HB 128 g/L,N%为68.1%,L%为21.5%。CRP 5.25 mg/L。ESR 26 mm/h。门诊嘱停药观察,5月15日、7月3日两次电话随访,患者无发热、咳嗽等不适。

注:A、B、C为HE染色;D为革兰染色(箭头所指为阳性杆菌)。

图3 患者抗红球菌感染治疗后肺部CT检查结果(2022年4月13日)
2 文献复习
截至2023年5月,全球共报道红串红球菌感染病例8例(含本例,见表1),其中美国3例,中国、日本、韩国、德国、尼日利亚各1例;男性4例;除1例6岁男童外,其余年龄均在44岁以上,最大年龄82岁,成人平均年龄63.5岁;4例存在免疫缺陷性疾病,1例使用利妥昔单抗;CRP轻中度升高,范围在45~62 mg/L;WBC受白血病、肿瘤化疗等影响较大,个体差异明显,未合并此类疾病的感染者,WBC轻度升高;肺部感染、血流感染、手术部位感染各2例,脑膜脑炎、腹腔感染各1例。主要临床表现有发热、感染部位疼痛等症状,肺部感染者存在呼吸道症状;大多数通过培养获得病原学诊断,mNGS可快速实现病原学诊断;该菌目前尚无标准药敏折点,可能敏感的药物有万古霉素、喹诺酮类、多西环素、米诺环素、氨基糖苷类、利福平等;尽管有应用β-内酰胺类药物成功治疗的报道,但大多数认为对该类药物耐药率高,应避免使用;多种抗菌药物联合、疗程≥10 d的抗感染方案,效果良好。使用利妥昔单抗的患者继发红串红球菌脑膜脑炎,预后不佳。
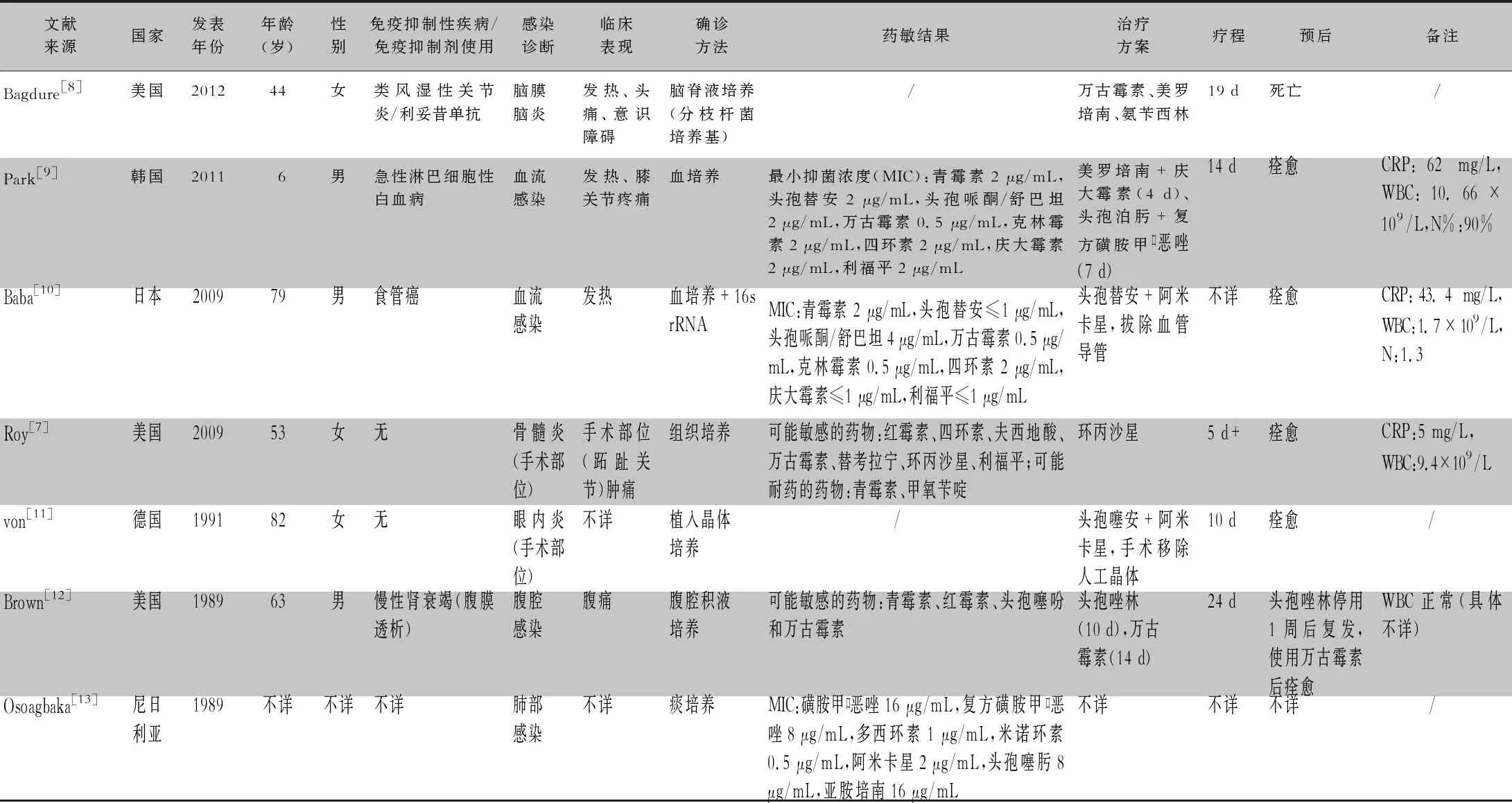
表1 红串红球菌感染病例列表
3 讨论
红串红球菌是一种条件致病菌,致病力较弱,全球范围内该菌感染的病例报道较少。既往报道的感染者均为常规病原体培养所确诊,本例为首次采用分子生物学测序方法确诊的病例。确诊的主要依据有:临床表现、实验室检查和肺部影像学均符合感染性疾病。肺穿刺组织的mNGS获得了红串红球菌,从分子生物学角度确定了病原体。mNGS的结果还有两个证据的支持:肺组织革兰染色可见阳性杆菌;常规单药抗感染治疗,疗效不佳,针对红球菌属的联合抗感染方案,取得较好效果。因此,该病例诊断为红串红球菌感染明确。
本病例从诊断的角度具体来说,患者系老年男性,既往有糖尿病病史,血糖控制不佳,临床表现为短程发热,伴感染中毒和咳嗽、咳痰等症状,炎症指标轻-中度升高,肺部CT示双肺多发高密度影。患者临床表现首先考虑感染性疾病,感染病灶锁定在肺部,外院先后给予第三代头孢菌素类、喹诺酮类单药经验性治疗,疗效不佳。呼吸科、放射介入科会诊意见示病灶位于肺外带,纤支镜灌洗获得病原体的概率要低于穿刺活检,因此3月30日完善结节穿刺活检,mNGS初步报告未获得病原体,调取背景数据发现红串红球菌序列数达到43条。考虑患者存在免疫缺陷,且穿刺组织为无菌部位标本,红球菌属感染不能完全除外。在报道的红串红球菌治疗药物的基础上,参考马红球菌的治疗方案[6-7],给予莫西沙星+利福平+多西环素三联抗感染治疗,患者症状迅速缓解,提示单药治疗红串红球菌疗效较差,需要多药联合治疗。本病例的诊断存在一定的证据缺陷:仅为mNGS测序的阳性结果,病灶不大,穿刺组织有限,标本未同时送病原学培养,也未对可能的致病菌进行sanger测序或聚合酶链式反应(PCR)的验证,但患者病理标本发现了可疑的阳性杆菌,印证了mNGS测序红串红球菌结果的可靠性。
红串红球菌作为人体条件致病菌罕见,之前尚无该菌感染后的病理特点的报道,同时常规病理诊断细菌的方法(如PAS、六胺银等)在该细菌中的阳性率不高,因此临床病理诊断红串红球菌感染较困难。本例的病理显示为机化性肺炎的改变(部分肺泡腔内炎性纤维素性渗出,间质纤维化增生、玻璃变性,个别肺泡腔内纤维母细胞团插入生长),为非化脓性炎性改变,与马红球菌感染的化脓性改变明显不同[14],提示为低毒力的病原体。该病例患者送检肺穿刺组织在HE染色时并未发现明显的球杆状及杆状细菌,且抗酸染色、六胺银染色、糖原染色均为阴性。mNGS测序发现疑似背景菌红串红球菌。mNGS结果回报后,加做肺穿刺组织革兰染色,发现肺泡腔内偶见少量紫蓝色小杆菌,提示革兰阳性菌,为患者临床诊断提供了一定支持。因此,当患者肺部多发结节状病灶,病理上显示机化性肺炎的改变,临床提示感染性病变不能排除时,应加做革兰染色进一步排除细菌感染。同时mNGS检测能有针对性地对病原体进行诊断和鉴别诊断,是临床提高真菌、细菌诊断水平的有效手段[15]。值得注意的是红串红球菌感染罕见,故mNGS生物信息学分析时将其列为背景菌,这也提示在对待无菌标本检出罕见病原体或者低毒力病原体时,应注意结合临床分析,不宜仅根据序列数草率归类为背景菌。
本例需要鉴别的主要疾病有肺隐球菌病、肺部肿瘤、血播散性肺脓肿、结缔组织病(肺结节病、血管炎等)、淋巴瘤等。患者有感染中毒征象,但循环稳定,PCT仅轻度增高,泌尿系统梗阻因素已解除,尿常规中未见明显的白细胞,不支持泌尿系统感染革兰阴性杆菌导致血流感染再播散至肺部。也未发现皮损和其他部位的感染病灶,整体不支持血流感染播散至肺部;患者病程短,有感染中毒征象,无原发肿瘤依据,肺部病灶边界欠清,纵隔淋巴结无明显肿大,不支持肿瘤肺转移;无鼻窦炎或鼻息肉征象,肾功能正常,血管炎相关抗体阴性,血管炎依据不足;结节样的肺隐球菌病的组织病理多表现为肉芽肿炎,而该患者肺穿刺活检病理提示炎性改变和机化征象,组织的真菌特殊染色和mNGS均未发现隐球菌的证据,故肺隐球菌病基本排除。组织mNGS背景菌发现红串红球菌,给予莫西沙星、利福平、多西环素三联抗感染治疗,体温下降,症状改善,肺部病灶吸收,而之前的β-内酰胺类抗生素和单用莫西沙星效果不佳,从治疗角度上支持红球菌感染。只是红球菌感染中马红球菌相对多见,多表现为化脓性感染,而该患者病理学检查未提示化脓性坏死征象。
目前红串红球菌感染病例的报道较少,其感染危险因素和临床特点总结存在一定的困难。结合该病例和文献报道,以下几点值得关注。首先,感染红串红球菌的病例大多数为免疫缺陷人群,如糖尿病、血液系统疾病、恶性肿瘤、使用免疫抑制剂患者等,特别是使用利妥昔单抗继发红串红球菌脑膜脑炎的患者,预后不佳。提示使用药物抑制B淋巴细胞的增殖可显著降低免疫力,增加红串红球菌感染的概率和严重程度。其次,红串红球菌可以感染的部位较多,一般不存在组织器官特异性,目前报道来看血流、肺部、手术部位等都可以发生感染。特别是手术部位感染病例,提示该菌存在医院感染的可能,要加强免疫缺陷人员该菌医院感染的防控。第三,红串红球菌感染的临床表现无特异性,大多数患者有发热症状,以及感染部位定位症状,如腹痛、头痛、手术部位肿痛等。第四,既往确诊的病例均有赖于病原学培养,本例报告显示了分子生物学手段,特别是mNGS在诊断该菌感染中的重要价值。最后在抗感染治疗方面,红串红球菌对于大多数β-内酰胺类药物耐药,而对喹诺酮类、氨基糖苷类、万古霉素、四环素类、利福平等药物可能敏感,单药治疗效果较差,推荐联合治疗,疗程应在10 d以上。
综上所述,红串红球菌感染病例罕见,感染者常有免疫缺陷基础,临床表现无特异性,确诊有赖于病原学结果,新兴的mNGS技术可实现快速病原学诊断。针对红串红球菌感染,推荐使用喹诺酮类、四环素类、利福平等药物联合治疗。经过规范抗感染治疗,多数患者预后良好。
利益冲突:所有作者均声明不存在利益冲突。
