La2O3负载非金属矿物基陶粒制备及其除磷性能研究*
2023-09-23冯宇博田承涛邢丽静郝禅光何东升
冯宇博 梁 欢# 田承涛 邢丽静 郝禅光 何东升 师 懿
(1.武汉工程大学资源与安全工程学院,湖北 武汉 430074;2.湖北三宁化工股份有限公司,湖北 宜昌 443200;3.武汉中地格林环保科技有限公司,湖北 武汉 430223)
长江中上游流域集中分布的磷矿资源和磷化工企业给当地创造了巨大的经济效益,但也对生态环境带来了威胁。“三磷”(磷矿、磷化工、磷石膏库)污染是流域水体富营养化的重要推手[1]。因此,水体中磷去除成了解决“三磷”行业可持续性发展和水资源安全利用的关键环节[2]。
很多矿物材料具备发达的孔隙结构和界面反应活性,而且可通过结构修饰和界面调控来进一步提升其吸附容量。矿物材料大都自然储量丰富且环境友好,成为新型廉价高效吸附剂的研究热点[9]。硅藻土是表面具有丰富的Si—OH反应活性基团的多孔、高比表面积的硅藻骨架沉积物[10];蒙脱石是具有高度黏结性和可塑性的由Si—O四面体和Al—O八面体构成的网架状结构硅酸盐矿物[11]。以上两种矿物材料极易通过负载金属氧化物进行表面改性,从而提升其吸附效率[12]。
因此,本研究运用恒温水浴法对硅藻土和蒙脱石的混合物进行La2O3负载,制备具有多孔结构的非金属矿物基陶粒,研究负载La2O3的陶粒吸附除磷性能,分析吸附动力学和吸附等温线,通过扫描电子显微镜(SEM)/电子能谱(EDS)和Zeta电位等分析陶粒的微观形貌和吸附特性,研究La2O3负载非金属矿物基陶粒除磷的作用机理。
1 材料与方法
1.1 实验原料、试剂与仪器
1.1.1 实验原料与试剂
硅藻土购自吉林省天元催化剂有限公司,蒙脱石和煤矸石购自河北省鑫磊矿物粉体工厂,经粉碎研磨后备用;六水硝酸镧(La(NO3)3·6H2O)、氧化钙(CaO)、磷酸二氢钾(KH2PO4)、四水钼酸铵((NH4)6Mo7O24·4H2O)、抗坏血酸(C6H8O6)、腐殖酸(HA)、氯化钠(NaCl)、硫酸钠(Na2SO4)和氟化钠(NaF)均为分析纯,实验用水为去离子水。
1.1.2 实验仪器
电子天平(ME204E/02),集热式恒温加热磁力搅拌器(DF-101S),电热恒温鼓风干燥箱(DHG-9140A),SEM/EDS(Hitachi Regulus8100),Zeta电位分析仪(Malvern Zetasizer Nano ZS90),高温箱式炉(SXL1700),紫外/可见分光光度计(UV-2450),回旋式水浴恒温振荡器(GY2016-SH)。
1.2 实验方法
1.2.1 La2O3负载非金属矿物基陶粒制备
配制0.1 mol/L的La(NO3)3溶液;分别称取硅藻土、蒙脱石和CaO 20、15、5 g,用集热式恒温加热磁力搅拌器将硅藻土、蒙脱石和200 mL La(NO3)3溶液混合搅拌均匀,加热到 60 ℃后加入CaO,恒温搅拌4 h后停止磁力搅拌,继续60 ℃恒温沉淀老化8 h;抽滤,将固形物取出,在电热恒温鼓风干燥箱中100 ℃干燥,再与煤矸石粉末以质量比8∶2混匀,筛选出粒径为8~15 mm的颗粒,烘干后转至高温箱式炉中设置预热温度200 ℃,保温2 h后升温至700 ℃,煅烧2 h后降至室温,得到La2O3负载非金属矿物基陶粒。
1.2.2 磷吸附实验
模拟含磷废水由KH2PO4和去离子水配制而成。量取50 mL一定总磷浓度的模拟含磷废水置于锥形瓶中,调节初始pH后投加陶粒,常温下置于转速为150 r/min的回旋式水浴恒温振荡器内振荡,一定时间后取上清液,采用《水质 总磷的测定 钼酸铵分光光度法》(GB 11893—89)测定水中总磷,并计算陶粒的吸附量和总磷去除率,相同实验条件做3次平行实验取平均值。
1.3 分析方法
1.3.1 材料表征方法
利用SEM/EDS分析陶粒吸附前后表面微观形貌以及表面元素成分。利用Zeta电位分析仪测定陶粒在吸附前后不同pH条件下的Zeta电位并确定等电点(pHpzc)。
1.3.2 吸附动力学
本研究选用准一级动力学模型(见式(1))和准二级动力学模型(见式(2))进行动力学模型拟合[13]。
qt=qe(1-e-k1t)
(1)
(2)
式中:t为吸附时间,min;qt为t时的吸附量,mg/g;qe为吸附平衡时的吸附量,mg/g;k1为准一级动力学模型吸附速率常数,min-1;k2为准二级动力学模型吸附速率常数,mg/(g·min)。
1.3.3 吸附等温线
本研究选用Langmuir吸附等温线模型(见式(3))和Freundlich吸附等温线模型(见式(4))分析吸附类型[14]。
(3)
(4)
式中:qm为最大理论吸附量,mg/g;ce为吸附平衡时的总磷质量浓度,mg/L;KL为Langmuir常数,L/mg;KF为Freundlich常数,mg1-1/n·L1/n/g;n为非线性因子。
2 结果与讨论
2.1 陶粒除磷性能探究
2.1.1 初始pH对磷吸附的影响

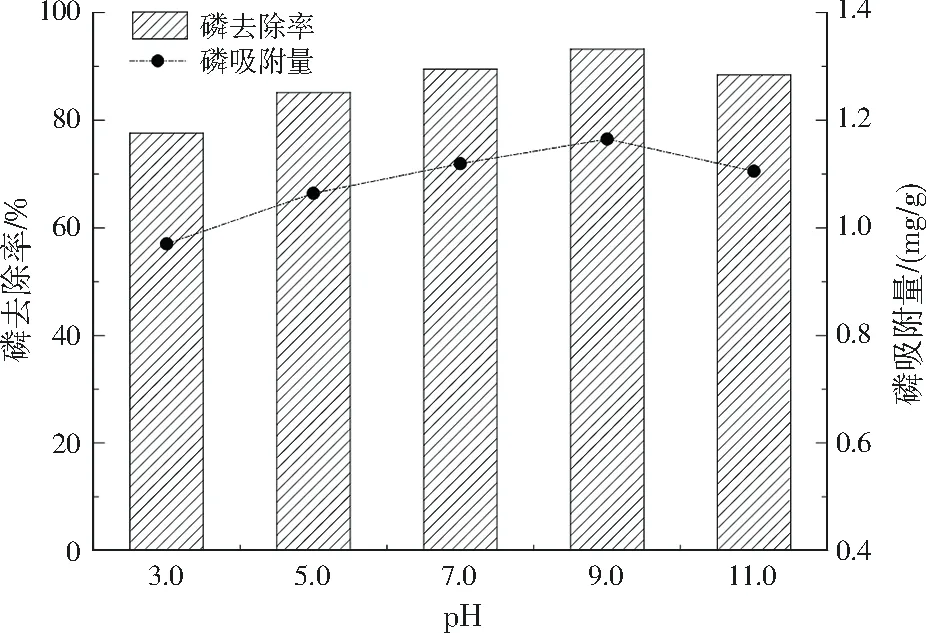
图1 初始pH对磷吸附效果的影响Fig.1 Effect of initial pH on phosphorus adsorption
2.1.2 陶粒投加量对磷吸附的影响
控制初始pH=9.0,初始总磷质量浓度为50 mg/L,吸附时间为8 h,研究陶粒投加量为10~50 g/L对陶粒除磷效率的影响,结果如图2所示。当陶粒投加量从10 g/L增加到50 g/L时,磷去除率从57.6%升高到93.6%,而陶粒的磷吸附量却从2.88 mg/g降至0.95 mg/g。为保证较好的磷去除率并提高陶粒利用率,节约成本,陶粒投加量宜为40 g/L。
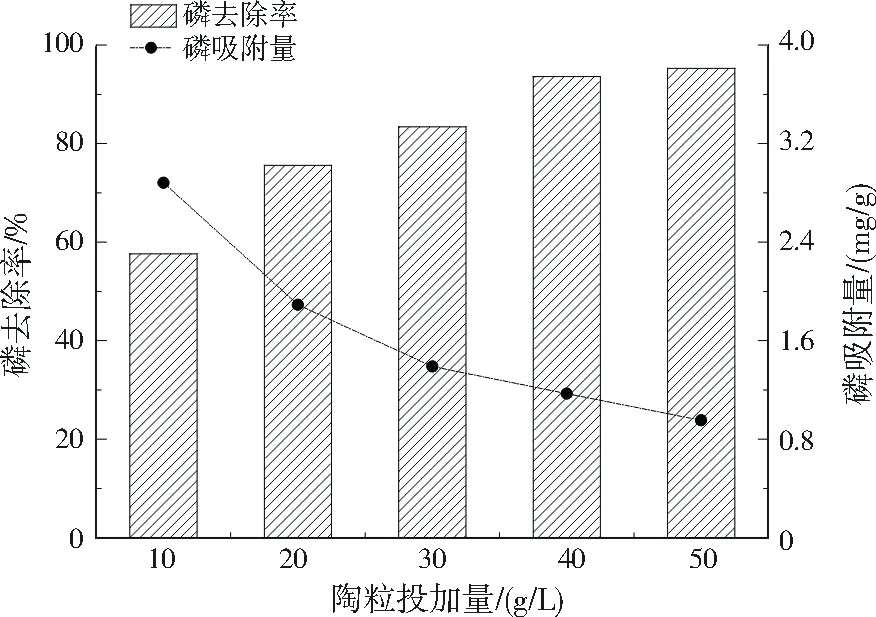
图2 陶粒投加量对磷吸附效果的影响Fig.2 Effect of ceramsite dosage on phosphorus adsorption
2.1.3 初始总磷浓度对磷吸附的影响
控制初始pH=9.0,陶粒投加量为40 g/L,吸附时间为10 h,研究初始总磷质量浓度5~200 mg/L对陶粒除磷效率的影响,结果如图3所示。初始总磷质量浓度由5 mg/L升高至200 mg/L,陶粒的磷吸附量从0.12 mg/g升高至4.55 mg/g,磷去除率从98.1%降低至91.0%。为平衡磷吸附量和磷去除率,初始总磷质量浓度宜为100 mg/L。

图3 初始总磷质量浓度对磷吸附效果的影响Fig.3 Effect of initial total phosphorus mass concentration on phosphorus adsorption
2.1.4 干扰因子对磷吸附的影响
控制初始pH=9.0,初始总磷质量浓度为50 mg/L,陶粒投加量为40 g/L,吸附时间为8 h,分别加入0.05 mol/L的NaF、NaCl、Na2SO4、HA,并设置空白对照,研究引入不同干扰因子对陶粒除磷效率的影响,结果如图4所示。添加HA、NaCl和Na2SO4与空白相比,陶粒除磷效率只是略有下降,但添加NaF,磷去除率和陶粒的磷吸附量均下降明显,可能是F-较高的电负性使陶粒中的阳离子对F-表现出更强的静电吸引作用[18-19],与磷发生竞争吸附。因此,一般来说,大部分干扰因子对陶粒吸附磷影响不大,但像F-这样电负性高的阴离子可能与磷发生竞争吸附。
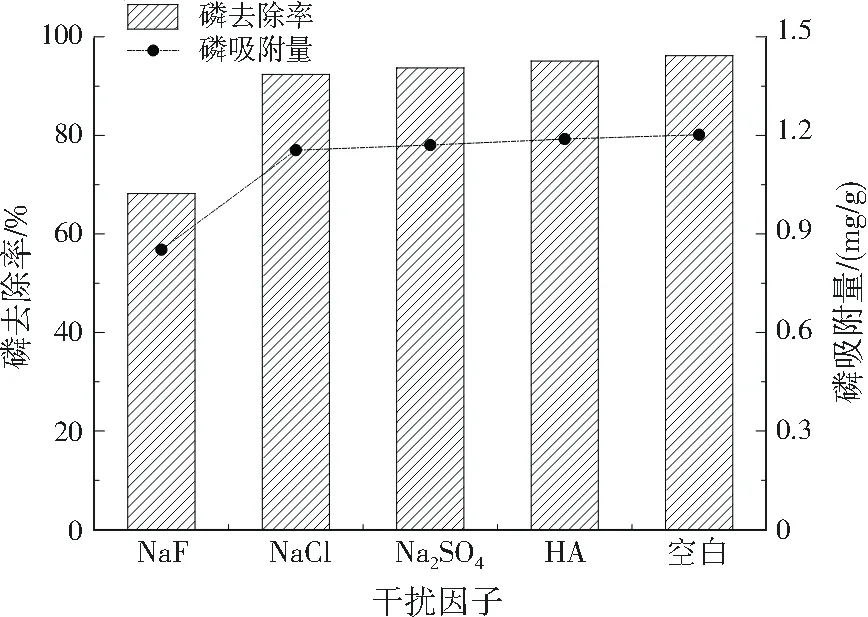
图4 干扰因子对磷吸附效果的影响Fig.4 Effect of interference factors on phosphorus adsorption
2.1.5 对实际含磷废水的除磷效率
以湖北三宁化工股份有限公司的磷石膏渣场渣水作为实际含磷废水(总磷质量浓度为219.83 mg/L,pH为5.3,F-质量浓度为28.6 mg/L),将100 mL实际含磷废水调整至接近模拟含磷废水的优化除磷条件,即稀释至总磷质量浓度为104.27 mg/L,初始pH为8.6,F-质量浓度为13.6 mg/L,陶粒投加量为40 g/L,在回旋式水浴恒温振荡器内振荡30、60、120、240、480、960 min取样,结果如图5所示。随着吸附时间延长,陶粒处理实际废水的除磷效率逐渐提升,960 min时磷去除率可达到98.9%,陶粒的磷吸附量为2.57 mg/g,可见陶粒处理实际含磷废水具有较好的性能,干扰因子的影响不大。

图5 实际含磷废水的除磷效率Fig.5 Phosphorus removal efficiency of actual phosphorus wastewater
2.2 吸附动力学研究
量取100 mL总磷质量浓度为50、100、200 mg/L的模拟含磷废水于250 mL的锥形瓶中,陶粒投加量为40 g/L,调节初始pH为7.0,分别于0.10、0.15、0.30、0.50、1.00、1.50、2.00、3.00、4.00、5.00、6.00、8.00、10.00、12.00、20.00、24.00、30.00 h时取上清液,其他条件及步骤同1.2.2节磷吸附实验。
由图6可知,陶粒的吸附除磷过程呈现出“前期快速吸附,中期表面填充,后期逐步平衡”的特征,大体可分为3个阶段:0~2.00 h为快速吸附阶段;2.00~6.00 h为表面填充阶段;6.00~30.00 h为逐步平衡阶段。2.00 h时,磷去除率已基本达到60%,对整个过程磷吸附的贡献已很大,随后陶粒对磷吸附变缓直至平衡。
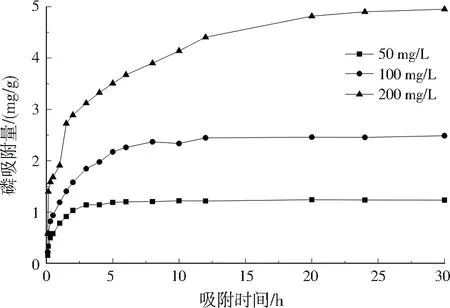
图6 吸附动力学过程Fig.6 Adsorption kinetic process
分别用准一级动力学模型和准二级动力学模型进行拟合发现,在总磷质量浓度分别为50、100、200 mg/L时,准一级动力学模型的决定系数(R2)分别为0.707 6、0.891 4、0.991 3,而准二级动力学模型的R2分别为0.999 8、0.999 3、0.994 7,表明陶粒吸附除磷的过程更符合准二级动力学模型,由物理吸附与化学吸附共同作用,且化学吸附为主要的限制性因素和控制条件[20]。
2.3 吸附等温线研究
量取50 mL总磷质量浓度为5、10、20、50、100、200 mg/L的模拟含磷废水于100 mL锥形瓶中,陶粒投加量为40 g/L,调节pH为9.0,分别在温度为25、35、45 ℃条件下至吸附平衡,取上清液,测定总磷平衡浓度,其他条件及步骤同1.2.2节磷吸附实验。
由表1的等温吸附实验数据可知,总磷平衡浓度随着温度升高而降低,陶粒的平衡时的吸附量随着温度升高而增大,最高可达4.993 1 mg/g,表明磷在陶粒表面的吸附速率受温度影响,陶粒对磷的等温吸附过程为吸热过程,温度升高提高了陶粒的吸附活性。
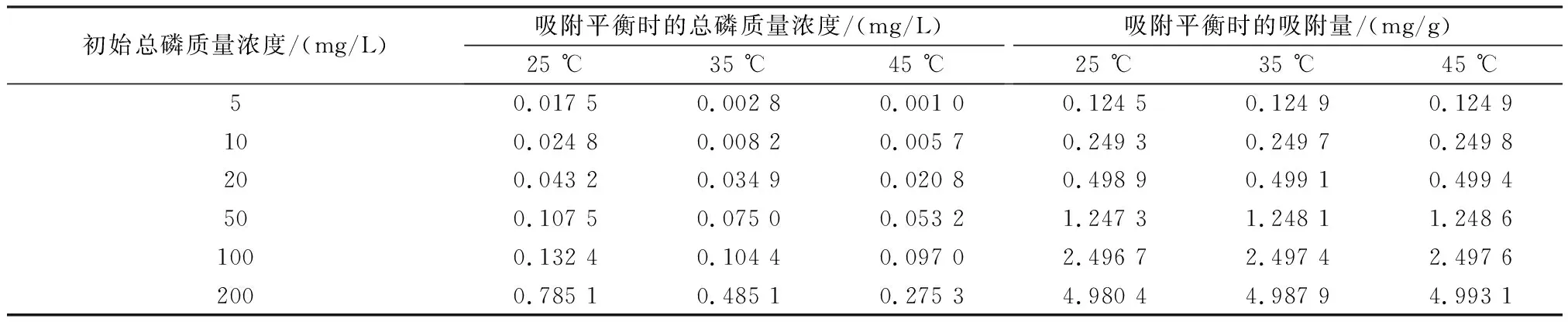
表1 等温吸附实验数据Table 1 Experimental data of isothermal adsorption
分别用Langmuir吸附等温线模型和Freundlich吸附等温线模型进行拟合,得到各模型的拟合参数如表2所示。温度为25、35、45 ℃时,Langmuir吸附等温线模型的R2分别为0.959 2、0.996 3、0.999 0,均分别高于Freundlich吸附等温线模型的R2,因此Langmuir吸附等温线模型能更准确地描述陶粒吸附除磷过程,表明陶粒表面的磷吸附过程为多分子层吸附[21]。Langmuir吸附等温线模型拟合得到45 ℃时陶粒的最大理论吸附量为10.131 4 mg/g。
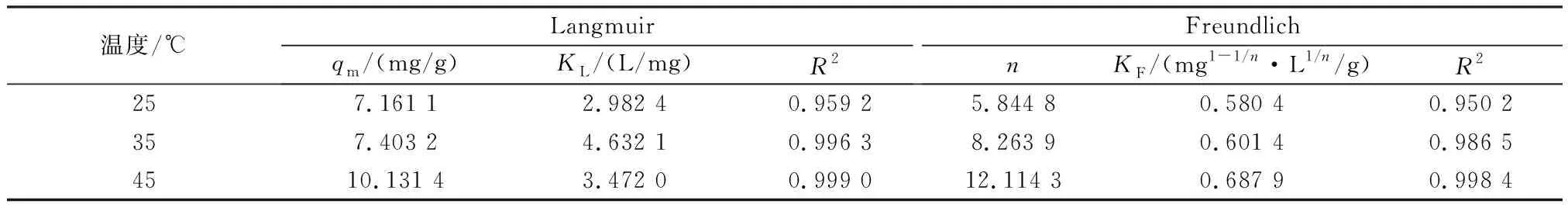
表2 吸附等温线模型拟合参数Table 2 Fitting parameters of isotherm adsorption models
3 机理分析
比较陶粒吸附磷前后的SEM照片发现,吸附磷前,陶粒表面粗糙多沟壑,具有不规则介孔狭缝和大量颗粒状附着物,La2O3颗粒界面清晰;吸附磷后,陶粒表面出现细小结晶,介孔狭缝明显减少,这可能是La3+、Si—OH活性基团与磷酸盐阴离子反应形成矿物晶体黏结于陶粒表面并填充介孔狭缝所致。
陶粒吸附磷前La元素和Si元素的EDS分析表明,陶粒表面广泛分布有La元素和Si元素,提供了金属阳离子和Si—OH活性基团,增加了陶粒吸附的活性位点。陶粒吸附磷后La元素和P元素的EDS分析表明,陶粒吸附磷后表面的La元素分布密度减少,P元素被均匀吸附在陶粒表面,这是陶粒表面的La3+参与了吸附络合反应,与磷酸盐结合形成了LaPO4络合结晶物覆盖在了陶粒表面[22]。
陶粒在吸附过程中随溶液pH变化表面电荷会发生改变[23]。由图7可见,陶粒表面的Zeta电位随pH升高而升高,陶粒吸附磷前、后的pHpzc分别为6.5、8.6。陶粒吸附磷后,pHpzc为8.6,此时陶粒表面静电斥力基本为零,证明陶粒在弱碱性溶液中除磷效果最好,静电吸附在陶粒除磷过程中发挥重要作用[24-25]。
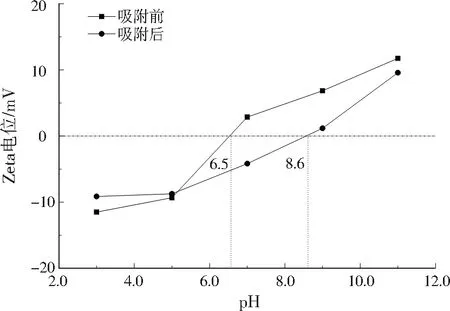
图7 陶粒表面Zeta电位变化Fig.7 Zeta potential variation on ceramsite surface
4 结 论
(1) 用模拟含磷废水研究得到:陶粒投加量为40 g/L,初始pH=9.0,初始总磷质量浓度为100 mg/L时,除磷效率较好。将总磷质量浓度为219.83 mg/L,pH为5.3,F-质量浓度为28.6 mg/L的实际含磷废水稀释并调整至接近模拟含磷废水的优化除磷条件,960 min时磷去除率可达到98.9%,陶粒的磷吸附量为2.57 mg/g。
(2) 陶粒除磷的吸附过程符合准二级动力学模型和Langmuir吸附等温线模型,即磷在陶粒表面发生多分子层物理吸附与化学吸附,且化学吸附为主要的限制性因素和控制条件,平衡吸附量随温度升高而增加,Langmuir吸附等温线模型拟合计算出45 ℃时陶粒的最大理论吸附量为10.131 4 mg/g。
(3) 陶粒表面La3+和Si—OH活性基团为吸附提供了有效的活性位点,在弱碱性溶液中除磷效果最好,静电吸附在陶粒除磷过程中发挥了重要作用。
