非编码RNA 对强直性脊柱炎的调控机制研究进展
2023-09-23黄杨竣周红海陈龙豪李季霖陆庆旺李东阳
黄杨竣,周红海,陈龙豪,李季霖,陆庆旺,李东阳
(广西中医药大学骨伤学院,广西 南宁 530001)
强直性脊柱炎(ankylosing spondylitis,AS)是一种慢性进行性炎症性免疫疾病,在中国人群的发病率约为0.2%~0.4%,以青年男性居多,主要累及脊柱与骶髂关节,病变后期可出现脊柱和骶髂关节的融合,导致脊柱活动性降低,严重影响患者的生存质量[1]。目前认为AS 的发病可能与遗传、环境或免疫等多因素相互作用有关,尚不清楚其作用机制,治疗靶点不明确,现暂无标准的达标治疗及维持缓解方案。因此,探索AS 的作用机制以及治疗的新靶点,对于AS 的防治而言具有重要意义。
非编码RNA(ncRNA)是基因调控网络中具有调节蛋白质翻译特性的RNA,包括微小RNA(miRNA)、长链非编码RNA(lncRNA)、环状RNA(circRNA)等,近年来的研究表明,miRNA、lncRNA、circRNA 在AS 患者的组织中出现异常表达,并在AS 的发展中发挥重要调控作用,提示ncRNA 与AS有着密切联系[2]。因此,本研究重点从miRNA、lncRNA、circRNA 在AS 发病中的诊断价值及作用机制研究进展进行综述。
1 miRNA 与强直性脊柱炎
miRNA 是一组内源性的短链非编码RNA 分子,大多数由RNA 聚合酶Ⅱ转录,并通过调控其上游区域包含受转录因子调控的典型核心启动子和增强子,以控制多个基因靶标的表达,在生物调节中起着至关重要的作用[3]。随着高通量测序技术的发展,越来越多的研究表明,miRNA 参与了AS 的发病过程[4]。
1.1 miRNA 参 与AS 骨 代 谢 调 控
在AS 的发病过程中存在着2 种相互矛盾的骨代谢过程:一是椎骨、突关节和韧带结构的病理性新骨形成,另一个是椎体内小梁骨量的丢失,导致骨质疏松。研究表明,miRNA 在AS 的骨代谢调控过程中发挥了重要作用[5],提示miRNA 可能参与了AS 的骨代谢过程。
1.1.1 miRNA 调控Wnt/β-catenin 成骨途径 Wnt/β-catenin 信号通路是一条高度保守的通路,与骨代谢密切相关,主要通过Wnt 蛋白与卷曲蛋白受体和LRP5/6 共受体结合,抑制糖原合成酶激酶-3(GSK-3β) 的 β-catenin 磷 酸 化 和 降 解APC-Axin-GSK-3β 复 合 物,增 加β-连 环 蛋 白(β-catenin)在细胞质中的稳定性和积累,进入细胞核与 T 细胞因子/淋巴增强因子(TCF/LEF)结合,从而发挥靶基因的转录和表达功能[6]。目前已证实miR-29a、miR-17-5p、miR-96、miR-495 通 过 调 控Wnt/β-catenin 信号通路参与AS 的发病过程。Huang 等[7]通 过 实 验 证 实 了miR-29a 在AS 患 者 的外周血单个核细胞(PMBC)中的高表达水平,并与AS 病程及改良Stoke AS 柱评分(mSASSS)之间呈正相关,由于mSASSS 指数是一项反映脊柱新骨形成的复合指标,故提示miR-29a 可能参与AS 的新骨形 成 过 程。扶 忠 超 等[8]发 现,miR-29a 在AS 患 者PMBC 高 表 达 的 同 时,Dickkopf 蛋 白1(DKK1)与GSK-3β 的的表达显着降低,提示miR-29a 可能通过调 控DKK1、GSK-3β 等 因 子 参 与AS 的 新 骨 形 成。这一猜想在Li 等[9]的研究中得到了证实,通过生物信息学手段确定了DKK1、GSK-3β 是miR-29a 的直接标靶。而DKK1 和GSK-3β 均是Wnt/β-catenin 信号通路的负性调节因子,通过抑制该通路的表达而抑制其成骨作用,其中,DKK1 通过阻止Wnt 蛋白与LRP5/6 的结合来抑制Wnt 信号传导,而GSK-3β 通过 在Thr-41、Ser-37 和Ser-33 处 磷 酸 化β-catenin 来破坏它的稳定性。Li 等[9]的研究结果表明,miR-29a通过靶向抑制DKK1 和GSK-3β 的表达在,从而提高TCF/LEF 转录活性,促进AS 的新骨形成。Qin等[10]发现,在AS 来源的成纤维细胞中,miR-17-5p的表达显著升高,其在抑制DKK1 表达的同时,促进了血管内皮生长因子(VEGF)的表达,而VEGF 是一种在血管生成中起关键作用的信号蛋白,主要参与软骨内骨化,提示miR-17-5p 可促进成骨分化。随后的体外和体内试验则提示强直性蛋白质同源物(ANKH)是miR-17-5p 的功能靶标,miR-17-5p 通过靶向ANKH 的3’UTR 来调节AS 成纤维细胞的骨化过程。因此,miR-17-5p 可通过调控ANKH、DKK1、VEGF 来参与AS 进展。蓬乱蛋白Dsh 同源物是Wnt/β-catenin 通路中的关键正性调控因子,主要通过抑制APC-Axin-GSK-3β 的功能来降低β-catenin 的磷酸化,促使细胞质中的β-catenin 转移至细胞核,与TCL/LEF 结合形成转录激动剂。研究显示,miR-96 的过表达上调了Wnt1、β-catenin 和GSK-3β 的表达,通过诱导β-catenin 和GSK-3β 的磷酸化,激活Wnt 信号通路,并且miR-96 还可靶向调节Wnt 信号抑制剂SOST,从而促进AS 的成骨因子碱性磷酸酶活性和钙结节形成[11]。Du 等[12]在AS患者组织中提取的人成纤维样滑膜细胞细胞中发现,miR-495 的表达低于健康对照组,通过生信方法及荧光素酶活性测定,确定DVL-2是 miR-495 的靶基因,miR-495 通过抑制DVL-2 增加了wnt3a、runt相关转录因子2(RUNX2)和β-catenin 的表达,促进了HFLS 细 胞 的 成 骨 分 化。 因 此,miR-29a、miR-17-5p、miR-96、miR-495 均 可 通 过 调 控Wnt/β-catenin 信号通路促进AS 的新骨形成。
1.1.2 miRNA 调 控BMP/TGF-β 成 骨 途 径 骨 形态发生蛋白2(BMP-2)是转化生长因子β 超家族(TGF-β)的成员,其通过与BMP 受体结合,作用于Smad 蛋白,使Smad1/5/8 末端丝氨酸残基被磷酸化进入细胞核内,作用于成骨细胞特异性转录因子RUNX2、Osterix等基因序列并上调其表达发挥成骨 调 节 作 用[13]。据 报 道,miR-204、miR-204-5p、miR-214-3p 可 通 过 调 控BMP/TGF-β 信 号 通 路 参与AS 的成骨分化过程。冯仲锴等[14]通过实验发现miR-204 在AS 来源的成纤维细胞中表达降低,通过生信分析预测了miR-204 的靶基因是RUNX2。经分析,RUNX2 在AS 来源的成纤维细胞和BMP-2和TGF-β1 处理的成纤维细胞中高表达,而经miR-204 转染处理后,其表达则明显降低。证明了miR-204 可通过抑制RUNX2,有效抑制成纤维细胞的骨化。Zhao 等[15]发现miR-204-5p 在AS 组织中表达明显降低,而Notch2 表达的上调。通过TargetScan 预 测Notch2是miR-204-5p 的 靶 基 因,miR-204-5p 通过靶向Notch2 抑制AS 韧带成纤维细胞中RUNX2 和BMP-2 的表达,抑制了AS 的骨形成。最新研究表明,miR-214-3p 在AS 成纤维细胞中下调,并可通过靶向BMP-2,阻断BMP-TGFβ 轴来抑制 AS 成纤维细胞的成骨分化[16]。可知,miR-204、miR-204-5p、miR-214-3p 通 过 阻 断BMP/TGF-β 信号通路传导以抑制AS 韧带成纤维细胞成骨分化。
1.1.3 miRNA 调控JAK/STAT 成骨途径 除了Wnt/β-catenin 与BMP/TGF-β 信号通路之外,JAK/STAT 信号通路也是调节骨代谢的重要通路,有研究表明,miR-21 通过调节Janus 激酶2(JAK2)/信号转导与转录激活子3(STAT3)参与AS 的成骨分化过程[17]。该研究显示,miR-21 的表达和成骨活性与TNF-α 浓度呈负相关,在0.1 ng/mL 浓度时成骨活性最强,证明炎症环境与异常骨形成具有相关性。同时,在miR-21 模拟物转染的成纤维细胞中观察到,JAK2 和STAT3 的表达升高,在小鼠体外注射miR-21 则会引起新骨形成及骶髂关节融合,提示miR-21 通过JAK2/STAT3 途径促进骨形成。
1.1.4 miRNA 调控破骨细胞生成 体内骨重建还取决于成骨细胞和破骨细胞之间的平衡,当这两种细胞的功能障碍或异常可导致骨稳态紊乱,故破骨细胞功能失常也是AS 骨代谢紊乱的重要因素之一。在Liu 等[18]的实验中,AS 患者的间充质干细胞比健康供体者表现出更强的抑制破骨细胞生成的能力,这一现象与CXC 趋化因子5(CXCL5)的分泌呈正相关,生物信息学分析表明CXCL5是miR-4284 的靶基因,使用miR-4284 抑制剂转染细胞时,CXCL5分泌增加,并显著抑制了破骨细胞生成,证实了miR-4284 通过靶向CXCL5 使AS 患者的MSC 表现出更强的抑制破骨细胞生成的能力。程序性细胞死亡因子(PDCD)是促进细胞凋亡的重要因子。Huang 等[19]研究发现AS 患者的miR-21 水平显着升高,其表达水平与AS 的疾病持续时间、活动性以及骨密度减少呈正相关,这可能与miR-21 靶向抑制PDCD4 进而抑制破骨细胞凋亡,促进破骨细胞分化有关,提示miR-21 可充当AS 病理性破骨细胞生成中的相关标志物。
因 此,miRNA 可 通 过 介 导Wnt/β-catenin、BMP/TGF-β、JAK/STAT 等信号通路以及相关成骨、破骨因子参与了AS 的骨代谢调控。以这些miRNA 为靶点,研制miRNA 与相关信号通路或基因的传导的促进/阻断剂,进而抑制AS 异常骨化,可以很大程度地降低AS 后期关节间的骨性融合几率,从而提高患者的生存质量。
1.2 miRNA 参与AS 免疫炎症反应
AS 是复杂的慢性炎症性疾病,研究表明miRNA 参与了AS 的炎症反应过程[20]。辅助T 细胞17(Th17)作为CD4[+] T 细胞的一个亚群,其特征是产生促炎细胞因子白细胞介素-17(IL-17),参与AS的 发 病 过 程。Chen 等[21]研 究 证 明,miR-10b-5p 在AS 患者的Th17 细胞表达增加,过表达的miR-10b-5p 可 降 低AS 的CD4+ T 细 胞 中Th17 的分化和IL-17A 的产生,这与miR-10b-5p 通过3’UTR 端结合抑制Th17 细胞中的MAP3K7,沉默的MAP3K7 进而抑制IL-17A 的产生相关。
IL-23 是由单核细胞,巨噬细胞和树突状细胞等分泌的异源二聚体细胞因子,主要通过促进Th17细胞的分化参与机体的免疫反应。Lai 等[22]研究发现在IL-23 培养的K562 细胞中12 个miRNA 的表达水平显著升高,4 个miRNA 水平降低。在这些IL-23 调 控 的miRNA 中,miR-29b-1-5p、miR-4449、miR-211-3p、miR-1914-3p 和miR-7114-5p 在AS 患者T 细胞中的表达明显升高。其中,miR-29b-1-5p的转染可抑制K562 细胞中IL-23 介导的STAT3 磷酸化,STAT3 是Th17 细胞分化所需的IL-23 信号通路的关键下游转录因子。经过NGS 分析和验证后发现miR-29b-1-5p 还可上调血管生成素与干扰素-γ(IFN-γ)的 表 达。故miR-29b-1-5p 通 过 抑 制IL-23 介导的STAT3 磷酸化,在AS 的炎症反应过程中发挥负反馈控制作用。何孝亮等[23]在AS 患者外周血中发现miR-146a 表达升高且与TNF-α、IL-1β、IL-6 等炎性细胞因子以及病情活动度呈正相关,提示miR-146a 可能通过调控炎性细胞因子参与AS 病情活动,这一机制可能与miR-146a 抑制TRAF6基因的表达来实现,但具体机制还有待进一步验证。
由于miRNA 序列中的单核苷酸多态性可能会改变miRNA 的表达,并与AS 的发病机制相关。Xu等[24]研究了汉族人口中的miR-146a rs2910164G>C 和miR-499 rs3746444T> C 这两个SNP 与AS 的关系,以期寻找可用作鉴定早期AS 的候选标记物。结果显示,miR-146a rs2910164G> C 与AS 具有关联性。然而,Niu 等[25]扩大了该研究的样本量后,得到了相反的结果,认为这一差异可能是由不同队列的抽样引起的,提示miR-146a rs2910164G> C 作为AS 诊断标记物的研究仍有待深入。由此可知,过表达的miR-29b-1-5p、miR-146a 可通过调节炎症因子促进AS 的炎症反应,有望作为AS 治疗的潜在靶点。
1.3 miRNA 参与AS 细胞自噬过程
自噬是细胞存活与死亡之间的纽带,在大多数细胞应激(例如营养缺乏)下起细胞保护作用,而在严重或长时间的应激反应下则可导致细胞死亡。此外,自噬也可以作为感染或炎症的先天防御。在AS 的中晚期,巨噬细胞的自体吞噬作用可以减轻炎性反应。let-7i 是首个被发现通过调控细胞自噬参 与AS 进 展 的miRNA[26]。研 究 者 发 现miRNA let-7i 在Jurkat 细胞中过表达,并可显着抑制其靶标胰岛素样生长因子-1 受体(IGF1R)的表达。IGF1R因子通过磷酸肌醇3-激酶/Akt 和丝裂原活化蛋白激酶途径的转导,保护T 细胞免于凋亡。该研究表明,抑制IGF1R 介导的信号转导会降低mTOR/Akt的磷酸化和Bcl-2 表达水平,并降低Bax/caspase-3/PARP 的负调节,从而随后诱导自噬,而过表达的let-7i 通过抑制IGF1R 以诱导细胞自噬来保护T 细胞 免 于 凋 亡。Wang 等[27]在AS 患 者 的T 细 胞 中 观察到miRNA-199a-5p 和自噬相关基因(LC3、beclin1和ATG5)的表达显着降低,miRNA-199a-5p 的过表达可抑制靶基因Rheb,并使其下游信号mTOR 传导异常,从而促进了T 细胞自噬。王亚韩等[28]发现miR-148a-3p 在AS 患者中过表达,而其靶基因DNMT1的表达水平较低。过表达的miR-148a-3p 可促进炎性因子(L-6、IL-17 和IL-23)的分泌,而且能够显著抑制自噬相关蛋白(Beclin-1 和ATG5)的表达并下调LC3 Ⅱ/LC3 Ⅰ的比例,表明miR-148a-3p 可能通过调控DNMT1 的表达参与调控AS 的T 细胞自噬及炎症进程。炭疽性毒素受体2(ANTXR2)作为一种膜蛋白,通过内吞作用和相关的信号转导参与 介 导 细 胞 外 基 质 稳 态。Xia 等[29]证 实 了 在AS 患者外周血中的ANTXR2的表达被下调,而miR-124被上调,并通过荧光素酶报告测定法确定ANTXR2为miR-124 的靶基因。在随后的验证实验中,过表达的miR-124 在Jurkat 细胞中显著抑制了ANTXR2的表达,并促进c-Jun 氨基末端激酶的激活并诱导自噬。
1.4 miRNA 参与AS 细胞程序性死亡过程
细胞程序性死亡是正常组织在整个生命进程中(如新陈代谢的生理过程、机体创伤过程)都会发生的过程。按照死亡的方式不同,细胞死亡分为程序性死亡和非程序性死亡。程序性死亡又包含着细胞凋亡与细胞焦亡。其中,细胞凋亡是细胞通过外源性、内源性和内质网应激诱导途径以主动结束生命的方式来清除受损及衰老细胞以维护内环境稳定的过程,Li 等[30]观察到在AS 患者的T 细胞中miR-130a-3p 表达下降,而其靶基因HOXB1 的表达升高。miR-130a-3p 模拟物可促进Jurkat T 细胞的增殖能力并抑制细胞凋亡,但这些影响都可以被HOXB1 逆 转,故miR-130a-3p 通 过 靶 向HOXB1 来调节T 细胞的存活。细胞焦亡是依靠炎性半胱天冬酶-1(caspase-1)形成质膜孔,导致促炎细胞因子的释放和细胞裂解。研究发现,用miR-204 模拟物处理的成纤维细胞样滑膜细胞(FLS)抑制了细胞焦亡率和Caspase-1/PI 细胞分化,并降低了FLS 中的[Ca2+]、活性氧(ROS)、热解相关基因(Caspase-1、Caspase-11和NLRP3)水平,而上调miR-204 的靶基因GSDMD则可阻止miR-204 过表达对FLS 的影响。而GSDMD 恰好是引发细胞焦亡的caspase-1通路关键因子,故上调的miR-204 通过抑制GSDMD 来 抑制AS 中FLS 的焦 亡[31]。
由此可知,miRNA 主要通过调控骨代谢、免疫炎症反应、细胞自噬及细胞程序性死亡途径来参与AS 的发病过程。
2 lncRNA、circRNA 与强直性脊柱炎
lncRNA、circRNA 作为竞争性内源性RNA(competing endogenous RNA,ceRNA)网络的一员,通过与miRNA 应答元件竞争性结合或共享miRNA来调控靶基因,从而解除或减少miRNA 对靶基因的作用(又称为“海绵作用”),进而对生物的发育和相关疾病产生影响[32]。
lncRNA 是一类长度超过200 个核苷酸的RNA转录物,其包含一个或多个miRNA 的结合位点,通过ceRNA 机制调节靶mRNA 的表达,主要参与表观遗传、基因转录及转录后的基因表达调控,也参与AS 的发生与发 展[33]。lncRNA MEG3 是较早被发 现 参 与AS 疾 病 进 程 的lncRNA。Li 等[34]发 现MEG3 在AS 患者中下调,下调的MEG3 与炎症因子IL-1、IL-6、TNF-α 水平呈负相关,但这一抑制作用可以被miR-146a 的过表达所逆转,qRT-PCR 确定了miR-146a 与MEG3 的靶向作用,因此,MEG3通过海绵化miR-146a 抑制炎症细胞因子的水平。然而,也有学者指出,MEG3 表达水平与病程呈负相关,与自噬相关基因Beclin 1水平以及IL-23 水平呈正相关,推测MEG3 可能是通过抑制AS 患者的自噬水平参与AS 的发病和进展,但其作用机制暂不详[35]。lncRNA H19 也与炎性疾病的发病相关,Zhang 等[36]发现H19 在AS 患者中过表达,使用H19的小干扰RNA(Si-H19-1484)转染细胞可抑制H19的表达,并显着下调miR22-5p 的表达以及增加miR675-5p 的表达,降低了维生素D 受体以及IL-17A 和IL-23 细胞因子的表达,从而抑制了AS 的炎症反应。提示H19 可多靶向结合miR22-5p、miR675-5p,并 通 过H19-miR22-5p-VDR-IL-17A/IL-23 轴 与H19-miR675-5p-VDR-IL-17A/IL-23 轴促进AS 炎症反应的进行。NF-kB 信号通路可调节促炎细胞因子的表达,在炎症反应中发挥关键作用,LOC645166 是最近被证实通过NF-κB 信号通路参与AS 炎症反应的lncRNA[37]。LOC645166 在AS患者T 细胞中的表达降低,其通过与K63 连接的多聚泛素链结合抑制了由Toll 样受体介导的自转磷酸化并激活IKK2,进而导致激活的IKK2 下调IκB磷 酸 化。稳 定 的IκB 与NF-κB 结 合,使NF-κB/IκB复合物保留在细胞质中。因此,LOC645166 通过结合K63 连接的多聚泛素链激活NF-κB 通路进而促进AS 的炎症反应。此外,LncRNA 还参与了AS 的异位骨化过程。Xie 等[38]微阵列以鉴定在成骨分化的 AS 的MSC 中差异表达的lncRNA,CNC 网络和基因表达的相关性分析表明,lnc-ZNF354A-1、lnc-LIN54-1、lnc-FRG2C-3 和lnc-USP50-2 可 能 通过BMP2 参与ASMSC 的异常成骨分化过程,为进一步探讨lncRNA 调控AS 患者异位骨化提供了依据。王琛等[39]通过微阵列芯片从AS 患者的髋关节周围韧带的上千种差异表达的lncRNA、miRNA 及mRNA 中筛选出lnc-NR_045553/miR-17-5p/FGD5调控轴,并在AS 患者的骨髓MSC 中发现lnc-NR_045553 以ceRNA 的方式与FGD5 竞争性地结合miR-17-5p,缓解miRNA 对靶基因的负调控作用,促进FGD5 的表达,激活Wnt/B-catenin 信号通路,从而正向调控成骨分化过程。可知,lncRNA 主要通过“海绵化”miRNA 调控Mrna 表达来参与AS 的炎症反应、成骨分化过程。因此,与miRNA 相比,lncRNA 存在的多靶点效应可能在未来的临床转化及实际应用中获益更大。

表1 miRNA 在强直性脊柱炎的调控作用Tab 1 Regulation of miRNA in ankylosing spondylitis
CircRNA 是一类具有共价闭合环状结构的新型内源性非编码RNA,这种封闭环状结构使它们非常稳定,且由于其具有组织特异性,在许多组织中高度保守,是良好的治疗靶点及生物标记物。高丽红 等[40]在AS 患 者 的 记 忆 性CD4+T 细 胞 中 发 现circPDESA、circCCNY 和circRASA1 在AS 中表达明显上调,随后的实验证明circCCNY 和circRASA1 可 作 为miR-181c-5p 的 海 绵,调 控PKC-δ 的 表达,干扰circCCNY、circRASA1 表达或过表达miR-181c-5p 模 拟 物 均 可 降 低PKC-δ 的 表 达,并 观察到自噬相关基因ATG5、ATG7 和LC3B-Ⅱ表达明显下降,提示细胞自噬水平的降低。因此,circCCNY、circRASA1 通过海绵吸附miR-181c-5p调 控PKC-δ 以 促 进 细 胞 自 噬 水 平。Li 等[41]发 现hsa_circ_0056558 和CDK6 在 AS 组 织 中 的 表 达 水平均显着高于正常样本,并可正向调控PI3K/AKT/NF-kB 信号通路的相关蛋白水平,这一反馈可被miR-1290 抑制,因此,hsa_circ_0056558 可以通过靶向结合miR-1290,促进CDK6 表达在AS 中的表达来抑制细胞增殖和分化。cicrRNA 功能稳定且特异性强,在多项生物调节中发挥重要作用,有望成为AS 的早期诊断标志物及治疗靶点,但目前关于circRNA 与AS 的相关文献报道较少,研究有待深入。
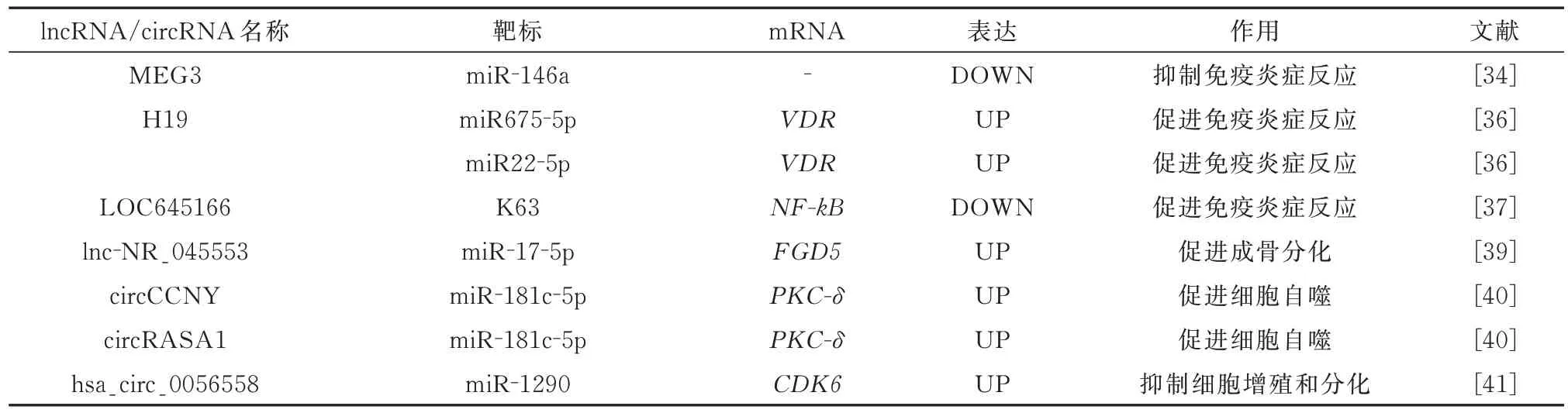
表2 lncRNA/cicrRNA 在强直性脊柱炎的调控作用Tab 2 Regulation of lncRNA/cicrRNA in ankylosing spondylitis
3 小结
由于AS 的病因复杂、发病机制以及治疗靶点尚不明确,目前其干预措施未达成共识,故临床治疗以缓解症状、控制病情进展为主,导致其治疗难度大、致残率高,严重影响患者的生活质量。随着高通量测序技术的发展,已经发现越来越多的ncRNA 与AS 的骨代谢、炎症反应、细胞存活过程有着密切联系,说明ncRNA 参与了AS 的生理病理变化,预示其具有广阔的研究前景。因此,寻找能够作为AS 早期诊断生物标记和治疗靶点的ncRNA,阐明其作用机制,制定更为有效的干预方法或将成为未来研究的方向。此外,对功能稳定且特异性强的circRNA 以及其他ncRNA(如小干扰RNA、PiWi蛋白相互作用RNA 等)的研究过少,相信随着研究深入,更多相关调控机制会被揭示。
