缺氧环境下的肝星状细胞中缺氧诱导因子1α与缺氧诱导因子2α对CD248表达水平影响
2023-09-22陈纪宏许向波何福亮田苗苗胡思隽祁兴顺
陈纪宏, 许向波, 何福亮, 田苗苗, 胡思隽, 祁兴顺
1.北部战区总医院 消化内科,辽宁 沈阳 110016;2.大连医科大学研究生院,辽宁 大连 116044;3.首都医科大学附属北京友谊医院肝病中心,北京 100050;4.空军军医大学西京消化病医院 国家消化系统疾病临床研究中心 肿瘤生物学国家重点实验室,陕西 西安 710032;5.西北工业大学医学研究院,陕西 西安 710072
缺氧与肝炎、肝纤维化、肝癌等多种肝疾病的发病机制密切相关[1]。在肝损伤早期,局部组织即可发生缺氧,缺氧可抑制肝组织再生,同时也可刺激肝发生纤维化[2]。缺氧是导致肝发生物理和化学损伤的重要因素之一,对肝星状细胞(hepatic stellate cell,HSC)激活具有重要作用[3]。HSC激活、增殖和分化转移是肝纤维化和肝癌等疾病发生的重要标志。HSC可分泌细胞外基质,还可以通过旁分泌信号传导机制影响肝细胞增殖和肝组织再生[4-5]。当肝组织缺氧时,HSC中的缺氧诱导因子(hypoxia inducible factor,HIF)激活表达上调,进而参与保护肝细胞、刺激血管生成和能量代谢等过程,同时也参与肝肿瘤发生、肝脂质积聚和肝纤维化等病理过程[6]。目前,在HIF家族中已知参与调控细胞适应低氧变化的亚基主要是HIF-1α、HIF-2α[7]。CD248是一种Ⅰ型跨膜糖蛋白,主要存在于活化的间充质细胞的质膜上[8]。CD248在成人正常组织中表达很低或几乎不表达,但在缺氧、恶性肿瘤、炎症和一些纤维化疾病的间充质细胞中则会表达升高[9]。在肝组织中,CD248仅在HSC和成纤维细胞中表达,且与纤维化和肿瘤的发生有着密切的关系,HSC中的CD248表达可抑制肝细胞增殖,达到影响肝疾病进展的作用[10-11]。HIF-1α、HIF-2α和CD248在肝组织缺氧时均会在HSC中表达增加,且均与肝纤维化和肝癌等多种肝疾病有着密切的关系。然而,目前在缺氧环境下HIF-1α、HIF-2α对CD248调控作用尚未被充分阐明。布-加综合征(Budd-Chiari syndrome,BCS)的疾病进程与缺氧密切相关[12],且慢性BCS随着病情发展可发生肝纤维化[13],故本研究选用BCS患者肝活检组织进行临床样本研究。本研究旨在探讨缺氧状态下的HSC中HIF-1α、HIF-2α对内皮唾液酸蛋白(endosialin/CD248/TEM1)表达水平的影响。现报道如下。
1 材料与方法
1.1 免疫组织化学 BCS患者肝组织活检标本来自既往报道的9例患者[14]。将已经脱蜡水化的标本切片放在3% H2O2中,在室温下孵育5~10 min,随后用PBS冲洗。分别滴加CD248(英国Abcam)、HIF-1α(英国Abcam)和HIF-2α(英国Abcam)等抗体,室温孵育30~60 min后用PBS冲洗。再滴加相应的二抗(英国Abcam),室温孵育10~20 min后PBS冲洗,应用DAB溶液显色,蒸馏水冲洗、复染、脱水和封片。以PBS代替一抗作为阴性对照,采用已知阳性片作为阳性对照。应用Image-Pro Plus 6.0软件(Media Cybernetics,Inc,Rockville,MD,USA)对结果进行分析,得出CD248、HIF-1α、HIF-2α的免疫组化累积光密度(immunohistochemical cumulative optical density,IOD)值。
1.2 细胞培养 本实验所有HEK293T(上海吉凯)和HSC-LX2细胞(上海吉凯)所用的培养液均为含胎牛血清(上海微科)的DMEM完全培养液(美国Hyclone),并放于5% CO2、37℃培养箱中进行培养。
1.3 构建和鉴定过表达质粒 根据Gene Bank中HIF-1α(NM_001530)和HIF-2α(NM_001430)的基因序列设计并合成上下游引物。引物序列如下:HIF-1α上游引物序列为5′-GAGGATCCCCGGGTACCGGTCGCCACCATGGAGGGCGCCGGCGGCGCG AACGACAAGAAAAAG-3′,下游引物序列为5′-TCCTTGTAGTCCATACCGTTAACTTGATCCAAAGCTCT GAGTAATTCTTC-3′。HIF-2α上游引物序列为5′-GAGGATCCCCGGGTACCGGTCGCCACCATGACAGC TGACAAGGAGAAGAAAAGG-3′,下游引物序列为5′-TCCTTGTAGTCCATACCGGTGGCCTGGTCCAGGG CTCTGAGGA-3′。HIF-1α、HIF-2α基因重组过表达质粒的构建均是在AgeI和BamHI酶切位点应用相应限制性核酸内切酶(美国NEB)对GV358载体(Ubi-MCS-3FLAG-SV40-EGFP-IRES-puromycin,上海吉凯)进行双酶切完成的。将经凝胶电泳检测合格的聚合酶链反应(polymerase chain reaction,PCR)扩增产物连接入线性化表达载体,形成带有HIF-1α、HIF-2α基因的重组过表达载体(Ubi-HIF1α-3FLAG-SV40-EGFP-IRES-puromycin和Ubi-HIF2α-3FLAG-SV40-EGFP-IRES-puromycin)。将其产物转化大肠杆菌感受态细胞DH5α(上海吉凯),应用嘌呤霉素抗性细菌培养基进行筛选。对PCR鉴定阳性的克隆结果进行测序,并对克隆质粒进行PCR凝胶电泳鉴定,克隆质粒凝胶电泳共设置12个点样孔,分别为空白对照(双蒸水)、阴性对照(空载自连质粒)、阳性对照(甘油醛-3-磷酸脱氢酶,GAPDH)、DNA Marker(250 bp-Ⅱ DNA Ladder,上海捷瑞)和1~8号重组质粒。
1.4 包装过表达慢病毒 将制备好的重组过表达质粒及p Helper 1.0载体质粒(上海吉凯)、p Helper 2.0载体质粒(上海吉凯)分别进行高纯度无内毒素抽提,然后进行转染HEK293T细胞。培养对数生长期的HEK293T细胞,将消化后的细胞重新培养至细胞密度达到70%~80%。在转染前2 h更换为Opti-MEM培养基(美国Gibco),向离心管中加入20 μg的GV358载体、15 μg的p Helper 1.0载体和10 μg的p Helper 2.0载体,将稀释后的DNA与相应体积的转染试剂混合均匀。混合液转移至HEK293T细胞的培养液中进行转染,转染6 h后更换为完全培养基培养48 h,随后收集富含慢病毒颗粒的细胞上清液,离心除去细胞碎片。用滤器过滤上清液,置于超速离心管中进行离心,离心后将病毒浓缩液移出,分装后保存于病毒管中。
1.5 测定病毒滴度 选用荧光法测定病毒滴度。在测定前1 d使用HEK293T贴壁细胞铺板,每孔4×104个细胞。将病毒稀释0.1、1.0和10.0 μl 3种滴度加在不同孔内。24 h后加入完全培养基100 μl,4 d后观察荧光表达情况并计算病毒滴度。
1.6 确定慢病毒载体最佳感染条件 将密度为4×104个/ml的100 μl HSC-LX2细胞悬液接种于96孔板中。在慢病毒感染时,细胞融合率已达到40%,按照感染复数为100、10和1这3个梯度加入病毒。每个梯度均分别设置4个不同培养基进行筛选,分别为完全培养基、含5 μg/ml Polybrene(助感染试剂;美国Sigma-Aldrich)的完全培养基、含ENi.S(感染增强溶液;上海吉凯)的完全培养基和含5 μg/ml Polybrene+ENi.S的完全培养基。感染72 h观察荧光表达情况,在感染复数为10的含ENi.S的完全培养基中荧光强度最大且细胞存活较多,最终确定为最佳感染条件。
1.7 慢病毒载体感染HSC-LX2细胞 HIF-1α、HIF-2α过表达慢病毒感染HSC-LX2细胞时,均分别设置了阴性对照组和过表达慢病毒感染组。阴性对照组每孔均加入空载体慢病毒(上海吉凯)感染HSC-LX2细胞,过表达慢病毒感染组均加入HIF-1α、HIF-2α过表达慢病毒感染HSC-LX2细胞。
1.8 细胞低氧处理 细胞低氧处理使用1 000 μmol/L的 CoCl2作为缺氧诱导剂。在观察缺氧条件下HIF-1α、HIF-2α过表达慢病毒和空载慢病毒感染HSC-LX2细胞后CD248的表达水平时,对HIF-1α、HIF-2α过表达慢病毒和空载慢病毒感染HSC-LX2细胞均使用1 000 μmol/L的CoCl2进行低氧处理。
1.9 RNA获取、反转录和定量PCR 应用定量PCR(quantitative polymerase chain reaction,qPCR)技术对HSC-LX2细胞中的HIF-1α、HIF-2α和CD248表达水平进行检测并分析。以β-actin作为内参基因,相对表达量采用2-ΔΔCt法进行计算。qPCR引物序列如下:HIF-1α上游引物序列为5′-GTGTTATCTGTCGCTTTGAGTC-3′,下游引物序列为5′-GTCTGGCTGCTGTAATAATGTTC-3′;HIF-2α上游引物序列为5′-TTGCTCTGAAAACGAGTCCGA-3′,下游引物序列为5′-GGTCACCACGGCAATGAAAC-3′;CD248上游引物序列为5′-AGTGTTATTGTAGCGAGGGAGAGAC-3′,下游引物序列为5′-CCTCTGGGAAGCTCGGTCTA-3′;β-actin上游引物序列为5′-GGCGGCACCACCATGTACCCT-3′,下游引物序列为5′-AGGGGCCGGACTCGTCATACT-3′。
1.10 Western blot法 对过表达慢病毒感染HEK293T细胞目的基因融合蛋白进行检测时设置阴性对照(HEK293T空细胞)、阳性对照(感染含SURVIVIN-3FLAG-GFP慢病毒空载体的HEK293T)和HIF-1α/HIF-2α-3FLAG-GFP融合蛋白组(感染HIF-1α/HIF-2α重组过表达慢病毒的HEK293T细胞)。首先,对细胞进行裂解并提取总蛋白,用BCA法(美国HyClone)定量检测蛋白浓度。使用恒压80 V进行SDS-PAGE电泳2 h。电泳结束后,使用转移电泳装置在4℃,170 mA恒流条件下转膜100 min,将蛋白转移到PVDF膜上。用5%脱脂牛奶的TBST溶液室温封闭PVDF膜2 h,然后进行室温下HIF-1α与HIF-2α一抗(英国Abcam)孵育2 h,并使用TBST洗膜3次,每次10 min。然后,用封闭液稀释相应的二抗(英国Abcam),室温下孵育PVDF膜2 h,并使用TBST洗膜3次,每次10 min。采用ECL发光液试剂盒(美国Amersham)进行显色。
2 结果
2.1 BCS患者肝组织样本HIF-1α、HIF-2α与CD248的IOD值相关性分析 通过免疫组化分析BCS患者肝组织样本(图1a)并检测IOD值,结果发现,组织中CD248表达水平与HIF-1α(Pearson相关系数:r=0.285,P=0.010;图1b)和HIF-2α(Pearson相关系数:r=0.382,P<0.001;图1c)的表达水平呈现显著的正相关。因此,CD248的表达与HIF-1α、HIF-2α的表达可能存在着密切的关系。
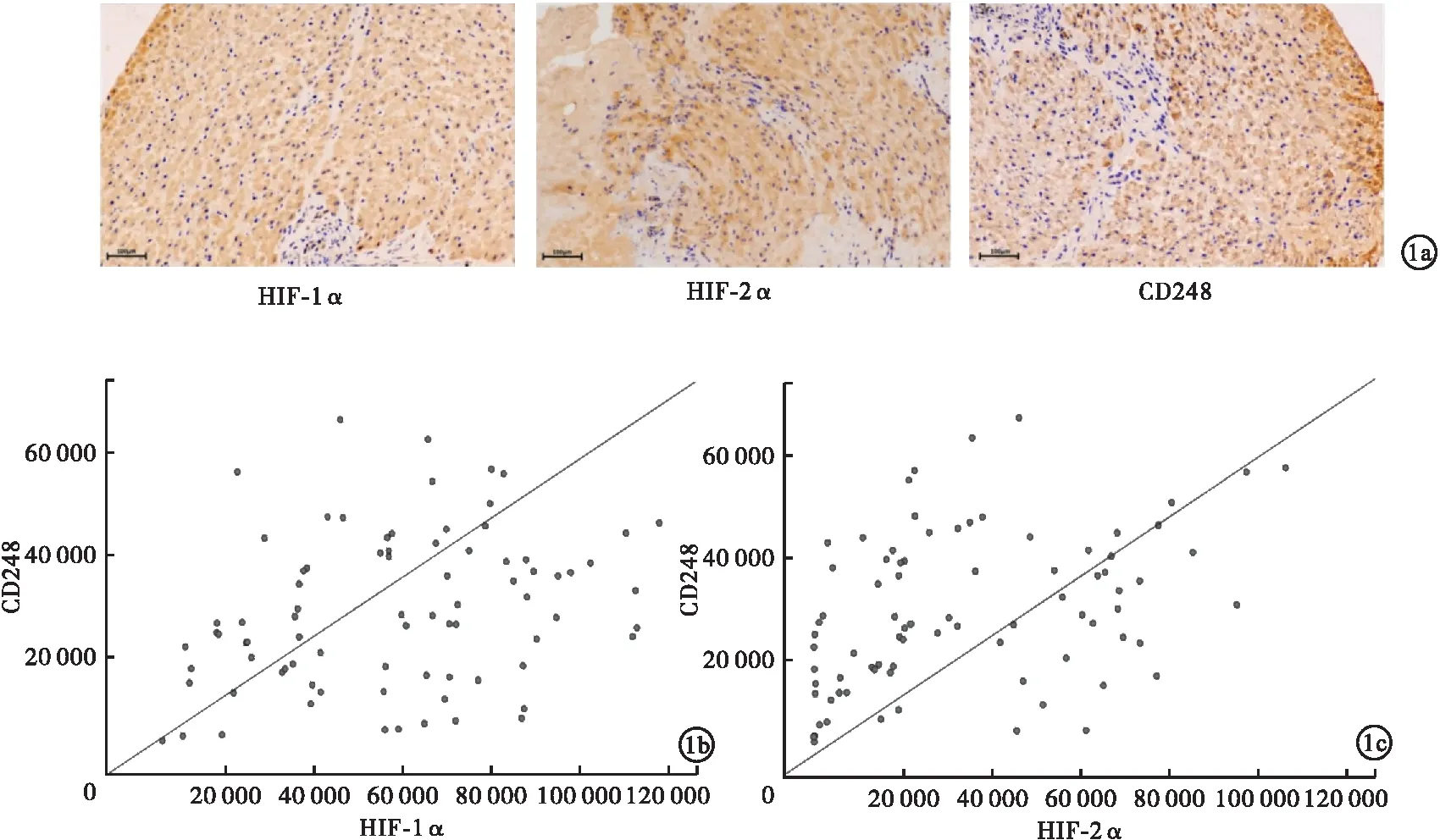
图1 BCS患者肝组织免疫组化代表性图片及HIF-1α、HIF-2α与CD248的IOD值相关性分析(每例患者均有3张肝组织免疫组化切片,每张切片随机挑选3个200倍视野进行拍照分析;a.BCS患者肝组织中HIF-1α、HIF-2α和CD248免疫组化代表性图片;b.BCS患者肝组织中HIF-1α与CD248表达散点图;c.BCS患者肝组织中HIF-2α与CD248表达散点图)
2.2 HIF-1α、HIF-2α过表达慢病毒的成功包装与表达效果检测
2.2.1 HIF-1α、HIF-2α过表达重组质粒的构建与鉴定 根据设计好的HIF-1α、HIF-2α引物进行PCR扩增,并对其产物进行凝胶电泳,可见两者特异性条带大小分别为2 522 bp和2 654 bp,与预期相符(图2a、b)。此外,产物测序结果与目的基因序列一致(图2e、f)。将构建好的HIF-1α、HIF-2α重组质粒进行PCR凝胶电泳鉴定,结果显示,两种转化子PCR产物大小分别为619 kb和1 368 kb(图2c、d),与预期相符,证明两种重组质粒构建成功。

图2 HIF-1α、HIF-2α重组过表达质粒的构建[a.HIF-1α引物PCR扩增产物凝胶电泳结果;b.HIF-2α引物PCR扩增产物凝胶电泳结果;c.HIF-1α重组过表达质粒凝胶电泳结果:d.HIF-2α重组过表达质粒凝胶电泳结果;e.HIF-1α重组过表达质粒阳性克隆部分测序结果;f.HIF-2α重组过表达质粒阳性克隆部分测序结果;图2a、b电泳图说明:M#为Marker,1#为HIF-1α引物PCR扩增产物,2#为HIF-2α引物PCR扩增产物;图2c、d电泳图说明:1#为阴性对照(ddH2O),2#为阴性对照(空载自连质粒),3#为阳性对照(GAPDH),4#为Marker,5-12(C)#为HIF-1α的1-8号转化子,5-12(D)#为HIF-2α的1-8号转化子]
2.2.2 HIF-1α、HIF-2α过表达慢病毒的包装与鉴定 将HIF-1α、HIF-2α过表达质粒与包装质粒共转染HEK293T细胞后成功获得HIF-1α、HIF-2α过表达慢病毒。使用荧光显微镜观察结果显示被转染的HEK293T细胞发射绿色荧光较强(图3a),说明质粒荧光标记基因表达正常,质粒转染成功。通过Western blot法检测HIF-1α-3FLAG-GFP和HIF-2α-3FLAG-GFP融合蛋白表达情况,结果显示两种蛋白大小分别为96 KD和98 KD(图3b、c),与预期相符,因此判断两种重组质粒过表达成功。在转染48 h后收集培养液上清中的病毒对HIF-1α过表达慢病毒[LV-HIF1A(8580-1)]和HIF-2α过表达慢病毒[LV-EPAS1(15237-1)]使用荧光法测定病毒滴度(图4),结果显示,两种病毒滴度分别为2×108TU/ml和1×108TU/ml。这提示,成功获得高滴度的HIF-2α和HIF-2α过表达慢病毒。
2.2.3 HIF-1α、HIF-2α过表达慢病毒感染HSC-LX2细胞表达效果检测 以β-actin为内参基因,对HIF-1α、HIF-2α过表达慢病毒载体感染HSC-LX2细胞后HIF-1α、HIF-2α表达效果进行qPCR和Western blot检测。结果显示,与空载慢病毒感染的HSC-LX2细胞比较(分别为HIF-1α对照组和HIF-2α对照组),HIF-1α、HIF-2α过表达慢病毒感染的HSC-LX2细胞中(分别为HIF-1α组和HIF-2α组)基因表达丰度均显著升高(P<0.05),说明两种过表达慢病毒感染效果理想。见图5。

图5 HIF-1α、HIF-2α过表达慢病毒感染HSC-LX2细胞后表达效果检测(a.与HIF-1α对照组比较,HIF-1α组HIF-1α mRNA的表达水平显著升高;b.与HIF-2α对照组比较,HIF-2α组HIF-2α mRNA的表达水平显著升高;c.HIF-1α、HIF-2α过表达慢病毒感染HSC-LX2细胞后应用Western blot检测蛋白表达情况)
2.3 HIF-1α、HIF-2α过表达慢病毒感染HSC-LX2细胞对CD248表达水平的影响 使用HIF-1α、HIF-2α过表达慢病毒和空载慢病毒感染HSC-LX2细胞,并使用浓度为1 000 μmol/L的CoCl2溶液进行低氧处理。以β-actin作为内参基因,使用qPCR对细胞中CD248的表达情况进行检测,结果显示,与空载慢病毒感染的HSC-LX2细胞(分别为HIF-1α阴性对照组和HIF-2α阴性对照组)比较,HIF-1α、HIF-2α过表达慢病毒感染的HSC-LX2细胞(分别为HIF-1α过表达组和HIF-2α过表达组)中,CD248基因表达丰度均显著升高(P<0.05)。见图6。因此,在缺氧环境下的HSC中,HIF-1α、HIF-2α均可能参与调控CD248基因表达增加。
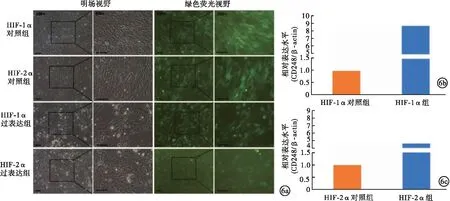
图6 HIF-1α、HIF-2α过表达慢病毒感染HSC-LX2细胞对CD248 mRNA表达水平的影响(a.HIF-1α、HIF-2α过表达慢病毒感染HSC-LX2细胞的明场视野与绿色荧光视野;b.与HIF-1α阴性对照组比较,HIF-1α过表达组CD248 mRNA表达水平显著升高;c.与HIF-2α阴性对照组比较,HIF-1α过表达组CD248 mRNA表达水平显著升高)
3 讨论
目前,CD248被认为是激活状态的周细胞和肿瘤间质肌成纤维细胞的标记物[15]。CD248在肿瘤疾病进程中主要参与血管生成、调节细胞增殖和细胞迁移等过程[16-17]。有研究发现,CD248过表达的细胞有较强的迁移能力及粘附性质[18]。目前,关于CD248下游调控分子机制的研究较少。近年的研究发现,CD248主要通过PDGF受体信号途径调节细胞增殖,细胞中的CD248可调控PDGF-BB刺激诱导PDGF受体和MAP激酶ERK-1/2磷酸化及转录因子c-Fos表达,进而调节细胞增殖[19]。此外,目前关于CD248表达及其上游调控分子机制也缺乏足够的认识。本研究在探索HIF对CD248调控作用时,首先在BCS肝组织活检样本中发现了CD248与HIF-1α、HIF-2α之间表达呈现显著的正相关,随后通过构建HIF-1α、HIF-2α过表达慢病毒载体并感染使用CoCl2低氧诱导的HSC-LX2细胞来观察CD248的表达情况,结果显示,与空载慢病毒感染组比较,HIF-1α、HIF-2α过表达慢病毒感染的HSC-LX2细胞中CD248 mRNA表达明显增高,这表明,在HSC中HIF-1α、HIF-2α过表达可能直接或间接上调CD248基因的表达水平。
HIF是细胞在缺氧环境中保护细胞和调节细胞适应缺氧环境的重要细胞因子。在正常氧水平的环境下,HIF的α亚基被氧依赖的脯氨酸羟化酶(prolyl hydroxylase,PHD)修饰,导致α亚基发生泛素化,进而发生蛋白降解。缺氧时,PHD被诱导失活,导致α亚基稳定存在并转位到细胞核中,与β亚基结合形成有活性的转录复合体[20]。HIF可以调节多种基因表达,包括促进血管生成的血管内皮生长因子及血管生成素-2等[21-22]。然而,目前少有研究评估肝组织中HIF对CD248基因表达的影响。Ohradanova等[23]在肿瘤细胞的缺氧环境中评估了HIF-1α、HIF-2α与CD248表达之间的关系,发现在缺氧条件下HIF-2α会上调CD248基因表达水平,并在CD248基因的上游调节区中发现了可与HIF-2直接结合并介导缺氧反应的顺式反应元件;该研究还发现,高细胞密度上调CD248表达是由缺氧环境通过SP1转录因子介导的;但此研究未证实HIF-1α在缺氧条件下对CD248基因表达调节的影响。本研究发现,在缺氧状态下的HSC中,HIF-1α与HIF-2α均可诱导CD248基因表达上调。
本研究存在一些局限性。由于BCS是一种罕见疾病,本研究仅收集到了9例合格的BCS患者,样本量较小,在日后的研究中笔者将扩大样本量并制作动物模型进一步探索。此外,本研究仅完成了mRNA水平上HIF-1α与HIF-2α对CD248表达调控的研究。日后的研究应将继续探索在蛋白水平上HIF-1α与HIF-2α对CD248表达的影响,并进一步阐明其在肝疾病中的作用机制。
近年来,随着HIF和CD248在癌症和纤维化等肝疾病中的作用机制被不断阐明,二者也逐渐成为治疗此类疾病的理想靶点[24-25]。笔者认为,本研究对日后探索缺氧相关肝疾病的分子靶向治疗方面具有重要意义,并为进一步探索HIF对CD248的调控关系奠定了基础。
综上所述,在缺氧状态下的HSC中,HIF-1α、HIF-2α均可能参与调控CD248基因表达增加。
