亚低温辅助治疗缺血性脑病分子机制研究
2023-09-22张华霖王加璐周大伟
张华霖, 王 硕, 杨 华, 王加璐, 周大伟, 毛 琪
1.联勤保障部队第九六七医院 急诊科,辽宁 大连 116000;2.联勤保障部队第九六八医院 神经内科,辽宁 朝阳 122000;3.中国医科大学附属第一医院 神经内科,辽宁 沈阳 110000
缺血性脑病是造成人类死亡的重要疾病之一。脑缺血后的炎症反应在缺血性再灌注损伤中发挥着重要作用,其中,相关的细胞因子主要有肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-6、IL-8、IL-10等[1-3]。有研究报道,脑缺血再灌注可导致TNF-α、IL-6、IL-8等炎症因子表达水平明显升高,这些高表达的炎症因子又进一步加重了脑损伤[4-6]。亚低温对于急性缺血性脑病的治疗具有良好的辅助及保护作用,具有疗效确切、不良反应少、便于推广等特点[7-9],但其具体的作用机制尚未完全阐明。本研究旨在探讨亚低温辅助治疗缺血性脑病的分子机制。现报道如下。
1 材料与方法
1.1 实验动物 将24只4周龄雄性SD大鼠(购自北京维通利华实验动物技术有限公司)随机分为阴性对照组、假手术组、实验组和亚低温实验组,每组各6只。人脑微血管内皮细胞(human cerebral microvascular endothelial cells,hCMEC/D3)、人外周血单核细胞系(humanacute monocytic leukemia cell line,THP-1)均由本实验室保存。
1.2 研究方法
1.2.1 动物模型构建 实验组参照线栓法[10]制备SD大鼠大脑中动脉闭塞模型,2%异戊巴比妥钠30 mg/kg腹腔麻醉大鼠,逐步分离直至显露右侧的颈总动脉和迷走神经,再依次分离显露颈总动脉分叉部、颈内动脉、颈外动脉,然后将尼龙缝合线从颈总动脉插入颈内动脉并向前推动,阻断至大脑中动脉,直至出现轻微阻力。栓塞2 h后,去除阻塞的缝合线,制备再灌注模型,通过悬尾实验判断造模是否成功。假手术组手术步骤同实验组,仅未插入线栓。阴性对照组未给予任何手术干预措施。亚低温实验组在实验组的基础上增加亚低温处理。
1.2.2 亚低温处理方法 将亚低温实验组大鼠放入装有冰袋的代谢笼中,前30 min内将大鼠肛温降至(33±1)℃,具体测试方法为将大鼠肛温温度计插入大鼠肛门约4 cm;鼓膜的温度降至(31±1)℃(用数位温度表测量),每10 min测量1次;温度控制稳定后,每1 h监测肛温与鼓膜温度1次,持续亚低温72 h[11]。
1.2.3 脑组织炎症因子检测 处死大鼠,取大鼠脑组织研磨液,离心处理后取上清,采用酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)法对大鼠脑组织研磨液上清中的TNF-α、IL-6和IL-8表达含量进行检测。ELISA试剂盒购自美国Life technology公司。
1.2.4 hCMEC/D3、THP-1细胞中炎症因子转录水平检测 分别设置阴性对照组、实验组和亚低温实验组。两种细胞株每种处理条件下备6组细胞。阴性对照组37℃控温处理。实验组在37℃温度条件下,利用革兰氏阴性菌脂多糖(lipopolysaccharide,LPS)分别作用0、2、4 h。亚低温实验组在LPS处理的基础上,采用亚低温(33℃)分别处理0、2、4 h。Trizol法提取细胞株中总RNA,去除DNA污染后的总RNA进行逆转录合成cDNA。采用实时荧光定量聚合酶链式反应检测IL-6、IL-8、TNF-α转录水平,反应体系为SYBR Green Mix(2×)10 μl、反转录后产物(模板)1 μl、引物(total)1 μl和RNase-Free H2O 8 μl,共20 μl,反应条件为95℃、10 min,95℃、15 s,60℃、60 s,40个循环。引物分别为F-ACCTCAGATTGTTGTTGT,R-GTCCTAACGCTCATACTT;F-AATTCATTCTCTGTGGTATC R-CCAGGAATCTTGTATTGC;F-AGGCAATAGGTTTTGAGGGCCAT,R-TCCTCCCTGCTCCGATTCCG。
1.2.5 hCMEC/D3细胞凋亡率检测 37℃条件下,利用LPS下分别刺激实验组hCMEC/D3细胞1 h和4 h。33℃条件下,利用LPS分别刺激亚低温实验组hCMEC/D3细胞1 h 和4 h。阴性对照组为含基础培养基的细胞悬液,置于37℃条件下培养。刺激结束后,根据AnnenxinV-FITC/PI细胞凋亡检测试剂盒说明书进行流式细胞仪细胞凋亡的定量检测。
1.2.6 蛋白免疫印迹法 采用蛋白免疫印迹法检测核因子κβ(nuclear factor κβ,NF-κβ)、凋亡级联效应因子天冬氨酸蛋白水解酶(aspartate proteolytic enzyme,Caspase-3)、凋亡相关的死亡结构域受体Fas蛋白,内参蛋白为甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GADPH)。抗体购自Abcom公司。
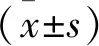
2 结果
2.1 各组大鼠脑组织炎症因子水平比较 实验组、亚低温实验组处理6、24、48 h的TNF-α、IL-8、IL-6均高于阴性对照组,且实验组高于亚低温实验组,差异有统计学意义(P<0.05)。见表1。
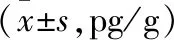
表1 各组大鼠脑组织炎症因子水平比较
2.2 各组hCMEC/D3、THP-1细胞中炎症因子转录水平 实验组与亚低温实验组处理后4、8 h的hCMEC/D3细胞中TNF-α mRNA、IL-6 mRNA、IL-8 mRNA表达水平比较,差异有统计学意义(P<0.05)。实验组与亚低温实验组处理2 h的hCMEC/D3细胞中TNF-α mRNA、IL-8 mRNA表达水平比较,差异有统计学意义(P<0.05)。实验组与亚低温实验组处理2、4、8 h的THP-1细胞中TNF-αmRNA、IL-6 mRNA、IL-8 mRNA表达水平比较,差异有统计学意义(P<0.05)。见表2~3。
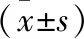
表2 各组hCMEC/D3细胞中炎症因子转录水平比较
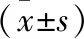
表3 各组THP-1细胞中炎症因子转录水平比较
2.3 各组hCMEC/D3细胞凋亡率比较 亚低温实验组处理1、4 h的hCMEC/D3细胞凋亡率分别为7.0%、17.0%,分别低于实验组的12.0%、28.0%,差异均有统计学意义(P<0.05)。阴性对照组处理1、4 h的hCMEC/D3细胞凋亡率分别为2.0%、3.1%,与亚低温实验组、实验组比较,差异均有统计学意义(P<0.05)。
2.4 各组相关信号通路标志蛋白表达结果 亚低温实验组、实验组NF-κB、Caspase-3、Fas蛋白表达量均明显高于阴性对照组,且实验组高于亚低温实验组,差异有统计学意义(P<0.05)。见图1。
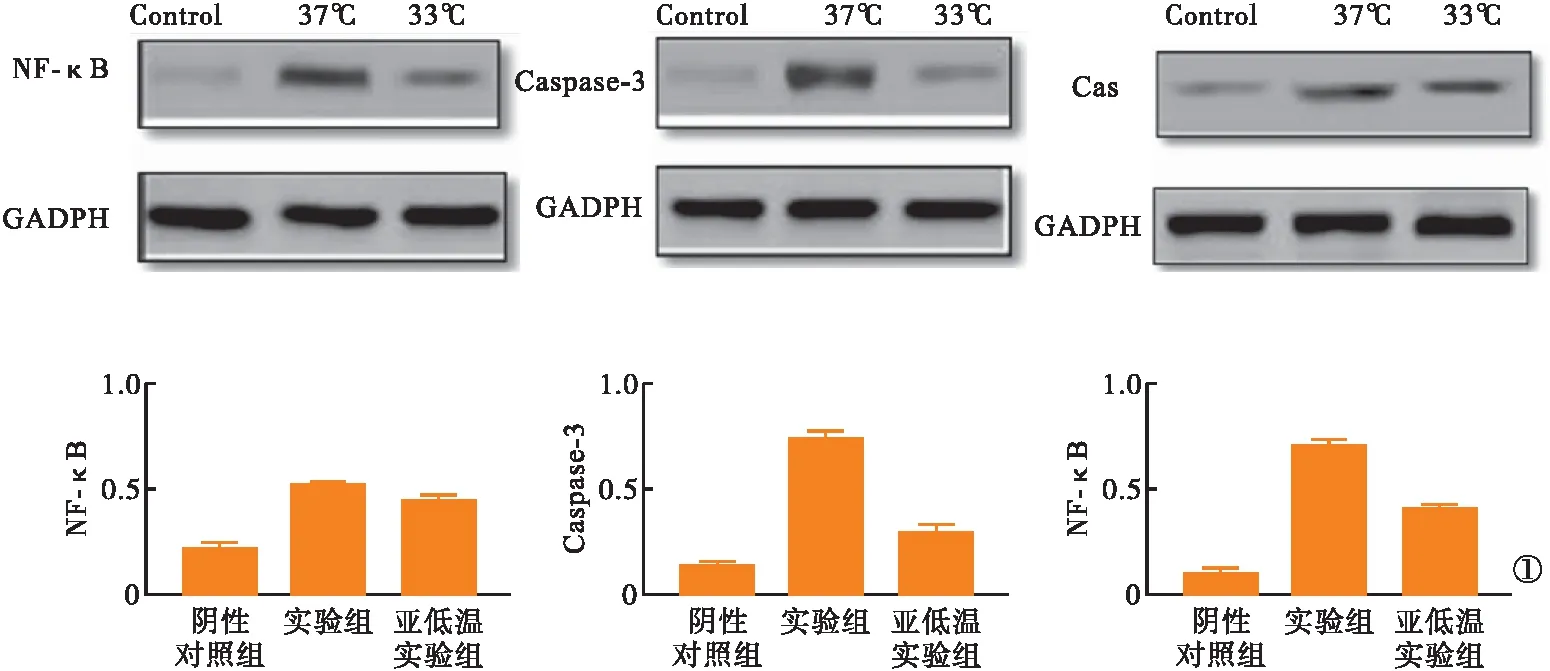
图1 相关信号通路标志蛋白表达结果
3 讨论
供血中断后,脑组织会出现一系列缺血相关级联反应;供血恢复后,脑组织又会出现脑缺血再灌注损伤[12]。脑缺血再灌注损伤会改变脑血管的形态及功能,进而影响大脑的物质交换能力,造成血氧供应下降,最终损伤脑细胞[13],引起一系列症状或体征,通常表现为肢体无力、偏瘫、感觉及语言障碍、共济失调等[14]。缺血性脑病的发病原因和机制相对复杂。目前,临床对脑缺血再灌注损伤发病机制的研究主要集中在炎症反应、氧化应激、细胞内钙超载、兴奋性氨基酸、线粒体功能障碍等,其中脑缺血后的炎症反应在缺血性再灌注损伤中发挥着重要作用[1]。再灌注后,血流复灌不仅给细胞带来营养物质和氧气,也使炎症级联反应加重,相关的细胞因子主要有TNF-α、IL-8、IL-6、IL-10等[2-3]。
本研究发现,亚低温处理可明显降低缺血再灌注后大鼠脑组织内部分相关炎症因子的表达水平,对脑组织损伤具有一定的缓解作用,与既往研究[15]结果一致。TNF-α由被激活的巨噬细胞及内皮细胞等分泌。在脑缺血早期,TNF-α分泌及合成增加是脑梗死形成的主要原因[2]。TNF-α的大量表达会促进脑缺血再灌注后的炎症反应,加重脑损伤[4]。作为趋化因子,TNF-α激活小胶质细胞和星形胶质细胞分泌大量的IL-6。而IL-6主要参与机体免疫应答和炎症反应,协同IL-8、IL-10等细胞因子促进B/T细胞活化,诱导其他炎症介质的产生。IL-6的过量表达会加剧神经元、胶质细胞及内皮细胞的损伤[3]。机体内IL-6的表达水平是判断缺血再灌注损伤程度的一个重要参考指标[5]。有研究报道,脑缺血再灌注可导致TNF-α、IL-6、IL-8等炎症因子表达量明显升高,这些高表达的炎症因子又进一步加重了脑损伤[6]。
本研究发现,脑缺血再灌注后,NF-κβ的表达均明显增加;亚低温处理后,大鼠脑组织中的NF-κβ的表达量明显降低,提示亚低温处理可明显降低NF-κβ的表达,从而发挥对脑缺血再灌注损伤的保护作用。NF-κβ是一组存在于细胞和病毒中,调控许多基因表达的重要转录调节因子。脑缺血再灌注时,NF-κβ的激活是造成炎症介质释放的关键因素,NF-κβ与诸多细胞因子间的复杂相互作用会进一步增强炎症反应[16]。有研究报道,使用对NF-κβ表达具有抑制作用的药物及治疗手段,可明显减轻脑缺血再灌注损伤,发挥保护脑功能的作用[17]。
Caspase-3是引起凋亡级联反应的关键因子。正常情况下,Caspase-3以酶原形式存在于细胞中,被激活后形成二聚体形式,并进一步切割不同的底物,级联反应逐步扩大,最终导致细胞凋亡。有研究报道,脑缺血时,Caspase-3参与的级联反应和多种细胞内容物的水解是缺血性细胞凋亡的重要原因[18-19]。有研究发现,亚低温治疗通过抑制Bcl-2、Bax和Caspase-3的表达影响细胞凋亡水平,进而在脑缺血再灌注模型中保护脑细胞。本研究发现,大鼠脑缺血性再灌注后,脑组织中的Caspase-3表达量较阴性对照组明显增多,而经过亚低温处理后,Caspase-3的表达量明显降低。这提示,亚低温处理减轻了大鼠脑缺血性再灌注损伤,可能与其抑制了Caspase-3的表达有关。
Fas是一种与凋亡密切相关的死亡结构域受体,可与细胞外的配体Fas-L、TNF-α、TRAIL结合活化,从而增强Fas介导的细胞凋亡,并且可使胞内的Caspase-8前体发生催化激活,进一步激活 Caspase-3等相关蛋白。有研究报道,脑缺血损伤大鼠脑组织中Fas的表达增加,而未表达Fas的突变大鼠脑缺血后损伤较小[20]。本研究发现,脑缺血再灌注大鼠脑组织中Fas蛋白的表达量明显高于阴性对照组,亚低温处理后,Fas蛋白的表达量明显减少,推测Fas参与了亚低温降低脑缺血再灌注损伤的保护机制。
目前,亚低温治疗已经在脑缺血、重型颅脑损伤、脊髓损伤、难治性癫痫持续状态等疾病中被应用。亚低温治疗在缺血再灌注时间窗内通过多种作用机制同时激活多条通路,发挥对神经血管单元的保护作用,进而产生有效的神经保护作用[7]。动物研究发现,亚低温能明显抑制炎症细胞在缺血区血管内的聚集和粘附,以及随后在缺血区脑实质内的浸润,从而阻断炎症级联反应,起到脑保护作用[21];低体温抑制了Caspase激活,刺激了Bcl-2家族中选择性抗凋亡蛋白发挥抗细胞凋亡作用,延长了神经元的存活时间[22]。
综上所述,亚低温处理可显著降低NF-κB、Caspase-3的表达,同时减少与细胞凋亡密切相关的Fas蛋白的表达,在脑组织缺血再灌注损伤过程中发挥保护作用。本研究存在局限性,由于检测水平的限制,pNF-kB、cleaved-Caspase-3等的表达情况未能检测,相关机制仍需进一步验证。
