氧化亚硅材料制备过程中影响生产率因素分析
2023-09-20郝浩博陈惠敏党元晓
郝浩博,陈惠敏,张 建,杨 洁,党元晓
(昌吉学院航空学院 新疆 昌吉 831100)
0 引言
随着科技进步,我们使用的能源正由不可再生能源向新能源转变,为了减少环境污染、化石能源等不可再生能源枯竭及气候变化现象,人们一直在寻找可持续能源来替代化石能源,其中包括太阳能、水能、地热能、风能等[1]。燃油交通工具给人们带来了极大的出行便利,但汽油等燃料需求量增大,尾气排放量也不断增加,对环境负面影响不断增加。为降低石油燃料供给压力,减轻环境污染问题,国务院发布文件,提出要对新能源进行深入的实施发展,从而推进我国的新能源产业向更高质量和可持续化发展[2]。新能源交通工具利用动力电池提供驱动动力,锂离子电池由于具有较高的能量密度、其工作电压高大于3.6 V、工作温度范围宽(-20~60 ℃)、无记忆效应、环保等优点[3],成为了新一代高容量、长寿命电池的首选。
20世纪70年代,锂一次电池被研制出来并成功应用,之后研发人员分析其使用过程中的不足,总结经验研发出可循环使用的锂二次电池,但由于当时以金属锂离子作为负极的电池安全隐患问题严重,未能商业化使用。1977年,Armond教授[4]初次提出以石墨嵌锂化合物作为锂二次电池的电极材料。1990年,日本Sony公司[5]首次将锂离子嵌入到炭材料里应用于电池的负极中,随着不断的研发,锂离子电池被不断改善,其负极材料多采用碳负极材料[6]、锡基负极材料[7]、含锂过渡金属氮化物负极材料[8]、合金类负极材料[9]及纳米级负极材料[10]等。
氧化亚硅材料在锂离子电池领域中得到了广泛应用,该材料在18世纪首次合成,歧化之后生成硅纳米颗粒和二氧化硅,以SiO2为基底包围Si纳米颗粒,其具备容量高、循环寿命长、体积形变系数低等优点,能有效地缓解硅基负极材料在锂离子电池中因体积形变所导致的一系列问题。
1 SiO材料制备方法
1.1 生产原料及制备原理
制备过程中以硅粉和石英砂为原料,硅粉为411型号工业细硅粉,工业硅又称为金属硅,411硅粉其Si含量达到99%,Fe和Al的含量占0.4%。石英砂型号为615,粒径在2 000目的石英砂粉末。制备原理以Si和SiO2为原料通过高温固相法合成SiO蒸气,通过冷凝成块状收集。
1.2 生产过程
实验使用的原料为微米级硅粉和二氧化硅粉末,根据理论的化学反应配比,即硅和二氧化硅的摩尔比例为1∶1进行配比。但是由于硅粉表面存在着氧化现象,选用硅粉的含量较高,其摩尔比约在(1~1.1)∶1,在本实验中选用的摩尔比例为1.07∶1,约1 kg的石英砂配比0.5 kg硅粉进行实验。
首先将硅粉和石英砂在140 ℃环境下烘干5 h备用,再将原料进行干法混合,是硅粉与石英砂粉末充分混合,随后加入蒸馏水进行造粒,将制备好的混合颗粒放入在140 ℃环境下烘干5 h,最后放入反应炉中以1 450 ℃高温反应。
2 生产中影响反应率因素分析
2.1 原料混合粒径大小及投料量对反应率影响
根据以上生产过程,通过改变制粒机筛网的孔径尺寸大小,控制制备出混合原料颗粒的粒径,并采用旋转切割制粒的方法制备出粒径为1 cm的球状料。生产中制备出的粒径大小分别为1 mm、2 mm、3 mm、5 mm和1 cm,投料时分别向反应室坩埚中装入厚度为1 cm和4 cm厚的原料,其他条件不变,观察其的反应率快慢。
在投料时精准测量每炉实验的投料总量,待反应结束后,取出坩埚内剩余的原料并称量,得到精准数据后计算每一炉实验的反应率,如图1所示。
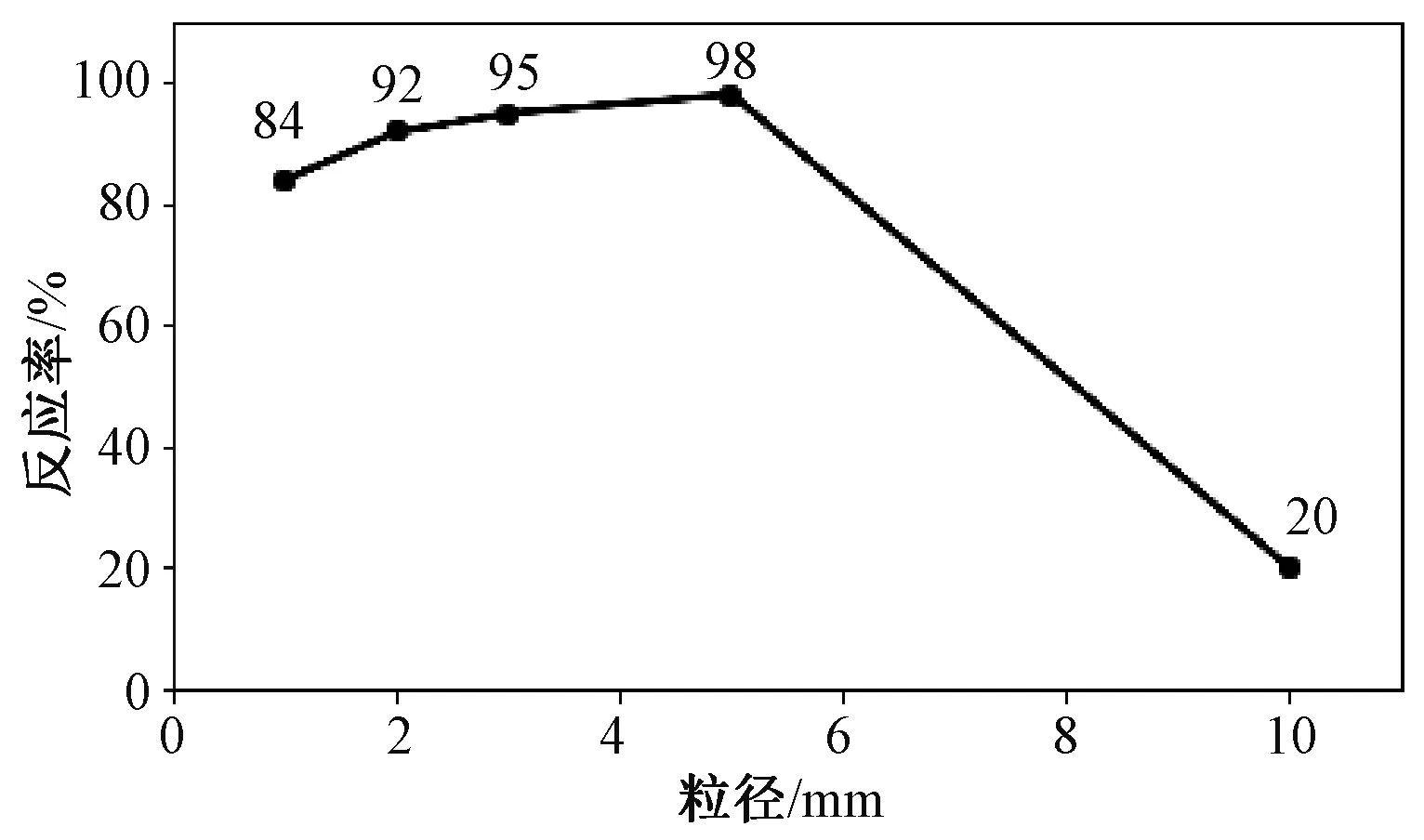
图1 不同颗粒粒径原料的反应率
由图1可以看出,随着颗粒粒径大小从1~5 mm逐渐增大,其反应率也在不断地上升,分析其原因为:当颗粒粒径过小时,可能导致原料颗粒之间堆积过于密切,不利于反应过程中原料内部生成的SiO蒸气排出,随着颗粒粒径的增大,颗粒间的间隙也随之增加有利于气体的挥发。但是观察到粒径为1 cm的球状原料反应率特低,几乎不参与反应,可能是在旋转切割制粒时旋转速度很高,原料与设备内壁碰撞导致小球内部过于致密,或是球状物料的粒径过大,球体内部生成的气体无法到达表面。
如图2所示,当投料量厚度为1 cm时,原料粒径大小为1~5 mm范围内的反应率明显高于投料量为4 cm时的反应率。
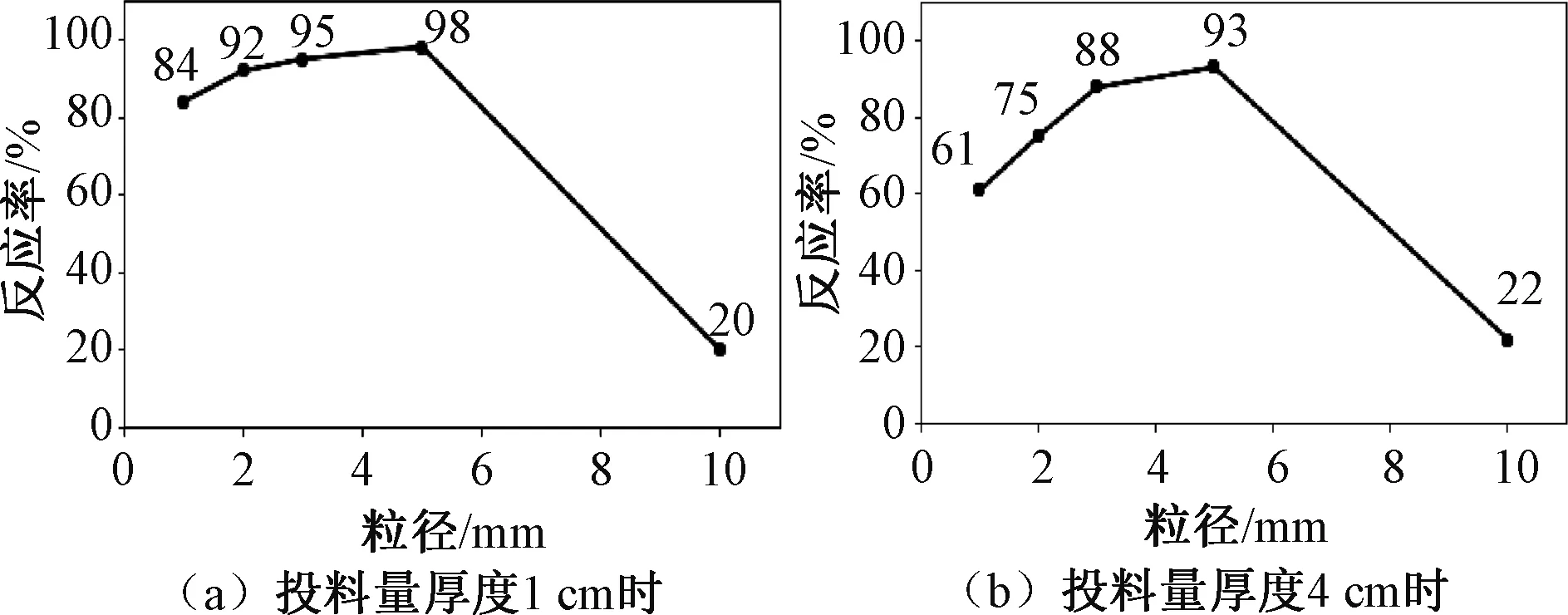
图2 投料量厚度1 cm和4 cm时不同颗粒粒径原料的反应率
由此可看出投料量的多少同样影响着反应率。当投料过多时,会导致原料颗粒间的堆积密度增大,从而阻碍反应时内部生成的气体挥发进入收集系统。
2.2 黏结剂对反应率的影响
将硅酸钠颗粒A、蔗糖和硅酸钠粉末B三种黏结剂添加至混合好的原料中混合成泥浆状制成小球,反应烧结,观察其反应率。生产过程中反应温度、颗粒粒径等实验条件不变。其中硅酸钠颗粒A:易溶于水,配置成1%的硅酸钠溶液,溶液的pH范围在12~13,碱性较强,其Na2O:SiO2= 1.03 ± 0.03。蔗糖:通用实验室药品,常温下不易溶于水,加热可溶解。硅酸钠粉末B:药品成粉末状,不易溶于水,配置成1%的硅酸钠溶液,溶液的pH范围在10~11,碱性与A相比较弱。
实验过程中分别出现三种不同现象如图3所示。

图3 实验过程中三种不同现象
实验一:用1%硅酸钠溶液A作为黏结剂混合后,混合浆料开始呈现泥浆状,有气体放出,经检测为氢气。泥浆料会慢慢膨胀,最后呈现出和发酵好的面团相似的物料。捏成球状烘干后,球状物料较硬。
实验二:以1%蔗糖溶液作为黏结剂,实验室蔗糖与水不太好溶解,混合后呈泥浆状,烘干后的物料容易破碎。
实验三:采用硅酸钠溶液B作为黏结剂,不易溶于水,混合后呈现泥浆状,无气体放出,无膨胀现象产生。烘干后在温度未降下时球状物料表面黏度很大。同时球状物料硬度也很高。
经过实验反应后反应情况如表1所示.。
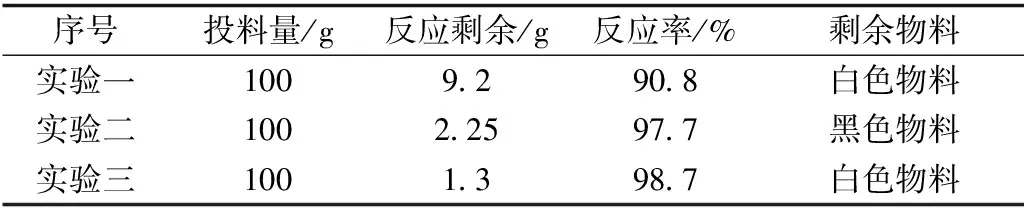
表1 使用不同黏结剂时的反应率
实验一:残余料较多,由于配比的1%的硅酸钠溶液的pH值为12~13,碱性太强,硅与碱发生反应释放出氢气。因此破坏了硅氧比的平衡,导致Si的含量过小,SiO2含量过多。实验二:混合后与加水混合无太大差别,反应后残渣为黑色,蔗糖里面含有碳元素。实验三:混合后和实验二现象无太大差别,烘干后在温度较高的环境下颗粒表面黏度较高。残渣也为白色,说明也存在一定的程度的硅损耗。其剩余残渣如图4所示。

图4 反应过后坩埚中剩余物料
为分析三个实验剩余残渣的成分,对三个实验的反应残渣进行检测。从图5所示,两种硅酸盐黏结剂的最后残渣成分一致,通过对比与SiO2的PDF82-1403标准卡片一致,坩埚内剩余的物料为SiO2。实验二以蔗糖为黏结剂坩埚内剩余物料的X射线衍射(X-raydiffraction,XRD)图如图5(b)所示:在2θ = 28.419,47.305,56.102等角度存在明显的Si特征峰。

图5 坩埚中剩余物料XRD图谱
2.3 反应温度对真空度及反应率影响本实验反应原理是硅与二氧化硅通过高温固相法反应如式(1)所示,
Si+SiO2→2SiO
(1)
该实验为强吸热反应。升高反应温度可以提升反应速率,实验中使用的是自主研发的反应装置,通过控制反应温度观察SiO材料的收集速率,其关系如图6所示温度与收集速率成正比,反应温度在1 350 ℃时收集速率在2 kg/h,温度升高至1 470 ℃时收集速率可达到12 kg/h。

图6 SiO反应温度与收集速率的关系图
将饱和蒸气压与温度作图,其关系如图7所示,在实验中发现反应时实际测量的压力低于理论值。反应温度为1 300 ℃相较1 200 ℃时压升ΔP约为8 Pa,1 400 ℃相较1 200 ℃时压升约为40 Pa(测量值之差)。

图7 SiO饱和蒸气压与反应温度关系图
实际测量压力偏低的原因:(1)在反应进行的同时,SiO蒸气也在冷凝收集,反应未达到理论平衡状态。(2)真空值的测量点在反应装置后端,反应时一部分SiO蒸气已经在收集端冷凝。根据图6和图7可知,升高反应温度可以加快收集速率,使反应中压力趋向饱和蒸气压,推动反应平衡向右进行,提高生产时的反应率。
3 结语
文章主要研究了原料不同粒径(1 mm、2 mm、3 mm、5 mm和1 cm),装料1 cm和4 cm时的反应情况;添加黏结剂时对生产中反应率的影响;反应温度对真空度和反应率的影响。当颗粒粒径过小时,原料间堆积过于紧致,不利于原料中气体的挥发。同时制粒时颗粒内部过于致密,也会导致颗粒内部的气体无法挥发,影响实验生产率;在研究投料量时发现采用分层装料不仅能提升反应率,还可以加大投料量。黏结剂的使用都增加了实验的反应率,表明黏结剂的使用能够促进反应的进行;研究发现随着温度的升高,收集速率在不断的上升,反应温度与饱和蒸气压成正比,升高反应温度可以加快收集速率,使反应中压力趋向饱和蒸气压,推动反应平衡向右进行,提高生产时的反应率。
